Какой метод не используют для диагностики чумы
Для лабораторной диагностики чумы используют бактериоскопический, бактериологический, биологический, серологические и молекулярно-генетические методы.
Диагноз чумы у человека ставится на основании выявления у него возбудителя – выделение и идентификация культуры, обнаружения специфического для чумного микроба антигена FI и специфических антител к антигену FI в сыворотках больных и переболевших.
В качестве экспресс-методов используют иммунофлюоресцентный анализ (обнаружение микроба с помощью флюоресцирующих иммуноглобулинов), ПЦР (обнаружение микроба по наличию искомого участка ДНК в результате его многократного копирования), иммуносуспензионные методы – система 2-3 компонентных реакций с эритроцитарными диагностикумами или иммуноферментный анализ для обнаружения специфических антигенов чумного микроба. С этой же целью применяют и другие варианты иммуносуспензионных методов: дот-иммуноферментный анализ, радиоиммунный анализ. Все экспресс-методы выполняют после обеззараживания материала.
Обязательному лабораторному исследованию подлежит материал:
- от больных людей с симптомами болезни, сходными с клиническими проявлениями всех форм чумы;
- лиц, контактировавших с больными легочной чумой;
- лиц, участвовавших (без защитной одежды) во вскрытии трупов людей и верблюдов, погибших от чумы;
- лиц, участвовавших в прирезке и разделке туши больного чумой верблюда и других животных, обработке мяса в процессе приготовления пищи, употреблявших в пищу мясо больных чумой животных;
- лиц, совершивших аварию с разбрызгиванием заразного материала при работе с возбудителем чумы.
Материал от больных, как правило, целесообразно брать сразу при поступлении в лечебное учреждение и спустя 3 дня после окончания специфического лечения антибиотиками с интервалами между очередными исследованиями 24 ч до получения трех отрицательных результатов. Материал от лиц, контактировавших с больными или контаминированными объектами – при поступлении в изолятор и по окончании профилактического лечения, перед выпиской.
Исследованию подлежит: при легочной форме чумы – мокрота, при её отсутствии – мазок из зева, кровь из вены, моча; при септической форме – кровь, моча; при бубонной форме – пунктат бубона, кровь, моча; при кожной форме – отделяемое язвы, кровь, моча; при кишечной форме – кал, кровь, моча; при менингиальных явлениях – спинномозговая жидкость.
У лиц, контактировавших с больным легочной формой чумы, а также в других случаях, если есть подозрение, что заражение произошло аэрогенным путем, исследуют мазок из зева. В остальных случаях у контактных исследования не проводят.
Забор материала на исследование у больных с подозрением на чуму следует, как правило, проводить в условиях стационара до начала специфического лечения обученным квалифицированным медицинским персоналом под наблюдением специалиста противочумного учреждения или специалиста по особо опасным инфекциям ЦГиЭ субъекта Российской Федерации. В случае невозможности забрать материал в первые 2 ч после возникновения подозрения, лечение начинают по клиническим показаниям до забора материала.
Забор материала у лиц, контактировавших с больными чумой и совершивших аварию, производят в изоляторе до начала профилактического лечения.
Исследование материала проводят специалисты территориальных противочумных учреждений на своей базе, а также на базе лабораторий отделов особо опасных инфекций ФГУЗ ЦГиЭ субъекта Российской Федерации, если они соответствуют требованиям действующих "Санитарных правил безопасности работы с микроорганизмами I-II групп патогенности". Специалисты отделов особо опасных инфекций проводят исследование обеззараженного материала экспресс-методами. Ведущим методом является люминесцентно-серологический. Определение антигена у больного возможно только при осложненной клинике в спинномозговой жидкости, в пунктате бубона – при тяжелом течении болезни, в моче – при всех формах болезни, начиная с 3-4 дня заболевания в низких титрах.
Методы забора материала – в приложении 8.
Запрещается давать окончательный (отрицательный или положительный) ответ на основании результатов экспресс-методов.
Исследование материала от больного чумой.
- приготовление мазков, окраска фиксированных мазков анилиновыми красителями, чумными флюоресцирующими иммуноглобулинами;
- полимеразная цепная реакция;
- посев на жидкие и плотные питательные среды со стимуляторами роста чумного микроба (кровь, моча, спинномозговая жидкость, пунктат бубона);
- посев на плотные питательные среды со стимулятором роста чумного микроба и ингибиторами посторонней флоры (мокрота, мазок из зева, субстрат из вскрывшегося бубона, отделяемое язвы, моча, испражнения);
- проба с диагностическими бактериофагами нативного материала на соответствующей плотной среде;
- проба на чувствительность к антибиотикам с нативным материалом на плотной среде методом дисков;
- поиск антигена FI иммуносуспензионными методами: реакция непрямой гемагглютинации, реакция нейтрализации антител, иммуноферментный анализ, дот-иммуноферментный анализ, радиоиммунный анализ (моча, спинномозговая жидкость, пунктат бубона); параллельно в качестве контроля ставят те же реакции с диагностикумами на другие инфекции (туляремия, бруцеллёз, холера и др.);
- заражение лабораторных животных (морские свинки, белые мыши) внутрибрюшинно и подкожно (кровь, пунктат бубона, спинномозговая жидкость), подкожно и накожно (мокрота, мазок из зева, вскрывшийся бубон, отделяемое язвы, моча, испражнения).
II этап (2-5 ч от начала исследования):
- выдача предварительного положительного ответа на основании наличия в мазках биополярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими чумными иммуноглобулинами, положительной ПЦР, положительных иммуносуспензионных реакций при отрицательных контролях.
III этап (24-48 ч):
- выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
Высев культуры для дальнейшей идентификации на питательный агар и агар с содержанием дефибринированной крови (5 %) для определения продукции FI после инкубации при 37° С. Одновременно выдача предварительного ответа о чувствительности выделенной культуры к антибиотикам. Посев культуры на среды Гисса с рамнозой, глицерином, сахарозой, арабинозой, ЦДС или среду Ленской для определения уреазной активности (после накопления чистой культуры).
IV этап (3-7-е сутки):
- выдача окончательного положительного ответа на основании выделения чистой культуры чумного микроба из посевов нативного материала, его идентификации по морфологическим, культуральным, биохимическим признакам, чувствительности к диагностическим бактериофагам, наличию специфических плазмид, а также на основании подтверждения диагноза выделением идентичных культур от павших или забитых лабораторных животных.
V этап (5-8-е сутки):
- выдача отрицательного ответа на основании отсутствия специфического роста на питательных средах при посеве нативного материала и органов забитых биопробных животных, отрицательной ПЦР, отрицательных иммуносуспензионных реакций с нативным материалом и органами забитых или павших биологических проб, отсутствия патологоанатомических изменений у последних, отсутствия в парных сыворотках больного специфических антител к чумному микробу.
Исследование материала от лиц, контактировавших с больными легочной формой чумы, а также лиц, присутствовавших при аварии с разбрызгиванием заразного материала.
Исследуемый материал – мазок из зева.
- приготовление мазков, окраска анилиновыми красителями, флюоресцирующими чумными иммуноглобулинами;
- полимеразная цепная реакция;
- посев на плотные селективные среды;
- заражение лабораторных животных подкожно и накожно.
- выдача предварительного положительного ответа на основании обнаружения специфически светящихся клеток в люминесцентном микроскопе, положительной ПЦР.
- выдача подтверждения предварительного положительного ответа на основании наличия характерных по морфологии колоний в посевах на плотной среде;
- пересев колоний на питательный слабощелочной агар, на селективный агар и на агар с кровью для дальнейшей идентификации (последний посев ставят в термостат с 37° С для последующего определения F1);
- при достаточном количестве колоний постановка пробы на чувствительность с диагностическими бактериофагами на плотной среде и пробы на чувствительность к антибиотикам методом дисков.
IV этап (3-4-е сутки):
- выдача положительного ответа на основании выделения типичной по морфологии культуры, лизирующейся диагностическими бактериофагами;
- положительных иммуносуспензионных реакций на наличие антигена F1;
- дальнейшая идентификация выделенной культуры.
V этап (5-8-е сутки):
- вскрытие забитых биопроб, их исследование бактериологически и серологически;
- выдача окончательного положительного ответа на основании выделения и идентификации культуры чумного микроба, типичной по морфологическим, культуральным, биохимическим свойствам, фаголизабельности, наличию специфических плазмид, подтверждения диагноза выделением идентичной культуры от павших или забитых биопробных животных (схема идентификации выделенных культур – в приложении 9;
- выдача отрицательного ответа на основании отсутствия специфически светящихся клеток в мазках, окрашенных люминесцирующими чумными иммуноглобулинами, отрицательной ПЦР, отсутствия роста характерных по морфологии колоний на плотной среде, отсутствия характерных для чумы изменений в органах у биопробных животных и отсутствия специфического роста на плотной среде из посевов отпечатков их органов.
Исследование материала от трупа человека, погибшего от чумы.
Исследованию подлежат: кусочки паренхиматозных органов, легких из мест, где есть характерные для чумы изменения, лимфатические узлы, как регионарные к первичному аффекту, так и другие, увеличенные и имеющие изменения, сгустки крови из сердца и крупных сосудов, сыворотка крови, полученная из сгустков при их сокращении, участки любой ткани, имеющие изменения септического характера, спинномозговая жидкость, моча, содержимое кишечника, в случае наличия признаков загнивания трупа исследуют спинной и головной мозг.
Исследования ведут по этапам, как исследование материала от больного чумой человека.
Положительный предварительный диагноз может быть поставлен на любом этапе, так как при гибели от чумы все органы и ткани содержат большое количество возбудителя и его антигенов, в том числе FI. Поэтому весьма вероятен первый положительный ответ уже через 2 ч после исследования на основании наличия грамотрицательных биполярно окрашенных палочек, специфически светящихся в люминесцентном микроскопе при обработке мазков-отпечатков флюоресцирующим чумным иммуноглобулином, положительной ПЦР, высокого титра антигена FI в тканях и органах, наличия противочумных антител в сыворотке.
Высокая вероятность подтверждения диагноза через 24-48 ч после начала исследования на основании обнаружения типичных по морфологии колоний чумного микроба, положительной пробы с бактериофагом, которую следует ставить на селективном агаре во избежании зарастания пятна лизиса культуры посторонней флорой и отрицательного ответа в 2-5 часов исследований
Окончательный положительный ответ может быть поставлен через 48 ч – 6 сут. по результатам идентификации культуры чумного микроба и подтверждения ее выделением идентичной культуры от биопробного животного.
Окончательный отрицательный диагноз дают на 5-8 сутки, как и при исследовании материала от больного.
Запрещается выдавать отрицательный ответ по результатам ускоренного исследования и на основании результатов экспресс-методов.
Дата добавления: 2015-09-15 ; просмотров: 3814 . Нарушение авторских прав
У человека чума, особенно ее септическая (в результате попадания бактерий в кровоток) и легочная формы, без лечения может быть очень тяжелым заболеванием с коэффициентом летальности 30-100%. Без раннего начала лечения легочная форма всегда приводит к смерти. Она носит особенно контагиозный характер и способна вызывать тяжелые эпидемии, передаваясь от человека человеку воздушно-капельным путем.
В 2010-2015 гг. во всем мире было зарегистрировано 3248 случаев заболевания чумой, в том числе 584 случая со смертельным исходом.
Признаки и симптомы
У человека, заразившегося чумой, по прошествии инкубационного периода от 1 до 7 дней обычно развивается острое лихорадочное состояние. Типичными симптомами являются внезапное повышение температуры, озноб, головная боль и ломота в теле, а также слабость, тошнота и рвота.
В зависимости от пути проникновения инфекции различаются две основные формы чумной инфекции: бубонная и легочная. Все формы чумы поддаются лечению, если выявляются достаточно рано.
Где встречается чума?
Как болезнь животных чума встречается повсеместно, за исключением Океании. Риск заболевания чумой человека возникает тогда, когда отдельно взятая популяция людей проживает на месте, где присутствует естественный очаг чумы (т.е. имеются бактерии, животные резервуары и переносчики).
Эпидемии чумы случались в Африке, Азии и Южной Америке, однако с 1990-х годов большая часть заболеваний человека чумой имела место в Африке. К трем наиболее эндемичным странам относятся: Мадагаскар, Демократическая Республика Конго и Перу. На Мадагаскаре случаи бубонной чумы регистрируются практически каждый год во время эпидемического сезона (сентябрь-апрель).
Диагностика чумы
Для подтверждения диагноза чумы требуется лабораторное тестирование. Образцовым методов подтверждения наличия чумы у пациента является изоляция Y. pestis из образца гноя из бубона, образца крови или мокроты. Существуют разные методы выявления специфического антигена Y. pestis. Одним из них является лабораторно валидированный экспресс-тест с использованием тест-полоски. Этот метод сегодня широко применяется в странах Африки и Южной Америки при поддержке ВОЗ.
Лечение
Без лечения чума может приводит к быстрой смерти, поэтому важнейшим условием выживания пациентов и профилактики осложнений является быстрая диагностика и раннее лечение. При своевременной диагностике чума успешно лечится антибактериальными препаратами и поддерживающей терапией. Нелеченая легочная чума может закончиться летальным исходом через 18-24 часов после появления симптомов, однако обычные антибиотики для лечения болезней, вызванных энтеробактериями (грам-отрицательными палочками), могут эффективно излечивать чуму при условии раннего начала лечения.
Профилактика
Профилактические меры включают в себя информирование населения о наличии зоонозной чумы в районе их проживания и распространение рекомендаций о необходимости защищать себя от укусов блох и не касаться трупов павших животных. Как правило, следует рекомендовать избегать прямого контакта с инфицированными биологическими жидкостями и тканями. При работе с потенциально инфицированными пациентами и сборе образцов для тестирования следует соблюдать стандартные меры предосторожности.
Вакцинация
ВОЗ не рекомендует проводить вакцинацию населения, за исключением групп повышенного риска (например, сотрудников лабораторий, которые постоянно подвергаются риску заражения, и работников здравоохранения).
Борьба со вспышками чумы
- Обнаружение и обезвреживание источника инфекции: выявление наиболее вероятного источника инфекции в районе, где выявлен случай (случаи) заболевания человека, обращая особое внимание на места скопления трупов мелких животных. Проведение надлежащих мероприятий инфекционного контроля. Следует избегать уничтожения грызунов до уничтожения блох – переносчиков инфекции, поскольку с мертвого грызуна блохи перейдут на нового хозяина и распространение инфекции продолжится.
- Охрана здоровья медицинских работников: информирование и обучение работников здравоохранения мерам инфекционной профилактики и инфекционного контроля. Работники, находившиеся в непосредственном контакте с лицами, заболевшими легочной чумой, должны носить средства индивидуальной защиты и получать антибиотики в качестве химиопрофилактики в течение семи дней или по меньшей мере в течение времени, когда они подвергаются риску, работая с инфицированными пациентами.
- Обеспечение правильного лечения: обеспечение получения пациентами надлежащего антибиотического лечения, а также наличия достаточных запасов антибиотиков.
- Изоляция пациентов с легочной чумой: пациенты должны быть изолированы, чтобы не распространять инфекцию воздушно-капельным путем. Предоставление таким пациентам защитных лицевых масок может сократить риск распространения инфекции.
- Эпиднадзор: выявление и отслеживание лиц, находившихся в близком контакте с больными легочной чумой, и проведение среди них химиопрофилактики в течение 7 дней.
- Получение образцов, которые следует собирать с осторожностью, соблюдая все профилактические меры и процедуры инфекционного контроля, после чего отправить в лаборатории для тестирования.
- Дезинфекция: рекомендуется регулярно мыть руки водой с мылом или использовать спиртосодержащие гели для дезинфекции рук. Для дезинфекции больших площадей можно использовать 10-процентный раствор бытового отбеливателя (раствор следует обновлять ежедневно).
- Соблюдение мер предосторожности при захоронении умерших: распыление антисептиков на лицо/грудь трупов больных, предположительно умерших от легочной чумы, является нецелесообразным и не рекомендуется. Следует накрывать территорию пропитанными антисептиком тканью или абсорбирующим материалом.
Эпиднадзор и контроль
Для осуществления эпиднадзора и контроля необходимо проводить обследование животных и блох, вовлеченных в чумной цикл в регионе, а также разработку программ по контролю за природными условиями, направленных на изучение природного зоонозного характера цикла инфекции и ограничение распространения заболевания. Активное продолжительное наблюдение за очагами проживания животных, сопровождаемое незамедлительными мерами реагирования во время вспышек заболевания среди животных, позволяет успешно уменьшить число вспышек заболевания чумой среди людей.
Для эффективного и результативного реагирования на вспышки чумы важным условием является наличие информированных и бдительных кадров здравоохранения (и местного сообщества), что позволит быстро диагностировать случаи болезни и оказывать надлежащую помощь инфицированным, выявлять факторы риска, вести непрерывный эпиднадзор, бороться с переносчиками и их хозяевами, лабораторно подтверждать диагнозы и передавать компетентным органам информацию о результатах тестирования.
Ответные действия ВОЗ
Целью ВОЗ является предупреждение вспышек чумы путем проведения эпиднадзора и оказания содействия странам повышенного риска в разработке планов обеспечения готовности. Поскольку резервуар инфекции среди животных может быть разным в зависимости от региона, что оказывает влияние на уровень риска и условия передачи инфекции человеку, ВОЗ разработала конкретные рекомендации для Индийского субконтинента, Южной Америки и стран Африки к югу от Сахары.
ВОЗ сотрудничает с министерствами здравоохранения для оказания поддержки странам, где происходят вспышки заболевания, в целях принятия на местах мер по борьбе со вспышками.

3. Возбудитель туляремии. Биологические свойства. Патогенез, иммунитет, методы микробиологической диагностики и специфической профилактики туляремии.
4. Возбудитель сибирской язвы. Морфологические, культуральные, биохимические и антигенные свойства. Резистентность. Патогенность для человека и животных. Факторы патогенности, токсины. Патогенез заболевания у человека, иммунитет. Микробиологическая диагностика. Специфическое лечение и профилактика сибирской язвы.
Микробиологическая диагностика чумы.
Возбудитель чумы – Yersinia pestis относится к высокопатогенным микроорганизмам (1 группы патогенности). Взятие, доставка материала при подозрении на чуму и работа с ним производятся в специализированных лабораториях с соблюдением особых правил предосторожности (в противочумном костюме, с применением специальных средств и устройств, предотвращающих попадание микроорганизма на кожу, слизистые оболочки и в дыхательные пути медицинского персонала, а также на различные объекты внешней среды).
Лица, контактировавшие с материалом, подозрительным на содержание возбудителя чумы, подвергаются полной санитарной обработке.
Принципы микробиологической диагностики чумы отражены в схеме 4. Бактериоскопический метод. Мазки, приготовленные из исследуемого материала, фик-
сируют в смеси Никифорова, окрашивают по Граму и метиленовым синим. С целью экспрессдиагностики мазки обрабатывают также меченой люминесцирующей сывороткой к Y. pestis (прямой ИФМ). Предварительный положительный ответ выдается в случае обнаружения в мазках биполярно окрашенных грамотрицательных овоидных бактерий, окруженных нежной капсулой (рис.7), дающих специфическое свечение в РИФ.
В качестве других методов экспресс-диагностики чумы применяют РНГА с иммуноглобулиновым чумным диагностикумом, ИФА для индикации антигенов возбудителя.
Методы ускоренной и экспресс-диагностики дают возможность дать предварительный ответ через 4 ч от начала исследования, окончательный - через 18-20 ч.
Бактериологическое исследование. Кровь при подозрении на чуму засевают на МПБ во флаконах; содержимое бубона, отделяемое язвы, мокроту и другой материал — на МПА с
цельной или гемолизированной кровью кролика или лошади
сывороткой для нейтрализации чумного фага, раствором
Схема 4. Микробиологическая диагностика чумы Материал : пунктат из бубона, мокрота, кровь, испражнения

Микроскопия окрашенных по Граму и метиленовым синим мазков из материала от больного с целью обнаружения биполярно окрашенных грамотрицательных овоидных бактерий, окруженных нежной капсулой и дающих специфическое свечение оболочки в РИФ
Постановка РНГА, ИФА, РИФ, РНАг с целью определения анти-
тел в крови больного
Постановка ПЦР Подкожное, внутрибрюшинное,
накожное или скарификационное заражение материалом от больного морских свинок или белых мышей. Микроскопическое и бактериологическое исследование трупов павших животных
1. день. Посев на МПБ, кровяной МПА с антифаговой сывороткой, раствором генцианового фиолетового и сульфита натрия, селективную среду с антибиотиками (агар CIN ). Инкубация п осевов при 25-28 0 С.
4 день. Заключение о виде выделенной культуры на основании ее идентификации по морфологическим, культуральным, ферментативным, антигенным свойствам и фаголизабельности.
Рис. 7. Возбудитель чумы ( Yersinia pestis ).
а - чистая культура, окраска метиленовым синим.
Палочки овоидной формы, окрашенные биполярно.х 630. б – мазок из материала от больного, окраска по Граму. Грамотрицательные, биполярно окрашенные, капсулообразующие палочки овоидной формы. х1350
Типичные колонии пересевают на скошенный МПА, чистую культуру чумных бактерий идентифицируют по морфологическим, культуральным, ферментативным, антигенным свойствам (РА с использованием диагностических сывороток против высокоспецифичного капсульного и соматического антигенов), фаголизабельности, определяют ее чувствительность к антибиотикам. Возбудитель чумы восстанавливает нитраты в нитриты, ферментирует глюкозу, ксилозу, маннит с образованием кислоты (без газа). В отличие от многих других представителей семейства энтеробактерий имеет более низкий температурный оптимум роста и физиологической активности - 28 °С. В процессе идентификации возбудитель чумы необходимо дифференцировать с другими иерсиниями (табл. 6).
Биологическое исследование. Заражают морских свинок или мышей подкожно, внутрибрюшинно или накожно, материалом от трупов – методом скарификации.
Животные погибают на 2—7-е сутки. Одно из зараженных животных умерщвляют на 2— 3-й день с целью выделения культуры иерсиний из крови и внутренних органов. В мазках из внутренних органов, крови, экссудата погибших животных обнаруживают большое количество грамотрицательных, биполярно окрашенных бактерий. После исследования трупы животных погружают в 5% лизол, а затем сжигают.
Рис. 8. Колонии возбудителя чумы ( Yersinia pestis ). х56
Таблица 6. Биологические свойства иерсиний
Подвижность при: 25 0 С
Чувствительность к чумному фагу
Вирулентная форма колоний
Серологическое исследование проводится с целью ретроспективной диагностики чумы. Ставят РНГА с эритроцитами, на которых адсорбирован капсульный антиген возбудителя чумы, реакцию нейтрализации антигена (РНАг), ИФА и непрямую РИФ. Диагностический титр
Генодиагностика . Разработана ПЦР для экспресс-диагностики чумы.
Самостоятельная работа студентов
1. Изучение правил пользования противочумным костюмом .
2. Изучение морфологии Yersinia pestis (мазки из содержимого бубона больного чумой – демонстрация);
3. Знакомство с методами лабораторной диагностики чумы. Используется наглядный материал (таблицы, схемы, слайды).
Бактериоскопический метод (обратить внимание на типичную морфологию возбуди-

Бактериологический метод (обратить внимание на характер роста; биохимическую активность - чумная палочка разлагает с образованием кислоты левулёзу, арабинозу, глюкозу, мальтозу, маннит; антигенные свойства; фаголизабельность).
4. Знакомство с препаратом для специфической профилактики чумы - живой атте-
нуированной вакциной из штамма EV.
Микробиологическая диагностика туляремии
Резервуаром возбудителя туляремии ( Francisella tularensis ) являются грызуны, человек заражается от них всеми известными способами (при прямом и непрямом контакте, алиментарным, аэрогенным, трансмиссивным путем). По клиническим проявлениям тулерямия напоминает чуму, однако летальность при этой инфекции не высока (1-2%). Выделяют язвенножелезистую (бубонную), глазо-бубонную, ангинозно-буббонную, кишечную и легочную формы туляремии.
Методы микробиологической диагностики туляремии отражены в схеме 5. Для лабораторной диагностики туляремии широко используются иммунологические методы (серологическая диагностика, аллергические пробы), осуществляемые в обычных клинических условиях. Биопробы с выделением чистой культуры возбудителя проводятся в специализированных лабораториях особо-опасных инфекций.
Серологический метод. В сыворотке крови больных специфические антитела появляются с 10-12 дня болезни. В диагностических целях используют развернутую РА (диагностический титр 1:100 и выше), РНГА (диагностический титр 1:1280 и выше), ИФА.
Аллергическая проба. Выпускается 2 вида аллергена – тулярина для постановки соответственно накожной и внутрикожной аллергической пробы – раннего (положительная реакция ГЗТ с 5 дня болезни) и специфического метода диагностики туляремии. Наличие инфильтрата и гиперемии диаметром 1 см и более через 24-48 часов после введения тулярина расценивается как положительная реакция.
Биологический и бактериологический методы. Выделить культуры возбудителя от больного путем непосредственного посева материала на питательные среды не удается. Для выделения чистой культуры возбудителя туляремии применяется биопроба. С этой целью исследуемый материал (см. схему 5) вводят мышам или морским свинкам подкожно, накожно, внутрибрюшинно и/или через рот. Если экспериментальные животные в течение 7-15 дней не погибают, их умерщвляют и трупы подвергают бактериоскопическому и бактериологическому исследованию. Для этого готовят мазки-отпечатки из внутренних органов и окрашивают их по Рома- новскому-Гимзе. Возбудитель туляремии - мелкие (0,2-0,7 мкм) кокковидные и палочковидные бактерии, располагающиеся в мазках-отпечатках из органов внутриклеточно и в виде скоплений с образованием нежной капсулы (рис. 8). Применяют также методы экспрессдиагностики (обнаружение возбудителя в материале с помощью ИФМ и ИФА). Параллельно с микроскопическим исследованием кровь, костный мозг, участки внутренних органов и лимфатических узлов трупа животного засевают на одну из плотных питательных сред (желточная среда, среда МакКоя, глюкозо-цистиновый агар с кроличьей кровью и антибиотиками), которую культивируют при 37 0 С. Рост туляремийного микроба в виде нежных мелких колоний (рис. 10) появляется на 3-5-20 день, иногда позже. Возбудитель туляремии хорошо размножается также в желточном мешке 12-дневного куриного эмбриона.
Выделенную чистую культуру идентифицируют по морфологическим, антигенным (РА с туляремийной агглютинирующей сывороткой) и биологическим свойствам, определяют ее чувствительность к антибиотикам. В биохимическом отношении возбудитель туляремии мало активен (ферментация глюкозы, продукция сероводорода).
Схема 5. Микробиологическая диагностика туляремии
Материал : кровь, пунктат из бубона, соскоб из язвы, отделяемое конъюнктивы, налет из зева, мокрота и др., органы павших и больных животных, переносчики (слепни, клещи, комары), объекты внешней среды (вода, пищевые продукты, воздух).
Не существует методов лечения и профилактики АЧС, поэтому быстрая диагностика, строгий контроль состояния здоровья животных и противоэпизоотические мероприятия являются основой борьбы против АЧС.
Прогресс в области диагностики, связан с развитием высоко чувствительных методов, позволяющих надежно диагностировать острую, хроническую и инапарантную форму болезни в течение нескольких часов.
Существует множество методов обнаружения вируса и специфических антител. Наиболее часто используемыми в настоящее время методами диагностики АЧС являются: ПЦР (стандартная и в режиме реального времени) для обнаружения вируса; ИФА и имммуноблотинг для исследования сывороток. Дальнейшая схема показывает методы и их применение наиболее часто используемые в референтных лабораториях.

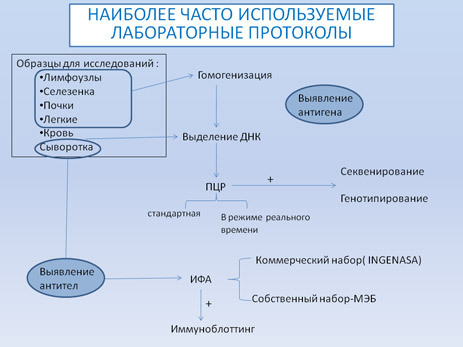
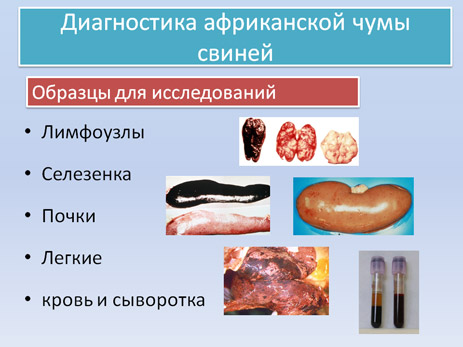
Требования к образцам направляемым в лабораторию
Для подтверждения/исключения АЧС в лабораторию направляют образцы селезенки, почек, лимфатические узлы. Также могут быть направлены образцы крови с антикоагулянтом (ЭДТА) от животных с повышенной температурой. Сыворотку от животных используют в серологических реакциях.
К направляемым образцам должна прилагаться сопроводительная документация с описанием клинического состояния животного.
Сопроводительная документация должна содержать:
- Имя и адрес владельца.
- Подозреваемую болезнь.
- Вид животного и время его нахождения на ферме (в хозяйстве). Это очень важно для обнаружения новых больных животных в хозяйстве.
- Дата обнаружения первых признаков болезни.
- Распространение болезни на ферме.
- Количество павших и животных с признаками болезни.
- Тип содержания и система производства.
- Лечебные мероприятия и вакцинации, проведенные в последние несколько дней.
- Перечень направляемых образцов.
МЕТОДЫ ВЫДЕЛЕНИЯ И ОБНАРУЖЕНИЯ ВИРУСА
Наиболее часто используемыми методами являются реакция гемадсорбции, реакция прямой иммунофлюоресценции и ПЦР.
Вирус АЧС выделяют с использованием первичной культуры клеток свиных макрофагов. В организме животного вирус инфицирует и реплицируется в лейкоцитах периферической крови, где вызывает развитие цитопатического эффекта в зараженных макрофагах. До наступления лизиса клеток вызванного вируса можно отметить феномен гемадсорбции. Микроскопические наблюдения показывают образование морул и розет из эритроцитов вокруг лейкоцитов.
Цитопатический эффект: цитопатический эффект можно наблюдать начиная с 12 после заражения клеток. Он выражается в группировании клеток, вауолизацией эндоплазматической сети и увеличением лизосомальных структур в клетке, приводящие в итоге к лизису клетки. Изменения в ядре клетки характеризуются конденсацией хроматина и появлением фибриллярных структур.
Гемадсорбция: Гемадсорбция представляет собой адсорбцию красных клеток крови вокруг инфицированных вирусом макрофагов. Не все штаммы вируса АЧС вызывают гемадсорбцию.
Некоторые штаммы АЧС являются не гемадсорбирующими. В этих случаях, должны быть проведены дополнительные исследования осадка клеток методами ПЦР и РПИФ, чтобы подтвердить наличие вируса.
Отсутствие гемадсорбции: Если цитопатический эффект в инфицированной культуре клеток проявляется без феномена гемадсорбции, это может быть связано с наличием негемадсорбирующего штамма АЧС, присутствием других вирусов (например при болезни Ауески) или даже от токсического эффекта от заражающего материала. В связи с этим, чтобы подтвердить наличие вируса АЧС, другие методы такие как ПЦР и РПИФ должны быть использованы.
Реакция гемадсобции является наиболее специфичным и чувствительным методом идентификации, поскольку ни один из вирусов поражающих свиней не вызывает развитие феномена гемадсорбции. Она является референтной методикой несмотря на трудности в постановке и продолжительности выполнения (5-10 дней). Обычно используется только в референтных лабораториях.
РПИФ рекомендуется использовать при отсутствии возможности проведения ПЦР. Данный метод лучше использовать совместно с другими серологическими тестами (ИФА и иммуноблотинг), что бы исключить ложноотрицательные результаты, вызванные блокировкой антителами.
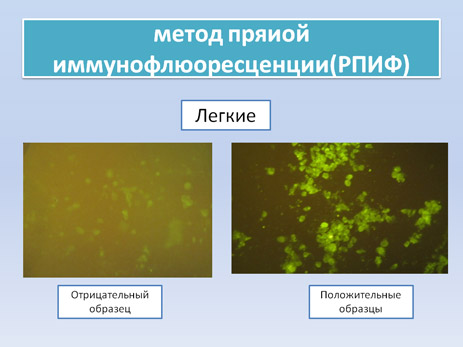
РПИФ основана на обнаружении вирусных антигенов в срезах тканей или мазках-отпечатках при взаимодействии с флюоресцентным конъюгатом. Это очень быстрый, простой и чувствительный метод, который также может быть использован при исследовании зараженных культур клеток. Микроскопические наблюдения показывают интенсивную флюоресценцию цитоплазматических включений в инфицированных клетках. При активном развитии инфекции флюоресценция может иметь зернистый вид.
В регионах где АЧС является эндемичной, и подострая и хронические формы болезни являются предоминантными, чувствительность данного метода уменьшается и составляет всего 40% при исследовании срезов органов и мазков-отпечатков.
Уменьшение чувствительности: при подострой и хронической формах болезни связано с наличием высокого уровня специфических антител. Они в свою очередь блокируют вирусные антигены и предотвращают специфическое связывание антивирусного флюоресцентного конъюгата.
Совместное использование РПИФ и РИФ или ИФА позволяет обнаруживать от 85% до 95% от всех случаев болезни (даже при наличии антител) менее чем за 1 час 15 минут. Не существует коммерческих наборов для данного метода.

ПЦР (полимеразная цепная реакция) наиболее часто используемая техника для обнаружения вируса. Она требует профессиональных навыков и достаточного опыта для постановки реакции, чтобы исключить контаминацию образцов и ложноположительные результаты. ПЦР является очень чувствительной и специфичной техникой обнаружения вируса , путем амплификации вирусной ДНК из исследуемого образца. В настоящее время широко используется референтными лабораториям для диагностики и подтверждения АЧС. ПЦР используется при исследовании образцов тканей и сывороток от животных с клиническими признаками болезни. Вирус припомощи ПЦР удается обнаруживать в крови больных животных начиная со 2 дня после заражения и в течение нескольких недель.

Референтные лаборатории:
Dr J.M. Sánchez-Vizcaíno
Facultad de Veterinaria, Laboratorio de Vigilancia Sanitaria (VISAVET), HCV Planta sótano, Universidad Complutense
Avda. Puerta de Hierro s/n, 28040 Madrid
ESPAÑA
Tel: (34.91) 394.40.82 Fax: (34.91) 394.39.08
Email: jmvizcaino@visavet.ucm.es
Dr Chris Oura
Institute for Animal Health, Pirbright Laboratory
Ash Road, Pirbright, Woking, Surrey GU24 ONF
REINO UNIDO
Tel: (44.1483) 23.24.41 Fax: (44.1483) 23.24.48
Email: chris.oura@bbsrc.ac.uk
Dr Baratang Alison Lubisi
Onderstepoort Veterinary Institute, Agricultural Research Council
Private Bag X5, Onderstepoort 0110
SUDÁFRICA
Tel: (27.12) 529.92.33 Fax: (27.12) 529.94.18
Email: Lubisia@arc.agric.za
Данный метод основан на применение праймеров комплементарных консервативному участку генома АЧС и позволяет обнаруживать широкий диапозон известных изолятов вируса АЧС, включая как гемадсорбирующие так и не гемадсорбирующие штаммы.
ПЦР может быть использована для исследования образцов плохого качества и малопригодных для исследований другими методами. При помощи ПЦР результаты могут быть получены в течение 5-6 часов.
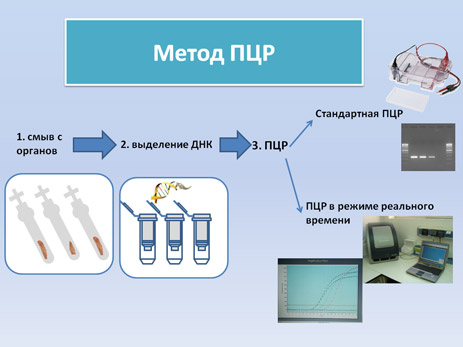
Существует два различных метода ПЦР-диагностики вируса АЧС. Для обоих из них необходимым является этап пробоподготовки и выделения ДНК перед непосредственным проведением ПЦР (смотри видео):
Стандартная ПЦР (смотри видео) (протокол): продукты реакции, полученные в результате амплификации вирусной ДНК, анализируются при помощи электрофореза в агарозном геле и УФ света.
ПЦР в режиме реального времени (смотри видео) (протокол): Для данного метода необходимо использование специального оборудования для детекции флюоресцентного сигнала. ПЦР в режиме реального времени имеет несколько преимуществ: анализ результатов в ходе реакции (реальном времени), возможность количественного определения вирусной ДНК, не требует постановки электрофореза.
Дальнейшее секвенирование ПЦР продуктов позволяет подтвердить положительные результаты реакции, и также определить генотип вируса при амплификации некотрых фрагментов генома вируса (ген p72, ген p54, центральный вариабельный регион -CVR).
СЕРОЛОГИЧЕСКИЕ МЕТОДЫ ОБНАРУЖЕНИЕ СПЕЦИФИЧЕСКИХ АНТИТЕЛ ПРОТИВ ВИРУСА АЧС.
Ввиду отсутствия вакцин против АЧС, наличие специфических антител к вирусу показывает наличие болезни.
Специфические антитела: антитела к вирусу АЧС обнаруживаются с 7 дня после заражения, и циркулируют месяцы даже годы. Данный факт очень полезен при диагностике подострой и хронической форм инфекции, а также для контроля и ликвидации болезни.
Большое количество серологических методов диагностики АЧС было разработано в последние годы, включая методы позволяющие выполнять диагностику в полевых условиях. В настоящее время наиболее используемыми являются реакция непрямой флюоресценции (РИФ), непрямой вариант ИФА и иммуноблотинг (ИБ).
Серологические методы являются основой лабораторной диагностики АЧС и используются в программах контроля и ликвидации болезни, благодаря их высокой чувствительности и специфичности.
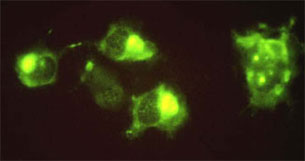
Данный метод является достаточно быстрым и обладает хорошей чувствительностью и специфичностью. Специфические к вирусу антитела находящиеся в сыворотке или экссудатах взаимодействуют с клетками инфицированными вирусом АЧС. В настоящее время практически не используется ввиду отсутствия коммерческих наборов для постановки реакции. Время постановки реакции занимает около 2 часов.
В случае положительного образца на клеточном монослое наблюдают флюоресценцию перинуклеарной области клеток, где расположен центр репликации вируса.
Этот метод используется для проведения широкомасштабного эпизоотического мониторинга и исследований при программах контроля болезни. Метод обладает высокой чувствительностью и специфичностью, простотой и быстротой выполнения и экономичностью. Хорошей воспроизводимостью результатов и легкостью интерпретации.
Недавно разработаны новые варианты ИФА, содержащие неинфекционные реагенты на основе рекомбинантных белков вируса p32, p54 и pp62. Они имеют большую чувствительность и специфичность при исследовании сывороток плохого качества.
Разработаны два варианта ИФА для обнаружения специфических к вирусу АЧС антител:
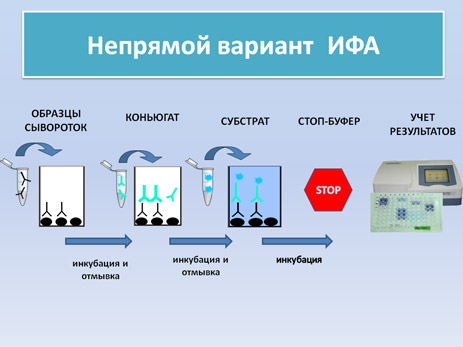
-Hепрямой вариант ИФА-OIE: данный метод разработан в лаборатории CISA-INIA и является официальным методом диагностики одобренным OIE: (смотри видео) (протокол)
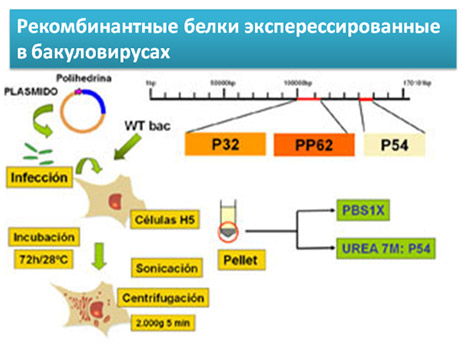
Настоящий метод ИФА основан на применение растворимого вирусного антигена содержащего большинство вирусных белков.
Рекомбинантные белки: Белки p32 и p54 являются высокоиммуногенными структурными белками вируса; полипротеин pp62 эксперссируется позднее и продуцирует два структурных белка p35 and p15. Перечисленные белки были получены методами генной инженерии путем клонирования кодирующих их генов в бакуловирусной системе.
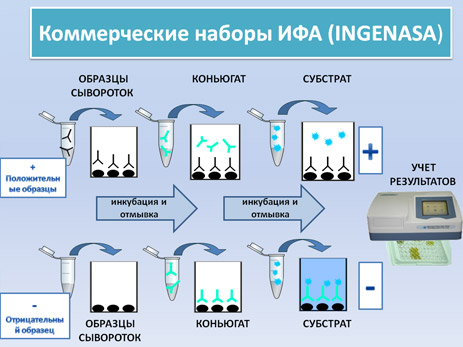
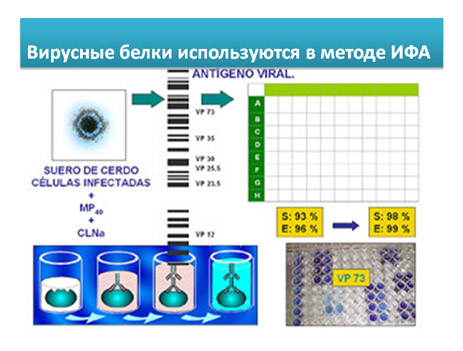
- Коммерческие наборы ИФА (INGENASA): (смотри видео) (протокол)
Это конкурентный вариант ИФА для обнаружения антител к белку vp73 вируса АЧС ( структурного компонента с высокой антигенной силой).
В данном ИФА наборе, на плашках иммобилизован белок vp73. После добавления исследуемой сыворотки, добавляются моноклональные анти-vp73 антитела, меченые пероксидазой. Моноклональные анти-vp73 антитела сорбируются на свободной от специфических антител поверхности плашки. Интерпретация результатов реакция прямо противоположна предыдущему варианту ИФА. Более интенсивная окраска лунки свидетельствует о меньшем количестве антител в сыворотке и наоборот.
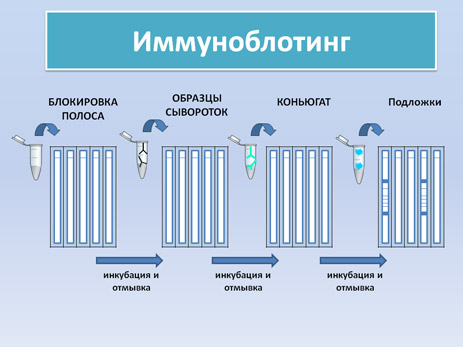
Является иммунофрементным методом основанном на применении нитроцеллюлозных фильтров, несущих предварительно сорбированные на них вирусные белки. Специфические к вирусу антитела взаимодействуют с иммобилизованными вирусными белками и получившийся комплекс выявляется при помощи меченого пероксидазой протеина А.
Вирусные белки: Белки используемые в ИБ для диагностики АЧС имеют молекулярную массу между 23.5 and 35 кДа, продуцируются клетками инфицированными вирусом. Именно эти белки первыми реагируют в ИБ на 7 день после заражения животного и обеспечивают постоянство антител у всех больных животных.
Иммуноблотинг позволяет определить реактивность антител против различных белков индуцируемых вирусом АЧС в сыворотках свиней. Таким образом, наряду с высокой чувствительностью и объективностью получаемых результатов, иммуноблотинг является идеальным методом для подтверждения африканской чумы свиней.
Этот метод выскочувствительный, легко выполним и не требует использования специального оборудования, но также не существует коммерческих наборов. Время постановки реакции занимает около 3 часов.
Другим преимуществом данного метода является возможность хранения стрипов, содержащих антиген, при комнатной температуре, без потери активности в течении более чем одного года, что означает безопасную возможность транспортировки реагентов.
Читайте также:


