Ингибиторы матричных биосинтезов дифтерийный токсин
Автор работы: Пользователь скрыл имя, 12 Апреля 2011 в 11:54, лекция
Подавление матричных биосинтезов может быть достигнуто либо путем структурной модификации матрицы и рибосом, либо путем инактивации ферментов.
Ингибиторы матричных биосинтезов_ФАРМ.doc
Ингибиторы матричных биосинтезов
Подавление матричных биосинтезов может быть достигнуто либо путем структурной модификации матрицы и рибосом, либо путем инактивации ферментов.
Антибиотики, подавляющие процесс трансляции прокариот могут использоваться как противобактериальные препараты.
Антибиотики, нарушающие функцию ДНК и РНК, находят применение при лечении злокачественных новообразований.
Токсичное действие возбудителей ряда инфекций обусловлено выделением веществ, специфически ингибирующих синтез белков в клетках организма человека. (α-аманитин, дифтерийный токсин).
Ингибиторы синтеза ДНК
Первый противоопухолевый антибиотик – дактиномицин – был получен в 1963 году. В настоящее время открыт целый ряд эффективных химиотер апевтических противоопухолевых препаратов, являющихся продуктами разных видов почвенных грибов или их синтетическими производными.
- Антибиотики:
- Актиномицины – в высоких концентрациях ингибируют ДНК-полимеразу.
- Антрациклины (даунорубицин, доксорубицин, рубомицин, карубицин, эпирубицин, блеомицин) – путем интеркаляции (обратимое связывание, встраивание в молекулу чего-либо) между парами азотистых оснований, нарушает вторичную спирализацию ДНК за счет взаимодействия с топоизомеразой II.
- Флеомицины (блеомицин, блеомицитин) – индуцируют фрагментацию ДНК с последующим образованием свободных радикалов.
- Разного химического строения (брунеомицин, митомицин – образует поперечные сшивки между нитями ДНК и угнетением синтеза ДНК и в меньшей степени в высоких концентрациях - РНК и белка).
- Алкилирующие средства – образуют перекрестные сшивки цепей ДНК, приводящие к разрывам цепей и гибели клетки.
- Производные бис-(вета-хлорэтил)-амина (Эмбихин, Пафенцил, Допан, Дегранол, Бендамустина гидрохлорид, Циклофосфан, Хлорбутин, Проспидин, Сарколизин, Спиробромин, Лофенал);
- Соединения, содержащие группы этиленимима и этилендиамина (Тиофосфамид, Имифос, Бензотэф, Гексафосфамид, Фторбензотэф, Фотрин, Дипин, Продимин, Фосфемид);
- Эфиры дисульфоновых кислот (алкилсульфонаты) и аналогичные препараты (Миелосан, Миелобромол);
- Нитрозомочевины (Нитрозометилмочевина, Дакарбазин).
- Алкалоиды растительного и полусинтетического происхождения:
- Ингибиторы топизомераз I и II (иринотекан, топотекан, этопозид, тенипозид) – связываются с комплексом топоизомераза-ДНК и препятствует респирализации (восстановлению разорванных связей).
Зидовудин (Азидотимидин; Виро-Зет; Вудазидин; Зайдовин; Зидо-Эйч; Зидовирин; Зидовудин; Зидовудин-Ферейн; Ретровир (Ретровир АЗиТи); Тимазид) – является аналогом тимидина и, конкурируя с ним, ингибирует обратную транскриптазу ДНК вирусов, включая вирус иммунодефицита человека (ВИЧ).
Идоксуридин (керицид, идуридин, офтон-УДИ) – является аналогом тимидина, встраивается в молекулу ДНК, подавляет репликацию отдельных ДНК-содержащих вирусов.
Видоробин (аденина арабинозид) – угнетает вирусную ДНК-полимеразу.
Ацикловир (ацивир, виролекс, зовиракс, цевирин) – синтетический аналог пуриновых нуклеозидов, включается в цепочку вирусной ДНК, вызывает обрыв цепи и блокирует дальнейшую репликацию вирусной ДНК без повреждения клеток хозяина.
Ингибиторы синтеза РНК
- Актиномицин D (космеген, лиовак) – ингибирует РНК-полимеразу.
- Производные ауреоловой кислоты (оливомицин) – подавляет ДНК-зависимый синтез РНК.
- Природные антибиотики (рифамицин, рифампицин – синт.) – (противотуб.) ингибирует РНК-полимеразу ПРОКАРИОТ.
Ингибиторы биосинтеза БЕЛКА
- Пуромицин – конкурентный ингибитор аа-т-РНК, вызывает преждевременную терминацию, включаясь в С-концевой участок синтезированной ППЦ.
- Хлорамфеникол (левомицитин) – Ингибирует пептидилтрансферазу бактерий.
- Тетрациклин, Эритромицин – тормозит связывание аа-т-РНК в А–участке рибосоме бактерий.
- Циклогексимид – тормозит транслокацию рибосомы.
- Стрептимицин, Неомицин – нарушает процесс считывания информации с м-РНК, АМК, включающиеся в белок не соответствуют кодону на м-РНК – синтезируется аномальный белок, и бактерии гибнут.
- Пенициллин – Тормозит синтез пептидов клеточной стенки бактерий
- Интерфероны – синтезируется в клетках в ответ на заражение её вирусом. Индуцируют образование протеина, который фосфорилирует FI2 – блокирует синтез белка. Повышают активность рибонуклеаз, расщепляющих м-РНК и р-РНК.
Вирусы и токсины - ингибиторы матричных биосинтезов
- Вирусы – внедряются в клетку хозяина, включаются в ДНК и прекращают синтез всех видов ДНК, РНК и белков у человека
- Альфа-аманитин (из гриба бледной поганки) – ингибирует РНК-полимеразу II и III.
- Дифтирийный энтеротоксин – вызывает АДФ-рибозилирование FЭ2 (фактора элонгации 2)
- Рицин (из клещевины обыкновенной, компонент касторового масла) – фермент, удаляет аденин из 28S-РНК большой субъединицы рибосомы и ингибирует синтез белков у эукариот.
Прекращение матричных биосинтезов ведет к гибели клетки. На этом основано применение антибиотиков (АБ), веществ, продуцируемых микроскопическими грибами, для лечения инфекционных болезней и злокачественных опухолей. АБ, взаимодействующие с ДНК, нарушают ее матричную функцию и подавляют репликацию или транскрипцию. Их применяют для лечения опухолей. Противоопухолевые АБ не отличаются избирательностью, т.е. практически взаимодействуют с ДНК как опухолевых, так и нормальных клеток. Поэтому при лечении могут повреждаться здоровые клетки, что требует хорошо поставленного контроля при использовании противоопухолевых АБ.
АБ, взаимодействующие с белками рибосом, ингибируют трансляцию. Они применяются в основном как противобактериальные средства, отличаются достаточно высокой избирательностью и часто сравнительно мало токсичны для человека. Это объясняется различиями в строении белков рибосом и бактерий человека.
- группа белков, регулирующих реакцию клетки на вирусную инфекцию. Синтез интерферонов индуцируется некоторыми компонентами вирусных частиц, в частности двуспиральной РНК, имеющейся во многих вирусах. Интерферон в свою очередь индуцирует синтез фермента протеинкиназы, которая катализирует фосфорилирование фактора инициации IF2:
В результате фактор инициации утрачивает активность, и синтез белков в клетке прекращается. Кроме того, интерферон активирует латентную РНКазу (механизм активации последней связан с активацией под влиянием интерферонов 2’,5’-олиго(А)-синтазы и накоплением в клетке 2’,5’-олиго(А)), которая расщепляет матричные и рибосомные РНК. Конечно, это ведет к гибели клетки, но вместе с ней погибают и вирионы.
Ингибирование синтеза белков дифтерийным токсином
Возбудитель дифтерии, размножающийся в слизистой зева, выделяет токсин белковой природы. Этот белок, состоящий из одной полипептидной цепи с мол. массой
60000, поступает в клетку, где под действием протеиназ клеток хозяина распадается на два фрагмента: А и В. Фрагмент А представляет собой фермент АДФ-рибозилтрансферазу, переносящий АДФ-рибозильный остаток с НАД + на фактор элонгации ЕF2:
НАД + + EF2 ® АДФ-рибозил-EF2 + никотинамид
Модифицированный таким образом фактор элонгации утрачивает способность участвовать в регенерации EF1 и трансляция прекращается. Этим объясняется токсическое действие белка. Фрагмент В не обладает ферментативной активностью, не токсичен. Он необходим для проведения фрагмента А через клеточную мембрану внутрь клетки.
С действием токсина связаны все основные симптомы дифтерии. Размножающиеся бациллы выделяют токсин, вследствие чего клетки слизистой зева погибают, и развивается воспалительная реакция. Из лейкоцитов, экссудата и погибших клеток образуется пленка, которая может стать причиной асфиксии, наиболее опасного осложнения дифтерии. Кроме того, дифтерийный токсин вызывает поражение сердца, что является частым осложнением заболевания.
Молекулярные механизмы генетической изменчивости
Естественный отбор и биологическая эволюция невозможны без генетической изменчивости, которая возникает за счет мутаций и рекомбинаций в процессе мейоза. В последнем случае происходит обмен участками ДНК между гомологичными хромосомами родителей.
С изменчивостью связаны такие явления как гетерогенность популяций человека и существование наследственных болезней.
Генные мутации
Мутации – это нерепарированные изменения первичной структуры ДНК, появляющиеся в молекуле в ответ на дефекты в работе ДНК-полимераз или ДНК-репарирующих систем, воздействия внешней и внутренней среды.
Точечные мутации (затрагивающие один нуклеотид ДНК) в основном бывают трех видов: замены (это наиболее распространенный тип повреждений молекулы ДНК), вставки и делеции (или выпадения) нуклеотидов.
Каждый тип мутации вызывает разные последствия: так, замена нуклеотида а) может быть “молчащей” и не проявиться в белке, если кодирующий триплет, в котором находится мутантный нуклеотид, из-за вырожденности кода обеспечивает включение в белок той же аминокислоты, что исходный кодон; б) может сопровождаться включением в белок одной измененной аминокислоты (миссенс-мутация). Так возникла, например, мутация, проявляющаяся как серповидно-клеточная анемия: кодон, ответственный за включение Glu в положение 6 b-цепи гемоглобина, превратился в кодон Val; в) если в результате замены образуется один из терминирующих кодонов – UAA, UAG или UGA (нонсенс-мутация), то синтез пептидной цепи обрывается и получается укороченный вариант белка.
Делеции и вставки также приводят к неоднозначным результатам: а) если включается или выпадает один нуклеотид или участок ДНК, в котором число нуклеотидов не кратно трем, то происходит сдвиг рамки считывания информации и при трансляции вся информация, расположенная за местом мутации, считывается неверно. В результате такой мутации синтезируется белок с бессмысленной последовательностью аминокислот. Такого типа мутации вызывают вещества, интеркалирующие (встраивающиеся) между азотистыми основаниями молекулами ДНК; б) если выпадает или включается в ДНК участок с длиной цепи, кратной 3, то сдвига рамки не происходит (делеция или вставка без сдвига рамки считывания информации). Белок, который зашифрован такой мутацией, будет либо укорочен (при делеции), либо удлинен (при вставке) на одну или несколько аминокислот.
В большинстве случаев мутации влияют на экспрессию или структуру генов, что проявляется в снижении количества или изменении структуры белкового продукта, а, следовательно, и его функциональной активности. Иногда снижение ил полное отсутствие белка является результатом мутаций в регуляторных участках генов.
Мутации в половых клетках передаются по наследству и могут проявляться в фенотипе потомства как наследственная болезнь, связанная со структурным или функциональным изменением белка. В соматических клетках мутации могут вызвать различные функциональные нарушения, такие как непереносимость некоторых пищевых и лекарственных веществ, предрасположенность к определенным заболеваниям, а иногда трансформацию клеток и развитие опухолей.
У разных особей возникают варианты (мутации) разных генов или варианты одного и того же гена. Варианты генов, образующиеся у отдельных особей, могут постепенно распространяться в популяции в результате наследования, если они не летальны. Так формируется генотипическая неоднородность популяции, которая ведет и к фенотипической неоднородности. На молекулярном уровне наиболее изучен (как следствие генотипической гетерогенности) полиморфизм белков – существование разных форм белка, выполняющего одинаковые или очень сходные функции (изобелки).
Причинами, приводящими к образованию изобелков, являются: 1) мутации; 2) рекомбинации. Гомологичные хромосомы половых клеток в процессе мейоза могут обмениваться аллелями или их частями. Если при рекомбинации аллельные гены обмениваются не целиком, а участками меньшей длины, то такой обмен будет приводить к появлению новых, прежде не существовавших в популяции аллелей (а не просто новых сочетаний прежних аллелей). Рекомбинации – гораздо более частые события, чем мутации, поэтому разнообразие форм внутри вида обусловлено главным образом именно рекомбинациями; 3) амплификация генов. При дихотомической эволюции происходит удвоение генов, т.е. образуются новые генные локусы: сначала это копии исходного гена, но последующие мутации копий приводят к появлению в организме изобелков. В этом случае варианты белка являются продуктами разных генных локусов, а не аллельных генов.
Т.о., изобелки – это множественные молекулярные формы белка, обнаруживаемые в пределах организмов одного биологического вида, как результат наличия в генотипе вида множественных аллелей или множественных генных локусов.
Примеры полиморфизма белков. Гемоглобин
Гемоглобины А (a2b2), А2 (a2d2), F (a2g2) содержатся в эритроцитах всех людей. Гены этих белков не аллельны – они занимают разные локусы. Эти гены возникли в результате дупликации гена-предшественника и последующих независимых мутаций. Но в крови некоторых людей обнаруживаются гемоглобины, являющиеся продуктами аллельных генов. Один из вариантов – это HbS. По аллелям HbA и HbS все люди делятся на три группы с генотипами AA, AS и SS. У людей первой группы эритроциты содержат HbA, у второй – HbA и HbS, у третьей – HbS. Распространенность аллеля S – людей с генотипами AS и SS – географически неравномерна: у некоторых народностей Азии и Африки – до 35%, тогда как у европейцев встречается редко.
Существует еще один вариант гемоглобина: Hb C (β6Glu→Lys). По этой паре аллелей существуют генотипы АА, АС и СС. Теперь всех людей можно разделить на пять генотипически и фенотипически разных групп: AA, AS, SS, АС, СС. Известно около 300 аллельных вариантов гемоглобина А. Следовательно, по всем аллелям HbA люди образуют около 600 генотипически различающихся групп.
Группы крови
Групповая принадлежность крови определяется системой АВО, имеющей важное значение для практики переливания крови.
Интегральный гликопротеин глифорин присутствует только в плазматической мембране эритроцитов. К N-концевой части белка, расположенной на наружной поверхности мембраны, прикреплено около 20 олигосахаридных цепей. Олигосахариды гликофорина – антигенные детерминанты системы групп крови АВО.
У созревающих эритроцитов этот олигосахарид имеет последовательность: фукоза - галактоза – N-ацетилглюкозамин – R. Олигосахарид ковалентно связан с липидами мембраны. При созревании эритроцита олигосахарид удлиняется на один моносахаридный остаток. Присоединение моносахарида к галактозе катализирует фермент гликозилтрансфераза. В популяции человека встречаются три аллельных гена этого фермента (А, В и О) и соответственно три аллельных варианта фермента, которые обозначаются теми же буквами. Варианты фермента А и В различаются по субстратной специфичности: вариант А присоединяет к олигосахариду N-ацетилгалактозу, а вариант В – галактозу. Аллельный ген О кодирует синтез белка, не имеющего ферментативной активности. Т.о. разные аллели обусловливают образование гликозилтрансфераз, катализирующие процессы:
аллель А ® фермент А ® олигосахарид А
аллель В ® фермент В ® олигосахарид В
аллель О ® неактивный белок ® олигосахарид не достроен.
Разветвленные олигосахариды А и В являются антигенами. К каждому из них могут вырабатываться антитела. При смешивании раствора анти-А с кровью, эритроциты которой содержат антиген А, происходит агглютинация эритроцитов. То же происходит при встрече анти-В с эритроцитами, содержащими антиген В. Поэтому при переливании крови руководствуются правилом: кровь донора и реципиента не должна содержать антиген и антитело, реагирующие между собой, иначе произойдет агглютинация эритроцитов и гемолиз.
В настоящее время известны десятки белков, для которых найдены множественные формы. Есть основания считать, что у значительной части из десятков тысяч структурных локусов генома человека имеются аллели. А это значит, что число разных генотипов может быть практически неисчерпаемым.
Полиморфизм белков и других биохимических структур настолько велик, что можно говорить о биохимической индивидуальности. С биохимической индивидуальностью связаны и индивидуальные особенности развития и здоровья.
Использование ДНК-технологий в медицине
Получение рекомбинантных ДНК.
Получение гена или его фрагмента осуществляется, как правило, с использованием рестриктаз – ферментов из группы эндонуклеаз, “узнающих” определенную последовательность нуклеотидов ДНК и расщепляющих обе нити. Расщепление обеих нитей ДНК может происходить двояким путем с образованием двухцепочечных (“слепых”) или одноцепочечных (“липких”) концов.
Ген или его фрагмент, имеющий “липкий” конец, может по принципу комплементарности взаимодействовать с “липким” концом другого, не родственного ему фрагмента ДНК, полученного при действии на ДНК одной и той же рестриктазы. Фрагменты ковалентно соединяют друг с другом с помощью ДНК-лигазы и получают рекомбинантные (гибридные) ДНК. Далее, с помощью вектора, обычно ретровируса, чужеродный ген вводится в бактерию, и здесь обеспечивается репликация, транскрипция и трансляция с образованием нужного продукта.
С помощью техники рекомбинантных ДНК оказалось возможным: а) использовать микроорганизмы в качестве продуцентов веществ, необходимых для человека (инсулин, гормон роста, VIII фактор свертывания крови для лечения гемофилии); б) лечить наследственные и ненаследственные (инфекционные) заболевания путем введения генов в клетки пациентов для устранения дефектов генов или придания им новых функций. Впервые эта задача была успешно решена в 1990 году, когда 4-летней девочке, страдающей наследственным иммунодефицитом, вызванным мутацией в гене аденозиндезаминазы, были пересажены ее собственные лимфоциты, предварительно трансформированные вне организма рекомбинантной ДНК, содержащей ген аденозиндезаминазы и ретровирусный вектор. В настоящее время предпринимаются попытки лечения подобным способом некоторых наследственных заболеваний, а также ВИЧ-инфекции.
Полимеразная цепная реакция (ПЦР)
- метод получения большого числа копий (несколько миллионов) гена или его фрагмента за короткий период времени в условиях репликации in vitro, требующий очень малых количеств исходной ДНК в образце. Объектами для выделения ДНК могут быть кровь, раневое отделяемое и т.д. Метод широко используется, в частности, в микробиологии для тестирования инфекционных возбудителей.
Дата публикования: 2015-11-01 ; Прочитано: 1156 | Нарушение авторского права страницы
studopedia.org - Студопедия.Орг - 2014-2020 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.004 с) . 
Один из путей выяснения тонких молекулярных механизмов синтеза нуклеиновых кислот и белков в клетках – использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не влияя на клетки организма человека. Некоторые препараты, действительно, оказывают такое избирательное действие, взаимодействуя с белками рибосом прокариот и выключая бактериальный синтез белка. Однако многие из них являются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена с целью выяснения молекулярного механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Один из мощных ингибиторов белкового синтеза – пуромицин. Он представляет собой аналог концевого участка аминоацил-тРНК адениловой кислоты и поэтому легко взаимодействует с А-центром пептидил-тРНК с образованием пептидил-пуромицина :
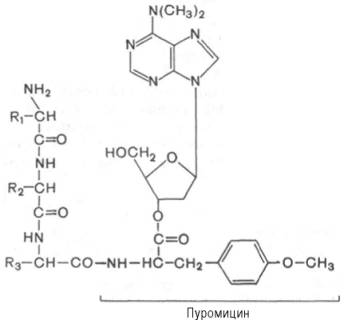
Пептидил-пуромицин не несет на себе триплета антикодона и поэтому тормозит элонгацию пептидной цепи, вызывая обрыв реакции, т.е. преждевременную терминацию синтеза белка. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo. Укажем также, что пуромицин оказывает тормозящее действие на синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, однако вследствие высокой токсичности препарат применяется редко. Он тормозит синтез всех типов клеточной РНК, особенно мРНК. Данное свойство объясняется тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней; это дает основание считать, что актиномицин D ин-гибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу, связываясь с ферментом. Наиболее чувствительной к нему оказалась бактериальная РНК-полиме-раза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина D. Следует указать, кроме того, на недавно открытое противовирусное действие рифамицина; в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. Это дает основание предположить, что данный антибиотик найдет применение в клинической онкологии при лечении опухолей, вызываемых вирусами.
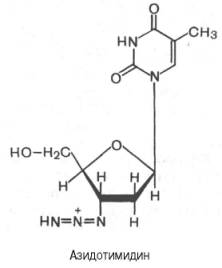
Одним из мощных ингибиторов синтеза вирусной РНК оказался азидотимидин (3'-азидо-2',3'-дидезокситимидин), синтезированный еще в 1964 г. в надежде на его противоопухолевый эффект. Было показано, что вирус иммунодефицита человека (ВИЧ) содержит РНК-й геном, в составе которого имеются как стандартные гены ретровирусов, так и необычные небольшие гены со множеством функций. Последние, в частности, подвержены мутациям с высокой скоростью вследствие низкой точности репликации, вызванной свойствами обратной транскриптазы. Эта вирусная обратная транскриптаза иммунодефицита человека оказалась наделенной значительно большим сродством к азидотимидину, чем к природному дезокситимидинтрифосфату (dTТФ). Азидотимидин конкурентно тормозит связывание dTТФ, вызывая тем самым терминацию (окончание) синтеза вирусной РНК.
Выяснены некоторые детали механизма действия ряда других антибиотиков, используемых при лечении тифозных инфекций. Так, хлорам-феникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий; на этот процесс в 80S рибосоме он не действует. Тормозит синтез белка в 80S рибосоме (без поражения процесса в 70S рибосоме) циклогексимид – специфический ингибитор транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделенным способностью катализировать реакцию АДФ-рибозилирования фактора элонгации эукариот (eEF-2), выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину, вероятнее всего, обусловлена трудностью или полным отсутствием проникновения (транспорта) токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Было высказано предположение, что эти антибиотики обусловливают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами: например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате чего образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считают, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S рибосоме. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Пенициллины не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомного механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т.е. тормозят синтез белка в клетках животных.
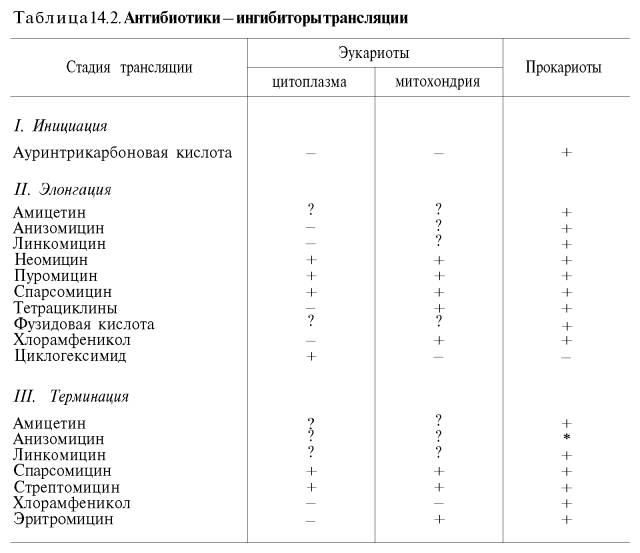
Полученные к настоящему времени данные о механизме действия антибиотиков на синтез белка с учетом стадии и топографии процесса трансляции суммированы в табл. 14.2 (по Харперу с небольшими изменениями).
Следует еще раз подчеркнуть, что нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и соответственно изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально.
Следует отметить, однако, что организм располагает мощными механизмами защиты. Подобные изменения генетического аппарата быстро распознаются специфическими ферментами – рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.
26. Механизм матричных биосинтезов: репликация ДНК, обратная транскрипция. Повреждения ДНК, повреждающие факторы. Репарация ДНК. Последствия повреждений ДНК.
Механизм матричных биосинтезов-способность к переносу генетич инф-ии. ДНК-рнк-белок.
1-репликация-синтез ДНК на матрице ДНК. Инициация репликации происходит в S фазу клет цикла., при инициирующем участии факторов роста, образование репликативной вилки, фрагментарный синтез (фрагменты Оказаки) новых цепей при участии фрагментов ДНК-полимеразы и ДНК-лигазы. (ингибиторы-противоопухолевые препараты)
2-транскрипция-синтез РНК на матрице ДНК. Инициация-образ транскрипционной вилки, Элонгация-рост цепи РНК, Терминация-аавершение синтеза, постранскрипционная модификация, формирование защиты, удаление некодирующих участков.
3-обратная транскрипция-синтез ДНК на матрице РНК
4-трансляция-синтез белка на матрице РНК
Повреждение-выявление нарушений повреждений, устранение ошибок, восст.целостности по принципу комплиментарности. Ферменты репарации-эндонуклеаза,рестриктаза,ДНК-полимераза-лигаза.
Причины-снижение активности ферментов репарации, истощение системы репарации, повреждение комплиментарности.
27. Биосинтез белков. Биологический код. Последовательность этапов в синтезе полипептидной цепи. Ингибиторы матричных биосинтезов. Посттрансляционная модификация белка.
Биосинтез белков - матричный биосинт.- способность к переносу генетической информации- способность живых оргз. ДНК - РНК - белок. 1.репликация - синтез ДНК на матице ДНК. 2.Транскрипция РНК на ДНК. 3.Обратная транскрипция ДНК на РНК. 4.Трансляция - белок на РНК
Ингибиторы-противоопухолевые препараты, яды,противобактериальные преп.
Трансляция-перевод генетич.языка и последоват АК в стр-ре белка.
Инициация-связывание тРНК с малой субъединицей рибосом через инициирующие кодоны, участие белковых факторов инициации (ингибиторы-стрептомицин, интерферон, тетрациклин)
Элонгация(удлинение)-образ пептидной связи, транслокация-перемещение рибосомы на 1 триплет, скорость синтеза 100 АК за 2 минуты. (ингибиторы-левомицитин, эритромицин,дифтерийный токсин)
Терминация-происх.в месте присутствия на мРНК терминального кодона.
Посттрансляционная модификация белка(созревние белка)-частичный протеолиз, модификация АК,фолдинг-формирование 2,3и 4й стр-ры
Последовательность аминокислот в полипептидных цепях зашифрована в виде последовательности триплетов дезоксирибонуклеотидов значащей цепи гена ДНК.
Св-ва генетического кода
1 Код триплетный
3 Код однозначен. Каждый триплет кодирует только одну аминокислоту.
4 Универсален. На всех уровнях живых систем конкретная аминокислота кодируется одним и теми же триплетами.
5 Соседние кодоны не имеют общих нуклеотидов.
6. между кодонами нет вставочных нуклеотидов. 7 Код однонаправленный. 5'-3'.
28. Основные компоненты белоксинтезирующей системы. Их строение, свойства, функции. Условия, обеспечивающие физиологический уровень работы системы.
Белоксинтезирующая система. Необходимы следующ. компоненты: 1.аминокислоты; 2.фак- торы инициации, элонгации, тер- минации; 3.транспортные РНК; 4.аминоацил-тРНК-синтетазы; 5. АТФ 6.матричная РНК; 7.ГТФ; 8.рибосомы; 9.ионы Мg. Первичная структура синтезируемого белка определяет первичной структурой мРНК, добавленной в систему.
29. Клеточная дифференцировка и онтогенез как результат регуляции активности генов. Доказательство идентичности первичной структуры ДНК в разных типах клеток одного организма. Стволовые клетки.
30. Молекулярные механизмы генетической изменчивости: молекулярные мутации, рекомбинации, увеличение числа и разнообразия генов в генотипе в ходе эволюции. Влияние условий среды. Молекулярные болезни.
Изменения генетической программы ДНК кл. - мутации. Различают хромосомные мутации (изменение числа хромосом, хромосомные аберрации) и молекулярные, или генные, мутации. Существуют следующие варианты генных мутаций: 1.транзиция, или замена пар оснований; 2.делеция, или выпадение одной пары или групп пар оснований (нуклеотидов) ; 3.вставка одной пары или групп пар оснований (нуклеотидов); 4.изменение местоположения отдельных участков ДНК. Генные мутации вызывают изменения генетического кода, нарушая порядок чередования нуклеотидов в ДНК и f транскриптонов. Мутации в структурных генах РНК могут привести к образованию дефектных тРНК и рРНК, что скажется на осуществляемых ими f (узнавании и транспорте соответствующих АК и сборке рибосом). Бывают природные мутагены, повышающие частоту спонтанных мутаций, и чужеродные. К природным относятся пероксидные соединения, альдегиды, свободные радикалы. К чужеродным мутагенам относятся хим. вещ-ва (алкилирующие соединения,НNO3, гидроксиламин, окислители), физич. (ионизирующие излучения) и биолог. факторы (вирусы способствуют образованию в клетке энзимов, повреждающих ее ДНК). Мутагены окружающей среды чрезвычайно многочисленны, что приводит к постоянному накоплению в последующих поколениях наследственных болезней. Высокой мутагенной активностью обладает радиоактивное излучение. Фоновая радиация среды постоянно повыш, за последние 30 лет она возросла на 10%, что увеличило частоту мутаций у людей. Многие лекарственные средства могут обладать выраженной мутагенной активностью. Особенно опасно применение хим. лекарственных вещ-в в период беременности, поскольку, проникая через плаценту, они могут вызвать пороки эмбрионального развития, уродства (действие препаратов называется тератогенным).
31. Основные условия биосинтеза нуклеотидов (субстраты, витамины, энергетическое обеспечение, регуляция). Катаболизм нуклеотидов. Образование и выделение конечных продуктов.
Синтез начинается с образования 5-фосфорибозил-1-амина.
Далее протекают реакции образования пуринового ядра. В результате образуется инозиновая к-та (ИМФ) - нуклеотид, пуриновая часть * представлена гипоксантином, служит предшественником основных пурин. нуклеотидов - АМФ,ГМФ.Регуляция биосинтеза. Реакция образования 5-фосфорибозиламина является лимитирующей стадией биосинтеза пуриновых нуклеотидов. Фермент катализирующий эту реакцию, ингибируется адениловой и гуаниловой к-ми. Кроме того, эта метаболическая цепь регулируется в месте ее разветвления: АМФ ингибирует реакцию образования аденилосукцината, а ГМФ — реакцию образования ксантиловой к-ты. механизм регуляции обеспечивает поддержание необходимой скорости синтеза АМФ и ГМФ. Катаболизм пуриновых нуклеотидов. Включ. реакции гидролитического отщепления фосфатного остатка, рибозного остатка и аминогруппы. В результате этих реакций из АМФ образуется гипоксантин, а из ГМФ — ксантин; в конечном счете пуриновое ядро пуриновых нуклеотидов превращается в мочевую кислоту при действии ксантиноксидазы.
32. Нарушение обмена нуклеотидов, возможные причины, формирование патологии, гиперурикемия, гиперурикурия (подагра, синдром Леша-Нихана, ксантинурия, оротацидурия).
Подагра. В крови здоров. человека содержится 3-7мг мочевой к-ты. Хроническое повышение концентрации мочевой к-ты (гиперурикемия- повышенная концентрация уратов в тканях). Мочевая к-та плохо растворима в воде. Даже небольшое повышение концентрации мочевой к-ты в крови и тканях приводит к образованию кристаллов. Хар-ный клинический признак подагры - приступы острого воспаления суставов. Подагрический криз связан с отложением кристаллов мононатриевой соли мочевой к-ты (урата натрия) в суставе. Кристаллы урата фагоцитируются лейкоцитами, в * под действием этих кристаллов разрушаются мембраны лизосом; освободившиеся лизосомные ферменты разрушают кл., а продукты клеточного, распада вызывают воспаление. Подагрические узлы возникают в результате местного отложения и накопления уратов.. Отложение уратов в ткани почек приводит к почечной недостаточности.
Читайте также:


