Иерсиниоз лечение в россии
Иерсиниоз является серьезной проблемой для многих регионов России. На клиническом примере рассматриваются отличия желтушной формы иерсиниоза от типичной формы вирусного гепатита, показана роль современных методов лабораторной диагностики и лечения иерсини
Yersiniosis is a serious problem in many regions of Russia. The differences in icteric forms of yersiniosis from the typical forms of viral hepatitis are shown in the clinical case. The role of modern methods of laboratory diagnosis and treatment of yersiniosis in children are discussed.
Заболеваемость иерсиниозом в Российской Федерации в течение 2010–2015 гг. стабильно высокая с неравномерным распределением по отдельным территориям. Более высокие показатели заболеваемости от 50 до 150 и более на 100 000 детей регистрируются в северных регионах России. Показатели на юге России значительно ниже — от 6 до 10 на 100 000 детского населения [1].
Возбудитель заболевания Yersinia enterocolitica длительно сохраняется в окружающей среде (до нескольких месяцев), что определяет его эпидемическую значимость.
Основным источником инфекции являются животные, больные иерсиниозом люди и бактериовыделители, что подтверждается ростом инфицированных лиц при осложнении эпидемической ситуации и возможностью внутрибольничного заражения иерсиниозом.
В естественных условиях возбудители иерсиниоза существуют как паразиты грызунов и выделяются во внешнюю среду с испражнениями и мочой. Наиболее обсемененными иерсиниями являются длительно хранящиеся овощи, в которых обнаружение возбудителя может составлять 10–20% и более [2].
Клиническая диагностика иерсиниоза затруднена в связи с полиморфизмом симптоматики, которую можно принять за различные заболевания инфекционной и не инфекционной природы. Выделяют следующие клинические формы иерсиниоза: гастроэнтероколитическую, желтушную, артралгическую, экзематозную, менингеальную, катаральную, смешанную и септическую.
Клиническая картина иерсиниоза характеризуется острым началом, токсикозом, повышением температуры тела до 39–40 °C, симптомами поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе схваткообразного или постоянного характера, жидкий стул). С первого дня заболевания у больных могут отмечаться мышечные и суставные боли, инъекция сосудов склер и конъюнктивы, катаральные явления в ротоглотке, экзантема и др. При развитии желтушной формы иерсиниоза на первый план выступают симптомы поражения печени: боли в правом подреберье, увеличение размеров печени и ее болезненность при пальпации, иктеричность кожи и склер, потемнение мочи, обесцвеченный кал [3, 4]. Общая клиническая картина желтушной формы иерсиниоза мало похожа на вирусный гепатит, но среди ошибок диагностики иерсиниоза, протекающего с желтухой, данная форма заболевания чаще всего трактуется как вирусный гепатит.
Следует отметить, что при желтушной форме иерсиниоза и вирусного гепатита есть много общих симптомов: иктеричность кожи и склер, увеличение печени и ее болезненность, изменение цвета кожи и кала. Вместе с этим в клинике этих заболеваний есть отличия, имеющие решающее значение для диагностики иерсиниоза даже на стадиях анамнестического и клинического обследования.
Приводим одно из наших наблюдений.
При осмотре в приемном отделении состояние тяжелое, температура 38 °C. Выраженная иктеричность кожи и склер. Пульс 90 в 1 минуту, ритмичный, удовлетворительного наполнения и напряжения, АД 90/60 мм рт. ст. Тоны сердца приглушены, чистые. Над легкими перкуторный тон ясный, дыхание везикулярное. Живот мягкий, не вздут, безболезненный при пальпации. Нижний край печени пальпируется на 6 см ниже реберной дуги, поверхность ее гладкая, эластичная, пальпация безболезненная. Селезенка не пальпировалась. Кал окрашен, моча насыщенная. Из эпидемического анамнеза выяснилось, что больной контактов с больными желтухой не имел, никаких инъекций в течение последних 6 месяцев не получал. Все члены семьи здоровы.
Анализ крови при поступлении: эритроциты — 3,5 × 10 12 /л, гемоглобин — 122 г/л, лейкоциты — 5,9 × 10 9 /л, эозинофилы — 2%, палочкоядерные лейкоциты — 3%, сегментоядерные лейкоциты — 46%, лимфоциты — 43%, моноциты — 2%, СОЭ — 6 мм/час. Общий билирубин крови — 68 мкмоль/л с преобладанием прямой фракции. Показатель аланинаминотрансферазы (АЛТ > 31 мкмоль/л). Протромбиновый индекс — 70%.
Несмотря на проводимую дезинтоксикационную и антибактериальную терапию (Цефотаксим в суточной дозе 2 г) с последующей его заменой на амикацин в суточной дозе 10 мг/кг массы тела сохранялась лихорадка на фебрильных цифрах. Желтуха нарастала, и к 11-му дню заболевания общий билирубин крови повысился до 129 мкмоль/л, прямой — 97 мкмоль/л, непрямой 32 мкмоль/л, сохранялась ферментемия: АЛТ — 24,8 мкмоль/л, холестерин — 5,14 мкмоль/л, ЩФ — 0,60 мкмоль/л. В общем анализе крови при нормальном числе лейкоцитов появился нейтрофилез с палочкоядерным сдвигом, СОЭ до 60 мм/час. Печень увеличилась до 8 см ниже края реберной дуги, стала более плотной. Моча оставалась темной, обесцветился кал. Смена антибактериальной терапии на Левомицетин сукцинат натрия из расчета 50 мг/кг массы тела (суточная доза) позволила добиться купирования лихорадки в течение первых 3 дней применения данного препарата до субфебрильных цифр и ее нормализации на 10-й день лечения Левомицетином (21-й день заболевания). Одновременно шло уменьшение иктеричности кожи и склер. К 22-му дню заболевания показатель общего билирубина составлял 47 мкмоль/л, АЛТ — 16,5 мкмоль/л, холестерина — 1,7 мкмоль/л, ЩФ — 0,60 мкмоль/л. К 30-му дню заболевания показатели общего билирубина и его фракций полностью нормализовались. Показатель АЛТ снизился до 2,38 мкмоль/л, показатели гемограммы соответствовали норме. Размеры печени уменьшились. Полная нормализация АЛТ достигнута на 37-й день заболевания.
Проведенное дополнительное обследование крови на маркеры вирусных гепатитов, гемокультуру, определение титра антител в парных сыворотках крови с помощью РНГА с иерсиниозным антигеном, обследование на лептоспироз, псевдотуберкулез дали отрицательный результат. Иммуноферментный анализ крови на иерсиниоз положительный (IgM). На 17-й день заболевания из крови больного выделена Yersinia enterocolitica серовар 03, биотип 4. На 19-й день заболевания данный возбудитель выделен из кала. На 24-й день заболевания титр антител в реакции непрямой гемагглютинации (РНГА) 1:50 с последующим нарастанием титра антител к иерсиниозному антигену в 3 раза. Выделенный возбудитель оказался чувствительным к Левомицетину.
Заключительный клинический диагноз: иерсиниоз, желтушная форма.
Особенностями данного клинического наблюдения является высокая активность гепатоцеллюлярных ферментов, что считается не характерным для иерсиниозных гепатитов.
Комплекс анамнестических, клинических и лабораторных данных, полученных при обследовании больного, позволил с большей степенью достоверности предположить иерсиниоз. Специфические методы обследования лишь подтвердили установленный диагноз.
Анализируя приведенный клинический пример, можно привести убедительный и простой довод отвергнуть вирусный гепатит.
Как мы видели, больной заметил желтуху кожных покровов и потемнение мочи в тот день, когда температура тела поднялась до максимальных цифр, а самочувствие его оставалось плохим. При вирусном гепатите в подавляющем большинстве случаев с появлением желтухи самочувствие и состояние больных заметно улучшаются: нормализуется температура (если она была повышенной), появляется аппетит, уменьшается слабость, т. е. многие симптомы преджелтушного периода ослабевают или исчезают совсем. Лишь при самом тяжелом течении вирусного гепатита появление желтухи не сопровождается улучшением самочувствия больных, напротив, симптомы интоксикации могут нарастать, но на фоне нормальной или, реже, субфебрильной температуры.
Распознавание желтушной формы иерсиниоза с тяжелым течением заболевания может быть простым или, напротив, нелегким, а на стадии амбулаторного обследования и невозможным делом. Диагноз прост во время вспышки иерсиниоза и весьма сложен при спорадических случаях инфекции, как в нашем примере.
Дифференциация иерсиниоза от тифопаратифозных заболеваний, лептоспироза, вирусного гепатита, псевдотуберкулеза и т. д. в условиях инфекционного стационара не представляет затруднений и базируется на изучении динамики основных проявлений инфекции, различий в гематологических сдвигах и, самое важное, — на выделении возбудителя и результатах серологического обследования. Следует помнить, что отрицательные результаты серологического обследования на иерсиниоз еще не исключают диагноз. Для повышения достоверности диагноза необходимо использование бактериологического и серологического методов.
Бактериологический метод позволяет определить возбудитель у больных людей, животных, а также на объектах окружающей среды. Материалом для исследования являются: смывы из носоглотки, кровь, суставная жидкость, ликвор, операционный материал, испражнения, моча. Целесообразно проводить бактериологическое исследование до начала антибактериальной терапии, на первой неделе заболевания, трехкратно. Результат данного исследования получают через 2–3 недели.
Для ранней диагностики используются иммунологические методы выявления антигенов возбудителя: иммуноферментный анализ, реакция непрямой иммунофлюоресценции, реакция латекс-агглютинации и др. Материалом для данных исследований являются слюна, кровь, копрофильтраты, органы животных, смывы из объектов внешней среды. Исследования лучше проводить в первые 10 дней заболевания, используя не менее 2 видов материалов от больных.
Для серологической диагностики с целью выявления специфических антител используются реакция агглютинации (диагностический титр 1:160), РНГА. Доступным для большинства лабораторий инфекционных стационаров является определение антител к Yersinia enterocolitica 03 и 09 методом РНГА. Диагностическим считается титр 1:400. Исследования проводят с 5–7 дня болезни в парных сыворотках крови, взятых с интервалом 10–14 дней. В последние годы чаще стала использоваться генетическая диагностика — полимеразная цепная реакция [5].
Препаратами выбора для лечения иерсиниоза являются антибактериальные препараты: цефалоспорины III поколения, аминогликозиды II–III поколения, доксициклин (с 8-летнего возраста), хлорамфеникол (Левомицетин), карбапенемы (при генерализованных формах иерсиниоза). Длительность курса лечения 10–14 дней и более по показаниям. Патогенетическая терапия включает дезинтоксикацию, антигистаминные препараты, иммунокоррекцию при тяжелых формах с использованием иммуноглобулинов для внутривенного введения. По показаниям назначаются сорбенты, ферменты, спазмолитики, гепатопротекторы, антипиретики и др. [3, 5, 6].
Литература
Г. А. Харченко 1 , доктор медицинских наук, профессор
О. Г. Кимирилова, кандидат медицинских наук
ФГБОУ ВО АстГМУ МЗ РФ, Астрахань

За прошедшие 10‒15 лет применение высоких технологий позволило получить новые результаты, которые определили особое место иерсиниозов в современном мире. На настоящий момент в исследования по проблеме иерсиниозов вовлечен весь мир – это страны Северной (США, Канада) и Южной (Колумбия, Бразилия) Америки, Великобритания и Ирландия, страны Центральной Европы (Франция, Германия, Бельгия, Испания, Польша, Болгария), Скандинавии (Финляндия, Норвегия, Швеция) и Африки (Мадагаскар), а также Россия, Китай, Южная Корея, Япония, Израиль.
Псевдотуберкулез у человека до середины 1950-х годов встречался как редкое спорадическое заболевание, протекающее в виде острого аппендицита и мезентериального лимфаденита, и был известен лишь в Европейских странах, Северной и Южной Америке, Японии, Индии [21, 26].
Не будет преувеличением сказать, что именно Россия обратила внимание всего мира на проблему эпидемического псевдотуберкулеза, и в целом иерсиниозов, с тех пор как с 1959 года впервые стало известно о вспышках во Владивостоке своеобразной инфекционной болезни, с охватом до нескольких сотен человек, первоначально получившее название дальневосточная скарлатиноподобная лихорадка (ДСЛ) [5]. В период 1960-1990-х годов под руководством академика РАМН Георгия Павловича Сомова в НИИЭМ СО РАМН, при сотрудничестве с военными и практическими врачами, ВГМИ (ныне – ТГМУ), было проведено комплексное изучение этиологии, эпидемиологии, патоморфологии, клиники и иммунологии, лечения и профилактики этой новой болезни. В 1989 году, за проведение этих крупномасштабных исследований, группа специалистов во главе с Г.П. Сомовым была удостоена Государственной премии СССР. А спустя 20 лет было доказано, что клинико-эпидемическое проявление псевдотуберкулеза (ДСЛ) связано с конкретной клональной линией Y. рseudotuberculosis, распространенной в РФ и характеризующейся определенным плазмидным профилем (pVM82, pYV 48 MDa), сиквенстипом (2ST) и аллелем гена yadA (1й аллель) [7].
Повсеместный интерес к проблеме иерсиниозов имеет отражение в регулярно проводимых с 1967 года Международных симпозиумах – International Symposium on Yersinia (Франция, Швеция, Канада, Австралия, Япония, Италия, Нидерланды, Финляндия, США, Бразилия, Китай). Последний 11-й Международный симпозиум в Китае в 2013 году показал, что высокий интерес к иерсиниозам обусловлен тем, что до сих пор в значительной мере не раскрыты побудительные мотивы к эволюции возбудителей внутри рода Yersinia, транс- и межконтинентальной трансмиссии иерсиний, в первую очередь Yersinia pestis, с возникновением эпидемий и пандемий, а также механизмы возможной реверсии и поддержания высокой патогенности нечумных иерсиний.
Прежде всего, важность и значимость углубленного изучения иерсиниозов обусловлены их принадлежностью к эмерджентным инфекциям, одновременно с особо опасной чумной инфекцией. Непредсказуемость и опасность их возникновения требуют перманентного контроля и глубокого всестороннего изучения. Недавно показано [11], что возбудитель чумы, Y. pestis, эволюционировал из возбудителя псевдотуберкулеза, Y. pseudotuberculosis, и оба патогена генетически почти идентичны. Причем, переход Y. pseudotuberculosis в Y. pestis сопровождался утратой многих и приобретением нескольких генов, ассоциированных с патогенностью возбудителей. В этой связи не следует забывать о том, что у Y. pseudotuberculosis сохранилась способность изредка вызывать у человека геморрагическую пневмонию, напоминающую легочную чуму.
Об опасности эмерджентных инфекций свидетельствует история Черной Смерти, вызванной Y. pestis. В средние века чума путешествовала по суше из Азии и прибыла через морскую торговую сеть в Европу (1347 год), уничтожив 30-50 % ее населения. Позднее вспышки чумы продолжали появляться в Европе в течение четырех веков, с последующей реинтродукцией заболевания из Азии в Европу, происходившей без существования локального природного резервуара [37]. Имеются сведения о том, что первые пандемические волны чумы начались в Китае и Центральной Азии еще более 2 600 лет тому назад и с помощью караванов, шедших по Великому шелковому пути, болезнь проникла в Европу, а затем и в Африку. Причем выявлены специфические мутации Y. pestis в зависимости от географического региона.
В начале XXI века вновь началась регистрироваться эмерджентная заболеваемость Yersinia-caused инфекциями. Так, на Мадагаскаре зимой 2011 года описано две вспышки чумной пневмонии с летальностью, достигшей 75 % [33]. Эти вспышки подтвердили высокую контагиозность легочной чумы и необходимость быстрой идентификации первых случаев заболеваний для немедленного применения мер защиты и предупреждения быстрого распространения заболевания.
Вторым уязвимым место в проблеме иерсиниозов является то, что их возбудители признаны потенциальными агентами биотерроризма. Пристальное внимание исследователей к проблеме иерсиниозов с начала XXI века в большой мере связано с возросшей угрозой биотерроризма во всем мире, а также с потенциальной способностью гетерогенных популяций патогенных иерсиний к реверсии вирулентных свойств, ассоциированной с изменениями на геномном уровне в определенных условиях внешней среды. Эти изменения могут быть причиной полиморфизма клинико-морфологических проявлений иерсиниозов, что требует целенаправленного исследования на основе современных методических подходов. В конечном итоге, углубленное понимание биологии и патологии инфекционных процессов в контексте их связи с молекулярно-генетической характеристикой патогенов создаст новые возможности для борьбе с иерсиниозами в целом.
Биохимические маркеры Yersinia pseudotuberculosis complex (YPC)
Примечаниея. 1) – Sprague et al., 2008; 2) – Laukkanen-Ninios et al., 2011; 3) – Savinа et al., 2014; 4) – Fukushima et al., 2001.
Используя секвенирование целого генома всех видов Yersinia, S. Reuter et al. [35] очертили комплект гена (или дополнение гена) рода в целом и определили закономерности эволюции вирулентности иерсиний. Несколько различных экологических специализаций, вероятно, дают расщепление остро патогенных штаммов Yersinia от непатогенных линий из окружающей среды. Вопреки гипотезе, что все патогенные виды Yersinia имеют общего патогенного предка, показано, что они развивались независимо друг от друга, но с последующими параллельными путями эволюции в приобретении одних и тех же детерминант вирулентности. Эти геномные вариации привели к параллельному появлению родственных возбудителей, где отображается их все более специфический образ жизни, со спектром потенциала вирулентности.
Ферментативная активность микроорганизмов является достаточно стабильной, поэтому исследование биохимических свойств Yersinia может служить надежным инструментом для таксономической характеристики новых видов. По ферментативной активности, все виды, входящие в Yersinia pseudotuberculosis complex, проявили высокую биохимическую однородность [36, 39]. Однако были выявлены биохимические маркеры, по которым можно провести дифференциальную диагностику между Y. pseudotuberculosis, Y. similis и Korean group по активности ферментов пиразинамидаза, D-мелибиоза, β-галактозидаза, D-раффиноза, D-таггатоза (таблица). При этом активность указанных видов Yersinia по основным ферментам, входящим в дифференциально-диагностический спектр оказалась полностью идентичной. Таким образом, все исследованные виды иерсиний, входящих в Yersinia pseudotuberculosis complex, по биохимическим маркерам представляются в качестве трех отдельных видов.
Нестабильность фенотипических свойств затрудняет интерпретацию получаемых результатов по дифференциации микроорганизмов. Это вызывает необходимость разработки приемов молекулярной диагностики, основанной на анализе структуры генома, отличающегося большей консервативностью по сравнению с фенотипическими свойствами. С. Savina et al. [36>, на основании секвенирования и анализа единичных вариабельных нуклеотидов 417 изолятов из 29 стран, показали генетическое сходство и разнообразие видов, входящих в Yersinia pseudotuberculosis complex (рисунок). Установлено, что все секвенированные штаммы Y. pseudotuberculosis, Y. similis и Korean group представляют собой три однородных кластера с минимальной вариабельностью нуклеотидов (0,04–1,4 %), что подтверждает обособленность этих видов иерсиний. В то же время эти виды оказались генетически близкими друг другу: количество вариабельных нуклеотидов варьировало от 0,8–1,8 % (пара Y. pseudotuberculosis и Korean group) до 4,2–4,5 % (пара similis и Korean group).
Весьма важный аспект проблемы иерсиниозов касается нового фактора патогенности, идентифицированного у штаммов Y. pseudotuberculosis I серотипа, ответственного за уникальный клинический синдром, описанный на Дальнем Востоке как скарлатиноподобная лихорадка (Far East scarlet-like fever, FESLF) [27]. Это ранее неизвестный белок вирулентности Y. pseudotuberculosis (TcpYI), который имеет значительную гомологию последовательности с членами семейства Toll / IL-1 рецептора (TIR). Бактериальный TIR домен содержит белки (Tcps), действующие на иммунную систему по TIR-TIR взаимодействиям, и подрывает защитные реакции организма с помощью многогранных механизмов. Белок TcpYI увеличивает внутриклеточное выживание штаммов in vitro и в селезенки мышей на модели перитонита, участвует в торможении фагоцитоза, даже штаммов Y. pseudotuberculosis группы FESLF, где плазмида вирулентности pYV отсутствует. Таким образом, подтверждена гипотеза, что белок TcpYI самостоятельно способствует патогенности Yersinia и играет решающую роль в качестве потенциального фактора вирулентности Y. pseudotuberculosis, который особенно связан с штаммами дальневосточной скарлатиноподобной лихорадки I серотипа, имеющими измененный ген кластера вирулентности [16, 32].
В настоящее время возбудитель псевдотуберкулеза привлекает внимание исследователей всего мира в качестве модели для раскрытия молекулярных механизмов взаимодействия патогенных Yersiniae в системе микроорганизм-хозяин, где первостепенное значение придается клеткам врожденного иммунитета. Патогенные для человека виды Yersinia преимущественно инактивируют клетки врожденного иммунитета, что является важным шагом, с помощью которого эти бактерии избегают элиминации и вызывают заболевание [41]. Установлено, что в ответ на заражение иерсиниями, фундаментальную роль в первичной иммунной защите играют нейтрофилы, которые используют несколько механизмов для ликвидации бактерий, таких как фагоцитоз, оксидативный стресс и дегрануляция, а также образование нейтрофильных внеклеточных ловушек (NET) – особого типа повреждения клеток, наряду в некрозом и апоптозом, а также пироптозом.
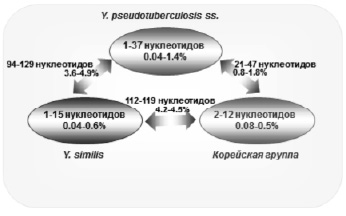
Кластеры генетического разнообразия Yersinia pseudotuberculosis complex (пояснение в тексте)
Многочисленные исследования, проведенные в конце ХХ в., коренным образом изменили представление о факторах патогенности бактерий рода Yersinia. Иерсинии имеют способность преодолевать механизмы врожденного иммунитета, обладая большим набором факторов патогенности, часть из которых кодируется хромосомными генами, а часть – генами плазмид (внехромосомных генетических элементов) [5, 9, 18, 31].
Детально охарактеризованы факторы патогенности, детерминированные хромосомными генами [8]. Это: 1) инвазин, м.м. 103 кДа (обеспечивает температура-зависимое проникновение в клетки хозяина); 2) белок Ail 17 кДа (действует как вторичный фактор адгезии и инвазии уже после адаптации клеток бактерий к температуре тела хозяина); 3) антиген рН6 (экспрессируется максимально при температуре 37 °С и низком значении рН; белок 21 кДа – экспрессирует образование фимбрий).
Доказано, что вирулентность бактерий рода Yersinia ассоциируется с наличием плазмиды pYV молекулярной массой 42–48 МDa. Плазмида pYV кодирует комплекс белков, объединенных в единую систему и предназначенных для нейтрализации иммунокомпетентных клеток хозяина [10, 28]. Она состоит из эффекторых белков (Yops) и системы секреции III типа (T3SS), позволяющей бактериям вводить синтезируемые ими эффекторные белки в цитоплазму клетки-мишени без проникновения в нее. T3SS является общей для всех патогенных Yersiniae и играет существенную роль в возникновении инфекции [13, 20].
На настоящий момент особый интерес представляет плазмида Y. pseudotuberculosis с мол. массой 82 MDa (рVM82), которая обнаруживается только у штаммов Y. pseudotuberculosis I серовара – наиболее частого этиологического агента ДСЛ [19]. Способность Y. pseudotuberculosis вызывать эпидемические вспышки инфекции у людей связывают с одновременным наличием у микроба плазмид pYV и pVM82 [5]. Сообщается о способности штаммов Y. pseudotuberculosis, несущих плазмиду pVM 82, оказывать иммуносупрессивное действие и индуцировать апоптоз [2, 3, 4, 27]. Однако до сих пор остается недостаточно выяснен спектр эффектов плазмиды pVM 82 в проявлениях вирулентности Y. pseudotuberculosis и особенностях инфекционного процесса. В этой связи, в модельных экспериментах первостепенное значение имеет использование штаммов Y. pseudotuberculosis, выделенных от больных ДСЛ, уникальность которых признается исследователями всего мира.
Нами [2, 6, 30] установлены различия реакции клеток врожденного иммунитета при инфицировании разными плазмидными вариантами Y. pseudotuberculosis. Так, более выраженное апоптоз-индуцирующее действие вызывает слабовирулентный pVM82 вариант, по сравнению с высоковирулентным pYV48:pVM82 вариантом, который преимущественно вызывает некроз фагоцитов.
Актуальной проблемой микробиологии является поиск новых, более быстрых и точных методов идентификации штаммов возбудителей инфекций. Большой прорыв в идентификации микроорганизмов позволил осуществить принципиально новый метод – матрично-ассоциированная лазерная десорбция/ионизация (МАЛДИ) в комплексе с времяпролетной масс-спектрометрией (МALDI-ToF) [15, 23]. Этот метод дает возможность проводить анализ сложных биоорганических молекул, получать молекулярные профили нуклеиновых кислот и белков. В дальнейшем, полученные белковые профили анализируются, определяются родо- и видоспецифические протеиновые биомаркеры, которые используются для таксономической характеристики возбудителей и диагностики инфекций. Недавно проведенный углубленный протеомный анализ бактерий рода Yersinia [22] продемонстрировал наличие родоспецифических и видоспецифических биомаркеров. В 2014 году опубликованы результаты успешной апробации метода в Иркутском НИПЧИ с целью кластеризации возбудителей иерсиниозов [1].
Важное значение имеет профилактика иерсиниозов, в первую очередь, особо опасной чумной инфекции. Привлекают внимание исследования последних лет, касающиеся разработки современных эффективных вакцин против чумы на основе модифицированных штаммом Y. pseudotuberculosis. Живая чумная вакцина (live pestis vaccine, LPV) Y. pestis EV NIEG широко используется для профилактики у человека более 70 лет. Однако антительный ответ к этой вакцине был изучен главным образом к капсулярному антигену F1 и LPS.
Французскими учеными [14] выбрана вакцинная стратегия, основанная на живом, аттенуированном штамме Y. pseudotuberculosis, генетически почти идентичном виде Y. pestis, но менее патогенном и генетически более стабильном. Сконструирован штамм, названный V674TnF1, который является сильно аттенуированным ((LD50 ≥ 1010 CFU, оральный путь) и обеспечивает 100 % защиту против бубонной чумы после однократного подкожного введения 107 CFU V674pF1, даже когда была использована высокая доза заражения Y. pestis (105 CFU = 104 x LD50).
W. Sun et al. [40] получили аттенуированный штамм Y. pseudotuberculosis, синтезирующий гибридные белки, состоящие из YopE, сшитых с LcrV (V-антиген, супрессирующий воспалительный ответ в ранней стадии инфекции) или LcrV221 и доставляемые через систему секреции III типа (T3SS). Эти белки могут быть транслоцированы в цитоплазму культуральных клеток HeLa. Мыши, орально иммунизированные аттенуированным штаммом Y. pseudotuberculosis, синтезирующим YopE – LcrV, продуцировали высокий уровень секреторного IgA и также были значительно защищены к интраназальному заражению примерно 104 CFU вирулентной Y. pestis (примерно 100 LD50).
Резюмируя вышесказанное, можно заключить, что на настоящий момент по проблеме иерсиниозов перспективными для российских ученых следует считать:
1. Поиск и изучение новых факторов патогенности, детерминируемых плазмидой pVM82 у дальневосточных штаммов Yersinia pseudotuberculosis I серотипа, что будет способствовать углубленному пониманию сложности и многообразия взаимодействия этого патогена и макроорганизма, а также идентификации ранее неизвестных механизмов развития эпидемического псевдотуберкулеза.
2. Cравнительная характеристика инфекционных процессов, вызываемых разными плазмидными вариантами Yersinia pseudotuberculosis, в контексте раскрытия закономерностей защитных механизмов системы врожденного иммунитета и иммунопатологии эпидемического псевдотуберкулеза.
Полный текст:
В последние годы разрабатываются и внедряются в клиническую практику новые подходы к профилактике и лечению различных нозологических форм заболеваний – сочетание базовой терапии с иммунокоррекцией. Обзор посвящен анализу современного состояния неспецифической профилактики и лечения псевдотуберкулеза и кишечного иерсиниоза. Приведены данные об эффективности иммуномодуляторов, продуктов жизнедеятельности растительных клеток и обитателей морей, пребиотиков, комплексного иммуноглобулинового препарата (КИП) при профилактике и лечении этих заболеваний.
младший научный сотрудник лаборатории иммунологии ООИ
Россия, 344002, г. Ростов-на-Дону, ул. М. Горького, 117
1. Ющук, Н.Д. Иерсиниозы. - М.: Медицина, 2003.
2. Железникова, Г.Ф., Бехтерева, М.К. Энтеропатогенные иерсинии и система цитокинов хозяина // Журнал микробиологии, эпидемиологии и иммунобиологии - 2010. - №6. - С. 112- 121.
3. Тимченко, Н.Ф., Терентьев, Л.Л., Недашковская, О.И., Разник, Н.В., Рассказов, В.А. Действие термостабильного токсина Yersinia pseudotuberculosis на биосинтез ДНК, РНК и белка в эукариотических клетках // Эпидемиология и инфекционные болезни. - 2002. - №1. – С. 22-25.
4. Резников, Ю.П. Иммунокоррегирующая терапия на рубеже тысячелетий. - М.: Медицина, 2001.
5. Хаитов, Р.М., Пинегин, Б.В., Андронова. Т.М. Отечественные иммунотропные лекарственные средства последнего поколения и стратегия их применения // Педиатрическая фармакология.- 2002. - С. 20-24.
6. Плотников, К.П. Использование тимогена в комплексной терапии псевдотуберкулеза. // Актуальные проблемы химиотерапии бактериальных инфекций: Тез. докл. – Москва, 1991. – С. 504 -505.
8. Горячева, Л.Г., Ботвиньева, В.В., Романцов, М.Г. Применение циклоферона в педиатрии. - Москва-СПб; 2004.
9. Кветная, А.С., Бехтерева, М.К., Железнова, Л.И., Калиногорская, О.С. Применение циклоферона в комплексной терапии сальмонеллёзной и иерсиниозной инфекции у детей // Антибиотики и химиотерапия. - 2012. – Т. 57. № 3-4. – С. 9-16.
10. Бениова, С.Н., Маркелова, Е.В. Иммунокоррекция рецидивирующего течения псевдотуберкулёза у детей // Цитокины и воспаление. - 2003. - Т.2. - №3. – С. 13-17.
11. Ценёва, Г.Я., Демакова, Т.Е., Симбирцев. А.С. и др. Влияние рекомбинантного интерлейкина 1β на экспериментальный псевдотуберкулёзный процесс. //Инфекц. бол-ни: Совр. пробл. диагностики и лечения: Рос. научн.-практ. конф.: Москва-СПб, 2008. - С. 282-283.
12. Феклисова, Л.В., Галкина, Л.А. Оценка включения нуклеоната натрия в комплексную терапию детей, больных иерсиниозом // Инфекции, обусловленные иерсиниями: Матер. междунар. конф. - СПб, 2000. - С. 60.
13. Дубровина, В.И., Голубинский, Е.П., Борсук, Г.И. и др. Коррекция фагоцитоза при псевдотуберкулёзной инфекции иммуномодуляторами природного происхождения. //Инфекции, обусловленные иерсиниями: Матер. междунар. конф. - СПб, 2000. - С.19.
14. Запорожец, Т.С., Крылова, Н.В., Иванушко, Л.А. и др. Коррекция дефектов фагоцитоза при псевдотуберкулёзной инфекции иммуномодуляторами природного происхождения. //Журн. микробиол.- 1997. - № 5. – С. 55-58.
15. Долматова, Л.С., Заика, О.А., Тимченко, Н.Ф. Влияние экстракта из дальневосточных видов голотурий при различных способах применения на функциональную активность перитонеальных макрофагов мышей, инфицированных бактериями Yersinia pseudotuberculosis. //Инфекции, обусловленные иерсиниями: Матер. III. Всеросс. науч.-практ. конф. - СПб, 2011. - С. 52-53.
16. Бондаренко, В.М., Лиходед, В.Г. Идеи И.И. Мечникова и современная микроэкология кишечника человека. //Журн. микробиол. - 2008. - №5. – С. 23-29.
17. Чичерин, И.Ю., Погорельский, И.П., Лундовских, И.А., Дармов, И.В., Маракулин, И.В. Оценка возможности профилактики, лечения и коррекции дисбиотических нарушений кишечной микрофлоры при экспериментальном псевдотуберкулёзе // Журн. инфектологии. - 2012. – Т.4. - №4. – С. 71- 79.
18. Чичерин, И.Ю., Погорельский, И.П., Лундовских, И.А. и др. Колонизационная резистентность слизистой оболочки кишечника при экспериментальном иерсиниозе. //Журн. инфектологии. - 2013. – Т.5. - №1. – С. 75-82.
19. Бондаренко, В.М., Грачева, Н.М. Препараты пробиотики, пребиотики и синбиотики в терапии и профилактике кишечных дисбактериозов. // Фарматека. - 2003. - № 7. - С. 56- 63.
20. Добрица, В.П., Ботерашвили, Н.М., Добрица, Е.В. Современные иммуномодуляторы для клинического применения. Руководство для врачей. - Политехника, 2001.
21. Копанев, Ю.А., Соколов, А.Л., Алешкин, В.А. и др. Действие комплексного иммуноглобулинового препарата на условнопатогенную флору. //Врач. – 1998. - № 5. - С. 38.
22. Грачева, H.М., Петров, М.С., Аваков, A.A., Партии, О.С. Иммуноглобулиновые препараты для энтерального применения в практике лечения детей и взрослых. //Новые лекарственные препараты. - 2003. - Вып. 4. - С. 33-42.
23. Филиппенко, А.В., Морозова, И.В., Иванова, И.А. и др Влияние комплексного иммуноглобулинового препарата (КИП) на течение экспериментальных инфекций, вызываемых представителями рода Yersinia. Иммунопатология и иммунореабилитация: от теории к практике. //Матер. Всероссийской науч.-практ. конф. - Пенза, 2015. - С. 79-80.
24. Дорошенко, Е.П., Омельченко, Н.Д., Морозова, И.В. и др. Новый подход к лечению псевдотуберкулезной инфекции. //Инфекционные болезни. - 2015. - №13 (приложение 1). – С. 113.
25. Иванова, И.А., Морозова, И.В., Филиппенко, А.В. и др. Влияние комплексного иммуноглобулинового препарата на развитие, течение и исход экспериментального кишечного иерсиниоза. //Медицинская иммунология. – 2015. – Т.17. - №3. – С.267-268.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


