Дифтерийный токсин ингибирует стадию в процессе трансляции
Один из путей выяснения тонких молекулярных механизмов синтеза нуклеиновых кислот и белков в клетках – использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не влияя на клетки организма человека. Некоторые препараты, действительно, оказывают такое избирательное действие, взаимодействуя с белками рибосом прокариот и выключая бактериальный синтез белка. Однако многие из них являются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена с целью выяснения молекулярного механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Один из мощных ингибиторов белкового синтеза – пуромицин. Он представляет собой аналог концевого участка аминоацил-тРНК адениловой кислоты и поэтому легко взаимодействует с А-центром пептидил-тРНК с образованием пептидил-пуромицина :
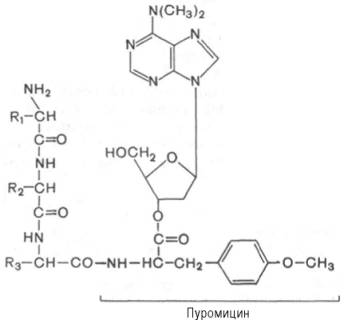
Пептидил-пуромицин не несет на себе триплета антикодона и поэтому тормозит элонгацию пептидной цепи, вызывая обрыв реакции, т.е. преждевременную терминацию синтеза белка. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo. Укажем также, что пуромицин оказывает тормозящее действие на синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, однако вследствие высокой токсичности препарат применяется редко. Он тормозит синтез всех типов клеточной РНК, особенно мРНК. Данное свойство объясняется тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней; это дает основание считать, что актиномицин D ин-гибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу, связываясь с ферментом. Наиболее чувствительной к нему оказалась бактериальная РНК-полиме-раза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина D. Следует указать, кроме того, на недавно открытое противовирусное действие рифамицина; в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. Это дает основание предположить, что данный антибиотик найдет применение в клинической онкологии при лечении опухолей, вызываемых вирусами.
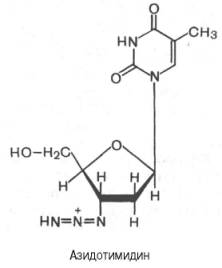
Одним из мощных ингибиторов синтеза вирусной РНК оказался азидотимидин (3'-азидо-2',3'-дидезокситимидин), синтезированный еще в 1964 г. в надежде на его противоопухолевый эффект. Было показано, что вирус иммунодефицита человека (ВИЧ) содержит РНК-й геном, в составе которого имеются как стандартные гены ретровирусов, так и необычные небольшие гены со множеством функций. Последние, в частности, подвержены мутациям с высокой скоростью вследствие низкой точности репликации, вызванной свойствами обратной транскриптазы. Эта вирусная обратная транскриптаза иммунодефицита человека оказалась наделенной значительно большим сродством к азидотимидину, чем к природному дезокситимидинтрифосфату (dTТФ). Азидотимидин конкурентно тормозит связывание dTТФ, вызывая тем самым терминацию (окончание) синтеза вирусной РНК.
Выяснены некоторые детали механизма действия ряда других антибиотиков, используемых при лечении тифозных инфекций. Так, хлорам-феникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий; на этот процесс в 80S рибосоме он не действует. Тормозит синтез белка в 80S рибосоме (без поражения процесса в 70S рибосоме) циклогексимид – специфический ингибитор транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделенным способностью катализировать реакцию АДФ-рибозилирования фактора элонгации эукариот (eEF-2), выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину, вероятнее всего, обусловлена трудностью или полным отсутствием проникновения (транспорта) токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Было высказано предположение, что эти антибиотики обусловливают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами: например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате чего образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считают, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S рибосоме. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Пенициллины не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомного механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т.е. тормозят синтез белка в клетках животных.
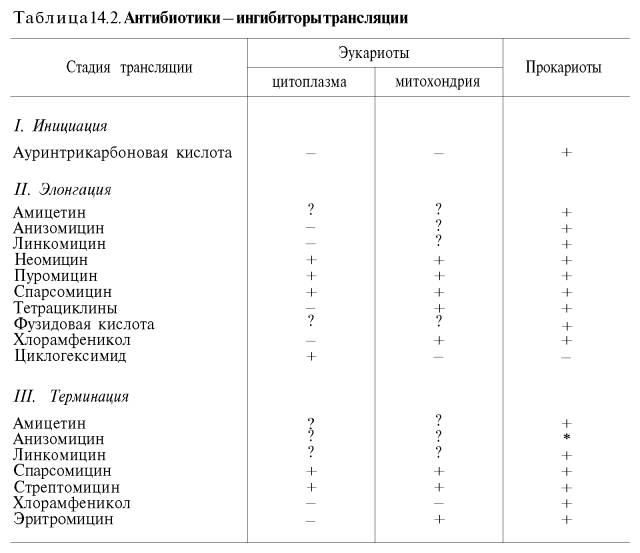
Полученные к настоящему времени данные о механизме действия антибиотиков на синтез белка с учетом стадии и топографии процесса трансляции суммированы в табл. 14.2 (по Харперу с небольшими изменениями).
Следует еще раз подчеркнуть, что нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и соответственно изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально.
Следует отметить, однако, что организм располагает мощными механизмами защиты. Подобные изменения генетического аппарата быстро распознаются специфическими ферментами – рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.
Многие антибиотики, используемые для лечения бактериальных инфекций также как и некоторые токсины действуют путем ингибирования трансляции. Ингибирование может быть произведено на всех стадиях трансляции от инициации элонгации к терминации.
Некоторые Антибиотики и токсины - ингибиторы трансляции
Ингибирует пептидилтрансферазу на большой субъединице рибосом прокариот
Ингибирует пептидилтрансферазу на большой субъединице рибосом эукариот
Ингибирует транслокацию прокариотическими большими субъединицами
Ингибирует элонгацию у прокариот путем связывания EF-G GDP, предотвращая диссоциацию его от большой субъединицы
Аналог аминоацил-тРНК, вызывает преждевременную терминацию у прокариот и эукариот
Ингибирует инициацию роста пептидной цепи, способствует неправильному считыванию иРНК, у прокариот
Ингибирует связывание аминоацил тРНК к прокариотической малой субъединице
Ингибирует связывание аминоацил - т-РНК к прокариотической маленькой субъединице Каталитически инактивирует eEF-2 путем АДФ- рибозилирования
Смертельный растительный лектин. Найден в касторовом семени, катализирует распад рРНК большой субъединицы рибосом эукариот
Синтезированные на рибосомах белки доставляются к местам их деятельности разными путями.
К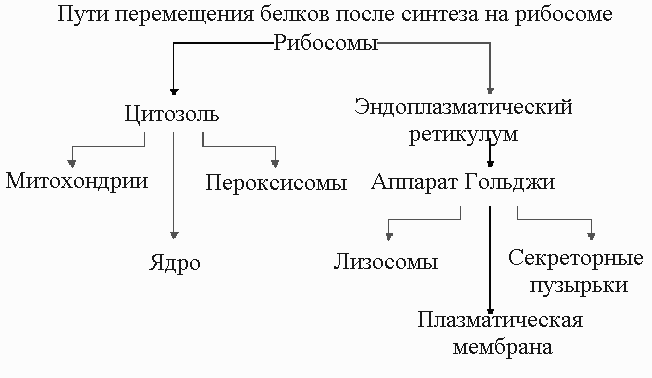
летки эукариот содержат клеточные органеллы, каждая из которых состоит из спеРисСхема путей перемещения белков после синтеза на рибосоме.
цифических белков. Лишь небольшая часть этих белков может быть синтезирована в пределах органеллы, а основная масса их синтезируется на рибосомах и нуждается в механизмах доставки этих белков. В цитоплазме клеток эукариот имеется две пространственно изолированные популяции рибосом. Одни из них ( рибосомы, связанные с мембраной ), расположены на обращенной к цитоплазме поверхности мембраны ЭР (шероховатый ЭР) и заняты синтезом белков, которые сразу же переносятся внутрь ЭР. Другие (свободные рибосомы) не прикреплены к мембранам и производят все остальные белки, кодируемые ядром. Связанные и свободные рибосомы идентичны по строению и функции. Они различаются только по белкам, которые синтезируются на них в каждый данный момент. Если рибосоме достается синтез белка с сигнальным пептидом для ЭР, то такой сигнал направляет рибосому к мембране ЭР.
Белки, синтезируемые свободными рибосомами – Это белки, предназначенные дляцитоплазмы или для включения в митохондрии, хлоропласты или ядра. Вновь синтезированные белки, предназначенные для митохондрий (подобный механизм вероятен и для хлоропластов) содержат специфичные аминокислотные последовательности (то есть, сигнальные последовательности) на своих N - концевых отделах. Многие сигнальные пептиды таких белков имеют положительно заряженные аминокислотные остатки, которые чередуются с гидрофобными.Сигнальные последовательности не только обеспечивают встраивание белка в мембраны, но и выполняют роль сигналов, которые способствуют точному и целенаправленному переносу белка к месту его функционирования. Среди белков, направ
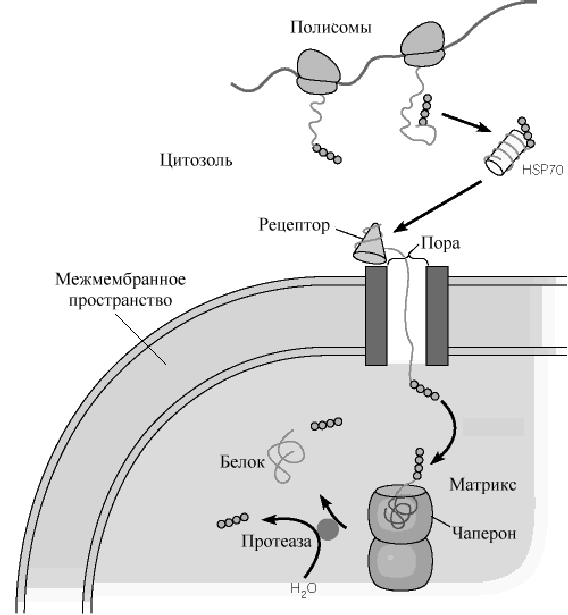
Рис .Белки теплового шока обеспечивают прохождение белков из цитозоля в матрикс митохондрий.
ляющихся в ядро, большинство имеет сигнальные пептиды, образованные кластером положительно заряженных аминокислотных остатков. Наконец, некоторым белкам цитозоля присущи сигнальные пептиды, с которыми ковалентно связывается жирная кислота, направляющая эти белки к мембранам Важную роль в механизме переноса таких белков принадлежит специальному классу белков, получивших название шапероны. Функция этих белков не ограничивается только участием в переносе белка. Шапероны состоят из нескольких полипептидных цепей, формирующих внутримолекулярную полость с рядом гидрофобных поверхностей внутри этой полости. Такая полость выполняет роль хранителя полипептидных цепей синтезированной молекулы от неправильного сворачивания и межмолекулярной агрегации. Наиболее хорошо изученные шапероны - члены семейства белков " теплового шока "(HSP) . Эти белки образуются у бактерий в ответ на тепловое воздействие. Они классифицируются, как правило, по молекулярным массам. Различают семейства HSP70, HSP60 и т.д. Белки при взаимодействии с шаперонами остаются развернутыми и доставляются к участку рецептора на мембране органеллы. Развернутый белок затем проходит через специальные ворота, расположенные во внутренней и внешней мембранах митохондрий. В процессе этого транспорта происходит специфическое узнавание белков, предназначенных для межмебранного пространства, мембран, или матрикса. Если комплекс проходит в матрикс, белок может быть принят внутриорганельными шаперонами для конечного сворачивания. N - концевая последовательность удаляется во время этого транспорта
Белки, синтезируемые на шереховатом эндоплазматическом ретикулуме - белки, предназначенные для клеточных мембран, лизосом, или внеклеточного транспорта используют специальную систему сортировки, вовлекающую шереховатый эндоплазматический ретикулум (ШЭР) и комплекс Гольджи. ШЭР - представлен сетью связанных между собой пузырьков, окруженных мембраной в пределах цитоплазмы. На внешней, цитозольной поверхности пузырьков располагаются полисомы, придающие мембране шереховатый вид. Комплекс Гольджи по строению напоминает ШЭР, он состоит из стека небольших, окруженных мембраной пузырьков, не связанных между собой и не покрытых рибосомами. Комплекс Гольджи действует как " переключающий центр " для белков различного предназначения.
Белки, транспорт которых связан с участием комплекса Гольджи, синтезируются полирибосомами, связанными с ШЭР следующим образом
1. Рибосома начинает синтез N - концевой гидрофобной лидирующей (сигнальной) последовательности на цитоплазматической иРНК.
2. Сигнальные частицы, распознающие сигнальную последовательность (SRPs), состоящие из нескольких белков и небольшой (7SL) РНК, узнают лидирующие последовательности соответствующих синтезированных белков и связываются с ними, как только те покинут рибосомы. Это соединение временно останавливает трансляцию, до тех пор, пока N - концевая лидирующая последовательность, сошедшая с рибосомы не свяжется со специальным связывающим белком на ШЭР мембране.
3. Этот белок связывает рибосому с ШЭР, и лидирующая последовательность вставляется в ШЭР мембрану.
4. SRP отделяется и трансляция возобновляется.
5. Синтезируемый белок фактически протягивается через мембрану АТФ зависимым процессом.
6. Прежде, чем трансляция завершится, лидирующие последовательности удаляются связанной с мембраной протеазой. Белки высвобождаются в просвет ШЭР и подвергаются дальнейшей сортировке. Белки, которые остаются в эндоплазматическом ретикулуме, имеют устойчивые специальные сигнальные пептиды на С- концах и таким образом остаются связанными к мембраной ШЭР
Р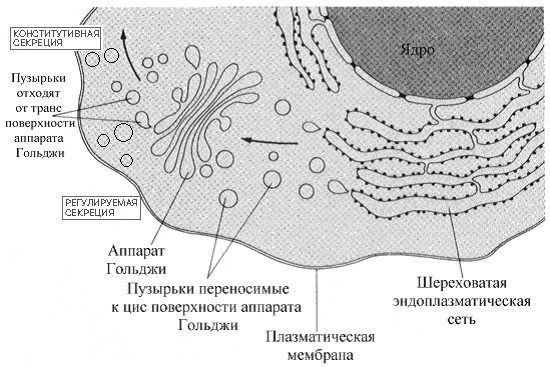
оль комплекса Гольджи - В просвете ШЭР, белки подвергаются первым стадиям Рис.Роль аппарата Гольджи в секреции белков клеткой.
Везикулярный транспорт белков от комплекса Гольджи требует высокой специфичности в целенаправленном перемещении. Нарушение везикулярного транспорта - причина клеточного хаоса. Мембраны везикул переносящих упакованные в пузырьки белки метятся специфичными белками мембран. В некоторых случаях мембраны пузырьков содержат комплементарные белки (называемые ловушками), которые взаимодействуют с другими мембранами и вызывают слияние мембран и точную доставку переносимых белков.
Секретируемые из клетки белки в составе пузырьков (везикулярный транспорт) могут покидать клетку несколькими путями. Различают конститутивную и регулируемую секрецию. В механизмах регулируемой секреции важное место отводится специальному белку клатрину (покрытые клатрином окаймленные пузырьки).
Клатрин - консервативный фибриллярный белок (18О кДа), образующий вместе с другим полипептидом (35 кДа) характерный многогранный чехол на поверхности так называемых окаймленных пузырьков. Основным структурным компонентом чехла служит трехвалентный белковый комплекс (трискелион ), состоящий из трех полипептидных цепей клатрина и трех меньших по размеру полипептидов. Трискелионы образуют на поверхности окаймленных пузырьков корзиноподобные сетки из шести- и пятиугольников. Выделенные трискелионы при соответствующих условиях способны к спонтанной агрегации. При этом даже в отсутствие пузырьков формируются типичные многогранные корзинки. Остальные белки, входящие в состав мембран окаймленных пузырьков, по-видимому, отвечают за связывание клатриновой оболочки с пузырьком и за улавливание рецепторов плазматической мембраны в окаймленные ямки и пузырьки.
В механизмах конститутивной секреции участвуют неклатриновые окаймленные пузырьки.
У бактерий свои особенности транспорта белков. Бактериальные белки, предназначенные для секреции (транслокация через клеточную мембрану) содержат высоко гидрофобные отрезки аминокислот (называемые сигнальными последовательностями или лидирующими последовательностями) на их N- концевой области. После того, как белок прошел через мембрану, лидирующая последовательность удаляется.
В настоящее время принятая модель транслокации показана на рис.10-14. Последовательность событий выглядит следующим образом:
Б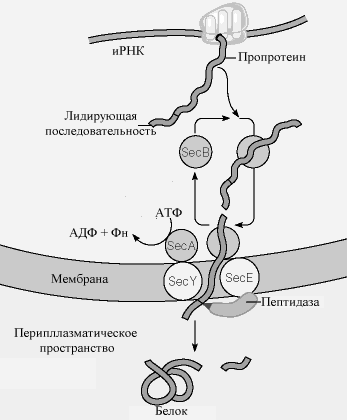
елок, который участвует в транслокации (называемый про-белком) - образует комплекс в цитоплазме с шапероном (например,Sec B белок). Комплекс предохраняет белок от преждевременного сворачивания, которое помешало бы пройти через пору. По
Рис.. Механизм переноса белков через мембрану у бактерий.
следняя состоит из двух трансмембранных белков, Sec E и Sec Y. Sec A - АТФаза, которая способствует транслокации. После того, как про-белок пройдет через мембрану, лидирующий пептид удаляется связанной с мембраной протеазой , и белок может свернуться в свою активную трехмерную форму.
Одним из путей выяснения механизмов синтеза нуклеиновых кислот и белков в клетках является использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не оказывая влияния на организм человека. Некоторые препараты действительно обладают таким действием, однако многие из них оказываются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена ниже с целью выяснения механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Одним из мощных ингибиторов белкового синтеза является пуромицин. В результате структурного сходства с концевым остатком АМФ в аминоацил-тРНК' он легко взаимодействует с А-участком пептидил-тРНК с образованием пептидил-пуро-мицина.
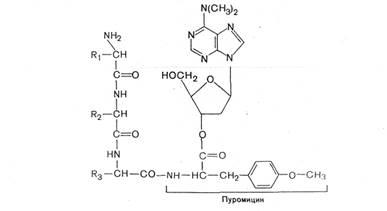
Поскольку пептидил-пуромицин не несет на себе триплета антикодона, он тем самым тормозит элонгацию пептидной цепи, вызывая обрыв реакции. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка denovo. Укажем также, что пуромицин тормозит синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, который вследствие высокой токсичности применяется редко. Он оказывает тормозящее влияние на синтез всех типов клеточной РНК, в особенности мРНК. Это свойство вызвано тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней. Можно считать, что актиномицин D ингибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу путем связывания с ферментом. Наиболее чувствительна к нему бактериальная РНК-полимераза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина t). Следует указать на недавно открытое противовирусное действие рифамицина, в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. По-видимому, этот антибиотик найдет применение в лечении опухолей, вызываемых вирусами.
Выяснены механизмы действия ряда других антибиотиков, применяемых при лечении тифозных инфекций. Так, хлорамфеникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий. На этот процесс в 80S рибосоме он не действует. Противоположное тормозящее действие на синтез белка в 80S (без поражения процесса в 70S рибосоме) оказывает циклогексимид, являющийся ингибитором транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделен способностью катализировать реакцию АДФ-рибозилирования фактора элонгации (трансляционный фактор-2, TF-2). выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину обусловлена трудностью проникновения токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним -штаммов бактерий. Высказано предположение, что эти антибиотики вызывают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами; например, кодон УУУ вместо фенилаланина начинает кодировать лейцин — в результате образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считается, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S субчастице рибосомы. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Пенициллины не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомального механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т. е. тормозят синтез белка в клетках животных.
Полученные к настоящему времени данные по механизму действия антибиотиков на синтез белка с учетом стадии и топографии процесса трансляции суммированы в табл. 13.2 (по Харперу).
Следует еще раз подчеркнуть, что нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и, соответственно, изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально. Следует отметить, что организм располагает мощными механизмами защиты: подобные изменения генетического аппарата быстро распознаются специфическими ферментами — рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.
Процесс образования полипептидной цепи на рибосомах обычно подразделяют на три стадии: инициацию (начало), элонгацию и терминацию (завершение).
Т. о., на стадии инициации происходит связывание рибосомы с инициирующим кодоном мРНК и с молекулой формилметионил-тРНК. Выбор истинного инициирующего кодона из многих АУГ и ГУГ, содержащихся в середине цепи мРНК, происходит, по-видимому, путем комплементарного взаимодействия РНК малой рибосомной субчастицы с начальным участком мРНК, в к-ром принимает участие также один из рибосомных белков. Кроме того, в образовании и стабилизации комплекса инициации (мРНК — РНК малой рибосомной субчастицы) существенную роль играют белки, называемые факторами инициации — IF (F, или FI, FII, FIll). На этой же стадии осуществляется взаимодействие формилметионил-тРНК с мРНК, при этом антпкодон тРНК комплементарно связывается с инициирующим кодоном мРНК. Полагают, что затем происходит связывание формилметионил-тРНК в центре (сайте) специфического связывания аминоацил-тРНК (A-сайте, или Асп) большой рибосомной субчастицы, в результате чего образуется целая рибосома. Далее происходиттранслокация (см.) формилметионил-тРНК в пентидильный участок большой рибосомной субчастицы, причем на этот процесс затрачивается энергия, высвобождающаяся при гидролизе одной молекулы гуанозинтрифосфата (ГТФ).
В отличие от бактерий в клетках высших организмов роль инициаторной аминоацил-тРНК играет не формилметионил-тРНК, а метионил-тРНК. Так же как и у бактерий, существенное значение в инициации Т. имеют факторы инициации и комплементарное взаимодействие мРНК и РНК малой рибосомной субчастицы.
Стадия терминации синтеза полипептидной цепи начинается в тот момент, когда против Асп на рибосоме оказывается терминирующий кодон мРНК, для к-рого в клетке нет соответствующей аминоацил-тРНК. Существует три кодона такого рода — УАГ, УАА и УГА. Эти триплеты узнаются специфическими вне-рибосомными белковыми факторами терминации ((RF-1 или RF-2), к-рые расщепляют эфирную связь, соединяющую завершенный полипептид с тРНК аминокислоты, вошедшей в полипептидную цепь последней. При этом полипептид и тРНК покидают рибосому, после чего она диссоциирует на две субчастицы.
Как правило, молекула мРНК транслируется одновременно несколькими рибосомами. Как только 5′-конец молекулы мРНК выходит из одной рибосомы, он может сразу же взаимодействовать с другой рибосомой, инициируя Т. следующей полипептидной цепи. Т. о., возникает структура, называемая полирибосомой, или полисомой, и представляющая собой гроздь рибосом, соединенных молекулой мРНК. Количество рибосом в одной полисоме в значительной степени определяется длиной мРНК, а также соотношением скорости инициации и элонгации.
Взаимодействие кодонов мРНК с антикодонами тРНК на рибосомах осуществляется на основании принципа комплементариости. Однако оказалось, что один и тот же антикодон тРНК может взаимодействовать более чем с одним кодоном мРНК. На основании этого Ф. Крик предложил гипотезу о так наз. неоднозначном соответствии, согласно к-рой первые две пары оснований кодона и анти-кодона должны взаимодействовать между собой по принципу комплементарности. Что же касается третьей пары оснований (3′-конец кодона и 5′-конец антикодона), то для нее стерические ограничения не столь жестки, и в этом случае возможны нек-рые отклонения от абсолютной комплементарности. В целом эта гипотеза подтвердилась полученными данными о последовательности антикодонов многих тРНК.
В основе действия многих антибиотиков лежит блокирование синтеза белка на бактериальных рибосомах. В молекулахстрептомицина в (см.), неомицинов (см.) иканамицина (см.) содержится общая хим. структурная группировка, однако с рибосомами эти антибиотики связываются по-разному. В результате действия стрептомицинов рибосомы начинают неправильно считывать генетический код. Устойчивость бактерий к стрептомицину (см.Лекарственная устойчивость микроорганизмов) возникает при мутационных изменениях отдельных белков малой рибосомной субчастицы.Тетрациклины (см.) ингибируют связывание аминоацил-тРНК с Асп рибосомы. Хлорамфеникол (см.Левомицетин) ингибирует образование пептидной связи между остатками аминокислот и действует на большую субчастицу рибосомы. Эритромицин (см.Макролиды) также связывается с большой субчастицей рибосомы, однако он, по всей видимости, блокирует транслокацию, задерживая, т. о., пептидил-тРНК в Асп рибосомы. Мутации (см.Мутация), приводящие к устойчивости микроорганизмов к эритромицину, затрагивают один из белков большой субчастицы рибосомы.
Из веществ, влияющих на синтез белков на рибосомах у высших организмов, известны циклогексимид, фусидиевая к-та, дифтерийный токсин. Первые два соединения блокируют транс локацию пептидил-тРНК из Асп рибосомы в пептидильный центр. Дифтерийный токсин, попадая в клетку, также блокирует транслокацию, воздействуя на один из факторов элонгации.
Многочисленные данные свидетельствуют о том, что в клетках высших организмов аппарат синтеза белков является в значительной степени универсальным: мРНК одного клеточного типа могут эффективно транслироваться в бесклеточных системах и даже интактных клетках другого типа без необходимости введения каких-либо специфических факторов.
В клетках млекопитающих регуляция Т. осуществляется прежде всего через воздействие на стадию инициации Т. Такого рода контроль показан на примере действия гемина на синтез белка в ретикулоцитах. При нарушениях синтеза гема (см.Гемоглобин), наследственных или же вызванных дефицитом железа, свинцовым отравлением и др., интенсивность синтеза глобинов в ретикулоцитах снижается. Оказалось, что угнетение синтеза белка осуществляется на стадии инициации Т. В отсутствие гемина образуется ингибитор — фермент протеинкиназа (см.Киназы), блокирующий присоединение инициирующей метионил-тРНК к малой рибосомной субчастице путем непосредственного воздействия на один из белковых факторов инициации. Возможно, в клетках существует множество регулирующих систем такого рода, зависящих от разных компонентов внутриклеточной среды. Регуляторную роль в процессе Т. могут играть также белки, находящиеся в комплексе с мРНК в виде цитоплазматических рибонуклеопротеидов — информосом.
В осуществлении процессов Т. у высших организмов большое значение имеет структура мРНК. В составе мРНК, помимо транслируемых, имеются нетранслируемые последовательности, расположенные в начале и в конце молекул мРНК. Последовательность нуклеотидов в них позволяет образовываться здесь двуспиральным и петельным структурам, к-рые могут быть вовлечены во взаимодействие с различными компонентами системы Т., а также определять стабильность и срок жизни мРНК. Транслируемые последовательности мРНК могут быть также вовлечены в регуляцию синтеза белка. В отдельных мРНК предпочтительно для кодирования нек-рых аминокислот используются определенные кодоны. Это дает возможность клетке регулировать Т. благодаря тем или иным наборам изоакцепторных тРНК, различающихся своими антикодонами.
Универсальность системы синтеза белка у высших организмов заставляет предположить, что генетические дефекты любого из ее компонентов должны отражаться на общем синтезе клеточных белков, у гомозигот такие мутации могут оказаться летальными. Изменения в структуре мРНК в результате генных мутаций (см.) являются причинами моногенных наследственных болезней (см.) у человека, приводя к резкому снижению или полному отсутствию синтеза данного белка или же обусловливая образование структурно и функционально аномальных белков.
Библиогр.: Ашмарин И, П. Молекулярная биология, с. 141, Л., 1974; Бреслер С. Е. Молекулярная биология, с. 493, Л., 1973; Гайцхоки В. С. Информационные РНК клеток животных, М., 1980; Спирин А. С. и Гаврилова Л, П. Рибосома, М., 1971; Стент Г. и Кэлиндар Р. Молекулярная генетика, пер. с англ., М., 1981; Уотсон Д ж. Молекулярная биология гена, пер. с англ., М., 1978; Crick F. Н. С. Codon — anticodon pairing, the wobble hypothesis, J.; molec. Biol., v. 19, p. 548, 1966; LodishH. F* Translational control of protein synthesis, Ann. Rev, Biochem., v, 45, p. 39, 1976.
Источник: Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание
Читайте также:


