Чувствительным маркером сепсиса является следующий показатель
Оценить диагностическое значение референсных показателей маркера сепсиса в диагностике синдрома системной воспалительной реакции (ССВР) и сепсиса у пациентов с нозокомиальной пневмонией (НП).
Материалы и методы
В исследование были включены 100 пациентов (68 мужчин; средний возраст 62,1±7,2 лет) с НП, которых распределили на следующие группы: 1-я (n=33) – без ССВР, 2-я (n=29) – с 1-2 критериями ССВР, 3-я (n=38) – с сепсисом, 4-я (n=8) – с тяжелым сепсисом и 5-я (n=3) – с септическим шоком. Результаты анализа пресепсина оценивали в соответствии с технической документацией: 300 пг/мл – системная инфекция (сепсис) возможна; >500 пг/мл – умеренный риск развития системной инфекции (тяжелый сепсис); >1000 пг/мл – высокий риск развития системной инфекции (тяжелый сепсис/септический шок). Диагностическую значимость уровня пресепсина определяли с помощью построения ROC кривых и измерения площади под кривой (area under the curve – AUC)
Значения AUC в первых трех группах составили 30,1%, 44,4% и 64,5% и указывали на низкое диагностическое значение концентрации пресепсина. AUC была достаточно высокой (75,2%) только у пациентов с тяжелым сепсисом. Выявлена статистически значимая корреляционная связь между уровнями пресепсина и сывороточного креатинина (r=0,439; р Заключение
Результаты ROС-анализа у пациентов с НП свидетельствует о невысоком диагностическом значении референсных показателей маркера сепсиса пресепсина у больных с умеренно выраженными признаками ССВР. Информативность данного показателя повышалась у пациентов с принаками тяжелого сепсиса. Интерпретировать содержание пресепсина у пациентов с НП следует с учетом комплекса клинических и лабораторно-инструментальных данных.
Нозокомиальная пневмония (НП) является одной из наиболее распространенных нозокомиальных инфекций, возникающих в отделении реанимации и интенсивной терапии (ОРИТ) [1]. Согласно международным исследованиям смертность от НП на фоне искусственной вентиляции легких достигает 4,4% (95% доверительный интервал [ДИ] 1,6-7,0) на 30-й день и 5,9% (95% ДИ 2,5-9,1) на 60-й день [2]. НП сопровождается развитием системной воспалительной реакции, а также приводит к развитию сепсиса, что требует быстрой диагностики и адекватной антибактериальной терапии (АБТ). Хотя смертность пациентов с НП и сепсисом постепенно снижается, она по-прежнему остается высокой [3].
Высокий уровень смертности от сепсиса в определенной степени связан с трудностями его диагностики [4,5]. Клинические критерии характеризуются низкой чувствительностью и специфичностью [6], что может приводить как к гипердиагностике, так и гиподиагностике сепсиса. Критерии диагностики и классификации сепсиса были предложены на конференции American College of Chest Physicians (ACCP)/S):1–112. ociety of Critical Care Medicine (S):1–112. CCM) еще в 1992 г. Последние поправки в данные критерии были внесены в марте 2016 г., в частности было исключено понятие “тяжелого сепсиса” [7,8]. Особую сложность представляют клинические ситуации, когда существует риск развития раннего послеоперационного сепсиса, например, после обширных хирургических вмешательств (абдоминальных, кардиохирургических, торакальных операций) [9].
Для послеоперационного периода характерно развитие синдрома системной воспалительной реакции (ССВР), который зависит от типа и объема оперативного вмешательства, а также возможных интраоперационных осложнений. Его бывает сложно отличить от раннего сепсиса на фоне НП или других инфекций [1013]. Поэтому необходим универсальный диагностический маркер, который позволил бы клиницисту судить о наличии сепсиса на фоне различных инфекционных осложнений, в частности НП. С этой целью в настоящее время используют С-реактивный белок и прокальцитонин. Изучается также диагностическое значение лейкоцитарного индекса интоксикации, фактора некроза опухоли-α, интерлейкина-6 [14]. На данные маркеры возлагались большие надежды, однако все они имеют ряд недостатков и не позволяют своевременно диагностировать ранний послеоперационный сепсис 16.
Одним из современных маркеров сепсиса является пресепсин – растворимый аминоконцевой фрагмент кластера дифференцировки (CD) маркерного белка CD14. Пресепсин высвобождается в кровоток при активации моноцитов. В доклинических и клинических исследованиях было показано, что он является высокочувствительным и высокоспецифичным маркером сепсиса. Однако чувствительность и специфичность пресепсина в ранней диагностике сепсиса, а также возможность использования биомаркера для оценки его тяжести, динамики состояния пациента на фоне лечения и прогноза остаются неясными. Мало изучено влияние сопутствующей патологии, медикаментозной терапии, генетических факторов на уровень пресепсина [18,19].
Целью исследования было оценить диагностическое значение референсных значений уровня пресепсина в диагностике ССВР и сепсиса у пациентов с НП.
Материал и методы
В ретроспективное исследование включали пациентов с НП, которые находились в отделениях реанимации и интенсивной терапии университетской клинической больницы 1 Первого МГМУ им. И.М. Сеченова. Диагноз НП №1 им. Н.И. Пирогова. Рациональная фармакотерапия в устанавливали в соответствии с клиническими рекомендациями (Нозокомиальная пневмония у взрослых, 2016 г.) [20], сепсиса – на основании критериев ACCР/S):1–112. CCM 2001 г. [21]. Пациенты с установленным диагнозом сепсиса получали терапию согласно стандартам и протоколам ведения больных сепсисом (S):1–112. urviving S):1–112. epsis Campaign, 2012 г.).
Концентрацию пресепсина в крови определяли в экспресс-лаборатории УКБ 1 методом иммунохемилюми№1 им. Н.И. Пирогова. Рациональная фармакотерапия в несцентного анализа (автоматический анализатор PATHFAS):1–112. T LS):1–112. I Medience Corporation). Результаты интерпретировали в соответствии с технической документацией: 300 пг/мл – системная инфекция (сепсис) возможна; >500 пг/мл – умеренный риск развития системной инфекции (тяжелый сепсис); >1000 пг/мл – высокий риск развития системной инфекции (тяжелый сепсис/септический шок).
Анализировали следующие переменные: возраст, пол, наличие и характер оперативного вмешательства, уровень пресепсина, длительность искусственной вентиляции легких (ИВЛ), результаты микробиологического исследования, клиренс креатинина и летальность.
С помощью ROC анализа площади под кривой оценивали диагностическое значение уровня пресепсина при различных клинических состояниях [22]. При анализе площади под кривой (AUC ROC) использовали следующие значения для определения диагностического значения модели: 50-60% – неудовлетворительное, 60-70% – среднее, 70-80% – хорошее, 80-90% – очень хорошее, 90-100% – отличное.
Статистический анализ выполнен с помощью пакета статистических программ IBM S):1–112. PS):1–112. S):1–112. S):1–112. tatistics 18.0. Данные представлены в виде средних значений и стандартных отклонений, медиан и интерквартильного размаха. Доверительные интервалы для частоты рассчитывали на основе биномиального распределения. Достоверность различий частот определяли при помощи критерия χ2 (для таблиц 2×2 – в точном решении Фишера). Достоверность различий средних арифметических значений в группах определяли при помощи дисперсионного анализа. Поскольку величина коэффициента эксцесса у пресепсина достаточно большая, даже в группе более 30 человек использование параметрических методов статистики может быть некорректным. Поэтому помимо дисперсионного анализа, использовали непараметрические методы, определяли достоверность различия средних рангов между двумя группами с помощью критерия U Mann-Whitney-Wilcoxon, а между тремя и более группами с помощью критерия Kruskal–Wallis. Различия считали статистически достоверными при р
Результаты
В ретроспективное исследование были включены 100 пациентов с НП, которых распределили на следующие группы: 1-я – отсутствие критериев ССВР, 2-я – наличие 1-2 критериев ССВР, 3-я – сепсис, 4-я – тяжелый сепсис, 5-я – септический шок (табл. 1). В группах пациентов без ССВР и с 1-2 критериями ССВР уровень пресепсина был достоверно ниже, чем в группах пациентов с сепсисом, в то время как между группами пациентов с сепсисом, тяжелым сепсисом и септическим шоком он существенно не различался (табл. 2).
| Показатели | 1 группа, нет критериев ССВР | 2 группа, 1-2 критерия ССВР | 3 группа, сепсис | 4 группа, тяжелый сепсис | 5 группа, септический шок |
|---|---|---|---|---|---|
| Число больных | 33 | 27 | 29 | 8 | 3 |
| Муж/жен | 20/13 | 19/8 | 20/9 | 6/2 | 3/0 |
| Средний возраст [диапазон], лет | 62,2 36 | 62,2 27 | 62,06 47 | 61,6 [38- 77] | 62,1 43 |
| Послеоперационный период, дни | 29 | 20 | 20 | 7 | 3 |
| ИВЛ, дни | 11 | 10 | 17 | 8 | 3 |
| Возбудители | |||||
| грам (+) | 2 | 0 | 5 | 3 | 0 |
| грам (-) | 8 | 0 | 12 | 6 | 0 |
| грам (+)/грам (-) | 0 | 0 | 4 | 2 | 0 |
| Летальность, n (% | 13 (39,9) | 14 (51,4) | 17 (58,2) | 6 (75,0) | 2 (66,7) |
| Показатели | 1 группа, нет критериев ССВР | 2 группа, 1-2 критерия ССВР | 3 группа, сепсис | 4 группа, тяжелый сепсис | 5 группа, септический шок |
|---|---|---|---|---|---|
| Пресепсин (пг/мл) | |||||
| средний | 637±419 | 888±517 | 2095±1107 | 1575±1318 | 1821±2169 |
| диапазон | 307-532 | 318-1801 | 526-2516 | 812-2125 | 555-2738 |
| р (U тест Maнн-Уитни) | 0,004 | 0,010 | 0,056 | 0,502 | 0,141 |
Уровень пресепсина не зависел от локализации дополнительного очага инфекции (табл. 3). Исклю чение составили пациенты с сочетанием НП и нозокомиального трахеобронхита, ассоциированного с проведением ИВЛ, у которых уровень пресепсина был достоверно выше, чем в других группах (р=0,029).
Также был проведен анализ уровня пресепсина у пациентов, перенесших различные типы оперативных вмешательств (табл. 3). У больных, которым были выполнены кардиохирургические и торакальные вмешательства, а также у пациентов, находившихся в отделении гнойной хирургии, уровень пресепсина был достоверно выше, чем у других больных (р=0,011, р=0,019 и р=0,002, соответственно) (табл. 3). В то же время он не отличался между указанными группами (р=0,712, р=0,885 и р=0,658 соответственно).
| n | М±m (пг/мл) | р* | |
|---|---|---|---|
| Примечание: *Kruskal–Wallis | |||
| Инфекционный очаг | |||
| Нозокомиальный бронхит | 16 | 1926,4±1280,8 | 0,029 |
| Перитонит | 5 | 1543,9±2778,9 | 0,955 |
| Невыявленный очаг инфекции | 18 | 1018,3±1273,1 | 0,503 |
| Инфекции области хирургического вмешательства | 13 | 1687,0±1283,0 | 0,786 |
| Характер оперативного вмешательства | |||
| Кардиохирургические операции | 31 | 1255,0±827,0 | 0,011 |
| Абдоминальные операции | 34 | 1489,9±544,5 | 0,019 |
| Торакальные операции | 18 | 526,6±422,0 | 0,578 |
| Операции на крупных сосудах и аорт | 10 | 633,4±422,0 | 0,425 |
| Санация гнойного очага в отделении гнойной хирургии | 11 | 1456,0±388,0 | 0,002 |
AUC, рассчитанная с помощью ROC-анализа, у больных НП без ССВР и с 1-2 критериями ССВР составила 30,1% (95% ДИ 19,7-40,5) и 44,4% (95% ДИ 32,056,1), соответственно. что указывало на низкое диагностическое показателя при данных состояниях (рис. 1). У пациентов с сепсисом значение AUC достигло 64,5% (95% ДИ 51,6-71,4), что также свидетельствовало о невысоком диагностическом значении концентрации пресепсина. Значение AUC было диагностически значимым только у пациентов с развернутой клинической картиной тяжелого сепсиса – 75,2% (95% ДИ 65,0-85,1). У 3 пациентов с септическим шоком значение AUC не рассчитывали.
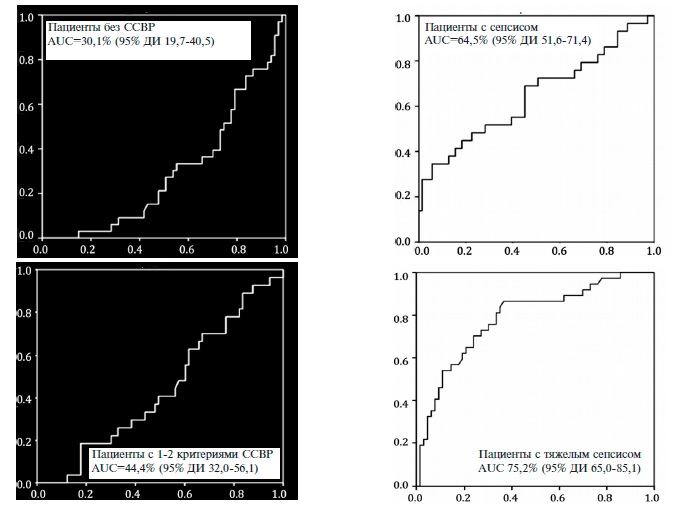
Рис. 1. Результаты RОCОВЕТ анализа уровня пресепсина в различных группах пациентов с НП
Результаты ROC-анализа также показали, что уровень пресепсина не позволял с достаточной точностью предсказать относительный риск летального исхода (AUC 65,4%; 95% ДИ 54,6-76,2).
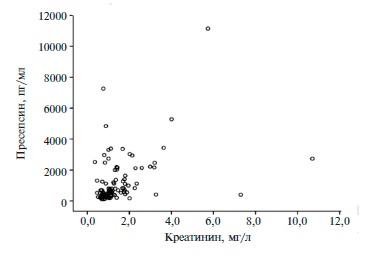
Рис. 2. Зависимость уровня пресепсина от уровня креатинина
Выявлены положительные корреляционные связи уровня пресепсина с сывороточной концентрацией креатинина (r=0,439; р
Обсуждение
У пациентов, перенесших различные оперативные вмешательства и находящихся на искусственной вентиляции легких в отделении интенсивной терапии, значительно повышается риск развития НП и сепсиса. В данной ситуации необходим точный диагностический маркер, позволяющий диагностировать сепсис, развившийся на фоне НП. Соответственно, целесообразно оценить возможность применения заявленных производителем референсных значений пресепсина с дифференциально-диагностической целью в данной когорте пациентов. Однако в большинстве исследований референсные значения данного маркера определяли у здоровых добровольцев. Так, в исследованиях D. Giavarina и соавт. [23] и С. Chenevier-Gobeaux и соавт. [24] у пациентов без ССВР референсные значения пресепсина не превышали 184 и 202 пг/мл, соответственно. Однако они не анализировались у больных с очагом инфекции, у которых отсутствовал ССВР или имелись только 1-2 критерия ССВР. Кроме того, во многих исследованиях сравнивали значение уровня пресепсина и других общепринятых маркеров – С-ре ак тивного белка и прокальцитонина [19].
Полученные нами данные свидетельствуют о невысоком значении референсных значений концентраций пресепсина в диагностике сепсиса у пациентов с НП в обычной клинической практике. В связи с этим при интерпретации содержания пресепсина следует учитывать как клинические, так и лабораторно-инструментальные данные. Необходимо проведение дополнительных исследований для изучения уровня пресепсина у пациентов с предполагаемым сепсисом на фоне НП или других инфекционных осложнений (перитонита, медиастинита, трахеобронхита и др.), так как он может отличаться у больных разного профиля. В двух исследованиях референсные значения уровня пресепсина у пациентов, которым проводилась ИВЛ, и больных с интрабдоминальными инфекциями были сопостави с таковыми у пациентов с сепсисом [25,26]. Наши данные демонстрируют высокое диагностическое значение концентрации пресепсина у пациентов с НП, сочетавшейся с ИВЛ-ассоциированным трахеобронхитом и сепсисом. В исследовании J. Bojan и соавт. была отмечена высокая информативность уровня пресепсина у пациентов с НП, развившейся на фоне ИВЛ, и сепсисом [27].
Полученные нами данные во многом согласуются с результатами исследований, продемонстрировавших четкую зависимость между сывороточными уровнями креатинина и пресепсина у пациентов с нарушением функции почек [28,29]. Наличие такой связи свидетельствует о необходимости более тщательного изучения содержания пресепсина у пациентов с нарушением функции почек, в частности с острым почечным повреждением, развившимся в раннем послеоперационном периоде или индуцированным сепсисом, при проведении сеансов заместительной почечной терапии.
Наше исследование имеет ряд ограничений, основным из которых является ретроспективный дизайн. Кроме того, мы не оценивали концентрацию пресепсина в динамике.
Заключение
Результаты ROС-анализа свидетельствует о невысоком диагностическом значении референсных показателей маркера сепсиса пресепсина у больных с умеренно выраженными признаками ССВР на фоне НП, хотя информативность показателя повышалась у пациентов с принаками тяжелого сепсиса. Интерпретировать содержание пресепсина у пациентов с НП следует с учетом других клинических и лабораторно-инструментальных данных.

Инфаркт миокарда по-прежнему занимает особое место в кардиологии. Эта патология сопряжена не только с осложнениями, но и нередко угрожает жизни пациента. Зачастую формируется по известному сценарию. Существующие факторы кардиального риска и/или дисфункция эндотелия запускают воспалительные и атеросклеротические изменения. Они, в свою очередь, вызывая ишемию миокарда и/или коронарный тромбоз, либо эмболию коронаров формируют участок некроза с последующим возникновением аритмии и кардиосклероза. Далее происходит ремоделирование и дилатация желудочков, приводящие к недостаточности сердца с возможностью летального исхода.
В диагностической медицине исследования в направлении определения биохимических маркеров повреждения миокарда основываются на базе этой теории патогенеза заболеваний сердечно-сосудистой системы.
Классификация биомаркеров заболеваний сердечно-сосудистой системы:
1) Биомаркеры дислипидемии и модификации липопротеидов
2) Провоспалительные маркеры
3) Маркеры нестабильности и повреждения атеросклеротической бляшки
4) Маркеры ишемии и некроза сердечной мышцы
5) Маркеры дисфункции миокарда
6) Маркеры тромбообразования и фибринолиза
7) Маркеры ремоделирования
Провоспалительные цитокины: IL – 6; Туморнекротизирующий фактор альфа (TNFальфа)
Маркеры нестабильной бляшки: Матриксная металлопротеиназа – 9, Миелопероксидаза, Молекулы межклеточной адгезии (ICAM, VCAM).
Маркеры нестабильной бляшки: Растворимый комплекс CD0L (sCD40L), Плацентарный фактор роста (PIGF), Плазменный протеин А, ассоциированный с беременностью (PAPP -A).
Острофазные реактанты: С-реактивный белок (hhsCRP)
Маркеры ишемии: Ишемия модифицированный альбумин (IMA), не связанные с альбумином жирные кислоты (FFAu), Холин, Гликогенфосфорилаза ВВ.
Маркеры некроза: cTnT, cTnI, Креатинкиназа МВ, Кардиопротеин, связывающий свободные жирные кислоты (H-FABP), Миоглобин (Mb).
Миокардиальная дисфункция: BNP, NTropoBNP
Данная классификация важна, так как практически каждый биомаркер, представленный в ней, может быть использован для диагностики повреждений миокарда. Следует обратить внимание на перечень показателей повреждения миокарда, которые используются для диагностики острого коронарного синдрома (ОКС). Диагностика по определению концентрации биомаркеров проводится с помощью специальных тест-систем. Нужно сказать о том, что все-таки, самым важным критерием для каждого маркера является признание его эффективности для диагностики патологий сердечно-сосудистой системы, и доказательность этой эффективности. Расценивая биохимические маркеры по степени эффективности их диагностики, следует заметить, что она существует для следующих показателей: сердечные тропонины, изоформа МВ креатинкиназы, миоглобин, NTproBNP, hsCRP. Два последних не являются прямыми показателями некроза, но маркер NTproBNP – показывает функциональные возможности миокарда, а hsCRP – это маркер воспаления, он характеризует дестабилизацию атеросклеротической бляшки и степень повреждения мышечной стенки сердца. Благодаря тому, что данные маркеры были внедрены в медицинскую деятельность для диагностики, стало более ясным формирование таких диагнозов, как инфаркт миокарда и нестабильная стенокардия.
Несомненно, стоит заметить, что большинство традиционно используемых биомаркеров уходят из современной диагностической медицины. Например, такие показатели, как креатинфосфокиназа, изоформы лактатдегидрогеназы, аспартаттрансаминаза. В настоящий момент определение их концентрации с целью диагностики ОКС не рекомендуется.
Наиболее подробно рассмотрим диагностическую ценность таких маркеров как тропонины, СК-МВ и миоглобин.
В кардиологии для диагностики повреждения миокарда все чаще стали определяться такие биомаркеры как тропонины, а конкретнее, тропониновый комплекс кардиомиоцитов – кардиоспецифические белки TnT и TnI.
Что же такое тропонин? Тропонин – это структура, входящая в состав поперечно-полосатой мускулатуры, имеющая белковую природу. Его локализация – это тонкие миофиламенты сократительной части миокардиоцита. В состав тропонина входят три компонента, такие как: TnC, TnT и TnI. TnC по своему аминокислотному составу абсолютно идентичен миофибриллам миокарда. TnT и TnI это белковые компоненты тропонина, которые отличаются своим аминокислотным составом от сократительных миофибрилл миокарда. Таким образом, можно заверить, что TnT и TnI – это в действительности специфичные для миокарда изоформы тропонина. Если говорить о массе, то молекулярный вес TnT равен 37000 дальтон, TnI – 24000 дальтон. Также, эти два вида тропонинового маркера отличаются и количественным содержанием в кардиомиоцитах. Концентрация TnT в кардиомиоцитах в 2 раза превышает количественную концентрацию TnI. В самой клетке кардиомиоцита тропонины лежат организованно, но иногда можно встретить и свободные формы биомаркеров тропонинового ряда в цитоплазме клеток миокарда.
Если говорить о здоровом человеке, то у него тропонины в крови должны непременно отсутствовать. Если в организме человека произошел некроз миокарда, или же иначе сказать инфаркт, то при этом состоянии происходит гибель миокардиоцитов и тропонины, входящие в их состав, выходят из разрушенных клеток и направляются в кровеносное русло, циркулируя там как в свободной, так и в связанной форме. По прошествии 5 часов от начала приступа инфаркта миокарда, есть возможность определения тропонинов в венозной крови. Максимальная концентрация тропонинов наступает через 12–24 часа. Но даже при этом тропонины не являются самыми ранними биомаркерами для диагностики инфаркта миокарда.
Наиболее ранним в диагностике острого инфаркта миокарда является миоглобин. Обнаружить его в крови представляется возможным уже через 3,5 часа от начала приступа. К нормальным концентрационным показателям тропонин вернется через 15–39 часов. Если конкретизировать концентрационное повышения уровня отдельных форм тропонинов, то повышение уровня TnT в крови наблюдается примерно через 5 часов, TnI спустя 4,5 часа. В среднем, максимальная концентрация тропонинов наблюдается: TnT – через 18 часов, а TnI через 19 часов. Таким образом, несомненно, следить за повышением концентрации уровня данных диагностических биомаркеров необходимо на протяжении 6–12 часов [1].
Самым ранним биомаркером инфаркта миокарда является миоглобин, и в этом заключается его диагностическая ценность. Давайте разберемся, что же такое миоглобин. Миоглобин – это белок, которой находится в мышечной ткани сердца и скелетной мускулатуре. По своей функции миоглобин очень схож с гемоглобином, он обеспечивает перенос кислорода из легких к тканям, в нашем случае, к тканям сердца. После того, как миоглобин связывается с молекулой кислорода, он преобразуется в оксимиоглобин. Молекула кислорода освобождается от молекулы оксимиоглобина при сокращении миофибрилл, то есть при сокращении сердца. В условиях неповрежденного миокарда миоглобин не выходит в кровеносное русло. При повреждении сердечной мышцы, молекулы миоглобина попадают в кровоток, и у врача появляется возможность своевременно диагностировать инфаркт [2].
Нужно обратить внимание на то, что же представляет особую диагностическую ценность биомаркеров в общем. Это присущие им такие качества, как чувствительность и специфичность. M. Plebani с соавторами, в сравнительном аспекте, исследовали чувствительность и специфичность миоглобина, СК, СК-МВ, TnT и TnI в диагностике острого инфаркта миокарда через 3, 6 и 12 часов от начала развития заболевания.
По результатам анализа Plebani видно, что через 3 часа после инфаркта максимальная чувствительность наблюдается у миоглобина (69 %). Спустя 6 часов возрастает чувствительность тропонинов и СК-МВ более чем в 1,5 раза, а к 12 часам все четыре показателя имеют чувствительность – 100 %.
Говоря же о специфичности, отмечается то, что самым высоким уровнем обладают тропонины, а самый низкий уровень наблюдается у миоглобина. Соотношение чувствительность и специфичности у тропонинов примерно соответствовало соотношению чувствительности и специфичности у СК-МВ [3].
По результатам этого исследования, можно заверить, что использование тропонинов, СК-МВ и миоглобина как маркеров острого коронарного синдрома вполне обосновано.
Проводить исследование уровня этих маркеров возможно в виде двойного теста, с определением динамики изменения их концентрации. В первую очередь, необходимо исследовать количество миоглобина, так как он является ранним, наиболее чувствительным биомаркером повреждения миокарда, а также наблюдение изменения концентрации тропонинов в течение суток. Из-за своей высокой специфичности тропонины являются ценными маркерами в диагностике инфаркта миокарда после реанимационных мероприятий и хирургических вмешательств, так как СК в подобных ситуациях реагирует на повреждение скелетных мышц. Но, несмотря на их высокую специфичность, повышение концентрации тропонинов может наблюдаться также при ряде других заболеваний, таких как: дилатационные кардиомиопатии, заболевания центральной нервной системы, хроническая почечная недостаточность, сепсис, заболевания легких и эндокринной системы, ВИЧ-инфекция, тяжелые классы хронической сердечной недостаточности. Конечно, при данных заболеваниях, диагностируемая концентрация тропонинов будет меньше, чем при коронарогенных некрозах (инфаркте миокарда). При хронической почечной недостаточности, появление в крови TnT связано с реэкспрессией генов, отвечающих за синтез кардиального TnT в поперечно-полосатой мускулатуре, при этом, для таких больных это свидетельствует о неблагоприятном прогнозе течения заболевания. Также появление TnT в скелетных мышцах может свидетельствовать о мышечной дистрофии Дюшена и полимиозите.
Говоря о главном преимуществе именно тропонинов, в сравнении с другими диагностическими маркерами, нужно упомянуть про их специфическую способность реагировать даже на самые незначительные очаги повреждения стенки миокарда [4]. В литературе высказывается мнение о том, что некроз даже 1 грамма миокарда сопровождается появлением высоких концентраций тропонинов в крови.
Какова же концентрация тропонинов в норме? В настоящее время точной информации об этом, к сожалению, нет. Можно утверждать о том, что даже самое незначительное повышение уровня тропонинов в крови уже представляет немалую опасность для пациента [5]. В этом смысле, логичной является точка зрения экспертов Европейского общества кардиологов и Американской коллегии кардиологов, которая заключается в том, что любое повышение уровня тропонинов, при обострении ИБС и при интракоронарных вмешательствах, говорит об инфаркте миокарда.
Какой же уровень тропонинов следует считать повышенным? Повышение уровня тропонинов мы можем диагностировать, если его количественное значение превышает 99 перцентиль от среднего значения, полученного в контрольной группе.
Если же обнаружение тропонинов, по какой-либо причине не представляется возможным, целесообразным будет исследование уровня биомаркера СК-МВ. Диагностировать инфаркт врач сможет только в том случае, если уровень СК-МВ будет превышен на 99 перцентилей, по сравнению с контрольной группой. Если же нет возможности исследования и этого биомаркера, тогда альтернативой может стать биомаркер СК. Патология выявляется также при двойном увеличении его концентрации.
В качестве примера можно рассмотреть клинический случай резкого повышения концентрации СК-МВ у пациента с инфарктом миокарда. В день поступления пациента в поликлинику, ему был проведен качественный тест на тропонины, без определения фракций и количественный тест на определение СК-МВ. Тропониновый тест, как в день поступления, так и на следующий день давал положительный результат. Уровень СК-МВ в день поступления был резко повышен – 100 ед./л., тогда как в норме уровень СК-МВ равен 6–25.
Увеличение количественного уровня тропонинов и СК-МВ при диагностике инфаркта миокарда, доказательно показывает нам корреляцию данных биохимических маркеров с уровнем некротических изменений кардиомиоцитов [7]. Данный момент дает возможность врачам выбирать быструю и правильную тактику лечения и оказания помощи пациентам.
Немаловажное значение имеет определение уровня маркеров при рецидивах инфаркта миокарда, а также определение их концентрации при интракардиальных хирургических вмешательствах. Но, важным является то, что уровень полученного количественного значения маркеров должен быть на 20 % больше предыдущего.
Такое осложнение, как острый инфаркт миокарда, может возникнуть после хирургического интракардиального вмешательства. Это возможно в результате двух процессов: 1) При формировании интракардиального тромба; 2) Жировая эмболия интраваскулярной бляшкой. Возникновение тромба приводит к обширному инфаркту миокарда, а эмболия приводит к развитию микроинфаркта. Именно для диагностики микроинфаркта необходимо использовать биомаркеры.
Диагностирование инфаркта миокарда как осложнения интракардиального вмешательства необходимо через 18–24 часа после проведения операции. Если говорить про биомаркер СК-МВ, то его превышение в 3 раза и более свидетельствует о поражении миокарда некрозом. Более полную картину можно проследить, если определить концентрацию СК-МВ не только после, но и до проведения операции. Операции, проводимые на миокарде, могут быть следующего плана, это: ангиопластика, стентирование и шунтирование.
Подведя итоги и обобщив исследовательские данные по увеличению концентрации биомаркеров, можно сказать, что в современном мире диагностика инфаркта миокарда непременно должна базироваться на определении уровня содержание специфических маркеров. В первую очередь, таких как тропонины, СК-МВ и миоглобин. Определение данных биомаркеров является чрезвычайно информативным методом диагностики инфаркта миокарда, и это очень важно, ведь инфаркт миокарда это патология, которая встречается довольно часто в наше время. Результаты определения количества биомаркеров повреждения миокарда помогут определить риски летального исхода, выбрать наиболее оптимальную тактику лечения и проследить эффективность назначенной терапии заболевания. Также, важным является определение количества биомаркеров и при хирургических манипуляциях на миокарде и коронарных сосудах. В данном случае, при повышении уровня тропонинов, уже можно поставить диагноз – инфаркт миокарда, даже без использования дополнительных методов диагностики этого заболевания, например, таких как ЭКГ. Однако изучение биомаркеров будет продолжаться.
Читайте также:


