Антитела при бруцеллезе животных
Бруцеллез (лихорадка мальтийская, средиземноморская, гибралтарская, кипрская, ундулирующая, тифомалярийная, болезнь Банга) – инфекционное заболевание из группы бактериальных зоонозов, возбудителем которого являются микроорганизмы рода Brucella. Патогенными для человека являются В. melitensis, Br. abortus, Br. suis. Инфицирование человека происходит преимущественно алиментарным путем, реже контактным или аэрогенным. Представляет собой системное инфекционно-аллергическое заболевание со склонностью к хроническому рецидивирующему течению с преимущественным поражением опорно-двигательной, нервной и мочеполовой систем организма. В зависимости от клинической картины выделяют острую, подострую, хроническую и резидуальную форму бруцеллеза. Наиболее чувствительным в настоящее время является иммуноферментный анализ (ИФА), который рекомендуют в качестве экспресс-метода при массовых обследованиях.
Антитела к бруцеллезу.
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Бруцеллез - зоонозная инфекция, характеризующаяся полиорганным поражением и склонностью к хронизации. Значимым патогенетическим компонентом бруцеллеза является аллергическая реактивность. Передача бруцелл происходит в основном пищевым и водным путем, наиболее часто через молоко и мясо зараженных животных. У скотоводов может реализоваться воздушный и контактный путь передачи бруцеллеза. Диагноз устанавливается при выявлении возбудителя в крови, пунктате лимфатического узла или цереброспинальной жидкости.
Заболевание вызывается неподвижными полиморфными грамположительными микроорганизмами рода Brucella. Вид бруцелл, вызывающих инфекцию, оказывает влияние на тяжесть течения, наиболее тяжело протекает бруцеллез, обусловленный заражением Brucella melitensis. Бруцеллы высокоинвазивны, размножаются внутри клеток организма хозяина, но способны сохранять активность и вне клетки. В окружающей среде устойчивы, сохраняются в воде более двух месяцев, три месяца - в сыром мясе (30 дней - в засоленном), около двух месяцев - в брынзе и до четырех - в шерсти животных. Губительно для бруцелл кипячение, нагревание до 60 °С убивает их через 30 минут.
Резервуаром бруцеллеза являются животные, источником заражения для человека преимущественно являются козы, овцы, коровы и свиньи. В некоторых случаях возможна передача от лошадей, верблюдов, некоторых других животных. Выделение возбудителя больными животными происходит с испражнениями (кал, моча), молоком, амниотической жидкостью. Передача инфекции осуществляется преимущественно фекально-оральным механизмом, чаще всего пищевым и водным путем, в некоторых случаях возможна реализация контактно-бытового (при внедрении возбудителя через микротравмы кожи и слизистых оболочек) и аэрогенного (при вдыхании инфицированной пыли) пути.
Значительную эпидемиологическую опасность представляют собой молоко, полученное от больных животных, и молочные продукты (брынза, кумыс, сыры), мясо, изделия из животного сырья (шерсть, кожа). Животные загрязняют испражнениями почву, воду, корм, что также может способствовать заражению человека непищевым путем. Контактно-бытовой и воздушно-пылевой пути реализуются при уходе за животными и обработке животного сырья.
При бруцеллезе у беременных существует вероятность внутриутробной передачи инфекции, кроме того, возможна постнатальная передача при лактации. Люди обладают высокой восприимчивостью к бруцеллезу, после перенесения инфекции в течение 6-9 месяцев сохраняется иммунитет. Повторное инфицирование бруцеллами отмечается в 2-7 % случаев.
Инкубационный период бруцеллеза в среднем составляет 1-4 недели, но при формировании латентного носительства удлиняется до 2-3 месяцев. Острый бруцеллез обычно развивается быстро, у пожилых лиц начало может быть постепенным (в этом случае больные отмечают продромальные явления в виде общего недомогания, бессонницы, разбитости, артралгий и миалгий с постепенным нарастанием интоксикации на протяжении нескольких дней). Температура тела резко поднимается, сильный озноб чередуется с потом, развивается интоксикация, чаще всего умеренная, несмотря на выраженную температурную реакцию.
Хронический бруцеллез протекает волнообразно, с проявлением симптоматики полиорганных поражений. При этом симптомы общей инфекционной интоксикации обычно выражены умеренно, температура редко превышает субфебрильные значения. Промежутки между обострениями заболевания могут продолжаться 1-2 месяца. В случае формирования нового инфекционного очага внутри организма общее состояние ухудшается. Симптоматика хронического бруцеллеза зависит от преимущественного поражения той или иной функциональной системы возбудителем и выраженности аллергического компонента.
Достаточным для подтверждения диагноза является определение антигенов бруцелл и антител к ним в крови пациента при помощи серологических методов. Исследованию подвергается обычно сыворотка крови, но возможно обнаружение антигенов и в спинномозговой жидкости. Положительный результат серологического исследования не менее чем в 3-4 различных тестах, с характерной соответствующей динамикой показателей, является достаточным основанием для подтверждения этиологии заболевания. Начиная с 20-25-го дня болезни и в течение длительного периода (несколько лет) после выздоровления отмечается положительная реакция на кожную пробу Бюрне (подкожное введение бруцеллина).
Серологические методы также могут быть полезны для дифференцировки острой и хронической формы бруцеллеза. С этой целью может выполняться определение отдельных классов иммуноглобулинов.
Для чего используется исследование?
- Для выявления инфекции (острой и хронической).
Когда назначается исследование?
- При симптомах бруцеллеза (остросептической формы): высокая температура 39-40 °С и выше, озноб, потливость, слабость, миалгия, артралгия, артрит;
- при обследовании пациентов с изолированным поражением мочеполовой системы и суставов при наличии в анамнезе указаний на употребление сырого козьего молока, особенно в эндемичных по бруцеллезу районах, и профессиональных особенностей (ветеринары, работники молочной и мясной промышленности);
- при эпидемиологическом обследовании населения и при отборе лиц для вакцинации против бруцеллезной инфекции;
- дифференциальная диагностика с гриппом, брюшным тифом, малярией, инфекционным мононуклеозом, лептоспирозом, лимфогранулематозом, ревматоидным полиартритом.
Что означают результаты?
Референсные значения: антитела не обнаружены.
Коэффициент позитивности (КП):
1,1 – положительный результат (антитела обнаружены).
КП – концентрация специфических антител в единице объема. Чем выше КП пробы, тем выше концентрация антител.
- отсутствие инфекции;
- слабая иммунная реакция пациента;
- низкий уровень антител.
- острая инфекция;
- рецидив заболевания;
- хроническая форма инфекции.
В случае получения сомнительного результата рекомендуется повторить исследование через 10-14 дней. При повторном результате "Сомнительно" результат следует рассматривать как отрицательный.
В случае заражения бактерией Brucella сначала появляются антитела IgM, затем через некоторое время антитела IgG. Диагноз "острый бруцеллез" подтверждается выявлением антител при острой симптоматике заболевания, совместным выявлением антител IgG, IgA, IgM или только IgM. Если было применено лечение, в течение 2-4 месяцев концентрация IgG, как правило, значительно уменьшается.
В случае хронического бруцеллеза особое значение имеют антитела IgG и IgA. Они свидетельствуют также о давно перенесенном заражении.
Наличие IgA, IgG при отсутствии IgM говорит о хронической инфекции или реинфекции бруцеллой.
60 Клинический и биохимический анализы крови - основные показатели
54 Сифилис RPR (антикардиолипиновый тест/микрореакция преципитации), титр
На сегодняшний день основными методами борьбы с бруцеллезом являются своевременное проведение диагностических исследований на бруцеллез крупного рогатого скота и выбраковки положительно реагирующих животных и использование противобруцеллезных вакцин.
Кратко о вакцинах, которые практически все выпускаются на нашем биокомбинате.
Сухая живая вакцина в S -форме из штамма №19,В SR –форме из штамма 82, в R -форме из штамма 75/79 и выпускалась инактивированная эмульгированная вакцина из штамма 17/100 КВ в R -форме. Все эти вакцины обеспечивают защиту в пределах 60-100%. Более иммуногенными считаются живые вакцины. И все вакцины имеют свои недостатки.
Вакцина из шт. № 19 предохраняет животных от абортов и все же главным ее недостатком является ее высокая агглютиногенность. Дело в том, что при исследовании привитого, крупного рогатого скота в установленные сроки, выявлялось значительное количество животных (особенно) коров с положительными реакциями. Причем эта реакция сохранялась в течение длительного времени (5-8) лет, а отличить их в серологических реакциях больного от вакцинированного животного не возможно.
Вакцина в этом отношении наиболее предпочтительная, через три месяца после применения вакцины не должны быть агглютиногенные реакции, но вызывает аборты у нетелей.
Вакцина из шт. 75/79 не абортогенна и не дает титры агглютиногенности, но по иммуногенности она ниже, чем вакцины из штаммов 19 и 82.
Инактивированная эмульгированная вакцина из штамма 17/100 КВ из-за очень сильных общих и местных воспалительных реакций, значительно снижающие продуктивность животных, пока требует ее доработки по снижению реактогенности.
При диагностике бруцеллеза также возникают пока вопросы. Хотя на сегодняшний много диагностических препаратов и часто возникают вопросы почему их столько? Каждый автор приводит доводы, что этот диагностический препарат выявляет больше реагирующих животных на несколько процентов по сравнению с другими диагностиками.
А диагностировать бруцеллез не всегда удается в 100% случаев. Очень часто у хронических больных животных в крови отсутствуют специфические антитела, на обнаружение которых в основном и построена диагностика. И болезнь никак не проявляется.
Это связано с тем, что возбудитель, персистируя внутри макрофагов, отгорожен мембранами этих клеток от контактов с иммунной системой хозяина. Лишь периодически, когда случается какое-либо ослабление иммунной резистентности (при стрессах, беременности, переохлаждении, токсикозах и т. д.) происходит некое обострение болезни и антигены бруцелл попадают в кровь. В результате активируются находящиеся в крови клетки памяти - долгоживущие В-лимфоциты. Они быстро дифферинциируются в плазматические клетки, которые начинают продуцировать антитела.
Наиболее информативна для выявления бруцеллеза на ранних стадиях или в период обострения это реакция агглютинации. В этот период в большом количестве синтезируются IGM .
В более поздние сроки (при хроническом течении болезни) образуются иммуноглобулины IgG , IgA , IgE , которые выявляются в РСК.
Кроме того используются аллергический тест, ИФА –наборы, разрабатываются очень чувствительные методы улавливания фрагментов ДНК бруцелл в крови, тканях или секретах (ПЦР). Этот метод перспективен, но нужно еще время чтобы его оценить.
Предлагается принципиально иной подход установления всех больных животных за счет провокации синтеза антител у хронически больных животных. Метод разработал д. б. н. Игнатов Петр Евгеньевич.
Для провокации синтеза антител предлагается использовать антиген БИВ. Антиген производится на нашем биокомбинате из биомассы бруцелл абортус штамма №19 и содержит в своем составе специфические компоненты нуклеопротеидной природы с добавлением сахарозно-желатинового стабилизатора. Это стерильный препарат не вызывающий синтеза противобруцеллезных антител у здоровых животных и индукции реакции гиперчувствительности замедленного типа, не реактогенен и не абортогенен.
Если обработать всех поголовно животных в иммунизирующей дозе, то здоровые животные приобретут некоторый краткосрочный иммунитет, то у больных животных произойдет провокация латентного бруцеллеза и в крови появятся антитела.
Если в определенное время провести диагностику на наличие бруцеллезных антител обычными антигенами (единый, РБП), то всех больных можно выделить и выбраковать для убоя.
Учитывая, что для развития реакция обострения и образования антител требуется время, первые диагностические тесты целесообразно проводить через 15 дней после обработки. Еще через 15 дней следует провести повторный тест, чтобы убедиться в отсутствии больных.
Если положительные реакции повторяются, можно через 15-20 дней проводить новые тесты до получения двукратного результата. При осложненных случаях, если через два-три месяца не удается полностью оздоровить стадо - рекомендуется еще раз ввести антиген БИВ, что еще больше иммунизирует здоровых и усилит провоцирующий эффект у больных.
Первые такие эксперименты на КРС проводили в Даниловском районе Волгоградской области (в трех хозяйствах на 2 тыс. голов КРС).
До введения антигена БИВ выявляли при каждом исследовании 1,5- 2,0% от всего поголовья, то через 15 дней после введения БИВ обнаруживалось от 4 до 6%. При повторном исследовании через 15 дней выявили еще 2-3%. При последующих исследованиях количество положительно реагирующих колебалось от 0 до 1%. А через некоторое время во всех хозяйствах получали отрицательные результаты.
То есть, за несколько месяцев при правильной организации работы можно быстро добиться двукратных отрицательных результатов.
Серологическая диагностика бруцеллеза является самой распространенной в ветеринарной практике.
В продолжение всей истории борьбы с бруцеллезом сельскохозяйственных животных серологические методы диагностики заболевания находятся в состоянии совершенствования старых методов и разработки новых. К настоящему времени широко экспериментируется или уже регламентируется в инструкциях некоторых стран ряд новых методов.
Поиски более совершенных методов обусловливаются необходимостью полного выявления в неблагополучных стадах и отарах всех инфицированных животных, так как до настоящего времени, как правило, не удается серологическая дифференциация здоровых животных от больных.
Скрытое бруцеллоносительство, при котором не бывает антител в крови животных, сильно выраженное количественное и качественное колебание бруцеллезных антител в крови животных в период инфекционного процесса и после него, появление у животных поствакцинальных антител, возникающих после вакцинации вакциной из штамма № 19 или другими агглютиногенными или слабоагглютиногенными вакцинами, а также влияние на образование антител возраста, физиологического состояния животных и другие факторы вызывают необходимость в повторном применении на практике методов прямой и дифференциальной диагностики бруцеллезных антител.
Существенное значение для совершенствования серологической диагностики вообще и серологической диагностики бруцеллеза в частности имеет разрабатываемая в последнее десятилетие иммунологическая классификация сывороточных глобулинов — носителей антител. По этой классификации иммунные глобулины человека делятся на 5 классов, различающихся в зависимости от их химической структуры. Обозначение этих классов следующее: IgG, IgM, IgA, IgD и IgE (Ig — это сокращенное название иммуноглобулина). Указанные классы иммуноглобулинов могут также обозначаться G, М, А, D и Е. Иммунные белки, различающиеся по константам седиментации Свеберга, получаемые на ультрацентрифуге в искусственном гравитационном поле, имеют разную степень иммунной активности. По современной классификации гамма-глобулины, обозначаемые 7S, преимущественно входят в класс IgG, кроме того, в класс IgA и IgD. Иммунные белки, обозначаемые 19S, входят в класс IgM, а иммуноглобулин 9S—в класс IgE.
Иммуноглобулины домашних животных, по данным Герберта (1974), изучены недостаточно по сравнению с иммуноглобулинами человека. Некоторые иммуноглобулины у животных, как и у человека, представлены различными классами, имеющими одинаковое название с человеческими, например IgG, IgM. Эти иммуноглобулины характерны для сельскохозяйственных животных и птиц.
Сравнение других иммуноглобулинов животных с иммуноглобулинами человека является весьма приблизительным, так как идентификация их проводится по признаку электрофоретической подвижности, а однозначное название иммуноглобулинов может быть тогда, когда они сравнимы еще и по другим признакам, например по константе седиментации, содержанию углеводов, месту синтеза, характеру реакции как антитела и др. Иммуноглобулины, имеющие наименьшую подвижность в электрическом поле, обозначаются у2а, в некоторых случаях они подразделяются на у2 а , у2 b , 72 c , где буква а соответствует компоненту с меньшей подвижностью, чем компонент, обозначенный буквой в и т. д. Глобулины с большей подвижностью, чем у2, обозначаются yI. Их также подразделяют на подгруппы. Наиболее подвижными являются глобулины, обозначаемые 19S; их относят к макроглобулинам и обозначают буквой М.
До настоящего времени подробно изучались указанные первые 2 класса иммуноглобулинов, имеющих довольно подробную характеристику. Иммуноглобулин G, по общему признанию, является наиболее активным антителом. Так, по данным Бойда (1969), гаммаглобулины, обозначаемые 7S, проявляют до 85—90% всей активности антител. Иммуноглобулины класса IgG имеют относительно небольшого размера молекулы (микроглобулины) и по 2 активных центра, способных присоединяться к детерминантному участку антигена. Эти антитела обнаруживаются не только в крови, но и в тканевых жидкостях, так как проходят через стенки сосудов. IgG вместе с тем возникают несколько медленнее по сравнению с IgM, но более длительно удерживаются в организме. Есть предположение (Бойд, 1969), что IgG ингибируют биосинтез IgM-антител. Так, например, если в первые дни (7 дней) возникают IgM-антитела, то к 25-му дню количество их постепенно уменьшается вплоть до полного исчезновения и нарастает количество IgG-антител. Важно отметить, что по современному представлению иммуноглобулины класса IgG (7S гаммаглобулин) синтезируются одним из двух типов плазматических клеток, принимающих участие в образовании антител, а другой тип тех же клеток синтезирует иммуноглобулины класса IgM (19S гаммаглобулин). Поэтому антитела обоих классов можно обнаружить в различных тканях иммунных животных.
IgG-антитела участвуют во всех серологических реакциях, которые основаны на соединении антигена с антителом. Однако требуется сравнительно большее количество тысяч молекул IgG-антител, чтобы осуществился феномен реакции агглютинации или реакции связывания комплемента, тогда как IgM-антител для тех же самых показателей требуются единицы молекул. Считается, что IgM-антитела более активны при их анализе в серологических реакциях с микробными антигенами, а IgG-антитела слабее проявляются с микробными антигенами, но более интенсивно с токсинами и другими подобными антигенами.
IgG-антитела имеют 75% тяжелых (относительная молекулярная масса 500 тыс.) аминокислотных цепей и 25% легких (относительная молекулярная масса 200 тыс.) цепей, соединенных между собой в молекулу днсульфиднымн связями. Эти цепи не разрываются при воздействии на них 2-меркаптоэтанолом. Иммунологическая активность этих антител в основном происходит за счет тяжелых цепей, следовательно, в особенности последних могут варьировать показания серологических реакции в зависимости от антигена и методики опыта. Каждый класс иммуноглобулинов имеет различающиеся тяжелые цепи. Например, показана большая разница между тяжелыми цепями иммуноглобулинов классов IgG и IgM.
IgM-антитела представляют собой крупные (относительная молекулярная масса 900 тыс.) молекулы и имеют значительно больше (до 10) активных центров взаимодействия с антигеном. Локализуются они преимущественно внутри сосудов крови. Эти антитела не проходят через плаценту. Поэтому в плодах животных могут быть обнаружены только IgG-антитела.
Практическое значение имеет свойство химического вещества 2-меркаптоэтаиола инактивировать IgM-антитела за счет разрыва дисульфитных связей, соединяющих части молекул. При аналогичной обработке IgG-антител их молекулы не изменяются. На этой основе считают возможным дифференцировать при помощи серологических реакций острую бруцеллезную инфекцию от хронической.
IgM-антитела стимулируются в организме животных только под влиянием грамнегативных бактерий.
По данным Герберта (1974), у крупного рогатого скота обнаруживаются в сыворотке крови 3 класса иммуноглобулинов — IgG, IgM, IgA. Иммуноглобулины класса IgG представлены и двумя подклассами — 1 gG1 и IgG2, различающимися по электрофоретической подвижности. Иммуноглобулины второго подкласса более подвижны, чем первого. Тяжелые цени обоих подклассов иммуноглобулинов класса IgG одинаковы. В молозиве обнаруживаются только иммуноглобулины подкласса IgG1 которые участвуют в реакции связывания комплемента, тогда как иммуноглобулины подкласса IgG2 в РСК не участвуют. У других животных (лошадей, овец и коз, свиней, а также собак, кошек и птиц) обнаружены иммуноглобулины разных классов и подклассов. Однако для серологии имеют реальное значение в основном иммуноглобулины с константой седиментации 7S (IgG) и 19S (IgM).
Рекомендации Комитета экспертов по бруцеллезу ФАО/ВОЗ (1971 г.) ограничиваются только двумя вышеуказанными классами иммуноглобулинов для исследований и обозначения в ветеринарной практике. Вместе с тем экспертами отмечено, что у телок после вакцинации их вакциной из штамма № 19 IgM-антитела появляются примерно на 5-й день после иммунизации и достигают максимального значения через 13 дней, в то время как IgG-антитела появляются одновременно с первыми или несколько позднее и достигают максимального значения на 28—42-й день после вакцинации. Напряжение IgM-антител уменьшается, но не всегда исчезает из сыворотки крови вакцинированных животных. Вместе с тем IgG-антитела исчезают из организма скорее, чем IgM-антитела.
После естественного инфицирования в организме появляются IgM — и IgG-антитела, но они резко различаются после вакцинации. Так, например, при бруцеллезе человека IgM-антитела являются основными агглютинирующими антителами, а IgG-антитела — фиксирующими комплемент, но часто не вызывают агглютинации корпускулярного антигена. В крови же крупного рогатого скота и IgM — и IgG — антитела вызывают агглютинацию, т. е. оба антитела агглютинируют корпускулярный антиген РА и способны фиксировать комплемент, т. е. соединяться с экстрактантигеном бруцелл. В крови свиней после их иммунизации вакциной из штамма № 19 IgM-антитела не фиксировали комплемент.
Отмечено, что на показания реакции связывания комплемента влияли следующие факторы: температура фиксации антигена (на холоде или при 37° С), структура антигена, виды сыворотки и класс антигена. Следовательно, при постановке РДСК на холоде можно получить лучшие результаты с одним и тем же классом иммуноглобулинов, чем при связывании комплемента при 37° С (см. РДСК при инфекционном заболевании, вызываемым Br. ovis, и при бруцеллезе).
Имеются сообщения о том, что неполные антитела у животных, вначале вакцинированных вакциной из штамма № 19 или 45/20, а затем инфицированных, обнаруживались дольше, чем агглютинирующие и фиксирующие комплемент антитела. Однако о наличии связи между инфекцией и неполными антителами не сообщается.
У собак, естественно инфицированных Br. canis, в сыворотке крови вначале появлялись IgM-антитела, а затем, через 7—13 дней, появлялись 4 подгруппы IgGS-антител и первые три IgGS-антител агглютинировали корпускулярный антиген.
В борьбе с бруцеллезом сельскохозяйственных животных имеет большое значение ранняя диагностика заболевания. Чем быстрее будут выявлены больные животные, тем раньше можно принять меры по ликвидации заболевания. Серологические реакции отвечают этому требованию более удовлетворительно по сравнению с методами аллергической, биологической и бактериологической диагностики. Диагноз на бруцеллез по реакции агглютинации и реакции связывания комплемента и другим реакциям, основанным на выявлении антител в крови, может быть установлен в близкие и отдаленные сроки после заражения животного бруцеллезом. После внедрения в организм заражающей дозы возбудителя через разные сроки у животных появляются в крови антитела. У крупного рогатого скота, овец, свиней антитела в крови появляются иногда на 5—8-й день после аборта, возникающего на почве генерализованного бруцеллеза. В других случаях в неблагополучном стаде молодняк заражается бруцеллезом в молочном периоде, а антитела в крови появляются через несколько месяцев или уже в период беременности (скрытое бруцеллоносительство). После наступившей бактериемии в крови животных могут быть обнаружены антитела методом РА раньше на 1-2 сут. чем по РСК. При параллельной постановке РА и РДСК эта разница не обнаруживается. Обычно такие случаи бывают на 5—8-е сут после наступившей бактериемии. Следовательно, ранний серологически и диагноз открывает для исследователя только тех зараженных животных, у которых инфекция уже приобретает активную форму. Животные, у которых инфекция находится в состоянии первичной латенции, не обнаруживаются серологическими методами, так как в крови таких животных еще не образовались бруцеллезные антитела. Поэтому важно, чтобы метод диагностики наиболее полно охватывал различные состояния инфекционного процесса, на этапах которого антитела могут быть разными. Например, в период начального развития инфекции обнаруживаются главным образом IgM-антитела, а в последующем — преимущественно IgG-антитела.
Бруцеллез протекает своеобразно почти у каждого в отдельности взятого животного, в зависимости от возраста, пола, беременности, физиологического состояния, вирулентности возбудителя, суперинфицирования и др. Поэтому в одном и том же неблагополучном стаде при возникновении инфекции наблюдаются индивидуумы, резко отличающиеся по времени и напряжению продукции антител. Кроме того, показания одной и тон же реакции выражение колеблются в зависимости от давности течения болезни и степени ее патологического проявления. Так, свежеинфицированные животные реагируют по РА в большем проценте, чем длительно болеющие; истощенные животные могут не реагировать либо реагировать очень слабо по всем реакциям.
Очень большое значение для своевременного распознавания болезнен имеет применяемый метод диагностики. Так, например, бараны, зараженные Br. ovis, в очень большом проценте реагируют по РДСК с экстракт-антигеном Br. ovis (до 95), но по РА они реагируют с корпускулярным антигеном Br. ovis слабо и в очень небольшом проценте (10—15), Эта разница объясняется тем, что клетки Br. ovis не имеют поверхностного бруцеллезного липополисахаридного S-антигена, следовательно, больные животные не имеют IgM-антител. Это положение в известной степени касается и бруцеллезной инфекции, поскольку поверхностно-оболочечный S-антиген сильно подвижен и резко снижается в клетках при диссоциации, происходящей в организме животных после начала бактериемии. Подвижность S-антигена немедленно отражается на степени эффективности отдельных реакций. Так, при параллельном исследовании по РА, РСК, РФ (реакции флокуляции) и КР (кольцевой реакции) сывороток крови крупного рогатого скота мы наблюдали несоответствие показаний от 0,5 до 8%. При этом меньше несовпадающих показаний отдельных реакций было с сыворотками свежеинфицировапных животных. Поэтому является общепризнанным, что при постановке двух, трех, четырех или большего количества реакций выявляется больных животных больше, чем при одной какой-либо реакции.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Предлагаемое изобретение относится к области ветеринарной биотехнологии, в частности к разработке способов диагностики бруцеллеза животных, и может быть использовано в ветеринарии.
Высокой чувствительностью и специфичностью при выявлении антител к возбудителям бруцеллеза обладают способы на основе принципа иммуноферментного анализа (ИФА).
Известен способ получения бруцеллезного антигена, используемый для диагностики бруцеллеза, который включает культивирование бруцелл, отмывание микробных клеток, обработку их фенолом [Григорьева Г.И., Игнатов П.Е., Федоров А.И. Способ получения антигенов из бактерий рода Brucella. А.с. №1631786. СССР. 1988.].
Однако антиген, полученный известным способом, используется только для постановки реакции агглютинации, с помощью которой обнаруживают специфические антитела в сыворотке больных бруцеллезом животных и людей.
Известен способ получения бруцеллезного антигена, включающий выращивание бруцелл, отмывку микробных клеток, обработку их ацетоном, эфиром, высушивание в вакуум-эксикаторе, экстракцию трихлоруксусной кислотой (ТХУ), высушивание, обработку щелочью, осаждение ацетоном, высушивание. Антиген, полученный данным способом, используют для выявления гемагглютининов в сыворотках больных бруцеллезом людей и животных [Григорьева Г.И., Игнатов П.Е., Федоров А.И. Способ получения антигенов из бактерий рода Brucella. А.с. №1631786. СССР. 1988].
Однако бруцеллезный антиген, полученный по данному способу, имеет недостатки при его получении: низкий выход антигена; сложная технология; использование большого количества токсических и взрывоопасных веществ (ацетона, эфира); время обработки биомассы составляет несколько суток.
Известен способ диагностики бруцеллеза методом непрямого иммуноферментного анализа характеризующийся высокой специфичностью и чувствительностью. Способ заключается в последовательной инкубации в лунках планшета компонентов тест-системы и анализируемого материала по следующей схеме: сенсибилизацию лунок планшетов для микротитрования очищенным ЛПС бруцеллезным антигеном; внесение и инкубацию контрольных и анализируемых образцов; внесение и инкубацию видоспецифических антител, меченных ферментом. После каждой стадии проведения анализа проводят отмывание лунок планшетов от несвязавшихся реагентов. т.е. происходит внесение субстрата ферментативной реакции. [Ж. J.Virol.Meth. - 1983 - v.6. - 19-29].
Учет результатов реакции проводят по величине оптической плотности анализируемых образцов.
При проведении сравнительных исследований 1000 сывороток крови крупного рогатого скота методами РДП и ИФА было выявлено: РДП+/ ИФА+540; РДП-/ИФА- 431; ИФА+/РДП- 29; ИФА-/РДП+0 (Ж. J.Virol. Meth. - 1983 - v.6. - 19-29).
Однако существуют ограничения, не позволяющие проведение достоверной диагностики, так возбудители, вызывающие заболевание, присутствуют в природе в S и R формах, которые отличаются между собой по строению и как следствие этого обладают разным антигенным составом. Это обстоятельство затрудняет диагностику, так как большинство существующих тест-систем способны выявлять антитела, образовавшиеся только при иммунном ответе на S формы возбудителя. Кроме того, для профилактики бруцеллеза в неблагополучных и угрожаемых районах широко применяется вакцинация. Вырабатываемые в организме поствакцинальные антитела, очень трудно дифференцировать от антител, вырабатываемых организмом в ответ на внедрение патогенного штамма возбудителя, что значительно усложняет работу по проведению оздоровительных мероприятий.
Задачей изобретения является разработка повышение чувствительности способа диагностики бруцеллеза животных, расширение его функциональных возможностей, т.е. возможность применения способа с целью выявлять и дифференцировать антитела к S и R формам бруцелл в сыворотках крови или молоке любых восприимчивых животных и человека.
На поверхности твердофазного носителя иммобилизуют S-ЛПС и R-ЛПС бруцеллезный антиген в 2 этапа, первый из которых - неспецифическая адсорбция моноклональных антител мыши к S-ЛПС и R-ЛПС бруцеллезным антигенам и второй - специфическое иммунологическое связывание S-ЛПС и R-ЛПС антигенов с моноклональными антителами мыши к этим антигенам. Далее вносят и инкубируют испытуемый материал вместе с ферментно мечеными моноклональными антителами. После проведения этапа инкубации отмывают несвязавшиеся реагенты. Добавляют субстрат ферментативной реакции для выявления связавшихся антител и определяют наличие антител по величине оптической плотности испытуемых образцов по сравнению с контролем.
Для осуществления способа используют тест-систему, в которую входят: сенсибилизированный S-ЛПС и R-ЛПС бруцеллезным антигеном планшет для микротитрования; меченные пероксидазой моноклональные антитела против S-ЛПС и R-ЛПС; контрольные положительные и отрицательные образцы сыворотки крови и молока.
Кроме того, используют субстратную смесь перекиси водорода и хромогена (донор протонов), разбавители компонентов реакции и раствор для промывки планшетов.
Получение компонентов тест-системы.
Для изготовления сенсибилизированного бруцеллезными антигенами твердофазного носителя используют моноклональные антитела 2Н2 и 2Н8 против S и R ЛПС бруцеллезных антигенов.
Моноклональные антитела к S-ЛПС бруцеллезному антигену продуцируют клетки штамма гибридомной линии клеток 2Н2.
Клетки штамма в дозе 2-10×10 6 клеток/мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получают асцитическую жидкость, титр специфических моноклональных антител к S-ЛПС антигену в которой составил в ИФА 1:640-1:5120. Препарат моноклональных антител получают из асцитической жидкости трехкратным осаждением раствором сульфата аммония 50% насыщения с последующим диализом против фосфатно-солевого буферного раствора, рН 7,2-7,4 и определяют концентрацию белка и активность антител.
Моноклональные антитела к R-ЛПС бруцеллезному антигену продуцируют клетки штамма гибридомной линии клеток 2Н8.
Клетки штамма в дозе 2-10×10 6 клеток/мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получают асцитическую жидкость, титр специфических моноклональных антител к R-ЛПС антигену в которой составил в ИФА 1:640-1:5120. Препарат моноклональных антител получают из асцитической жидкости трехкратным осаждением раствором сульфата аммония 50% насыщения с последующим диализом против фосфатно-солевого буферного раствора, рН 7,2-7,4 и определяют концентрацию белка и активность антител.
Бруцеллы вакцинного штамма В. abortus 19 выращивают в течение 48 ч, смывают микробные клетки нейтральным физиологическим раствором (НФР), центрифугируют, промывают трехкратно осадок с помощью НФР при центрифугировании, ресуспендируют осадок до получения суспензии, содержащей 200 млрд. м. кл. в 1 мл, добавляют равный объем 0.5% раствора фенола и автоклавируют в режиме 1 атмосфера 121°С в течении часа. Используют для изготовления сенсибилизированного антигеном твердофазного носителя.
Бруцеллы вакцинного штамма В. abortus 17/100 выращивают в течение 48 ч, смывают микробные клетки нейтральным физиологическим раствором (НФР), центрифугируют, промывают трехкратно осадок с помощью НФР при центрифугировании, ресуспендируют осадок до получения суспензии, содержащей 200 млрд. м. кл. в 1 мл, добавляют равный объем 0.5% раствора фенола и автоклавируют в режиме 1 атмосфера 121°С в течение часа. Используют для изготовления сенсибилизированного антигеном твердофазного носителя.
Контроль специфичности и активности антигена осуществляют в реакции диффузионной преципитации (РДП) после концентрирования в 10-100 раз. Антиген должен образовывать полосу преципитации с контрольной стандартной антисывороткой, идентичную полосе преципитации, образованной контрольным стандартным антигеном и контрольной стандартной антисывороткой. Активность S и R ЛПС бруцеллезных антигенов должна быть не ниже, чем 1:16-1:64.
Изготовление сенсибилизированного S и R-ЛПС бруцеллезными антигенами твердофазного носителя проводят в 2 этапа.
1 этап. Препараты моноклональных антител 2Н2 и 2Н8 к S и R-ЛПС бруцеллезным антигенам разбавляют фосфатно-солевым буферным раствором рН 7,2-7,4 до концентрации белка 5 мкг/мл и вносят порядно в 96-луночные планшеты для микротитрования по 100 мкл в каждую лунку. В нечетные ряды вносят антитела 2Н2, в четные ряды антитела 2Н8. Инкубируют в течение 16 часов при 2-8°С, отмывают от несвязавшихся антител промывочным раствором.
2 этап. В лунки панели вносят по 100 мкл S и R-ЛПС бруцеллезных антигенов. В нечетные ряды вносят S-ЛПС бруцеллезный антиген, в четные ряды вносят R-ЛПС бруцеллезный антиген. Инкубируют в течение 3 часов при температуре 37°С, отмывают от несвязавшихся антител промывочным раствором. Подсушивают планшет на воздухе при комнатной температуре (18-22°С) в течение 16 час. Упаковывают герметически в ламинированную фольгу или полиэтилен, удаляя излишки воздуха.
Изготовление контрольных сывороток.
Контрольными положительными сыворотками служат сыворотки крови кролика иммунизированных нативными бруцеллами из штаммов В. abortus 19 (S положительная сыворотка) и В. abortus KB 17/100 (R положительная сыворотка). Контрольные положительные сыворотки оттитрованы. Контрольными отрицательными сыворотками крови служат сборные сыворотки крови полученные не менее, чем от 10 коров отрицательно реагирующих в РА и РИД с бруцеллезным антигеном из благополучного по бруцеллезу району.
Положительное контрольное молоко получают добавлением положительных кроличьих сывороток в молоко не менее, чем от 10 коров отрицательно реагирующих в РА и РИД с бруцеллезным антигеном из благополучного по бруцеллезу району.
Изготовление меченных пероксидазой моноклональных антител (конъюгатов) против S и R-ЛПС бруцеллезных антигенов проводят с использованием штаммов гибридомных линий клеток 2Н2 и 2Н8. Клетки штаммов линии 2Н2 и 2Н8 в дозе 2-10×10 6 клеток на мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получали асцитическую жидкость с активностью моноклональных антител в ИФА 1:640-1:5120, из которой затем выделяют антитела трехкратным осаждением раствором сульфата аммония 50% от насыщения с последующим диализом против 0,01 М натрий-карбонатного буфера, рН 9,5. Содержание антител в препарате (по белку) составило 10-12 мг/мл. Связывание антител с пероксидазой из корней хрена проводят методом, разработанным Wilson, Nakane, после активации фермента перйодатом натрия (4). Полученный конъюгат титровали методом иммуноферментного анализа. Активность полученного конъюгата в иммуноферментном анализе для выявления S и R-ЛПС антигенов адсорбированных в лунках планшета 1:5000-1:30000.
Проведение иммуноферментного анализа для выявления антител к S и R-ЛПС бруцеллезным антигенам состоит в следующем.
В планшеты для микротитрования, сенсибилизированные ЛПС бруцеллезным антигеном, вносят по 0,1 мл конъюгатов анти-S-ЛПС и анти-R-ЛПС. Анти-S-ЛПС конъюгат вносят в нечетные ряды, анти-R-ЛПС конъюгат в четные ряды планшета, затем в лунки вносят по 0,01 мл контрольных и исследуемых образцов сыворотки крови, содержимое лунок тщательно перемешивают, планшет накрывают крышкой и инкубируют при 37°С в течение 1 часа. Затем содержимое лунок удаляют и четырежды промывают промывочным раствором. Далее вносят в каждую лунку по 0,1 мл субстратной смеси, содержащей хромоген и перекись водорода и оставляют при температуре 18-22°С на 5-10 мин в защищенном от прямых солнечных лучей месте. Измеряют оптическую плотность раствора в лунках. Тест считают достоверным, если:
- значение оптической плотности положительного контроля не превышает 0,3;
- отношение между величинами оптической плотности положительного и отрицательного контроля N/Р не менее 1,5.
Реакцию считают положительной, если оптическая плотность раствора в лунке испытуемой равно или меньше оптической плотности раствора в лунке отрицательного контроля.
Осуществление способа диагностики отражено в конкретных примерах.
Пример 1. Изготовление тест-системы и оценка достоверности теста для определения антител к бруцеллезным антигенам в сыворотках крови. Изготовление тест-системы и проведение анализа с контрольными сыворотками, как описано выше. Установку нуля фотометра осуществляют против пустого планшета той же серии, которая была использована для изготовления тест-системы.
Результаты проведения измерений приведены в таблице 1. Полученные в результате измерений значения оптической плотности составляют: для холостой пробы - менее 0,05 (0,02-0,04); для отрицательной контрольной сыворотки 1,750-2,200; для положительной контрольной сыворотки 0,3.
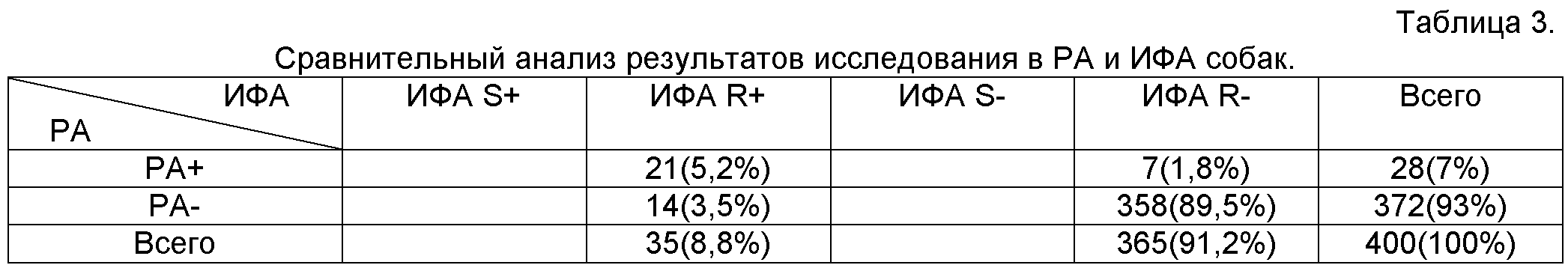
Пример 2. Сравнение чувствительности и специфичности серологических способов диагностики бруцеллеза - РА и ИФА. Тест-систему для выявления инфицированного крупного рогатого скота методом конкурентного иммуноферментного анализа готовили, как описано выше, с использованием S и R-ЛПС бруцеллезного антигена на основе штаммов В.abortus шт.19 (S-форма) и КВ-17/100(К-форма). Проводили параллельное исследование 347 сывороток крови крупного рогатого скота из неблагополучного по бруцеллезу хозяйства №1 (закрытого типа) в данной тест-системе и реакции диффузионной преципитации. Результаты исследования приведены в таблице 2. Совпадение результатов (РА+/ИФА+и РА-/ИФА-) отмечено в 87,5% случаев, несовпадение (РА+/ИФА- и РА-/ИФА+) - в 14,5% случаев. В ИФА было выявлено 40 (13% от числа исследованных) положительных проб, отрицательных в РА. Пять проб (1,5% от числа исследованных), положительных в РА, дали отрицательный результат в ИФА. Все положительные в ИФА сыворотки реагировали с S-бруцеллезным антигеном, так как возбудитель бруцеллеза крупного рогатого скота присутствует в природе в S-форме. Как видно из таблицы, предложенный способ является более чувствительным, по сравнению с РА. Пример 3. Чувствительность и специфичность иммуноферментного анализа с использованием моноклональных антител для исследования сывороток крови собак. Тест-систему для выявления бруцеллоносителей методом конкурентного иммуноферментного анализа готовили, как описано выше. В качестве антигена использовали препараты, на основе штаммов B.abortus шт.19 (S-форма) и КВ-17/100(R-форма). Проводили параллельное исследование 400 сывороток крови собак, доставленных из ветеринарных клиник. Совпадение результатов (РА+/ИФА+; РА-/ИФА-) отмечали в 365 или 91,2%, несовпадение (РА+/ИФА-; РА-/ИФА+) - в 5,3% случаев. Семь положительных по результатам РА пробы прореагировали отрицательно в ИФА (1,8%). В ИФА было выявлено 21 (5,2%) положительная проба, тогда как в РА- 14 (3,5%). Все положительные в ИФА сыворотки реагировали с R-бруцеллезным антигеном, так как возбудитель бруцеллеза собак присутствует в природе в R-форме. Из таблицы 3 видно, что по чувствительности метод иммуноферментного анализа превосходил РА и не уступал ей по специфичности. Эти результаты свидетельствуют о том, что по чувствительности предложенный способ значительно превосходит РА и приближается к прямому диагностическому тесту - полимеразной цепной реакции (ПЦР). Приведенные примеры свидетельствуют о высокой специфичности и чувствительности предложенного способа диагностики бруцеллеза путем выявления носителей возбудителя болезни методом конкурентного иммуно-ферментного анализа, независимо от способа получения антигена. Предложенный способ диагностики бруцеллеза, методом конкурентного иммуноферментного анализа, характеризуется следующими полезными свойствами: обладает высокими чувствительностью и специфичностью вследствие использования при изготовлении тест-системы двух моноклональных антител к повторяющимся антигенным эпитопам; возможность исследования в одной тест-системе различных видов животных; дифференциация циркулирующей в организме формы (S или R) возбудителя заболевания; является методом экспресс-диагностики, позволяющим получить результаты анализа в течение 1,5 часов; включает объективную оценку результатов и поддается автоматизации; позволяет использовать в качестве материала для исследования не только сыворотку крови, но и молоко, что выгодно экономически и снижает риск распространения инфекции при взятии крови. Способ диагностики бруцеллеза с одновременной дифференциацией возбудителя методом иммуноферментного анализа найдет применение в ветеринарии, что: позволит повысить эффективность оздоровительных мероприятий, сократить сроки оздоровления неблагополучных по бруцеллезу животноводческих хозяйств, выявлять инфицированных собак, находящихся в непосредственном контакте с людьми и в итоге - снизить заболеваемость человека бруцеллезом. Способ дифференциальной диагностики бруцеллеза, предусматривающий использование антигенов S- и R-форм для выявления антител в испытуемом материале с последующим определением наличия антител, отличающийся тем, что на поверхность твердофазного носителя иммобилизуют S-ЛПС и R-ЛПС бруцеллезные антигены в два этапа, где первый этап предусматривает неспецифическую адсорбцию моноклональных антител мыши к S-ЛПС и R-ЛПС бруцеллезным антигенам, и второй - специфическое иммунологическое связывание S-ЛПС и R-ЛПС антигенов с моноклональными антителами мыши к этим антигенам, далее вносят и инкубируют испытуемый материал вместе с меченными ферментом моноклональными антителами, после инкубации отмывают несвязавшиеся реагенты, добавляют субстрат ферментативной реакции для выявления связавшихся антител и определяют наличие антител к бруцеллезным антигенам по величине оптической плотности испытуемых образцов по сравнению с контролем. Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|