Анафилактический шок на фоне септических состояний
Причиной смерти фэшн-директора ЦУМа, вице-президента Mercury Аллы Вербер стал инфаркт, сообщает принадлежащий Григорию Березкину РБК со ссылкой на ее друга Олега Шарана.
Анафилактический шок развился после того, как Вербер попробовала блюдо с морепродуктами на итальянском курорте Форте-Деи-Марми. Возможно, именно они и привели к такой реакции организма.
Анафилаксия - это быстрое, резкое повышение чувствительности организма при контакте с аллергеном. У человека при анафилактическом шоке резко падает артериальное давление, и он может потерять сознание. Также возникают выраженные отеки, в том числе - органов дыхания, что представляет опасность для жизни. Хотя риск погибнуть от анафилактического шока в 10 раз меньше, чем оказаться убитым, для ослабленного организма резкая аллергическая реакция может стать фатальной. Вербер же, по словам знакомых, на ногах перенесла два воспаления легких.
В случае острой реакции необходимо ввести препараты, блокирующие дальнейшее распространение аллергена по организму, при анафилактическом шоке — адреналин. Также необходимо применение антигистаминных препаратов и глюкокортикостероидов. После первой помощи проводится симптоматическая терапия.
Сепсис развивается, когда реакция организма на инфекцию приводит к повреждению его собственных тканей и органов.
Он поражает сразу весь организм и способен развиться буквально за сутки. Самостоятельное выздоровление при сепсисе практически невозможно. Без использования антибиотиков и ряда других препаратов сепсис приводит к поражению всех органов - развиваются абсцессы легких и мозга, гнойный менингит, цистит, сердечная недостаточность. Возможно развитие септического шока — острого состояния, при котором ухудшается кровоснабжение, что негативно сказывается на доставку кислорода и других веществ к тканям. Смертность при септическом шоке достигает 50%.
Среди тревожных симптомов - изменение температуры тела, озноб, изменение психического состояния, затрудненное дыхание, учащенное сердцебиение, ослабление пульса, низкое кровяное давление, синюшность или мраморность кожи, похолодание конечностей, сильные боли или дискомфорт в теле.
Сепсис может развиться у любого человека с инфекцией, однако повышенному риску подвергаются уязвимые группы населения — пожилые люди, беременные женщины, новорожденные, пациенты в стационарах, люди с иммунодефицитом, раком, болезнями печени и почек, аутоиммунными заболеваниями и удаленной селезенкой.
Для профилактики сепсиса необходимо вовремя лечить местные гнойные процессы, дезинфицировать любые раны и повреждения. Также необходимо соблюдать гигиену рук и правила приготовления пищи.
Инфаркт - это некроз органа из-за острого недостатка кровоснабжения. Инфаркт миокарда развивается при закупорке просвета коронарной артерии. Чаще всего причиной становятся тромб или холестериновая бляшка, но инфаркт может развиться и при спазме артерии или эмболии.
Сердечно-сосудистые заболевания остаются основной причиной смерти во всем мире — по оценкам ВОЗ, в 2016 году от них умерли 17,9 млн человек, что составило 31% всех случаев смерти в мире. 85% этих смертей произошли в результате сердечного приступа и инсульта.
В России сердечно-сосудистые заболевания тоже остаются ведущей причиной смертности населения на протяжении многих десятилетий. По данным 2014 года, половина всех смертей (у мужчин — 44,9%, женщин — 55,4%) в стране произошла по причине сердечно-сосудистых заболеваний, причем более 80% из них были связаны с ишемической болезнью сердца и инсультами.
Основные факторы риска сердечно-сосудистых заболеваний — неправильное питание, недостаточная физическая активность, употребление табака и избыточное употребление алкоголя.
Здоровый образ жизни помогает значительно снизить риски.
Инфаркт проявляется дискомфортом или болью в груди, отдающей в руку, живот, лопатку. В 20-40% случаев наблюдаются признаки сердечной недостаточности. Кроме того, человек может испытывать затруднения в дыхании или нехватку воздуха; тошноту или рвоту; чувствовать головокружение или терять сознание; покрываться холодным потом, бледнеть. Основная задача врачей - восстановить кровоток.
Хотя инфаркт далеко не всегда бывает смертелен, после него в миокарде развиваются необратимые ишемические изменения, что может привести к осложнениям различной степени тяжести.
Ю.Л. Кецко, И.Г. Труханова, О.Л. Гелашвили, А.Д. Гуреев
ГБОУ ВПО СамГМУ МЗ России, Клиники СамГМУ
J.L. Kezko, I.G. Tryhanova, O.L. Gelashvili, A.D. Gureev
Ключевые слова: догоспитальный период, септический шок, клинико-лабораторные критерии, стандарты лечения сепсиса
Актуальность.
В России сепсис диагностируется при абдоминальной патологии в 18,3 - 56,7% случаев, при гнойно-воспалительных заболеваниях мягких тканей у взрослых и детей в 62,5 - 77,6% случаев, при этом доля тяжёлого сепсиса составляет от 2 до 18% [1]. Из всех больных с сепсисом септический шок (СШ) диагностируется в 58% от всех больных с тяжёлым сепсисом. На данную категорию больных приходится около 7% от всех
госпитализированных в отделения реанимации и интенсивной терапии (ОРИТ) [2]. Статистических данных по диагностике септического шока в условиях скорой медицинской помощи (СМП) нет.
Целью работы является анализ возможностей диагностики и соблюдения стандартов лечения СШ на догоспитальном этапе.
В современных национальных руководствах по СМП описаны клинические особенности и неотложные мероприятия при СШ (инфекционно-токсическом шоке) [3, 4, 5, 6]. В качестве клинических диагностических критериев СШ на догоспитальном этапе выступают [3, 4, 5]:
- систолическое артериальное давление ниже 90 мм рт.ст.;
- уровень нарушения сознания;
- величина диуреза, наличие олигурии;
- число дыхательных движений больше 20 в 1 мин;
- частота сердечных сокращений больше 90 в 1 мин;
- значение шокового индекса;
- температура тела выше 38 o С или ниже 36 o С;
- наличие очага инфекции (не всегда).
Более индивидуализированный подход к клинической картине СШ предусматривает
гипердинамическую и гиподинамическую фазы его течения [3, 6]. Зависимые внешние клинические признаки определяются характером гемодинамических нарушений (Таблица 1):
Таблица 1. Клинические симптомы в связи с фазами СШ

Основными направлениями лечения СШ на догоспитальном этапе являются 5:
- обеспечение адекватной вентиляции;
- поддержание перфузионного давления, используя инфузионную терапию и вазопрессорную поддержку;
- гормонотерапия.
С целью оценки значимости клинических диагностических критериев септического шока, их влияние на лечебный алгоритм, представляем клинический пример:
При поступлении в приемный покой 8.07.13 г. в 21:50 предъявляет жалобы на выраженную слабость, головокружение. Состояние тяжелое, кожные покровы бледно - розовые, сознание – оглушение I, тоны сердца глухие, АД 70 и 40 мм рт.ст., пульс 100 в мин., ЧДД 16 в мин., температура 36,1 о С. Повязка на нижней поверхности голени сухая. Признаков воспаления в области раны нет.
В 22:15 больной доставлен в ОРИТ из приёмного покоя для динамического наблюдения, дообследования, лечения. При поступлении: кожные покровы бледно-розовые, румянец на лице, уровень сознания по шкале Глазго - 14 баллов, дыхание самостоятельное, везикулярное с обеих сторон, ЧДД 18 в мин., SpO2 97%. Гемодинамика нестабильная, АД 90 и 50 мм рт.ст., ЧСС 124 в мин на фоне продолжающейся инфузии (Sol. Adrenalini 0,1%, скорость 0,05 mcg/kg/min).
Левая нижняя конечность в сравнении с правой не изменена, паховые лимфоузлы также симметричны в размерах, безболезненны.
Проведены диагностические исследования:
- ЭКГ: синусовая тахикардия, признаки гипертрофии левого желудочка;
- Обзорная рентгенография легких: без признаков инфильтрации;
- Общий анализ крови, биохимические исследования;
- Осмотр хирурга: снята повязка, локальных признаков воспаления и экссудата нет.
Результаты полученных анализов 8.07.13 г., 23:30:
Общий анализ крови:
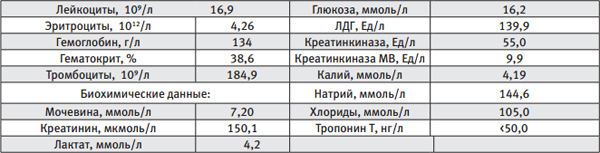
Данные КЩС: PaO2, мм рт.ст. – 86, pHa – 7,29; pCO2, мм рт.ст.– 28; BE, ммоль/л - 6,8.
Изменения лабораторных данных интерпретированы как недостаточная тканевая перфузия, прежде всего за счёт дефицита объема инфузионной терапии, субкомпенсированный метаболический ацидоз, умеренный рост креатинина, вторичная гипергликемия на фоне инфузии катехоламинов. Острое почечное повреждение (RIFLE II). Оценка по шкале SOFA - 5 баллов.
Лечебные манипуляции и назначения:
- Обеспечение центрального сосудистого доступа, ЦВД - отрицательное.
- Волемическая нагрузка: Sol. Sterofundini ISO 2500 ml.
В связи с выраженной тахикардией произведен перевод пациента на инфузию Sol. Noradrenalini 0,2% со скоростью 0,08 mcg/kg/min.
Состояние больного тяжелое, стабильное. На фоне адекватного дыхания в 23:40
состояние пациента ухудшилось: снизилось АД до 60 и 0 мм рт.ст., появился проливной холодный пот, слабость, неприятные болевые ощущения в верхних отделах живота.
На ЭКГ ишемические изменения в области нижней стенки левого желудочка. При ЭхоКГ выявлено нарушение локальной сократимости миокарда левого желудочка. Фракция изгнания по Симпсону 41%. Клапанной патологии не обнаружено. Не мочился. Живот мягкий, при пальпации безболезненный. С целью уточнения диагноза приглашены кардиолог и хирург. Заключение кардиолога: ИБС. ОКС без подъема ST от 8.07.13 г. Заключение хирурга: данных за острую хирургическую патологию нет.
К назначениям добавлено: Heparini 800 ED/h, Тромбо-АС 100 мг, коронал 5 мг, омез 20 мг.
9.07.13 г., 8:00 Состояние больного остаётся стабильно тяжёлым, в сознании (шкала ком Глазго 14 баллов) с признаками эмоциональной лабильности. Кожные покровы бледно - розовые, сухие, чистые, теплые. Температура тела 36,3 о С. Дыхание самостоятельное, ЧДД 18 в мин., SpO2 97% (FiO221%). Гемодинамика остаётся нестабильной: АД 105 и 58 мм рт.ст., ЧСС 86 - 114 в мин., ЦВД 5 мм рт.ст., на фоне продолжающейся вазопрессорной поддержки (Sol. Noradrenalini 0,2% со скоростью 0,14 mcg/kg/min). Диурез 20 мл/час, при суммарном объеме инфузии 4350 мл (Sol. Sterofundini ISO 3600 ml, Sol. Voluveni 750 ml).
Лабораторные данные на 6:00 09.07.13 г.:
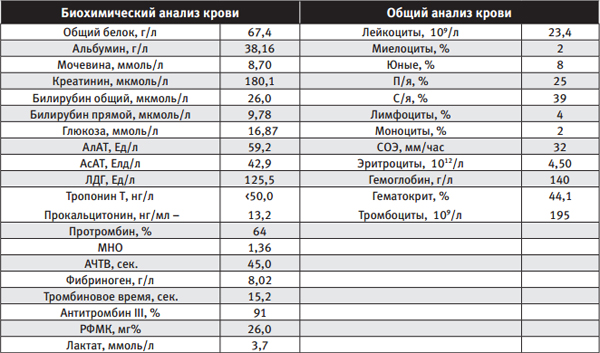
В связи с отрицательной динамикой клинико-лабораторных данных, характеризующих наличие у пациента невыявленного септического очага инфекции, а именно:
- Неэффективность инфузионной терапии с ростом дозы вазопрессорной поддержки;
- Появление признаков токсической энцефалопатии;
- Олигурия с ростом уровня креатинина;
- Рост лейкоцитоза со сдвигом влево в динамике;
- Высокий уровень прокальцитонина, фибриногена.
Произведена коррекция лечебно - диагностической программы:
- Вызов хирурга. На фоне отсутствия отчетливых визуальных признаков воспаления (незначительный безболезненный отёк вокруг раны) произведено снятие швов, ревизия и дренирование раны. Получено около 5 мл серого, мутного выпота. Влажно высыхающие повязки с гипохлоритом натрия.
- Назначение эмпирической антибактериальной терапии: Fortum 4000 mg/сутки, Metrogyli 1500 mg/сутки.
- УЗИ органов брюшной полости: признаки гепатоспленомегалии, хронического холецистита, хронического панкреатита, диффузных изменений паренхимы печени. Почки нормальных размеров и местоположения, эхогенность паренхимы не изменена, дифференцировка коркового и мозгового слоя сохранены.
С 12:30 значительное ухудшение состояния: признаки делирия, кожные покровы бледные, влажные, одышка до 40 в минуту, SpO2 93% (FiO230%), повышение вазопрессорной поддержки (Sol. Noradrenalini 0,2% со скоростью 0,18 mcg/kg/min) до поддержания АДср 68 мм рт.ст. Отмечен выраженный лимфангиит на голени и бедре. Под внутривенной анестезией произведено широкое вскрытие раны, в глубину до субфасциального пространства, дренирование.
С 23:00 - уменьшение дозы вазопрессорной поддержки. Полная стабилизация гемодинамики произошла 10.07.13 г. к 13:45.
12.07.13 г. состояние пациента средней тяжести, сознание ясное, гемодинамика стабильна АД 120 и 70 мм рт.ст., температура 36,5 о С, диурез за сутки 3450 мл. Для дальнейшего лечения 13.07.13 г. больной переведен в хирургическое отделение и 25.07.13 г. выписан с выздоровлением.
Развитие шока при сепсисе связано с тремя основными механизмами:
- снижением периферического сосудистого тонуса;
- ранней, прогрессирующей миокардиальной дисфункцией;
- потерей ОЦК вследствие повышенной сосудистой проницаемости, его секвестрации в микроциркуляторном русле.
Таблица 2. Сравнительные параллели клинических данных описанного примера и клинических критериев (Bone R.C. [20 - 22], SSC, 2012)
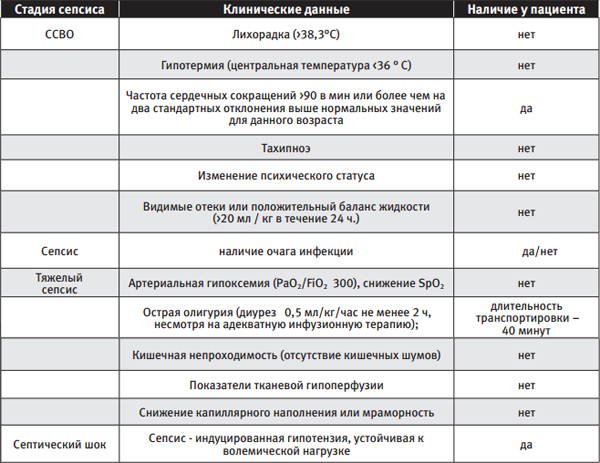
В выше описанном клиническом случае нет данных за анафилактический шок - по временной характеристике развития шока, отсутствия эффекта от вазопрессорной поддержки [7, 8]. Сложности догоспитальной диагностики СШ связаны с трудностями выяснения анамнеза, ограниченностью мониторинга при осмотре и в периоде транспортировки. При наличии более чем 170 различных биомаркеров сепсиса, в условиях СМП отсутствует возможность экспресс - лабораторного мониторинга, имеющего высокую клиническую значимость [23, 24].
Сепсис, являясь первостепенной медицинской проблемой и на сегодняшний день, продолжает оставаться одной из ведущих причин смертности, несмотря на различные открытия в патогенезе этого заболевания и применение новых принципов лечения. Тяжелым осложнением сепсиса является септический шок.
Септический шок — сложный патофизиологический процесс, возникающий в результате действия экстремального фактора, связанного с прорывом в кровоток возбудителей или их токсинов, что вызывает наряду с повреждением тканей и органов чрезмерное неадекватное напряжение неспецифических механизмов адаптации и сопровождается гипоксией, гипоперфузией тканей, глубокими расстройствами обмена.
Развитие внутрибольничного сепсиса и септического шока может быть обусловлено различными факторами. Вероятность инфицирования и риск развития септического шока несут с собой некоторые диагностические и лечебные процедуры, загрязнение внутривенных сред. Большой процент септических состояний связан с послеоперационными осложнениями. Повышенной вероятности развития сепсиса могут способствовать некоторые неотложные состояния, например панкреатит, жировая эмболия, геморрагический шок, ишемия и различные формы травм, сопровождающиеся повреждением тканей. Хронические заболевания, осложненные изменениями в иммунной системе, могут увеличить риск возникновения генерализованной инфекции. В этиологии септического шока чаще всего преобладает грамотрицательная инфекция (65—70 % случаев), но он может развиться и при сепсисе, вызванном грамположительными бактериями.
Достижения в области молекулярной биологии и иммунологии предоставили возможность понять многие патогенетические механизмы развития септического шока. В настоящее время доказано, что инфекция сама по себе не является непосредственной причиной многочисленных патологических сдвигов, характерных для сепсиса. Скорее всего они возникают как результат ответной реакции организма на инфекцию и некоторые другие факторы. Этот ответ обусловлен усилением действия различных эндогенных молекулярных веществ, которые запускают патогенез сепсиса. Если при нормальном состоянии подобные молекулярные реакции можно расценить как реакции приспособления или адаптации, то во время сепсиса их чрезмерная активация носит повреждающий характер. Известно, что некоторые из этих активных молекул могут высвобождаться непосредственно на эндотелиальной мембране органа-мишени, приводя к поражению эндотелия, и вызывать дисфункцию органа.
Некоторые известные медиаторы повреждения эндотелия, вовлекаемые в септические реакции:
туморнекротизирующий фактор (TNF);
интерлейкины (ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8);
фактор активации тромбоцитов (PAF);
лейкотриены (В4, С4, D4, Е4);
простагландины (Е2, Е12);
Наряду с вышеперечисленными медиаторами повреждения эндотелия в патогенез сепсиса и септического шока вовлекается много других эндогенных и экзогенных медиаторов, которые становятся слагаемыми воспалительного ответа.
Потенциальные медиаторы септического воспалительного ответа:
экзотоксин, части клеточной стенки грамотрицательной бактерии;
комплемент, продукты метаболизма арахидоновой кислоты;
полиморфно-ядерные лейкоциты, моноциты, макрофаги, тромбоциты;
гистамин, клеточные адгезивные молекулы;
каскад коагуляции, фибринолитическая система;
токсические метаболиты кислорода и другие свободные радикалы;
калликреин-кининовая система, катехоламины, стрессовые гормоны.
Нарушения гемодинамики и транспорта кислорода при септическом шоке занимают одно из центральных мест и отличаются большой сложностью. Некоторые исследователи утверждают, что одновременное и разнонаправленное действие этиологических и патогенетических факторов при септическом шоке приводит к нарушению распределения кровотока и органной перфузии даже на фоне нормального АД и высокого СВ. На первый план при шоке выступают именно нарушения микроциркуляции, а артериальная гипотензия является поздним симптомом септического шока.
Выделяют два основных синдрома расстройств кровообращения, которые характеризуют стадии развития септического шока, — гипердинамический и гиподинамический. Для ранней стадии септического шока, сопровождающейся циркуляторной гипердинамией, как правило, характерно снижение общего сосудистого сопротивления с рефлекторно обусловленным (с барорецепторов) увеличением СВ и работы сердца. Это, возможно, связано с прямым влиянием быстро накапливающейся бактериальной флоры и эндотоксинов на сердечно-сосудистую систему и клеточный метаболизм. Причинами снижения периферической сосудистой резистентности являются открытие низкорезистентных артериовенозных шунтов и непосредственный сброс крови через них. При этом значительно увеличиваются потребление кислорода и индекс его доставки, в то время как экстракция кислорода находится в пределах нормы. Дальнейшая манифестация септического шока также характеризуется значительными изменениями в симпатико-адреналовой, гипофизарно-надпочечниковой, калликреин-кининовой и других системах регуляции гомеостаза. Для следующей стадии септического шока характерны гипердинамический режим кровообращения и нарушения транспорта кислорода. В этой стадии шока сохраняется повышенная производительность сердца: существенно увеличена работа левого желудочка, однако СИ лишь незначительно превышает норму. В результате преобладания активности норадреналина, альфа-адреномиметическое действие которого способствует вазоконстрикции, повышается общее периферическое сосудистое сопротивление. Неизбежным следствием этого является развивающаяся тканевая гипоксия. Снижаются потребление кислорода и индекс его доставки тканям, существенно увеличивается экстракция кислорода. Развивается блокада утилизации кислорода на субклеточном уровне с накоплением лактата.
В поздних стадиях развития септического шока, несмотря на продолжительную вазоконстрикцию и перераспределение крови на периферии, наблюдается снижение преднагрузки, объясняемое опустошением капиллярного функционирующего русла и, главное, жидкостной экстравазацией. Этим и определяется развитие вторичного гиповолемического синдрома. Вместе с миокардиодепрессией гиповолемия формирует гиподинамический синдром. Стадия гиподинамического режима кровообращения характеризуется низкими показателями СВ, доставки и потребления кислорода на фоне повышенной экстракции последнего. Экстракция кислорода резко падает в терминальной стадии шока. Значительное повышение экстракции кислорода на фоне сниженной его доставки и потребления обусловлено не только перфузионной недостаточностью и гипоксемией, но и значительным нарушением клеточного метаболизма и утилизации кислорода. Компенсаторная вазоконстрикция с повышением общего сосудистого сопротивления может наблюдаться также и в гиподинамической фазе септического шока. Значительное повышение легочного сосудистого сопротивления и легочная гипертензия становятся дополнительными факторами прогрессирования миокардиальной недостаточности.
Установлено, что детерминирующим фактором в специфике нарушений гемодинамики при септическом шоке являются не особенности микрофлоры, а системная реакция организма больного, в которой большую роль играет повреждение иммунной системы. Гипер- и гиподинамические синдромы как при грамположительной, так и при грамотрицательной бактериемии наблюдаются практически с одинаковой частотой.
Следует подчеркнуть, что при септическом шоке раньше всего повреждается главный орган-мишень — легкие. Основная причина дисфункции легких обусловлена повреждением эндотелия медиаторами и факторами воспаления, что увеличивает проницаемость кровеносных сосудов, приводит к их микроэмболизации и капиллярной дилатации. Изменения проницаемости клеточной мембраны могут вести к трансмембранному потоку низкомолекулярных веществ и макроионов, что сопровождается нарушением функции клеток. Таким образом развивается интерстициальный отек легких.
Как только возникает повреждение эндотелия, в органах и тканях, являющихся мишенью, увеличивается вероятность развития полиорганной недостаточности. За дисфункцией легких могут последовать сначала печеночная, затем почечная недостаточность, что и формирует синдром полиорганной недостаточности (СПОН). По мере развития СПОН каждый из органов оказывается не в состоянии адекватно функционировать, что приводит к появлению новых факторов повреждающего воздействия на другие органы и системы организма.
В патогенезе септического шока важнейшим звеном являются расстройства микроциркуляции. Они обусловлены не только вазоконстрикцией, но и значительным ухудшением агрегатного состояния крови с нарушением ее реологических свойств и развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС) крови или тромбогеморрагического синдрома. Септический шок приводит к расстройствам всех метаболических систем. Нарушаются углеводный, белковый и жировой обмен, резко угнетается утилизация нормальных источников энергии — глюкозы и жирных кислот. При этом возникает резко выраженный катаболизм мышечного белка. В целом обмен веществ сдвигается на анаэробный путь.
Таким образом, в основе патогенеза септического шока лежат глубокие и прогрессирующие расстройства гуморальной регуляции, метаболизма, гемодинамики и транспорта кислорода. Взаимосвязь этих нарушений может привести к формированию порочного круга с полным истощением адаптационных возможностей организма. Предотвращение развития этого порочного круга и является основной задачей интенсивной терапии больных с септическим шоком.
Клиническая картина. Изменения функций жизненно важных органов под влиянием повреждающих факторов септического шока формируют динамический патологический процесс, клинические признаки которого выявляются в виде нарушений функций ЦНС, легочного газообмена, периферического и центрального кровообращения, а в последующем и в виде органных повреждений.

где С — сегментоядерные нейтрофилы, П — палочкоядерные, Ю — юные, Ми — миелоциты, Пл — плазматические клетки, Мо — моноциты. Ли — лимфоциты, Э —эозинофилы.
Нормальная величина индекса колеблется около 1. Повышение ЛИИ до 4—9 свидетельствует о значительном бактериальном компоненте эндогенной интоксикации, тогда как умеренное повышение индекса до 2—3 указывает на ограничение инфекционного процесса или преимущественный тканевый распад. Лейкопения с высоким ЛИИ является всегда тревожным симптомом септического шока.
В поздней стадии септического шока при гематологических исследованиях, как правило, выявляются умеренная анемия (Нb 90—100 г/л), гиперлейкоцитоз до 40x109/л и выше с предельным возрастанием ЛИИ до 20 и более. Иногда увеличивается количество эозинофилов, что уменьшает ЛИИ, несмотря на отчетливый сдвиг лейкоцитарной формулы в сторону незрелых форм нейтрофилов. Может наблюдаться лейкопения с отсутствием нейтрофильного сдвига. При оценке лейкоцитарной реакции необходимо обращать внимание на снижение абсолютной концентрации лимфоцитов, которое может быть в 10 раз и более ниже нормальной величины.
Среди данных стандартного лабораторного контроля заслуживают внимание показатели, характеризующие состояние метаболического гомеостаза. Наиболее распространена диагностика метаболических расстройств на основании контроля сдвигов КОС, газов крови и оценки концентрации лактата в крови. Как правило, характер и форма расстройств КОС, а также уровень лактата зависят от тяжести и стадии развития шока. Достаточно выражена корреляция между концентрациями лактата и эндотоксина в крови, особенно при септическом шоке.
При исследовании КОС крови на ранних стадиях септического шока нередко определяется компенсированный или субкомпенсированный метаболический ацидоз на фоне гипокапнии и высокого уровня лактата, концентрация которого достигает 1,5—2 ммоль/л и более. В ранней стадии септицемии наиболее характерен временный респираторный алкалоз. У некоторых больных отмечается метаболический алкалоз. В поздних стадиях развития септического шока метаболический ацидоз становится некомпенсированным и по дефициту оснований нередко превышает 10 ммоль/л. Уровень лактат-ацидемии достигает 3—4 ммоль/л и более и является критерием обратимости септического шока. Как правило, определяется существенное снижение РаО2, SaO2 и, следовательно, уменьшение кислородной емкости крови. Следует подчеркнуть, что выраженность ацидоза в значительной степени коррелирует с прогнозом.
В диагностике и лечении септического шока становится все более и более необходимым динамическое определение показателей центральной гемодинамики (МОС, УО, СИ, ОПСС и др.) и транспорта кислорода (a-V — разница по кислороду, СаО2, РаО2, SaО2), которые позволяют оценить и определить стадию шока и компенсаторные резервы организма. СИ в сочетании с другими факторами, характеризующими особенности транспорта кислорода в организме и тканевый обмен служат критериями не только эффективности кислородного обеспечения, но и ориентировки в прогнозе септического шока и выборе основного направления интенсивной терапии расстройств кровообращения при внешне одинаковых проявлениях этого патологического процесса — гипотензии и низком темпе диуреза.
Кроме функционального исследования, диагностика включает выявление этиологического фактора — определение возбудителя и изучение его чувствительности к антибактериальным препаратам. Проводят бактериологическое исследование крови, мочи, раневого экссудата и т.д. С помощью биологических тестов исследуют выраженность эндотоксинемии. В клиниках проводится диагностика иммунной недостаточности на основании общих тестов: Т- и В-лимфоциты, бласттрансформация, уровень иммуноглобулинов в сыворотке крови.
Диагностические критерии септического шока:
наличие гипертермии (температура тела >38—39 °С) и ознобов. У пациентов пожилого возраста парадоксальная гипотермия (температура тела 20 в минуту или PaCO2 12,0•109/л, 4,0•109/л или незрелые формы >10 %, ЛИИ >9-10;
уровень лактата >2 ммоль/л.
Некоторые клиницисты выделяют триаду симптомов, которая служит продромой септического шока: нарушение сознания (изменение поведения и дезориентация); гипервентиляцию,определяемую на глаз, и наличие очага инфекции в организме.
В последние годы находит широкое применение балльная шкала оценки органной недостаточности, связанной с сепсисом и шоком (шкала SOFA — Sepsis-related Organ Failure Assessment) (табл. 1). Полагают, что данная шкала, принятая Европейским обществом интенсивной терапии, является объективной, доступной и простой в оценке дисфункции органов и систем при прогрессировании и развитии септического шока.
Читайте также:


