Язвенно некротический энтероколит детская хирургия
William J. Cochran
, MD, Geisinger Clinic
Last full review/revision October 2018 by William J. Cochran, MD

У недоношенных младенцев некротический энтероколит (НЭ) диагностируется более чем в 85% случаев. Он составляет примерно у 1–8% случаев поступлений в отделение интенсивной терапии новорожденных.
Факторы риска
Общие факторы риска некротизирующего энтероколита в дополнение к недоношенности включают
Асфиксия при рождении
Врожденные заболевания сердца
Частота также может быть выше у младенцев, получающих гипертонические смеси.
Как правило, присутствуют три кишечных фактора:
Предшествующий ишемический инсульт
Внутрипросветный субстрат (те, энтеральное питание)
Этиология
Точная этиология некротического энтероколита не выяснена. Считается, что ишемический инсульт повреждает слизистую оболочку кишечника, что приводит к повышенной проницаемости кишечника и делает его восприимчивым к бактериальной инвазии. Некротический энтероколит редко возникает до начала применения энтерального питания и менее распространен среди младенцев на грудном вскармливании. Однако, как только было начато кормление, в просвете кишечника появляется достаточно субстрата для распространения бактерий, которые могут проникнуть в поврежденную стенку кишечника, вырабатывая газообразный водород. Газ может собираться в кишечной стенке (пневматоз кишечника) или попадать в воротную вену.
Первоначальный ишемический инсульт может быть результатом спазма брыжеечных артерий, вызванного бескислородным инсультом, запускающим примитивный дайвинг-рефлекс, который заметно уменьшает кишечный кровоток. Кишечная ишемия может также быть результатом низкого кровотока во время обменного переливания крови, при сепсисе или из-за использования гиперосмолярных смесей. Точно так же врожденный порок сердца с уменьшенным системным кровотоком или насыщением кислородом артериальной крови может привести к кишечной гипоксии/ишемии и предрасполагает к развитию некротизирующего энтероколита.
Некротизирующий энтероколит может возникнуть как группа случаев или как вспышки в отделениях интенсивной терапии новорожденных. Некоторые группы случаев, скорее всего, связаны с конкретными возбудителями (например, с Klebsiella, Escherichia coli, коагулазонегативными стафилококками), но тем не менее специфический патоген при этом часто бывает не идентифицирован.
Некроз начинается в слизистой оболочке и может прогрессировать до вовлечения стенки кишечника на всю толщину, что приводит к кишечной перфорациис последующим перитонитоми часто свободным воздухом в брюшной полости. Перфорация встречается чаще всего в подвздошной кишке; толстая кишка и проксимальные отделы тонкого кишечника поражаются реже. У 33% младенцев развивается сепсис и возможен смертельный исход.
Клинические проявления
У младенцев могут быть трудности с кормлением, остатки крови и желчи в желудке (после кормления), которые могут перейти в желчную рвоту, кишечная непроходимость проявляется вздутием живота или же большим количеством крови в стуле. Сепсис может проявляться вялостью, нестабильностью температуры, учащенными приступами апноэ и метаболическим ацидозом.
Диагностика
Обнаружение крови в стуле
Рентгеноскопическое исследование органов брюшной полости

Раннее применение рентгенографии может быть неспецифично и выявит только кишечную непроходимость. Тем не менее фиксированная расширенная кишечная петля, которая не изменяется при повторных рентгенах, свидетельствует о наличии некротизирующего энтероколита. Рентгенологическими диагностическими признаками некротизирующего энтероколита являются пневматоз кишечника и газы в портальной вене. Пневмоперитонеум указывает на перфорацию кишечника и срочную необходимость хирургического вмешательства.
Лечение
Антибиотики широкого спектра действия
Полное парентеральное питание
Иногда хирургическое вмешательство
Уровень смертности составляет 20–30%. Агрессивная поддержка и разумные сроки хирургического вмешательства максимизируют шансы на выживание.
Нехирургическая поддержка достаточна в более чем 75% случаев. Кормление должно быть немедленно прекращено при подозрении на некротизирующий энтероколит, кишечник должен быть декомпрессирован с использованием назогастрального зонда с двойным просветом, предназначенным для интермиттирующего всасывания. Для поддержания циркуляции должны применяться подходящие коллоидные и кристаллоидные растворы, поскольку обширное воспаление кишечника и перитонит могут привести к значительной троекратной потере жидкости. Полностью парентеральное питание необходимо в течение 14–21 дня, пока кишечник заживает.
Системные антибиотики следует начать вводить сразу с бета-лактамных антибиотиков (например, ампициллина, тикарциллина) и аминогликозидов. Дополнительные препараты против анаэробных микроорганизмов (например, клиндамицин, метронидазол) также могут быть рассмотрены и должны применяться в течение 10 дней (для дозировки, Рекомендованные дозировки некоторых парентеральных антибиотиков для новорожденных). Поскольку некоторые вспышки могут быть заразными, следует рассмотреть изоляцию пациентов, особенно если несколько случаев некротического энтероколита возникает в течение короткого промежутка времени.
Младенцу требуются тщательный мониторинг; частые полные переоценки (по крайней мере каждые 12 ч), а также серии рентгенов брюшной полости, общий анализ крови, определение тромбоцитов и газов крови. Кишечные стриктуры являются наиболее распространенными долгосрочными осложнениями некротического энтероколита, возникающими у 10–36% детей, выживающих после исходного заболевания. Стриктуры обычно проявляются в течение 2–3 мес. после эпизода некротизирующего энтероколита. Наиболее часто они возникают в толстой кишке, особенно с левой стороны. Требуется резекция стриктур.
Хирургическое вмешательство необходимо 25% младенцев. Абсолютными показаниями являются перфорация кишечника (пневмоперитонеум), признаки перитонита (отсутствуют кишечные звуки, диффузный мышечный дефанс, болезненность или эритемы, отек брюшной стенки) или аспирация гнойного отделяемого из брюшной полости путем парацентеза. Хирургическое вмешательство показано младенцам с некротизирующим энтероколитом, чьи клинические лабораторные показатели ухудшаются, несмотря на нехирургическую поддержку.
Во время операции проводят резекцию гангренозного участка кишечника и создают стом. (Первичный реанастомоз можно сделать, если оставшийся кишечник не имеет признаков ишемии). После прекращения сепсиса и перитонита целостность кишечника может быть восстановлена через несколько недель или месяцев.
Профилактика
Младенцев, находящихся в зоне риска, следует кормить грудным молоком, и кормление следует начинать с небольших порций, которые постепенно увеличиваются в соответствии со стандартными протоколами. (Смесь для недоношенных младенцев является подходящим заменителем грудного молока, в случае его отсутствия). Следует избегать гипертонических смесей, лекарственных средств или контрастных веществ. Полицитемия должна быть вылечена безотлагательно.
Пробиотики (например, Bifidus infantis, Lactobacillus acidophilus) помогают предотвратить НЭ, но необходимо проведение дальнейших исследований, чтобы определить оптимальные дозировки и соответствующие штаммы.
Ключевые моменты
Некротизирующий энтероколит (НЭ) является кишечным некрозом неясной этиологии. Он возникает, главным образом, у недоношенных или больных новорожденных после начала энтерального питания.
Осложнения включают перфорацию кишечника (чаще в терминальном отделе подвздошной кишки) и перитонит, сепсис возникает в 33% случаев и возможен смертельный исход.
Начальные проявления трудностей при кормлении и остатков крови и желчи в желудке (после кормления) после желчной рвоты, вздутие живота и/или больше количества крови в стуле.
Диагностика с помощью простой рентгенограммы.
Поддерживающая терапия с использованием инфузионной реанимации, назогастральной зондовой аспирации, антибиотиков широкого спектра действия, и полного парентерального питания является эффективным в более чем 75% случаев.
Хирургическая резекция гангренозных участков кишечника и лечение перфорации необходимо для 25% младенцев.
Н.А. Ренц, Н.Н. Хуторская, Е.В. Алексеевнин, С.В. Юрченко, В.Я. Вартанов, С.А. Павловская
N.A. Renz, N.N. Hutorskaya, E.V. Alekseevnin,
S.V. Yurchenko, V.Ia. Vartanov, S.A. Pavlovskaya
Работа посвящена проблеме лечения некротического энтероколита у новорожденных. Предложена методика, основанная на многолетнем опыте работы. Подробно описаны клиника, дифференциальная диагностика, осложнения и лечение, приведены меры профилактики и возможные проблемы деонтологического характера.Статья может быть интересна неонатологам, реаниматологам.
Ключевые слова: некротический энтероколит, новорожденный, недоношенность
Актуальность.
Достижения неонатологии, связанные с улучшением качества оказания помощи новорожденным с низкой массой тела, недоношенным, перенесшим хроническую внутриутробную гипоксию и другими неблагоприятными факторами, повысили не только выживаемость таких детей, но и увеличили популяцию новорожденных с риском развития тяжелых заболеваний желудочно-кишечного тракта [1, 3]. Наиболее тяжелыми и угрожающими жизни заболеваниями у новорожденных являются язвенно-некротический энтероколит (ЯНЭК) и перфорации желудочно-кишечного тракта, летальность при которых составляет 40-80%, достигая 100% у пациентов с наиболее тяжелыми формами заболевания и сопутствующими патологическими состояниями [2].
Клиническое течение ЯНЭК и перфораций ЖКТ у новорожденных очень тяжелое, сопровождается перитонитом, высоким внутрибрюшным давлением с развитием синдрома полиорганной недостаточности. Указанный комплекс патофизиологических процессов определяет развитие жизнеугрожающего состояния для пациента и создает трудности в лечении
Этиология ЯНЭК. Ишемия, перенесенная в перинатальном периоде, аномальная колонизация кишечника новорожденного, неадекватный характер питания ребенка в раннем постнатальном периоде и инфекционный агент играют важную роль в этиологии заболевания [2, 5].
По течению заболевания выделяют следующие формы:
- Молниеносная форма. От первых нечетких симптомов дискомфорта в состоянии ребенка до возникновения перфорации проходит не более 1,5-2 суток [5, 13].
- Острая форма. Заболевание начинается с ярко выраженных симптомов со стороны брюшной полости, отказа от еды, срыгиваний и рвот, вздутия живота, нарушение пассажа по кишечнику, что соответствует стадии 1. Вскоре присоединяются общесоматические симптомы, свидетельствующие об интоксикации и дисфункции жизненно важных органов и систем. При неадекватности или неэффективности консервативной терапии заболевание может быстро перейти в III-ю стадию развития процесса, что требует незамедлительного хирургического лечения.
- Подострая форма. Симптомы со стороны ЖКТ появляются постепенно и имеют перемежающийся характер, т. е. периоды клинического благополучия сменяются возвратом дисфункции со стороны органов ЖКТ. Заболевание развивается медленно, его течение нередко носит рецидивирующий характер[8,11,18].
В зависимости от распространенности процесса выделяют следующие формы:
- Локальная форма - поражение ограничено небольшим участком кишки.
- Мультисегментарная форма – поражено несколько участков кишки.
- Тотальное поражение кишечника или пан-некроз [9,10].
Острая форма ЯНЭК характерна для недоношенных детей с массой более 1000 г. При этой форме чаще встречается локальное поражение тонкой кишки, причем от первых симптомов до возникновения перфорации кишки обычно проходит 2-3 суток. Заболевание начинается остро на 10-28-й день жизни, с появления признаков поражения ЖКТ. Быстро присоединяются или нарастают общесоматические симптомы, состояние прогрессивно ухудшается. У больных чаще всего выявляют локальное поражение тонкой кишки или некроз стенки желудка, реже мультисегментарное распространение процесса или тотальный некроз кишки.
Подострая форма характерна для глубоко недоношенных детей и детей с критически низкой массой тела. Первые симптомы появляются на 12- 45-е сутки жизни. Ребенок перестает усваивать питание, начинает срыгивать, возникает вздутие живота, меняется характер стула – он может участиться, в нем появляется примесь зелени и крови, а иногда, наоборот, становится более редким и прекращается вообще. При подострой форме НЭК нередко в последующем развивается частичная, а затем и полная кишечная непроходимость, причинами которой могут быть межкишечные абсцессы, инфильтраты или обтурация кишечника плотными кишечными массами (обтурационная кишечная непроходимость).
Диагностика. Важнейшую роль играет рентгенологическое обследование. Расширение кишечных петель – наиболее частый симптом. Значительное расширение кишечных петель и появление горизонтальных уровней свидетельствует о тяжести заболевания и его прогрессирующем течении. Пневматоз кишечной стенки (интрамуральное скопление газа) является одним из наиболее важных радиологических признаков НЭК. Этот симптом чаще определяется в более поздних стадиях заболевания [11, 14]. Поскольку появление газа в стенке кишки связано с жизнедеятельностью микробов, находящихся в кишечнике, то пневматоз возникает чаще у детей, уже получавших энтеральное питание (84%), чем у пациентов, которые не кормились (16%). На рентгенограмме одного из наших пациентов (см. рис. 1) могут одновременно определяться два вида пневматоза – кистовидный и линейный.
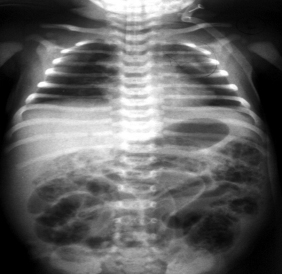
Рис.1. Обзорная рентгенограмма новорожденного С
По мнению некоторых исследователей, пневматоз свидетельствует о необратимой фазе поражения кишечника, требующей экстренной хирургической помощи [14]. Другие авторы полагают, что пневматоз не всегда предрекает перфорацию кишки, а поэтому при относительно стабильном состоянии больного возможно проведение консервативной терапии [18].
Газ в воротной вене (см. рис. 2) – очень грозный признак, часто свидетельствующий о далеко зашедшем процессе. Предполагается, что газ в виде эмболов попадает в систему воротной вены из некротизированной кишечной стенки (с пневматозом) или образуется непосредственно в сосудистых капиллярах в результате проникновения в эти капилляры газ-продуцирующих бактерий (анаэробов). Наличие газа в системе воротной вены встречается у 61% детей с тотальным некрозом кишки и предопределяет неблагоприятный прогноз, поэтому наличие данного симптома является абсолютным показанием к хирургическому лечению. Наличие неподвижной (статичной) петли кишки, не изменяющей свое положение на повторных снимках, свидетельствует о кишечной ишемии. Такие петли могут быть локализованными, единичными, или множественными. Сопоставление рентгенограмм, сделанных с некоторым интервалом во времени (6 – 8 часов), помогают отдифференцировать обычное расширение кишечных петель от фиксированных и неподвижных участков. Многие исследователи считают этот симптом патогномоничным для некроза кишки, и, соответственно, позволяющим ставить показания к операции.
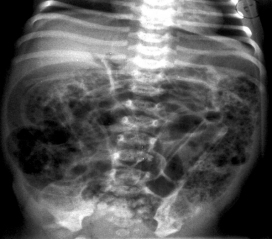
Рис. 2. Обзорная рентгенограмма новорожденного Р
Снижение пневматизации и неравномерное газонаполнение кишечных петель объясняется тем, что в результате активной перистальтики кишечное содержимое продвигается из жизнеспособных отделов кишки в ишемически пораженные, в которых перистальтика либо снижена, либо полностью отсутствует. Эти отделы кишечника, как правило, бывают заполнены жидким содержимым, что также способствует снижению количества находящегося в них газа. Его выявление позволяет продолжить консервативную терапию с тщательным контролем за состоянием ребенка и изменением рентгенологической картины.
Внезапное появление на рентгенограммах признаков асцита, выявляемых у 11% больных, является неблагоприятным фактором, говорящим о реакции брюшины на бактериальный перитонит, о возможной прикрытой перфорации кишки. Сочетание асцита и появления газа в воротной вене сопровождается с высокой смертностью пациентов [19].
Расширение желудка – еще один симптом ЯНЭК, выявляемый на обзорных рентгенограммах и обусловленный как атонией желудка, вызываемой воздействием бактериальных токсинов, так и псевдообструкцией пилорического отдела в результате отека слизистой.
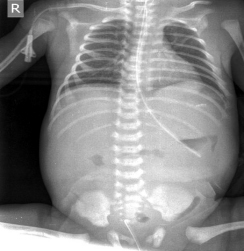
Рис. 3. Обзорная рентгенограмма новорожденного К.ЯНЭК III – IV, газ в свободной брюшной полости
УЗИ органов брюшной полости и забрюшинного пространства используется для выявления выпота в брюшной полости, обнаружения инфильтратов и абсцессов. На рис. 5 представлена УЗИ- картина пневмоперитонеума.
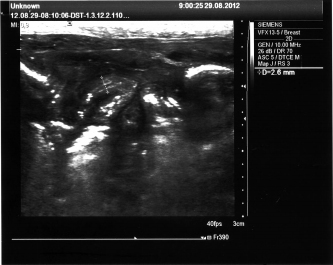
Рис. 4. УЗИ органов брюшной полости и забрюшинного пространства.
Воздух в брюшной полости
Лапароцентез (см. рис. 5) – достаточно часто использующийся в нашей практике метод экспресс-диагностики.
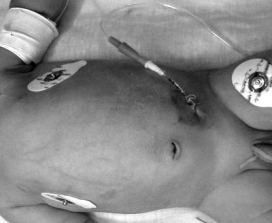
Рис. 5. Лапароцентез
Получение из брюшной полости при аспирация более, чем 1,0 мл желто-коричневого или зеленого, мутного содержимого свидетельствует о некрозе кишки.
Абсолютные показания к хирургическому лечению:
Лечение некротического энтероколита зависит от стадии заболевания и степени выраженности симптомов, складывается из консервативного и хирургического этапов.
Консервативное лечение некротического энтероколита [12, 15, 17, 20]
- Энтеральное питание - режим трофического кормления (1ml| kg - микроструйное введения) при НЭК I ст.
При малейшем подозрении на НЭК IIа ст. - отмена энтерального питания
Постановка в желудок для декомпрессии постоянного назогастрального или орогастральнога зонда (держать открытым) - Респираторная терапия (ИВЛ, неинвазивная вентиляция легких).
- Антибактериальная терапия.
(Карбапенемы + гликопептиды или комбинированные цефалоспорины)
Схемы антибактериальной терапии представлена в таблице № 1.
Таблица 1.
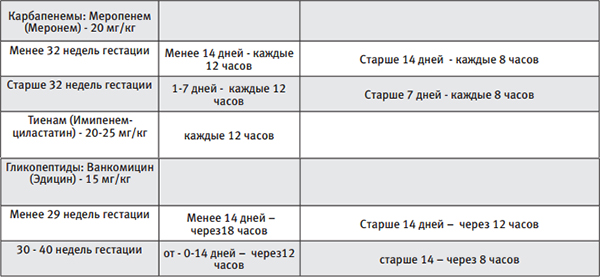
При выделении вероятного возбудителя – смена антибактериальной терапии с учетом спектра его чувствительности.
Бензодиазепины ( седуксен 0,02 – 0,3 мг/кг), согласно шкале СRIES.
Натрия оксибутират (100 -200 мг/кг/мин)
Основной принцип TPN – сбалансированность всех компонентов (белков, жиров, углеводов, микро- элементов, витаминов).
Критерии для проведения TPN:
- TPN необходимо назначать при развитии ЯНЭК II-III стадии и продолжить в ранние сроки после хирургического лечения (3-5сутки).
- Для назначения TPN необходимо добиться полной стабилизации состояния больного (коррекция метаболических нарушений и КОС, стабилизация гемодинамики, отмена планового наркотического обезболивания).
Таблица 2.
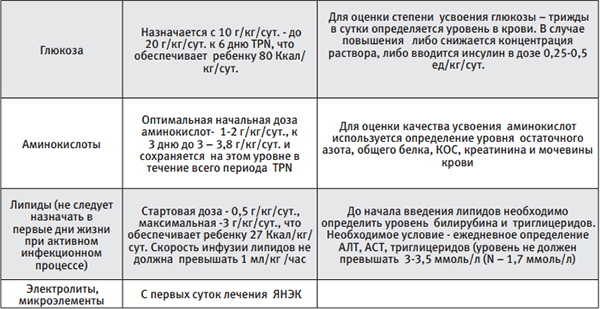
Период энтерального голода в группе детей, получающих консервативное лечение, которое оказывается эффективным, недлительный, редко превышает 7-8 дней. Энтеральное кормление возобновляется с того момента, как у ребенка восстанавливается пассаж по кишечнику, исчезает вздутие живота, появляется стойкая тенденция к улучшению или нормализации лабораторных показателей и рентгенологических данных.
Наилучшим видом питания для новорожденного ребенка, конечно, является грудное молоко. Однако, после тяжелых воспалительных заболеваний ЖКТ, длительной антибактериальной терапии развивается тяжелый дисбактериоз и вторичная лактазная недостаточность, поэтому при введении даже грудного молока у больного могут усиливаться бродильные процессы, страдать переваривание и всасывание.
По мере повышения толерантности организма к вводимой смеси, стабилизации весовых прибавок ребенка постепенно переводят на вскармливание грудным молоком.
Так как ухудшение состояния детей группы высокого риска развития НЭК часто происходит на фоне мнимого благополучия без выраженных клинических симптомов, актуальными являются деонтологические проблемы. Высокая вероятность хирургического вмешательства и неопределенный прогноз еще больше осложняют ситуацию в отношениях между медицинским персоналом и родителями ребенка. В связи с этим медицинский персонал должен устанавливать доверительные отношения с родственниками и достоверно информировать их о текущем состоянии больного и прогнозе для него [14, 16].
Настороженность в отношении развития ЯНЭК у детей группы риска, соблюдение правил введения энтеральной нагрузки, повышение защитной функции кишечника, отработанный алгоритм ведения этих детей по стадиям процесса до и после оперативного вмешательства, ранняя диагностика осложнений ЯНЭК, парентеральное питание с постепенным переходом на энтеральное, последующая реабилитация совместно с реаниматологом, хирургом, неврологом позволяют остановить процесс на более ранних стадиях и снизить летальность среди детей группы риска по развитию ЯНЭК.
К группе риска по развитию ЯНЭК относятся недоношенные дети, перенесшие гипоксию в родах, а также угрожаемые по развитию интранатальной и внутриутробной инфекции.
- Новорожденные должны консультироваться детским хирургом при появлении первых симптомов ЯНЭК, до развития хирургических осложнений.
- Улучшение результатов лечения ЯНЭК возможно лишь при тесном взаимодействии врачей различных специальностей, занимающихся выхаживанием недоношенных детей.
Е.Г.Новопольцева 1, В.А.Воробьева 1, О.Б.Овсянникова 1, Н.Б.Тумакова 2, Н.А.Плохорский 2, В.Е.Пивиков 2, Е.А.Новопольцев 2, Л.Б.Бурмистрова 1
1 Нижегородская государственная медицинская академия
2 Нижегородская областная детская клиническая больница
С целью оптимизации терапии представлена клиническая характеристика течения гастроинтестинального синдрома у недоношенных детей. Включение Кипферона® в комплексную терапию приводит к более быстрой нормализации функций желудочно-кишечного тракта, уменьшению выраженности патологических синдромов, сокращает сроки выздоровления. Назначение препарата приводит к нормализации показателей локального иммунитета ЖКТ, нормализации соотношения основных субпопуляций Т-лимфоцитов и иммунорегуляторного индекса (ИРИ), и оказывает положительное влияние на восстановление нарушенной микрофлоры у этих детей.
Ключевые слова: недоношенные дети, гастроинтестинальный синдром, язвенно-некротический энтероколит, внутриутробное инфицирование, Кипферон®.
Patterns of course of necrotizing ulcerative entherocolitis in prematurely born infants with prenatal infection
E.G.Novopaltseva 1, V.A.Vorobyova 1, O.B.Ovsyannikova 1, N.B.Tumakova 2, N.A.Plohorskiy 2, V.E.Pivikov 2, E.A.Novopaltsev 2, L.B.Burmistrova 1
1 State Medical Academy of Nijni Novgorod,
2 Regional Children’s Clinical Hospital of Nijni Novgorod
Clinical characteristics of course of gastrointestinal syndrome in prematurely born infants are presented. Inclusion of Cipferon® in complex therapy resulted in faster normalization of intestinal tract function, decrease of severity of pathological syndromes and shortening period of recovery. This medication use lead to normalization of indicators of local immunity in gastrointestinal tract, normalization of balance of main subpopulation of T-lymphocytes and immunoregulatory index, promote recovery of microflora.
Keywords: prematurely born infants, gastrointestinal syndrome, necrotizing ulcerative entherocolitis, Cipferon®.
Воробьева Валентина Андреевна – д.м.н., профессор, зав. кафедрой педиатрии и неонатологии ИПО Ниж. ГМА
Овсянникова Ольга Борисовна – д.м.н., профессор кафедры педиатрии и неонатологии ИПО Ниж. ГМА
Новопольцева Екатерина Геннадьевна – к.м.н., доцент кафедры педиатрии и неонатологии ИПО Ниж. ГМА
Бурмистрова Людмила Борисовна – аспирант кафедры педиатрии и неонатологии ИПО Ниж. ГМА
Пивиков Виктор Евгеньевич – зав.отделением реанимации и интенсивной терапии новорожденных ГУ НОДКБ
Новопольцев Евгений Александрович – врач анестезиолог-реаниматолог отделения реанимации и интенсивной терапии новорожденных
ГУ НОДКБ
Тумакова Нина Борисовна – врач-неонатолог отделения реанимации и интенсивной терапии новорожденных ГУ НОДКБ
Плохорский Н.А. – врач-хирург отделения хирургии новорожденных ГУ НОДКБ
Маловесные, в том числе недоношенные дети, вносят существенный вклад в показатели перинатальной и младенческой смертности в период новорожденности и раннего возраста. По данным зарубежных и отечественных исследований, до 40% преждевременных родов обусловлены внутриматочной инфекцией 1. Инфекционно-воспалительные заболевания, возникшие внутриутробно, являются одной из ведущих причин высокой заболеваемости и смертности недоношенных детей. Они занимают второе место после гипоксии и асфиксии в родах, что во многом связано с особенностями иммунологического ответа этой категории детей. Разработка стратегии профилактики тяжелых болезней у маловесных детей предусматривает назначение иммунотропных препаратов детям с инфекционно-воспалительными заболеваниями и детям с высоким риском внутриутробного инфицирования. Однако заболеваемость, связанная с инфекцией, особенно язвенно-некротический энтероколит (ЯНЭК) нередко регистрируется в постнатальном и раннем неонатальном периоде у детей без ярких симптомов внутриутробного инфицирования (ВУИ). Отсутствие иммунотропной терапии в лечении этой группы детей нередко приводит к летальным исходам 8.
Вышеизложенное определило цель исследования: дать клиническую характеристику течения гастроинтестинального синдрома у недоношенных детей с целью оптимизации терапии.
Всего под наблюдением находились 162 недоношенных новорожденных. Первую группу составили 132 ребенка с ВУИ (основная группа), у которых имело место проявление гастроинтестинального синдрома. Во вторую группу (сравнения) включено 30 недоношенных детей (без ВУИ). У детей с ВУИ клинические симптомы инфицирования манифестировали в первые трое суток.
У трети детей ВУИ носила генерализованный характер, с вовлечением двух и более систем, а в очень тяжелых случаях сопровождалось симптомами полиорганной недостаточности (33%), о чем свидетельствовала высокая (более 20 и 30 баллов) оценка состояния по NTISS (Neonatal Therapeutic Intervention Scoring System, Неонатальная Шкала Инвазивности Терапии, Gray J.E. и соавт., 1992). Из локализованных форм преобладали: пневмония – у 39 (29,5%), менингит / менингоэнцефалит – у 4 (3,0%), гепатит – у 14 (10,6%), кардит – у 1 (0,8%), поражения кожи и омфалит – у 3 (2,3%).
Ведущими патологическими синдромами у детей основной группы были: синдром дыхательных расстройств (47%), гипо- или гипертермия (60,6%), гипербилирубинемия (65,4%), которая появлялась в 1-2-е сутки жизни, сохранялась более 2-х недель и сопровождалась гепатоспленомегалией. Наиболее часто у детей с ВУИ развивался отечный синдром (31,8%) и геморрагический синдром (31,8%).
У всех недоношенных детей основной группы и у трети детей группы сравнения, в той или иной степени имели место симптомы дисфункции желудочно-кишечного тракта. Преобладающими патологическими синдромами со стороны ЖКТ у детей с ВУИ в первые дни жизни были нарушения моторики желудка и кишечника. У большинства детей клинические проявления поражения ЖКТ возникали в 1-3-и сутки жизни в виде пареза кишечника (43,2%), желудочных кровотечений (22,7%), застойных явлений в желудке (59,1%), синдрома срыгиваний и рвоты (62,9%). Перечисленные симптомы у детей группы сравнения регистрировались существенно реже (табл. 1).
Примечательно, что у детей с ВУИ в первые дни жизни достоверно чаще имел место синдром динамической кишечной непроходимости, который нередко сменялся в дальнейшем диарейным синдромом, синдромом срыгивания и рвоты, метеоризмом, недостаточной прибавкой массы тела. В последующем на 3-4-й неделе жизни диарейный синдром сменялся задержкой стула. Обстипация у детей основной группы встречалась достоверно чаще по сравнению с детьми группы сравнения (67,4% и 16,6% соответственно, рВ группе сравнения гастроинтестинальный синдром был непостоянным, компенсированным, не отмечено ни одного случая развития ЯНЭК.
Развитие патологических синдромов со стороны ЖКТ значительно усугубляло тяжесть состояния недоношенных и осложняло течение основного заболевания.
При исследовании иммунологического статуса у недоношенных детей с внутриутробными инфекциями обнаружилось статистически достоверное повышение уровня IgM в сыворотке крови по сравнению с показателями у недоношенных детей группы сравнения (рПри исследовании клеточного иммунитета у недоношенных детей с ВУИ было установлено значительное снижение относительных показателей субпопуляций Т-лимфоцитов: CD3, CD4, CD8 (табл. 3).
Показатели секреторного IgA (sIgA) анализировали в аспирате желудочного секрета, копрофильтратах и грудном молоке матерей. Следует отметить, что в желудочном аспирате sIgA обнаруживался у 86,4% детей основной группы и у 100% детей группы сравнения (рВыявлена обратная корреляция между уровнем sIgA в желудочном содержимом и выраженностью основных патологических синдромов: синдромом срыгивания и рвоты (r=-0,449, р=0,000), нарушением моторно-эвакуаторной функции желудка (r=-0,426, р=0,001). SIgA в копрофильтратах детей основной группы выявлялись у 59,1% и у 70% детей группы сравнения. У детей, находящихся на искусственном вскармливании, sIgA в кале не определялся. Концентрация sIgA в копрофильтратах детей основной группы была в 1,5 раза ниже, чем в группе сравнения (0,15±0,06 г/л и 0,26±0,08 г/л соответственно, рsIgA коррелировали с выраженностью основных патологических синдромов. Выявлены отрицательные корреляционные связи: между уровнем sIgA и метеоризмом (r=-0,523, р=0,001), изменением характера стула (r=-0,299, р=0,028), наличием дисбактериоза (r=-0,282, р=0,039), диареей (r=-0,481, р=0,005).
Выявленные патологические изменения, а также дефицит поступления с молоком матери иммуно-глобулинов усугубляют течение внутриутробных инфекций.
Учитывая значительные сдвиги в иммунном статусе недоношенных детей, было решено включить в состав терапии детей с ВУИ комплексный иммунобиологический препарат. Для оценки эффективности иммуномодулирующей терапии у недоношенных детей были сформированы две группы. В первую вошли 22 ребенка из основной группы, во вторую – 16 детей. Группы были сопоставимы по характеру лечения. Терапия отличалась единственной составляющей. Дети первой группы дополнительно к стандартной терапии получали прапарат Кипферон® суппозитории для вагинального или ректального введения (Кипферон®). На фоне проводимого лечения у них отмечалось раннее улучшение общего состояния (pВыраженная положительная динамика гастроинтестинальных нарушений на фоне комплексной терапии сопровождалась нормализацией состава кишечной микрофлоры. Так, у недоношенных детей
1-й группы (81,8%) положительные изменения в составе кишечной микрофлоры происходили к 10-14 дням терапии, у детей 2-й группы – в более поздние сроки (14-21-е дни) (табл. 5). Характер динамики клинических и бактериологических параметров полностью отражает изменения sIgA в копрофиль-тратах детей сравниваемых групп (табл. 6).
Кроме того выявлена отчетливая положительная динамика показателей клеточного иммунитета (табл. 7). Так, отмечено достоверное увеличение относительного и абсолютного количества зрелых Т-лимфоцитов (CD3, CD4), нормализация иммунорегуляторного индекса (ИРИ).
В отличие от 1-й группы, где в комплексную терапию был включен Кипферон®, у 1/4 новорожденных 2-й группы на фоне стандартной терапии дисбиотические проявления сохранялись, у 2-х недоношенных отмечалось нарастание симптомов поражения ЖКТ, что вероятно обусловлено сменой основного этиологически значимого возбудителя, негативно влияющего на течение и исход гастроинтестинальных симптомов.
Выводы
1. Гастроинтестинальный синдром является одним из основных клинических синдромов у недоношенных детей с ВУИ и усугубляет течение основного заболевания, нередко определяет его исход при развитии ЯНЭК.
2. Установлено, что представительства внутриклеточных и вирусных возбудителей ВУИ регистрируются тем чаще, чем ниже гестационный возраст младенцев.
3. Выявленные изменения в системном и местном иммунитете у детей с ВУИ могут быть основанием для включения иммунотропных препаратов в алгоритм терапии гастроинтестинального синдрома при ВУИ.
4. Включение Кипферона® в алгоритм комплексной терапии приводит к более быстрой нормализации функций ЖКТ, уменьшению выраженности патологических синдромов, сокращает сроки выздоровления. Назначение Кипферона® приводит к нормализации показателей локального иммунитета ЖКТ, нормализации соотношения основных субпопуляций Т-лимфоцитов и ИРИ, и оказывает положительное влияние на восстановление нарушенной микрофлоры у этих детей.
5. Комплексная оценка эффективности лечения маловесных детей свидетельствует о том, что включение Кипферона® в 1,6 раза повышает эффективность стандартной терапии.
6. Нежелательных эффектов на применение препарата Кипферон® не зарегистрировано.
Читайте также:
- Как называется вакцина против пневмококковой инфекции
- О мерах по совершенствованию мониторинга за возбудителями инфекционных и паразитарных болезней
- С какими заболеваниями госпитализируют в инфекционное отделение
- Прием анализов детская инфекционная больница
- Платные услуги в инфекционной больнице на конева


