Вакцины при респираторно-синцитиальной инфекции крупного рогатого скота
(организация-разработчик: компания Zoetis (Pfizer), США)
Вакцина изготовлена из культуральной жидкости перевиваемых линий клеток, инфицированных аттенуированными вирусами возбудителей инфекционного ринотрахеита, парагриппа-3 и респираторно-синцитиальной инфекции с добавлением гентамицина – 30 мкг/мл в качестве консерванта и стабилизаторов: раствора N-Z амина – 15%, раствора желатина – 3% и буферного раствора лактозы моногидрата – 15%.
Вакцина – лиофилизированная масса для приготовления раствора (сухая масса), разбавитель – раствор для инъекций (жидкость).
По внешнему виду вакцина представляет собой однородную сухую пористую массу светло-жёлтого цвета, разбавитель – бесцветную прозрачную жидкость.
Вакцина расфасована по 1, 5, 10, 25 и 50 доз, растворитель – по 2, 10, 20, 50 и 100 мл в стеклянные и/или пластиковые флаконы соответствующей вместимости. Флаконы герметично укупорены резиновыми пробками, укреплёнными алюминиевыми колпачками.
Флаконы с вакциной и разбавителем упакованы в картонную коробку. В каждую коробку с вакциной вложена инструкция по ее применению.
Вакцину хранят и транспортируют в сухом темном месте при температуре от 2°С до 7°С. Не допускается замораживание компонентов!
Вакцину следует хранить в местах, недоступных для детей.
Срок годности вакцины составляет 18 месяцев от даты выпуска при соблюдении условий хранения и транспортирования. По истечении срока годности вакцина к применению не пригодна.
Компоненты вакцины во флаконах без этикеток, с истекшим сроком годности, с нарушением целостности и/или герметичности укупорки, с измененным цветом и/или консистенцией содержимого, с наличием посторонних примесей, а также остатки вакцины, не использованные в течение 6 часов после вскрытия флаконов, бракуют и обеззараживают путем кипячения в течение 30 минут или обработки 2% раствором щелочи или 5% раствором хлорамина (1:1) в течение 30 минут и утилизируют.
Утилизация обеззараженной вакцины не требует соблюдения специальных мер предосторожности.
В одной иммунизирующей дозе вакцины содержатся аттенуированные штаммы возбудителей: инфекционного ринотрахеита (штамм RLB 106) не менее 10 5,5 ТЦД50, парагриппа-3 (штамм RLB 103) не менее 10 5,0 ТЦД50 и респираторно-синцитиальной инфекции (штамм BRSV/375) не менее 10 4,7 ТЦД50. Вакцина безвредна, лечебными свойствами не обладает
Вакцина предназначена для профилактики ринотрахеита, парагриппа-3 и респираторно-синцитиальной инфекции крупного рогатого скота.
Запрещено вакцинировать клинически больных и/или ослабленных животных. Вакцинации подлежат здоровые животные, включая стельных животных, с первой недели жизни.
Телят, вакцинированных до возраста 6 месяцев, следует ревакцинировать после 6 месяцев с целью предотвращения возможной интерференции иммунизации со стороны материнских антител.
Ревакцинацию проводят ежегодно.
Перед вакцинацией содержимое флакона с жидким компонентом переносят во флакон с лиофилизированным, соблюдая правила асептики, и взбалтывают до полного растворения.
Вакцину вводят интраназально в дозе 2 мл. В каждую ноздрю вводят по 1 мл вакцины.
Симптомов проявления инфекционного ринотрахеита, парагриппа-3, респираторно-синцитиальной инфекции или других патологических признаков при передозировке вакцины не установлено.
Особенностей поствакцинальной реакции при первичном и последующих введениях вакцины не установлено.
Следует избегать нарушений схемы (сроков) введения вакцины, поскольку это может привести к снижению эффективности иммунопрофилактики инфекционного ринотрахеита, парагриппа-3 и респираторно-синцитиальной инфекции. В случае пропуска очередного введения вакцины необходимо провести иммунизацию как можно скорее.
При применении вакцины в соответствии с настоящей инструкцией побочных явлений и осложнений, как правило, не отмечается.
В случае появления аллергических реакций использование препарата прекращают и назначают антигистаминные средства, адреналин, кортикостероиды или другое симптоматическое лечение.
Запрещено применять вакцину в одном шприце с другими иммунобиологическими препаратами.
Продукты убоя от вакцинированных животных реализуют для пищевых целей не ранее, чем через 21 день после введения вакцины, молоко используют без ограничений.
При работе с вакциной следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными препаратами ветеринарного назначения.
Все лица, участвующие в проведении вакцинации должны быть в спецодежде (резиновые сапоги, халат, брюки, головной убор, перчатки). В местах работы должна быть аптечка доврачебной помощи.
При случайном попадании вакцины на кожу и/или слизистые оболочки, их необходимо промыть большим количеством чистой воды. В случае разлива вакцины, зараженный участок пола или почвы заливают 5% раствором хлорамина или 2% раствором едкого натрия.
При случайном введении препарата человеку, место инъекции необходимо обработать 70% раствором этилового спирта, обратиться в медицинское учреждение.
Шемелькова Г.О., Верховская А.Е., Соболева Г.Л.
ООО "Ветбиохим", г. Москва
Шемельков Е.В., Иванов Е.В., Непоклонова И.В.
АНО "Научно-исследовательский институт диагностики и
профилактики болезней человека и животных", г. Москва
Алипер Т.И. "НПО НАРВАК",
"ФГБУ НИИ вирусологии им. Д.И. Ивановского" МЗ РФ, г. Москва
Аденовирус крупного рогатого скота широко распространен среди поголовья и часто, в сочетании с другими вирусными агентами (вирусы инфекционного ринотрахеита, парагрип-па-3, вирусной диареи, респираторно-синцитиальным, рота- и коро-навирусами), является первопричиной возникновения и развития основных респираторных и кишечных инфекционных заболеваний телят, которые, в дальнейшем, осложняются вторичными инфекциями бактериальной этиологии [2, 5, 7, 10].
Установлено, что аденовирусы являются иммунодепрес-сантами и способствуют развитию других инфекционных патологий. Из-за сходства с другими инфекционными заболеваниями вирусной этиологии клинико-эпизоотологическая диагностика аденовирусной инфекции крупного рогатого скота затруднена [4].
Ввиду частой полиэтиологичности первичных вирусных инфекций и невозможности разграничения ведущей роли того или иного агента в развитии патологии, наиболее эффективным методом специфической профилактики таких заболеваний является применение комбинированных вакцин, содержащих антигены сразу всех или нескольких из указанных возбудителей [3, 7]. Вакцинации подвергают стельных коров для создания у новорожденного потомства пассивного колострального иммунитета, а также телят с 2-3-х недельного возраста для создания активного поствакцинального иммунитета [9].
В настоящее время имеется ряд поливалентных вакцин против двух, трех и более указанных респираторных и/или кишечных вирусных заболеваний телят, но отсутствуют зарегистрированные биопрепараты, предназначенные для специфической профилактики аденовирусной инфекции крупного рогатого скота. Однако, наряду с другими вирусными агентами, аденовирусы играют значительную роль в этиологии указанных заболеваний [1, 2, 8, 11].
В ранее проведенных исследованиях нам удалось выделить и идентифицировать методом секвенирования фрагмента генома аденовирус крупного рогатого скота I-го типа. Выделенный штамм аденовируса был адаптирован к перевиваемой культуре клеток и депонирован в государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского МЗ РФ. В ходе проведенных исследований установили, что выделенный аденовирус обладает выраженными антигенными свойствами и пригоден для использования в составе инактивированных вакцин [6].
Целью настоящей работы была разработка комбинированной вакцины против аденовирусной инфекции, инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальной, рота- и коронавирусной болезнях крупного рогатого скота, а также оценка эффективности ее применения в производственных условиях.
Материалы и методы. Для проведения серомониторинга использовали пробы сыворотки крови крупного рогатого скота, полученные из разных субъектов РФ, которые исследовали на наличие ви-руснейтрализующих антител к аденовирусу, вирусам инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальному, рота- и коронавирусам крупного рогатого скота. Наличие специфических антител к возбудителям инфекционного ринотрахеита и респираторно-синцитиальной инфекции, так же определяли методом ИФА, с использованием соответствующих диагностических ИФА-наборов: "ИРТ-СЕРОТЕСТ" и "РСИ-СЕРОТЕСТ", производства ООО "Ветбиохим".
В качестве прототипа использовали инактивированную комбинированную вакцину "КОМБОВАК", производства ООО "Ветбиохим".
Экспериментальные образцы вакцины готовили из одной партии инактивированного аденовируса крупного рогатого скота I-го типа, штамм "Альфа" (выделен от 17-и суточного теленка) [6], а также инактивированных антигенов производственных штаммов вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи, рес-пираторно-синцитиального, рота- и коронавирусов крупного рогатого скота.
При выборе адъюванта для вакцины провели исследования шести различных коммерческих и экспериментальных препаратов: ISA 50, ISA 71, ISA 206, ISA 773 (SEPPIC, Франция), адъювантный комплекс Акрум-С (комплекс высокомолекулярного синтетического полиэлектролита со смесью поверхностно-активных гликозидов), гель гидроокиси алюминия (ГОА). Соотношения антигенной части и адъюванта брали в пропорциях, рекомендованных производителем адъюванта или подбирали опытным путем.
В качестве лабораторной модели, для оценки безвредности использовали группы морских свинок и белых мышей (n = 5 и n = 10, соответственно, на каждый образец). Морским свинкам вакцину вводили внутримышечно в дозе 2,0 мл, белым мышам - подкожно в дозе 0,5 мл. За животными вели наблюдение в течение 15 суток.
Антигенную активность образцов на лабораторной модели, оценивали путем проведения однократной внутримышечной вакцинации группы морских свинок (n = 10, на каждый образец), сформированной по принципу аналогов в дозе 1,0 мл, с последующим исследованием сыворотки крови, полученной до и через 21 сутки после вакцинации, на наличие специфических антител в реакции нейтрализации (РН).
Безвредность и антигенную активность изготовленных образцов в опыте на естественно восприимчивых животных оценивали путем проведения двукратной внутримышечной иммунизации коров за 1-2 месяца до осеменения (n=30 на каждый образец вакцины), сформированных в соответствующие группы по принципу аналогов, в дозе 3,0 мл. Кровь брали выборочно по 10 голов из каждой группы перед вакцинацией (Д0) и через 21 сутки после первой (Д21) и второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН.
Для определения оптимальной иммунизирующей дозы вакцины использовали три группы коров за 1-2 месяца до осеменения (n = 15 в каждой группе), которых иммунизировали внутримышечно двукратно с интервалом 21 сутки в дозах 2,0 мл (первую группу), 3,0 мл (вторую группу) и 4,0 мл (третью группу). А также две группы телят в возрасте 2,5-3 месяца (n = 15 в каждой группе), которых иммунизировали двукратно внутримышечно в дозах 1,0 мл (первую группу) и 2,0 мл (вторую группу). Кровь у животных брали перед вакцинацией (Д0) и через 21 сутки после второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН. В качестве контроля использовали группы невакцинированных животных (по 10 голов коров и телят).
Постановку и учет результатов РН осуществляли по стандартным методикам с использованием соответствующих контрольных штаммов вирусов.
Оценку эффективности применения вакцины в производственных условиях проводили в животноводческом хозяйстве, неблагополучном по респираторным и кишечным инфекционным заболеваниям телят. В хозяйстве вакцинировали стельных коров - дважды: первый раз - за 50-60 суток до отела, второй - через 14-21 сутки в дозе 3,0 мл. Полученных телят первый раз вакцинировали в возрасте 25-30 суток, повторно через 20-25 суток в дозе 2,0 мл. В качестве контроля использовали группы невакцинированных стельных коров и телят, которые содержались в другом помещении. Эффективность применения вакцины определяли по эпизоотологическим показателям: заболеваемость телят респираторными и кишечными инфекциями, смертность телят, а также их вынужденная выбраковка в опытной и контрольной группах.
Статистическую обработку данных выполняли общепринятыми методами (компьютерные программы Microsoft Excel 2010, Stat Plus 2005).
Результаты исследований. На первом этапе работы (20102012 г.) мы провели исследование 869 проб сыворотки крови коров и телят, полученных от невакцинированных животных, из 12 неблагополучных по основным респираторным и кишечным инфекционным заболеваниям хозяйств Вологодской, Воронежской, Калужской, Московской, Тамбовской областей, Алтайского и Краснодарского краев, Республики Башкирия. В ходе проведенного серомониторинга было выявлено наличие специфических антител к возбудителям: аденовирусной инфекции (АВ) в 24% исследуемых проб, инфекционного ринотрахеита (ИРТ) - в 47%, парагриппа-3 (ПГ-3) - в 85%, вирусной диареи (ВД) - в 86%, респираторно-синцитиальной болезни (РС) - в 62%, ротавирусной болезни (РВ) - в 89%, коронавирусной болезни (КВ) - в 87% исследуемых проб (рисунок 1).
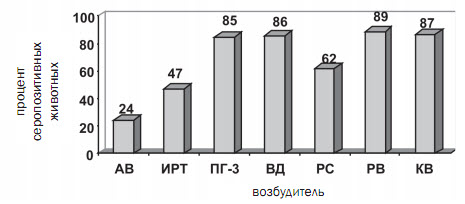
Рис. 1. Количество положительных проб сыворотки крови крупного рогатого скота
к соответствующему вирусу (в процентах от общего числа исследованных)
Результаты проведенных исследований свидетельствуют о широком распространении аденовирусной инфекции крупного рогатого скота в животноводческих хозяйствах, при этом, в подавляющем большинстве случаев, она встречается в сочетании с другими вирусными заболеваниями. Таким образом, аденовирус крупного рогатого скота играет существенную роль в этиологии основных вирусных заболеваний телят. Полученные результаты согласуются с данными других ученых, показывающими широкое распространение вирусных инфекций, в том числе и аденовирусной, среди поголовья крупного рогатого скота [1, 2, 5].
Кроме того, при проведении серологических исследований, установлена корреляция результатов по выявлению антител к вирусам ИРТ и РС, полученных в РН и ИФА.
На основании проведенных исследований, с учетом имеющихся литературных данных, мы пришли к заключению о целесообразности создания комбинированной вакцины против основных респираторных и кишечных вирусных заболеваний телят, включающей в себя аденовирус крупного рогатого скота.
Поскольку, по сравнению с прототипной вакциной "КОМБОВАК", в новой вакцине увеличивается количество вирусных антигенов и, следовательно, снижается объемная доля каждого отдельного антигена, то для нее требуется более иммунологически эффективный адъювант, способный обеспечить выраженный иммунный ответ на каждый антиген.
В ходе данной работы исследовали шесть адъювантов, с которыми изготовили экспериментальные образцы вакцины. Оценку изготовленных образцов проводили по показателям безвредности и антигенной активности в опытах на лабораторных и естественно восприимчивых животных.
Изучение безвредности показало, что экспериментальные образцы вакцины не вызывали заболевания или гибели подопытных животных, при этом у отдельных особей наблюдали образование плотных ограниченных припухлостей на месте введения образцов с масляными адъювантами.
В опытах на лабораторных и естественно восприимчивых животных установлено, что введение экспериментальных образцов вакцины вызывало развитие выраженного иммунного ответа (Р Таблица 1. Сравнительная оценка антигенной активности вакцины с разными адъювантами в опыте на лабораторных животных
Респираторно-синцитиальная инфекция (PC-инфекция) крупного рогатого скота — контагиозная, остро протекающая болезнь, характеризующаяся повышением температуры, преимущественным поражением органов дыхания. Регистрируется во многих странах мира, в том числе и в России.
В естественных условиях болеет крупный рогатый скот. Заболевание наиболее ярко проявляется у 1—3-месячных телят. PC-инфекция часто осложняется вторичной бактериальной инфекцией, особенно пастереллезом. Многие исследователи считают, что в этиологии массовых пневмоний молочных телят основная роль принадлежит PC-вирусу, который обнаруживали гораздо чаще, чем вирусы ринотрахеита, диареи и парагриппа-3. Отмечено, что особенно чувствителен к PC-вирусу чистокровный крупный рогатый скот герефордской породы. PC-вирус часто участвует в смешанных респираторных инфекциях с другими вирусами и бактериями.
Характеристика возбудителя. Вирус относится к семейству Paramyxoviridae, подсемейству Pneumovirinae, роду Pneumovirus. Вирионы вируса состоят из нуклеокапсида спиральной симметрии и липопротеидной оболочки, содержащей липиды и полисахариды. Вирус имеет единую односпиральную линейную минус-РНК. По размеру и форме вирионы неоднородны, однако многие из них имеют округлую форму.
Устойчивость к физико-химическим воздействиям. Вирус очень нестоек в окружающей среде. Он высокочувствителен к эфиру, хлороформу, дезоксихолату, трипсину, низким значениям pH (pH 3,0) и к замораживанию. При 4 °С он сохраняет активность в течение 7 дней, при минус 70 °С — до 2 мес. Инактивация его наступает при 56 °С за 30 мин. В лиофилизированном виде вирус сохраняет активность до одного года.
Антигенная структура. Изучена недостаточно. Установлено, что вирус не содержит нейраминидазы. Показано, что гликопротеид и F-белок имеют решающее значение для формирования защитного иммунитета.
Антигенная вариабельность. Вирус в иммунологическом отношении однороден. Штаммы PC-вируса крупного рогатого скота родственны человеческим штаммам этого вируса.
Антигенная активность. Вирус вызывает образование вируснейтрализующих, комплементсвязывающих и преципитирующих антител. Отмечена линейная корреляция между титрами комплементсвязывающих и нейтрализующих антител. PC-инфекция может развиваться на фоне циркулирующих антител. Показано, что антитела играют защитную роль при наличии их в титрах не ниже 1 : 128 в сыворотке крови.
Культивирование вируса. PC-вирус культивируется в первичных культурах клеток почки, тестикул, легких и селезенки крупного рогатого скота. При первичном выделении из патологического материала его удается выделить на третьем-четвертом пассажах, в которых на 3—7-й дни проявляются выраженные цитопатические изменения: очаги зернистых сморщенных клеток, синцитии, в большинстве которых имеются ацидофильные цитоплазматические включения. Вирус также культивируется в перевиваемых линиях клеток, полученных из слизистой оболочки носа, легких, почек (Таурус-1) крупного рогатого скота и клеток Vero. Куриные эмбрионы к PC-вирусу нечувствительны.
Гемагглютинирующие свойства. У вируса они не установлены.
Экспериментальная инфекция. Ее можно вызвать при итраназальном и интратрахеальном заражении месячных телят, у которых на 5-й день появляются характерные признаки болезни. У зараженных животных с третьего дня РИФ выявляли вирусный антиген в эпителиальных клетках носовой полости, трахеи, бронхов, бронхиол и альвеолярных макрофагах. Кроме того, выделяли вирус из слизистых носа, бронхов и легких. Удавалось воспроизвести экспериментальную инфекцию на ягнятах, обезьянах, хорьках, норках и морских свинках.
Клинические признаки. Вспышки болезни чаще наблюдают в переходные осенне-зимние и зимне-весенние периоды с охватом большого поголовья животных.
Симптомы болезни обычно проявляются слабо и могут быть незамеченными. Проявление клинических признаков болезни зависит от многих предрасполагающих и осложняющих факторов: условий содержания и кормления животных, их физиологического состояния, вирулентности и дозы вируса, присутствия других инфекционных агентов и др.
Болезнь обычно сопровождается повышением температуры тела до 41 °С, затрудненным дыханием, кашлем, слюноотделением, серозными истечениями из носа и развитием бронхопневмонии разной тяжести. Отмечено, что PC-вирус может вызвать аборт. У молодняка болезнь обычно продолжается не более 3—5, а у взрослых животных — 8—10 дней. Прогноз болезни, как правило, благоприятный, если нет бактериальных осложнений и созданы оптимальные условия содержания животных.
Патологоанатомические изменения. При вскрытии вынужденно убитых животных обнаруживают признаки эмфиземы легких и пневмонии, увеличение бронхиальных лимфатических узлов. При гистологическом исследовании в эпителии альвеол и бронхиол выявляют многоядерные, гигантские клетки.
Локализация вируса. Изучена недостаточно. PC-вирус в течение первой недели после заражения выделяли из носовых и конъюнктивальных смывов. Нередко его изолируют от новорожденных телят. Возможно длительное вирусоносительство.
Из организма больных животных вирус выделяется с носовым экссудатом и выдыхаемым воздухом.
Источник инфекции — больные животные. Инфекция передается воздушно-капельным путем. Считают, что естественная внутриутробная инфекция поддерживает циркуляцию в стаде РС-вируса.
Диагностика. Диагноз на PC-инфекцию ставят на основании эпизоотологических, клинических патологоанатомических данных и лабораторных исследований.
Взятие и подготовка материала. Они идентичны таковым при аденовирусной инфекции. Следует отметить, что PC-вирус очень нестоек, поэтому лучшие результаты выделения вируса получают, проводя заражение культур клеток как можно быстрее после взятия материала и избегая его замораживания до исследования.
Лабораторная диагностика. Диагностику PC-инфекции проводят с использованием набора диагностикума, выпускаемого биопромышленностью. Ее проводят параллельно с исследованием материала на парагрипп-3, аденовирусную инфекцию, инфекционный ринотрахеит и вирусную диарею.
Индикация вируса. В патологическом материале ее проводят путем обнаружения вирусного антигена в мазках, отпечатках из органов или в клетках, полученных после центрифугирования смывов, в РИФ.
Изоляцию вируса патологического материала выполняют в первичной культуре клеток ТБ, ПЭК, ЛЭК или в перевиваемых культурах клеток Таурус 1, ПЛЭК и др. Проводят не менее трех пассажей.
Идентификацию выделенного вируса проводят в PH, РИФ, редко в РДП, РСК.
Обнаруживают антитела в сыворотке крови больных и переболевших животных (ретроспективная диагностика) в РИГА, ИФА, PH, РДП.
Дифференциальный диагноз. Следует исключить парагрипп-3, вирусную диарею, инфекционный ринотрахеит, аденовирусную инфекцию, хламидиоз, так как эпизоотологические, клинические и патологоанатомические данные очень сходны с РС-инфекцией. Необходимо учитывать вероятность смешанного течения этих инфекций.
Иммунитет и специфическая профилактика. Иммунитет при PC-инфекции изучен недостаточно. У крупного рогатого скота, перенесшего болезнь, вырабатываются антитела, однако уровень гуморальных антител не может быть надежным критерием оценки напряженности иммунитета. Для PC-инфекции характерны повторные заболевания даже при наличии в крови антител, что свидетельствует о второстепенной роли сывороточных антител в иммунитете. Важное значение в иммунитете, вероятно, принадлежит секреторным антителам слизистой оболочки респираторного тракта и клеточным факторам.
Материнские антитела слабо предохраняют потомство от инфекции, но частота и тяжесть болезни обратно пропорциональны уровню специфических материнских антител.
В нашей стране вакцины против этой инфекции не разработаны. В зарубежных странах применяют живые вакцины.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
В.А.Мищенко, В.В. Думова ФГУ "Федеральный центр охраны здоровья животных"
Черных О.Ю. Государственное управление ветеринарии Краснодарского края
Введение. Заболевания органов дыхания у крупного рогатого скота являются одной из основных причин экономического ущерба в животноводстве. У молодняка респираторные болезни превалируют над всеми другими патологиями. В отдельных хозяйствах гибель молодняка в совокупности с вынужденным убоем достигает 40 - 55%, а привесы, т.е. окупаемость корма у больных и переболевших животных, снижаются в 2 - 3 раза. Указанная патология приводит к снижению экономической эффективности отрасли на 20 - 30% .
Как правило, первые признаки респираторной патологии появляются через 5-10 дней после технологической перегруппировки и перевода телят из родильного отделения в профилакторий. В ряде случаев массовой вспышке респираторного заболевания предшествовало чрезмерное переохлаждение или содержание животных на сквозняке, в помещениях с большой влажностью и загазованностью.
Результаты многочисленных исследований, проведённых в ФГУ "ВНИИЗЖ", свидетельствуют о том, что респираторные заболевания молодняка чаще всего протекают по типу смешанных инфекций. Установлено, что основную роль в возникновении первичных респираторных патологий играют вирусы парагриппа-3, инфекционного ринотрахеита, вирусной диареи, респираторно-синцитиальной инфекции и коронавирус [1,5,6,8,9]. Нормальная (условно-патогенная) микрофлора верхних дыхательных путей клинически здорового КРС (Mannheimia haemolytica, Pasteurella multocida тип А и Д, Actinomyces pyogenes, Haemophilus somnus и Mycoplasma bovis) способствует развитию вторичных инфекций после репликации вирусов [8]. По данным большинства исследователей массовые респираторные болезни регистрируют в основном у 1-6-месячного молодняка КРС [3,4,5].
В системе мер борьбы и профилактики респираторной патологии молодняка КРС профилактическая вакцинация занимает одно из ведущих мест, т.к. она является основным регулятором эпизоотического процесса, создаёт иммунитет в популяции восприимчивых животных. В ФГУ "ВНИИЗЖ" разработана технология изготовления и организовано промышленное производство эмульсионных инактивированных вакцин против ПГ-3 и ИРТ, ПГ- 3, ИРТ и коронавирусной инфекции; ПГ-3, ИРТ и ВД. Применение указанных препаратов позволило снизить заболеваемость молодняка КРС на 30 - 50%, а выбытие на 15 - 25% [2,6,8,9].
В доступной литературе имеются только отдельные и ограниченные сообщения зарубежных исследователей об эмерджентных вспышках респираторных болезней у взрослого КРС [3]. В последнее время на территории РФ были зарегистрированы вспышки массовых респираторных заболеваний взрослого КРС. А.М.Смирнов (2008) описал острое массовое респираторное заболевание взрослого КРС, приведшее к вынужденному убою и гибели 108 животных [7]. Заболевание местного скота возникло после смешивания с племенными нетелями, завезенными из Канады. Среди завезенных животных заболевание не было отмечено. В пробах патологического материала от взрослого КРС были выявлены вирус респираторно-синцитиальной инфекции (РСВИ), манхеймии, пастереллы и микоплазмы. По мнению автора, занос возбудителя РСВИ произошел с импортированными нетелями, привитыми в стране-поставщике живой вирус-вакциной против указанной инфекции.
В данной статье обобщены результаты изучения этиопатогенеза, клинические и патологоанатомические изменения у взрослого КРС при массовых респираторных заболеваниях. При эпизоотологическом обследовании животноводческих ферм проводился клинический осмотр животных, анализ патологоанатомических изменений, учитывались данные лабораторных исследований патологического материала и сыворотки крови, проведенные различными учреждениями на коммерческой основе.
Результаты исследований и их обсуждение. На первом этапе было проведено эпизоотологическое обследование 22 неблагополучных по респираторным заболеваниям взрослого КРС животноводческих хозяйств. Патологию органов дыхания зарегистрировали у нетелей, новотельных первотёлок и новотельных коров на 7, 7 и 8 фермах, соответственно. У взрослого крупного рогатого скота в обследованных хозяйствах респираторные заболевания проявлялись в основном в острой форме.
При анализе анамнестических данных из обследованных хозяйств было установлено, что вспышке респираторного заболевания предшествовало воздействие на животных ряда абиогенных факторов, в т.ч. длительная перевозка, перегруппировка, нарушение микроклимата, переохлаждение, сквозняки, загазованность, смешивание с животными другого происхождения, отёлы. У коров, как правило, заболевания органов дыхания регистрировали непосредственно после отёла. В отличие от молодняка у взрослого КРС заболевания органов дыхания возникали внезапно (эмерджентно), в острой или сверхострой формах, в случаях непринятия адекватных лечебных мер отмечали неблагоприятный исход.
При клиническом осмотре животных, находящихся в неблагополучных по респираторным заболеваниям родильных отделениях, было отмечено затрудненное дыхание брюшного типа, повышение температуры, угнетение, кашель, обильное слюнотечение, слабость, слизисто-гнойные истечения из носовых отверстий, отказ от корма и атония преджелудков. У большинства отелившихся коров были выражены клинические признаки нарушения обмена веществ.
При вскрытии трупов павших и туш вынужденно убитых новотельных коров отмечали резко выраженную гиперемию слизистых оболочек носовой полости, гортани, трахеи. Просвет гортани и трахеи был закрыт вспененной слизью с примесью фибринозных плёнок и крови.
У всех животных было отмечены двусторонние изменения в легких с поражением почти всех передних, средних и добавочных долей. Бронхиальные и средостенные лимфатические узлы гиперемированы и гиперплазированы, серо-розового цвета. Выражены обширные пораженные участки легких тёмно-красного или желто-красного цвета, плотной консистенции. При надавливании с поверхности разреза, главным образом из бронхиол и мелких бронхов, выделялся экссудат. Поражения легких чаще всего проявлялись в виде обширной острой или подострой лобарной серозно-катаральной или катарально-гнойной бронхопневмониии с очагами крупозной пневмонии, в основном в стадии красной гепатизации. Отмечали отёки интерстициальной соединительной ткани, обильные участки компенсаторной эмфиземы и очаги ателектаза. В отдельных случаях в грудной полости были отмечены фибринозный плеврит и большое количество экссудата, а также очаги некроза.
В большинстве проб сыворотки крови была выявлена гипогам-маглобулинемия, что свидетельствует об иммунодефицитном состоянии животных в околотельный период. В обследованные родильные отделения поступали глубокостельные животные с разным иммунобиологическим статусом. У животных из обследованных хозяйств были обнаружены наряду с поствакцинными (по анамнестическим данным) и постинфекционные антитела.
В ряде хозяйств заболевание было зарегистрировано только у коров одного происхождения, тогда как животные другого происхождения оставались здоровыми. При исследовании парных сывороток крови было выявлено четырехкратное увеличение титров антител к коронавирусу и вирусу ПГ - 3 в пробах из 19 хозяйств, к возбудителям РСВИ и ИРТ - из 4, к вирусу ВД - из 5 хозяйств. Вероятно, это связано с тем, что обычно в хозяйства поступали животные, вакцинированные против ИРТ, ВД и РСВИ. В пробах патологического материала были выявлены геномы указанных вирусов. Характеристика инфекционного процесса вирусной этиологии в обследованных хозяйствах представлена в табл.1.
Таблица 1. Результаты изучения этиологии респираторных заболеваний взрослого крупного рогатого скота
Читайте также:


