Туберкулез и микобактериальная инфекция
Аннотация научной статьи по клинической медицине, автор научной работы — Полякова Анастасия Александровна, Никольская Марина Викторовна
Изучены клинические особенности туберкулезной инфекции у ВИЧ-инфицированных с летальным исходом на территории Пензенской области в 2014-2017 гг. Выяснено, что в структуре микобактериальной инфекции преобладали генерализованные формы; туберкулез органов дыхания чаще протекал в диссеминированной форме.
Похожие темы научных работ по клинической медицине , автор научной работы — Полякова Анастасия Александровна, Никольская Марина Викторовна
МЕДИЦИНА И ЗДРАВООХРАНЕНИЕ
А. А. Полякова, М. В. Никольская
СТРУКТУРА МИКОБАКТЕРИАЛЬНОЙ ИНФЕКЦИИ У ВИЧ-ИНФИЦИРОВАННЫХ
Аннотация. Изучены клинические особенности туберкулезной инфекции у ВИЧ-инфицированных с летальным исходом на территории Пензенской области в 2014-2017 гг. Выяснено, что в структуре микобак-териальной инфекции преобладали генерализованные формы; туберкулез органов дыхания чаще протекал в диссеминированной форме.
Ключевые слова: ВИЧ-инфекция, коморбидные состояния, генерализованный туберкулез, туберкулез легких.
Анализ причин летальных исходов ВИЧ-ифицированных актуален не только для клиницистов, но и для работников органов здравоохранения, так как уровень летальности
на поздних стадиях отражает уровень организации оказания медицинской помощи этим больным [5]. Поэтому одной из важнейших задач всемирного здравоохранения является предотвращение распространения сочетанной инфекции ВИЧ и туберкулеза [7—9].
Цель: изучить клинические особенности заболеваний, вызванных микобактерия-ми, у ВИЧ-инфицированных пациентов с летальным исходом.
Материалы и методы
В исследование включено 92 пациента с коморбидными состояниями - ВИЧ-инфекцией и туберкулезом, умерших в 2014-2017 гг. Проведен ретроспективный анализ и обработка данных амбулаторных карт и протоколов патологоанатомического вскрытия. Выполненная работа не нарушала правил конфиденциальности в отношении больных ВИЧ-инфекцией. Проанализированы пол, возраст, социальное положение больных, клинические проявления микобактериальной инфекции при наступлении летального исхода. Статистический анализ и обработка полученных данных проведена с помощью стандартной программы Statistica 10.
Результаты и обсуждение
За период 2014 по 2017 г. на территории Пензенской области умерло 338 больных с лабораторно подтвержденной ВИЧ-инфекцией, у 92 пациентов (27,2 %) наблюдалось сочетание ВИЧ-инфекции с туберкулезом (рис. 1).
■ВИЧ-инфекция без туберкулеза ВИЧ-инфекция и туберкулез Рис. 1. Причины летальных исходов при ВИЧ-инфекции
Среди умерших от коморбидных состояний преобладали мужчины - 78 человек (84,8 %), женщин было 14 (15,2 %). В возрастной структуре умерших преобладали лица наиболее трудоспособного, репродуктивного и социально активного возраста: средний возраст пациентов составил 38,2 ± 5,4 года. Несмотря на трудоспособный возраст, большинство умерших -74 человека (80,4 %) - не имели работы, 18 человек (19,6 %) были трудоустроены. Летальность ВИЧ-инфицированных с коморбидными состояниями почти в три раза выше у городских жителей - 68 случаев (73,9 %), чем у жителей сел - 24 случая (26,1 %).
Пациенты были разделены на две группы: первая группа - больные с ВИЧ-инфекцией и генерализованным туберкулезом, вторая группа - ВИЧ-инфицированные с сопутствующим туберкулезом легких. Первая группа ВИЧ-инфицированных включала 58 пациентов, из них 44 человека - 75,9 % (подгруппа 1А) - скончались в результате генерализованной микобактериальной инфекции без поражения центральной нервной системы (ЦНС); у 14 (24,1 %) больных (подгруппа 1Б) генерализованный туберкулезный процесс сочетался с поражением ЦНС (рис. 2.).
"0,00 0 о 60.00% 50,00 0 О 40,00 Я о 30,00 о о 20,00 о о 10,00 о о
Генерализованная микобактериальная инфекция без поражения ЦНС
Генерализованная микобактериальная инфекция с поражением ЦНС
Рис. 2. Структура генерализованной микобактериальной инфекции
В подгруппе 1А чаще всего встречалась микобактериальная инфекция без сопутствующих заболеваний - 30 случаев (51,7 %), сочетание с пневмоцистной пневмонией было выявлено у пяти (8,6 %) больных, с генерализованным кандидозом - у четырех (7 %) человек, с сепсисом - у двух (3,5 %) пациентов; сочетание генерализованного туберкулеза с раком легкого, абсцессом поджелудочной железы, генерализованной цито-мегаловирусной инфекцией выявлены у одного (1,7 %) больного. В подгруппе 1Б у ВИЧ-инфицированных больных с генерализованной микобактериальной инфекцией наблюдалось поражение ЦНС в виде менингоэнцефалита - 10 случаев (17,2 %) и токсоплазмоза головного мозга - четыре случая (6,8 %).
Вторая группа ВИЧ-инфицированных включала 34 пациента, из них у 31 человека (91,2 %) туберкулез легких не сочетался с поражением ЦНС (подгруппа 2А), у трех (8,8 %) больных выявлено вовлечение в патологический процесс головного мозга (подгруппа 2Б) (рис. 3).
"0,00 0 о 60,00 0 о
50,00 0 о 40,00° о 30.00 О 20.00 о о 10.00 % 0.00 Чо
Туберкулез легких Туберкулез легких без поражения ЦНС с поражением ЦНС
Рис. 3. Сочетание туберкулеза легких и поражения ЦНС у ВИЧ-инфицированных
В подгруппе 2А изолированный туберкулез легких встречался наиболее часто -у 27 больных (79,42 %), но были и сочетания туберкулеза легких с саркомой Капоши и с бактериальной пневмонией - по два случая (по 5,88 % соответственно). В подгруппе 2Б поражение ЦНС наблюдалось у трех пациентов в виде энцефалопатии, гнойного менинго-энцефалита и абсцесса головного мозга неуточненной этиологии (по 2,94 %). Во второй группе больных диссеминированный туберкулез легких выявлен у 17 (50 %) пациентов, инфильтративная форма туберкулеза - у пяти (14,7 %) человек, фиброзно-кавернозная форма - у 12 (35,3 %) больных (рис. 4).
Диссеминированная Фиброзно-кавернозная Инфильтративная форма форма форма
Рис. 4. Структура туберкулеза легких у ВИЧ-инфицированных
Таким образом, микобактериальная инфекция является одной из ведущих причин летальных исходов при ВИЧ-инфекции - 27,2 % случаев. В структуре микобактериоза преобладают генерализованныеформы - 63 %, в том числе у 24,1 % больных отмечалось поражение центральной нервной системы. Туберкулез легких как сопутствующее заболевание выявлен у 37 % пациентов; в структуре преобладал диссеминированный туберкулез легких (50 %).
3. Азовцева, О. В. Летальные исходы у больных с ВИЧ-инфекцией, параллели с адекватностью диагностики, диспансеризации и лечения / О. В. Азовцева, Т. С. Трофимова, Г. С. Архипов, О. В. Огурцова, А. М. Пантелеев, Н. А. Беляков // ВИЧ-инфекция и иммуносупрессии. - 2018. -Т. 10, № 3. - С. 90-101.
4. Степанова, Е. В. Герпесвирусные заболевания и ВИЧ-инфекция : учеб.-метод. пособие для врачей / Е. В. Степанова. - СПб. : Балтийский мед. образовательный центр, 2009. - 60 с.
5. Азонцева, О. В. Анализ основных причин летальных исходов у ВИЧ-инфицированных больных / О. В. Азонцева, Т. Е. Богачёва, В. Р. Вебер, Г. С. Архипов // ВИЧ-инфекция и иммуносу-прессия. - 2018. - Т. 10, № 1. - С. 84-91.
6. Нефедов, В. П. Случай генерализованного милиарного туберкулеза у ВИЧ-инфицированного больного / В. П. Нефедов, Р. Ш. Валиев, Н. А. Цибулькин, Д. Э. Циплаков / / Казанский медицинский журнал. - 2016. - Т. 87, № 5. - С. 377-379.
8. Федеральные клинические рекомендации по диагностике и лечению туберкулеза у больных ВИЧ-инфекцией. - М. ; Тверь : Триада, 2014. - 56 с.
9. Фролова, О. П. Состояние контингента больных туберкулезом, сочетанным с ВИЧ-инфекцией, в Российской Федерации, межсекторальное и межведомственное взаимодействие при организации противотуберкулезной помощи больным ВИЧ-инфекцией / И. В. Щукина, О. А. Новоселова, М. В. Волик, В. А. Стаханов, А. Б. Казенный // Туберкулез и болезни легких. - 2014. -№ 4. - С. 26-31.
Полякова Анастасия Александровна, студентка, Пензенский государственный университет. E-mail: libra0800@mail.ru
Никольская Марина Викторовна, кандидат медицинских наук, доцент, кафедра микробиологии, эпидемиологии и инфекционных болезней, Медицинский институт, Пензенский государственный университет. E-mail: missmarina1956@yandex.ru
Полякова, А. А. Структура микобактериальной инфекции у ВИЧ-инфицированных / А. А. Полякова, М. В. Никольская // Вестник Пензенского государственного университета. - 2018. - № 4 (24). - С. 47-51.
Полный текст:
Представлены материалы изучения особенностей социального статуса, клинико-рентгенологических, микробиологических и иммунологических проявлений туберкулеза органов дыхания, сочетанного с микобактериозом, у 26 больных на поздних стадиях ВИЧ-инфекции при количестве СD4+ лимфоцитов менее 30 клеток/мкл крови в отсутствие антиретровирусной терапии, выделяющих микобактерии туберкулеза и нетуберкулезные микобактерии. Видовая принадлежность нетуберкулезных микобактерий устанавливалась путем молекулярно-генетической идентификации. M. avium complex были выявлены у 84,6% пациентов, M. kansasii — у 7,7%, M. fortuitum — у 3,8±% и M. xenopi — у 3,8%. Заболевание проявлялось через 6–9 лет после диагностики ВИЧ-инфекции, протекало с выраженным синдромом интоксикации, бронхолегочными и внелегочными проявлениями, сочеталось с другими оппортунистическими инфекциями. Методами лучевой диагностики выявляли синдром диссеминации с преимущественной локализацией в средних и нижних отделах легких, наличие мелких инфильтратов с полостями распада легочной ткани и поражение междолевой и висцеральной плевры.
3. ВИЧ-инфекция и СПИД / Под ред. В.В.Покровского. 4-е изд., перераб. и доп. М.: ГЕОТАР-Медиа. 2019. 156 с. [HIV infection and AIDS. Ed. by V.V. Pokrovsky. 4th ed., revised and amended. Moscow, GEOTAR-Media, 2019, 156 p. (In Russ.)].
4. Михайловский А.М., Чуркин С.А., Пашкова Н.А., Лепеха Л.Н. Частота выявления и особенности морфологии нетуберкулезного микобактериоза у больных на поздней стадии ВИЧ-инфекции (по данным Оренбургской области) // Туберкулез и болезни легких. 2016. Т. 94, №12. С. 57–61. [Mikhailovsky A.M., Churkin S.A., Pashkova N.A., Lepekha L.N. The detection rate and morphology of nontuberculous mycobacteriosis in patients with advanced HIV infection (according Orenburg region). Tuberculosis and Lung Diseases, 2016, Vol. 94, No. 12, pp. 57–61 (In Russ.)].
5. Мишин В.Ю. Туберкулез и другие микобактериальные инфекции // Пульмонология: Национальное руководство. 3-е изд., перераб. и доп. / Под ред. А.Г.Чучалина. Глава 9. С. 226–235. М.: ГЕОТАР-Медиа, 2018. 800 с. [Mishin V.Yu. Tuberculosis and other mycobacterial infections. In: Pulmonology: National leadership. 3rd ed., revised and amended. A.G.Chuchalina. Chapter 9. P. 226–235. Moscow: GEOTAR-Media, 2018, 800 p. (In Russ.)].
6. Мишин В.Ю., Мишина А.В., Эргешов А.Э., Романов В.В., Собкин А.Л. Диспансерное наблюдение и медицинская реабилитация больных туберкулезом, сочетанным с ВИЧ-инфекцией // ВИЧ инфекция и иммуносупрессии. 2018. Т. 10, № 3. С. 81–90. [Mishin V.Yu., Mishina A.V., Ergeshov A.E., Romanov V.V., Sobkin A.L. Dispensary follow-up and medical rehabilitation of TB patients with HIV co-infection. HIV Infection and Immunosuppressive Disorders, 2018, Vol. 10, No. 3, pp. 81–90 (In Russ.)].
7. Бартлетт Дж., Галлант Д., Фам П. Клинические аспекты ВИЧ-инфекции / Пер. с англ. М.: Р.Валент, 2012. 528 с. [Bartlett J., Gallant D., Pham P. Clinical aspects of HIV infection. Transl. from English. Moscow: R. Valent, 2012, 528 p. (In Russ.)].
8. Tortoli E. Microbiological features and clinical relevance of new species of the genus mycobacterium. Clin. Microbiol. Rev., 2014, Vol. 27, No. 4, pp. 727–752.
9. ТБ/ВИЧ в Российской Федерации. Эпидемиология, особенности клинических проявлений и результаты лечения. М.: РИО ЦНИИ организации и информатизации здравоохранения, 2018. 67 с. [TB/HIV in the Russian Federation. Epidemiology, features of clinical manifestations and results of treatment. Moscow: RIO Central research Institute of health organization and Informatization, 2018, 67 р. (In Russ.)].
10. Шульгина М.В., Нарвская О.В., Мокроусов И.В., Васильева И.А. Патогенные и условно-патогенные микобактерии. М.: НЬЮ-ТЕРРА, 2018. 104 с. [Shulgina M.V., Narvskaya O.V., Mokrousov I.V., Vasilyeva I.A. Pathogenic and conditionally pathogenic mycobacteria. Moscow: NEW-TERRA, 2018, 104 p. (In Russ.)].
11. Эргешов А.Э., Шмелев Е.И., Ковалевская М.Н., Карпина Н.Л., Ларионова Е.Е., Черноусова Л.Н. Микобактериозы в практике врачей пульмонологов и фтизиатров // Туберкулез и болезни легких. 2016. Т. 94, № 9. С. 39–43. [Ergeshov A.E., Shmelev E.I., Kovalevskaya M.N., Karpina N.L., Larionova E.E., Chernousova L.N. Mycobacteriosis in the practice of the physicians of chest diseases and tuberculosis. Tuberculosis and Lung Diseases, 2016, Vol. 94, No. 9, pp. 39–43 (In Russ.)].
12. Daley C.L., Griffith D.E. 36 nontuberculous mycobacterial infections. In: Murray and Nadel’s. Textbook of Respiratory Medicine, 6ed. Elsevier Inc., 2016, pp. 629–645.
13. Зюзя Ю.Р., Пархоменко Ю.Г., Зимина В.Н., Альварес Фигероа М.В. Морфологическая верификация ВИЧ-ассоциированного микобактериоза, вызванного нетуберкулезными микобактериями M. аvium complex // Клиническая и экспериментальная морфология. 2015. Т. 3, № 15. С. 11–21. [Zyuzya Yu.R., Parkhomenko Yu.G., Zimina V.N., Alvarez Figueroa M.V. Morphological verification of HIV-associated mycobacteriosis caused by non-tuberculosis mycobacteria M. avium complex. Clinical and Experimental Morphology, 2015, Vol. 3, No. 15, pp. 11–21 (In Russ.)].
14. Мишин В.Ю., Эргешов А.Э., Мишина А.В. Диагностика и дифференциальная диагностика диссеминированных поражений легких у больных с ВИЧ-инфекцией (обзор) // Consilium Medicum. 2018. Т. 20, № 3. С. 8–13. [Mishin V.Yu., Ergeshov A.E., Mishina A.V. Diagnosis and differential diagnosis of disseminated lung lesions in patients with HIV infection (review). Consilium Medicum, 2018, Vol. 20, No. 3, pp. 8–13 (In Russ.)].
15. Пантелеев А.М., Драчева М.С., Никулина О.В., Соколова О.С., Зонова А.В. Клинико-лабораторные особенности микобактериоза у больных ВИЧ-инфекцией // Журнал инфектологии. 2016. Т. 8, № 3. С. 40–45. [Panteleev A.M., Dracheva M.S., Nikulina O.V., Sokolova O.S., Zonova A.V. Clinical and laboratory features of mycobacteriosis in patients with HIV infection. Journal of Infectology, 2016, Vol. 8, No. 3, pp. 40–45 (In Russ.)].
16. Пантелеев А.М., Никулина О.В., Христусев А.С., Драчева М.С., Соколова О.С., Зонова А.В. Дифференциальная диагностика туберкулеза и микобактериоза у больных ВИЧ-инфекцией // Туберкулез и болезни легких. 2017. Т. 95, № 10. С. 48–52. [Panteleev A.M., Nikulina O.V., Christusev A.S., Dracheva M.S., Sokolova O.S., Zonova A.V. Differential diagnostics of tuberculosis and mycobacteriosis in patients with HIV infection. Tuberculosis and Lung Diseases, 2017, Vol. 95, No. 10, pp. 48–52 (In Russ.)].
17. Henkle E., Winthrop K.L., Nontuberculous mycobacteria infections in immunosuppressed hosts. Clin. Chest. Med., 2015, Vol. 36, No. 1, pp. 91–99.
18. British Thoracic Society (BTS) for guidelines for the management of non-tuberculous micobacterial pulmonary disease (NTM-PD). Thorax. 2017. URL: DOI:10.1136/thoraxjni-2017–210927.
19. Griffith D.E., Aksamit T., Brown-Elliott B.A., Catanzaro A., Daley C., Gordin F., Holland S.M., Horsburgh R., Huitt G., Iademarco M.F., Iseman M., Olivier K., Ruoss S., von Reyn C.F., Wallace R.J.Jr., Winthrop K. ATS Mycobacterial Diseases Subcommittee, American Thoracic Society, Infectious Disease Society of America. 2007. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care Med., No. 175, pp. 367–416. URL: DOI:10.1164/rccm.200604-571ST.
20. Hedjazi A., Hosseini M., Hoseinzadeh A. Lymph node co-infection of mycobacterium avium complex and cytomegalovirus in an acquired immunodeficiency syndrome patient. Infect. Dis. Rep., 2013, Vol. 22, Vol. 5, No. 1, pp. e2. URL: DOI:10.4081/idr.2013.e2.
21. Федеральные клинические рекомендации по диагностике и лечению туберкулеза у больных ВИЧ-инфекцией. М.; Тверь: Триада, 2014, 56 с. [Federal clinical guidelines for the diagnosis and treatment of tuberculosis in patients with HIV infection. Moscow; Tver: Triada, 2014, 56 p. (In Russ.)].

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Микобактерии различаются поверхностными липидами, обусловливающими их кислотоустойчивость. Существует более 30 представителей рода Mycobacterium, большинство из них непатогенно для человека. М. tuberculosis и тесно связанная с ней М. bovis вызывают туберкулез (Т), М. leprae — лепру; М. отит и другие атипичные микобактерии вызывают редко встречающиеся у человека заболевания.
В США в 1991 г. всего было зафиксировано 26 283 случая туберкулеза. Динамика заболеваемости имела тенденцию к снижению, но затем изменила свой характер — в последующие 5 лет число случаев возросло на 15 %. В США туберкулез становится болезнью пожилых горожан с низким уровнем жизни, представителей национальных меньшинств, иммигрантов из стран, где туберкулез эндемичен, больных ВИЧ-инфекцией. По всему земному шару зарегистрировано 30 млн. случаев активного туберкулеза и ежегодно 10 млн. новых случаев. Примерно 3 млн. больных туберкулезом умирают каждый год. М. tuberculosis передается от человека к человеку через дыхательные пути. Контагиозность коррелирует с числом микробов в выделяемой мокроте, длительностью легочного процесса и выраженностью кашля.
Проникая в легкие в виде капель аэрозоля, микобактерии туберкулеза поглощаются макрофагами и транспортируются в регионарные лимфатические узлы, где их дальнейшее распространение сдерживается. Микобактерии могут также попасть в циркулирующую кровь и диссеминировать. В легких, лимфатических узлах и местах диссеминации очаги поражения подвергаются заживлению под воздействием макрофагов и гистиоцитов и организуются в гранулемы. Микобактерии сохраняют жизнеспособность внутри макрофагов, но дальше не распространяются; их реактивация может произойти позже. В то время, как микобактерии продолжают размножаться внутриклеточно в течение 2-8 нед после контакта с больным, в ослабленном организме развивается клеточная реакция гиперчувствительности, интенсивность которой можно количественно оценить по реакции на туберкулин (кожный тест) — очищенный протеиновый дериват (PPD).
Инфицирование М. tuberculosis не дает симптомов, само заболевание сопровождается четкой клинической картиной. Туберкулез разделяют на: легочный, первичный, реактивированный и внелегочный.
Первичный туберкулез. Эта стадия не имеет симптомов или проявляется неспецифической пневмонией, затрагивающей нижние и средние отделы легких и лим-фаденопатией в области корней легких. Она может прогрессировать в клинически значимое заболевание.
Туберкулезная реактивация. Это хроническая изнурительная болезнь с общими симптомами (похудание, лихорадка, ночная потливость), которые выражены больше, чем симптоматика со стороны дыхательной системы.
Туберкулез легких. Процесс туберкулезной реактивации локализуется в апикальных задних сегментах верхних долей и в верхних сегментах нижних долей легких. Начало заболевания, как правило, незаметное. Симптомы: хронический кашель с одышкой, негнойной мокротой. Кровохарканье отмечается часто, но редко бывает массивным и особенно выражено при образовании каверн.
Внелегочный туберкулез. Выпотпной плеврит. Начало плевральных болей в груди часто внезапное, плевральный выпот, возникающий вследствие переноса мико-бактерий из периферического очага, обычно обилен и односторонний. Такое течение характерно для юных больных на фоне отсутствия туберкулеза легких. В США туберкулезный плеврит отмечается у многих больных старше 35 лет, в уз случаев он сопровождается туберкулезом легких. Выпот экссудативный, с содержанием белка более 30 г/л; среди клеток доминируют лимфоциты, клетки мезотелия редки. У У3 больных туберкулиновая проба отрицательна. Полное извлечение выпота не требуется. В отличие от туберкулезного плеврита бронхоплевральный свищ и туберкулезная эмпиема возникают в результате разрыва легочной ткани, что требует дренирования плевральной полости.
Перикардит. Полость перикарда обычно обсеменяется из инфицированных лимфатических узлов, реже это происходит в результате распространения плеврита. У больного отмечаются лихорадка и перикардиальные боли, может выслушиваться шум трения перикарда. Возможно развитие тампонады сердца. Выпот экссудативный; к поздним осложнением относится хронический констриктивный перикардит.
Перитонит. Брюшная полость обсеменяется гематогенно, лимфогенно или из мочеполовых путей; течение постепенное; выпот носит экссудативный характер.
Ларингит и эндобронхит. Туберкулезный процесс возникает в результате обсеменения слизистой оболочки гортани и бронхиального дерева при выделении инфицированной мокроты. Поражение гортани происходит при выраженном туберкулезе легких. Главный симптом — осиплость; кашель с выделением крови — ведущее проявление туберкулезного бронхита. Оба заболевания высоко контагиозны.
Аденит. Скрофулюс (туберкулезная золотуха) — хроническое туберкулезное воспаление шейных лимфатических узлов, чаще всего в переднем треугольнике шеи, чуть медиальнее ветви нижней челюсти. Узлы эластичны и безболезненны, заболевание развивается постепенно. У детей моложе 5 лет скрофулюс часто вызывается атипичными микобактериями М. scrofulaceum и М. intracellulare.
Мочеполовая система. В процесс может быть вовлечен любой участок мочеполовой системы мужчин и женщин. Туберкулез почки проявляется пиурией и гема-турией на фоне отрицательного бактериального посева. Могут возникать полости в паренхиме почек и стриктура мочеточника. У женщин туберкулезный сальпингит ведет к бесплодию. У мужчин процесс обычно поражает предстательную железу, семенные пузырьки и придатки яичка.
Менингит. Туберкулезный менингит чаще встречается у детей как раннее проявление обсеменения организма при первичном заражении. Менингит проявляется поражением черепных нервов, что связано с распространением инфекции по основанию мозга. В ликворе находят лимфоцитоз, повышение содержания белка и снижение содержания сахара.
Орган зрения. Наиболее часты хореоретинит и увеит. При милиарном туберкулезе на сосудистой оболочке глаза часто выявляют туберкулезные бугорки.
Пищеварительный тракт. При тяжелом кавернозном туберкулезе легких проглоченные микобактерии могут достигать терминальных отделов тонкой и слепой кишки. Проявлением заболевания служат хроническая диарея и образование свищей.
Надпочечники. При длительном течении туберкулеза легких вовлечение в процесс коры надпочечников может сопровождаться снижением их функциональной активности. Обсеменение надпочечников встречается часто, но четкая симптоматика имеется далеко не всегда.
Кожа. Вульгарная волчанка — гранулематозное заболевание кожи, встречается редко.
Милиарный туберкулез. Возникает при гематогенном распространении инфекции и проявляется лихорадкой, часто в сочетании с анемией. Симптоматика обычно предшествует появлению рентгенологических признаков на 4-6 нед. На рентгенограмме выявляют мелкие, однообразные, светлые узелки, рассеянные по поверхности обоих легких. При получении биоптатов трансбронхиально и из печени результаты, как правило, положительны; исследование костного мозга дает положительный результат у 2/3 больных; туберкулиновая проба часто отрицательна.
Туберкулез у больного с ВИЧ-инфекцией. Туберкулез является главной оппортунистической инфекцией у больных с ВИЧ-инфекцией. У больных с туберкулезом в анамнезе, если они заражаются ВИЧ, риск повторного развития туберкулеза составляет 5-10 % в год. Туберкулез развивается у 50 % больных с ВИЧ-инфекцией, если они контактируют с больными туберкулезом, часто это происходит на протяжении месяцев. Внелегочные формы туберкулеза развиваются примерно у ‘/2 больных с ВИЧ-инфекцией и туберкулезом. Туберкулез легких с атипичными рентгенологическими симптомами отмечен у ‘/2 этих больных.
Диагноз ставят при обнаружении кислотоустойчивых бактерий в мокроте, тканях или биологических жидкостях. Целесообразно применять окрашивание флю-оресцентным аурамин-родамином. Первичное выделение культуры может потребовать 4-8 нед. Радиометрические методы позволяют выявить возбудитель через 1-2 нед, но требуется дополнительное время для его идентификации. При исследовании биологических жидкостей (плевральная, перикардиальная, перитоне-альная), где количество микобактерий невелико, именно биопсия повышает вероятность их обнаружения. Для сокращения сроков диагностики применяют новые технологии, такие как полимеразная цепная реакция и жидкостная хроматография. Рентгенография грудной клетки остается важным диагностическим методом.
доктор медицинских наук, заведующий лабораторией молекулярно-клеточных механизмов терапевтических заболеваний,
630089, г. Новосибирск, ул. Б. Богаткова, д. 175/1
1. Васильева И.А., Коноплянников А.Г., Ерохин В.В и др. Лечебный эффект системной трансплантации культивируемых аутогенных мезенхимальных стволовых клеток костного мозга у больных с резистентными формами туберкулеза легких // Клеточная трансплантология и тканевая инженерия. - 2007. - Т. 2, № 1. - С. 77-80.
2. Калинина Н. И., Сысоева В. Ю., Рубина К. А. Мезенхимальные стволовые клетки в процессах роста и репарации тканей // Acta Naturae (русскоязычная версия). - 2011. - Т. 3, № 4 (11). - С. 32-39.
3. Скрягина Е. М., Скрягин А. Е., Исайкина Я. И. и др. Лечение пациентов с множественно-лекарственно-устойчивым туберкулезом с использованием аутологичной трансплантации мезенхимальных стволовых клеток // Рецепт. - 2011. - № 2 (76). - С. 84-93.
4. Das B., Kashino S. S., Pulu I. et al. CD271+ bone marrow mesenchymal stem cells may provide a niche for dormant Mycobacterium tuberculosis // Sci. Transl. Med. - 2013. - Vol. 5. - Issue 170. - Р. ra13.
5. Dumitru C. A., Hemeda H., Jakob M. et al. Stimulation of mesenchymal stromal cells (MSCs) via TLR3 reveals a novel mechanism of autocrine priming // FASEB J. - 2014. - Vol. 28, № 9. - P. 3856-3866.
6. Hawn T. R., Matheson A. I., Maley S. N. et al. Host-directed therapeutics for tuberculosis: can we harness the host? // Microbiol. Mol. Biol. Rev. 2013. - Vol. 77. - P. 608-627.
7. Modlin R. L., Bloom B. R. TB or Not TB: That Is No Longer the Question // Sci. Transl. Med. - 2013. - Vol. 5, Issue 213. - Р. sr6.
8. Raghuvanshia S., Sharmaa P., Singhb S. et al. Mycobacterium tuberculosis evades host immunity by recruiting mesenchymal stem cells // PNAS. - 2010. - Vol. 107, № 50. - P. 21653-21658.
9. Ren G., Chen X., Dong F. et al. Concise review: mesenchymal stem cells and translational medicine: emerging issues // Stem. Cells Transpl. Med. - 2012. - Vol. 1, № 1 - P. 51-58.
10. Romieu-Mourez R., Francois M., Boivin M.-N. et al. Cytokine Modulation of TLR Expression and Activation in Mesenchymal Stromal Cells Leads to a Proinflammatory Phenotype // J. Immunol. - 2009 - Vol. 182. - P. 7963-7973.
11. Salem H. K., Thiemermann C. Mesenchymal stromal cells: current understanding and clinical status // Stem Cells. - 2010. - Vol. 28. - P. 585-596.
12. Sendide K., Deghmane A.-E., Reyrat J.-M. et al. Mycobacterium bovis BCG urease attenuates major histocompatibility complex class II trafficking to the macrophage cell surface // Infect. Immun. - 2004. - Vol. 72, № 7. - P. 4200-4209.
13. Sun J., Deghmane A.-E., Soualhine H. et al. Mycobacterium bovis BCG disrupts the interaction of Rab7 with RILP contributing to inhibition of phagosome maturation // J. Leukoc. Biol. - 2007. - Vol. 82, № 6. - P. 1437-1445.
14. Tropel Ph., Noël D., Platet N. et al. Isolation and characterisation of mesenchymal stem cells from adult mouse bone marrow // Exp. Cell. Research. - 2004. - Vol. 295. - P. 395-406.
15. Waterman R. S., Tomchuck S. L., Henkle S. L. et al. A new mesenchymal stem cell (MSC) paradigm: Polarization into a pro-inflammatory MSC1 or an immunosuppressive MSC2 phenotype // PLoS ONE. - 2010. - Vol. 5, Issue 4. - Р. e10088.
Для цитирования: Шварц Я.Ш., Белогородцев С.Н., Филимонов П.Н., Чередниченко А.Г. Трансплантация аутологичных мезенхимальных стволовых клеток при экспериментальной микобактериальной инфекции: влияние условий кондиционирования. Туберкулез и болезни легких. 2015;(12):31-36.
For citation: Shvarts Y.S., Belogorodtsev S.N., Filimonov P.N., Cherednichenko A.G. TRANSPLANTATION OF AUTOLOGOUS MESENCHYMAL STEM CELLS IN THE EXPERIMENTAL MYCOBACTERIAL INFECTION: IMPACT OF CONDITIONING. Tuberculosis and Lung Diseases. 2015;(12):31-36. (In Russ.)
- Обратные ссылки не определены.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
№ 741 - 742
25 сентября - 8 октября 2017
Понравилась статья? Поделитесь с друзьями:
Эпидемическая ситуация по туберкулезу среди лиц с ВИЧ-инфекцией в Российской Федерации
Последние годы отмечается существенный рост распространения сочетания туберкулеза и ВИЧ-инфекции[2]. Прогрессирование ВИЧ-инфекции нередко приводит к развитию туберкулеза среди лиц, ранее инфицированных микобактериями туберкулеза (МВТ).
Цель исследования: определить влияние ВИЧ-инфекции на развитие эпидемического процесса при туберкулезе в России.
Материалы и методы
Результаты исследования
Растет показатель заболеваемости туберкулезом при сочетании с ВИЧ-инфекцией среди постоянного населения России: 2009 г. - 4,4; 2014 г. - 7,4; 2015 г. - 8,2 на 100 тыс. населения. Среди постоянных жителей, вставших на учет в 2015 г., 17,3% пациентов с туберкулезом были ВИЧ-позитивными (2009 г. - 6,5%; 2014 г. - 15,1%).
Заболеваемость туберкулезом среди пациентов с ВИЧ-инфекцией (постоянное население, 2015 г.) составила 2043,1 на 100 тыс. (рис. 1), что в 43,5 раза больше, чем в среднем среди населения России (47,0 на 100 тыс.).
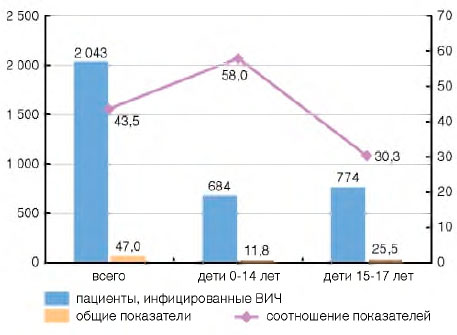
Рисунок 1. Заболеваемость туберкулезом постоянного населения Российской Федерации в 2015 г. (на 100 тыс. населения): всего и пациентов, инфицированных ВИЧ
В 2014 г. наступил перекрест показателей заболеваемости туберкулезом и ВИЧ-инфекцией среди всего населения страны (рис. 2). Впервые больных ВИЧ-инфекцией стало выявляться больше, чем пациентов с впервые зарегистрированным туберкулезом.
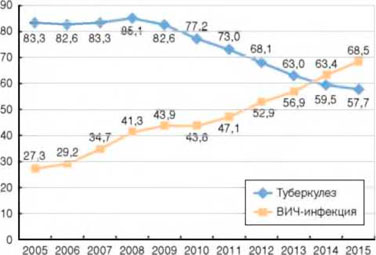
Рисунок 2. Заболеваемость туберкулезом и ВИЧ-инфекцией (на 100 тыс. населения)
Показатель смертности от туберкулеза в 2015 г. по сравнению с 2005 г., когда отмечался пик показателя, снизился в 2,5 раза (с 22,6 до 9,2 на 100 тыс.). При этом в 2015 г. отмечался рост показателя смертности от туберкулеза в Дальневосточном ФО на 2,4% (с 16,7, до 17,1 на 100 тыс.), где ВИЧ-инфекция влияет на эпидемический процесс при туберкулезе в наименьшей степени, и еще в 12 субъектах России.
Впервые в 2015 г. смертность от ВИЧ-инфекции превысила показатель смертности от туберкулеза (рис. 3).
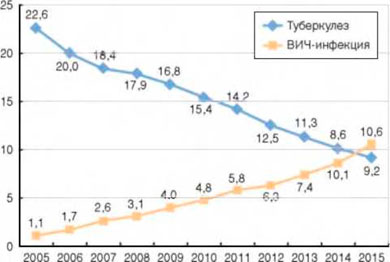
Рисунок 3. Смертность от туберкулеза и ВИЧ-инфекции (на 100 тыс. населения)
Доля туберкулеза как причины смерти в структуре смертности населения РФ от инфекционных и паразитарных болезней сокращается: 2005 г. - 82,8%; 2014 г. - 45,0%; 2015 г. - 39,2% (рис. 4). Доля туберкулеза как причины смерти в структуре смертности населения России от всех причин также сокращается: 2005 г. - 1,40%; 2014 г. - 0,77%; 2015 г. -0,71%.
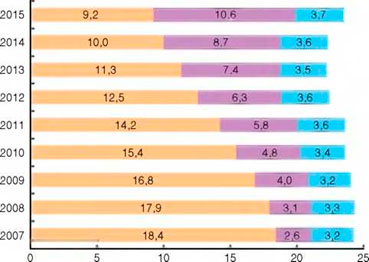
Рисунок 4. Смертность от некоторых инфекционных и паразитарных болезней в России (на 100 тыс. населения): с Крымским ФО с 2015 г.
Одновременно в структуре смертности населения России от инфекционных и паразитарных болезней растет доля умерших от ВИЧ-инфекции как причины смерти: 2005 г. - 3,9%; 2014 г. - 39,1%; 2015 г. - 45,2%. В структуре смертности населения России от всех причин доля ВИЧ-инфекции также увеличивается: 2005 г. - 0,07%; 2014 г. - 0,66%; 2015 г. - 0,81%.
ВИЧ-инфекция в молодом трудоспособном возрасте (18-44 года) выходит на одно из первых мест в структуре смертности населения России (рис. 5). От ВИЧ-инфекции (2015 г.) в возрасте 18-44 года умирает больше (6,9%), чем от заболеваний органов дыхания (4,0%) и нервной системы (1,9%), ишемической болезни сердца (5,4%), цереброваскулярных болезней (2,9%), туберкулеза (3,1%). Женщины от ВИЧ-инфекции в данном возрасте умирают чаще (8,4%), чем от заболеваний органов дыхания (4,3%), ишемической болезни сердца (3,7%), цереброваскулярных болезней (3,6%), болезней нервной системы (2,4%), туберкулеза (2,8%). Мужчины от ВИЧ-инфекции умирают чаще (6,4%), чем от злокачественных новообразований (4,5%), ишемической болезни сердца (6,0%), цереброваскулярных болезней (2,7%), болезней органов дыхания (3,9%) и нервной системы (1,7%), туберкулеза (3,2%).
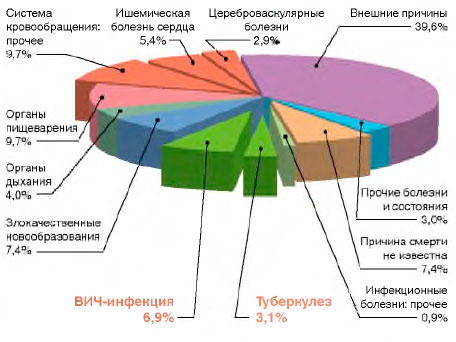
Рисунок 5. Структура смертности в России (2015 г.) населения молодого трудоспособного возраста (18-44 года)
Наблюдается рост общей летальности состоявших на учете пациентов с туберкулезом: 2012 г. - 11,6%; 2013 г. - 12,0%; 2014 г. - 12,5%; 2015 г. - 12,9%. При этом в структуре летальности сокращается доля пациентов, причиной смерти которых был туберкулез: 2012 г. - 49,2%; 2013 г. - 46,4%; 2014 г. - 42,7%; 2015 г. -39,1%.
В 2015 г. в смертность от ВИЧ-инфекции включали также пациентов с удовлетворительными показателями иммунитета на фоне ВИЧ-инфекции, когда число клеток CD4 было больше 350 и даже больше 500 в 1 мл крови, если у пациента был активный туберкулезный процесс. Отсюда такие быстрые темпы роста смертности от ВИЧ-инфекции. Умерло лиц с сочетанием ВИЧ-инфекции и туберкулеза в 2015 г. 9167 человек, в том числе при поздних стадиях ВИЧ-инфекции - 7394 человека, то есть на 1773 меньше.
В 8 субъектах России в 2015 г. пациенты с туберкулезом умерли от ВИЧ-инфекции на поздних стадиях в большем числе случаев, чем регистрировалась смерть от туберкулеза по Росстату.
В 2015 г. по сравнению с 2014 г. смертность от туберкулеза и от туберкулеза, зарегистрированного как смерть от ВИЧ-инфекции на поздних стадиях, снизилась на 2,7% (с 14,7 до 14,3 на 100 тыс. населения). При этом отмечается рост показателя в Сибирском ФО (+6,0%) и в 24 субъектах Российской Федерации.
Распространенность сочетания туберкулеза и ВИЧ-инфекции ежегодно растет: 2009 г. - 10,2; 2013 г. - 17,5; 2015 г. - 19,7 на 100 тыс. населения. Среди пациентов с туберкулезом, состоявших на учете в противотуберкулезных диспансерах на окончание 2015 г., 15,2% имели ВИЧ-инфекцию (2009 г. - 5,5%; 2014 г. - 12,7%).
Вследствие низкой летальности состоявших на учете пациентов с ВИЧ-инфекцией (2015 г. - 3,8%), которая существенно меньше летальности пациентов с туберкулезом (12,9%), показатель распространенности ВИЧ-инфекции растет быстрыми темпами и начиная с 2008 г. превышает показатель распространенности туберкулеза (рис. 6).
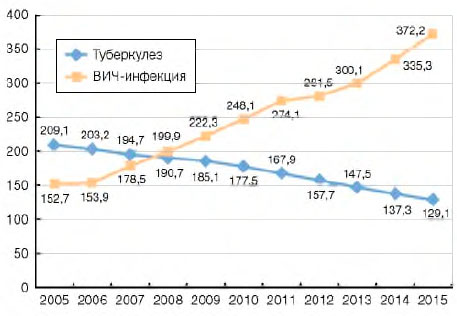
Рисунок 6. Распространенность туберкулеза и ВИЧ-инфекции на окончание года (на 100 тыс. населения)
На конец 2015 г. показатель распространенности туберкулеза среди пациентов с ВИЧ-инфекцией больше, чем в среднем по России в 41 раз (соответственно 5283,7 на 100 тыс. пациентов с ВИЧ-инфекцией и 129,1 на 100 тыс. населения в среднем по России).
Учитывая, что число больных ВИЧ-инфекцией ежегодно увеличивается, а при поздних ее стадиях заболеваемость туберкулезом высока, можно ожидать, что ВИЧ-инфекция не позволит в перспективе существенно снизить показатели заболеваемости и распространенности туберкулеза.
К 2020 г. ВИЧ-инфекция будет у 25% и более впервые выявленных пациентов с туберкулезом. Смертность от туберкулеза, по данным Росстата, будет уменьшаться, а от ВИЧ-инфекции - расти. К 2020 г. в структуре смертности больных ВИЧ-инфекцией причиной смерти до 60% будет туберкулез. А среди умерших пациентов с туберкулезом причиной смерти будет регистрироваться смерть от ВИЧ-инфекции в 1,5 раза чаще, чем смерть от туберкулеза.
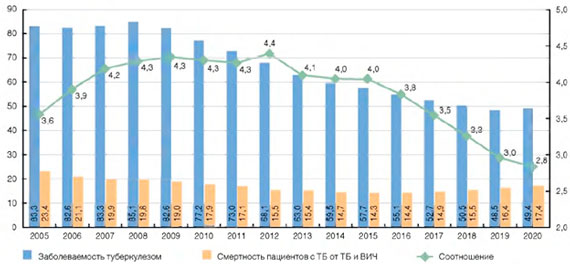
Рисунок 7. Прогноз показателей по туберкулезу в Российской Федерации (на 100 тыс. населения)
Среди состоящих на учете в противотуберкулезных диспансерах на окончание 2015 г. пациентов с туберкулезом больше всего пациентов с сочетанием туберкулеза и ВИЧ-инфекции в следующих субъектах Российской Федерации: Волгоградская, Иркутская, Кемеровская, Ленинградская, Московская, Новосибирская, Оренбургская, Самарская, Свердловская, Тюменская и Челябинская области, Республика Башкортостан, Ханты-Мансийский автономный округ, Алтайский, Красноярский и Пермский края, Москва и Санкт-Петербург. В этих 18 субъектах России состоят на учете 21142 пациента с сочетанной патологией - 73,4% от всех пациентов с коинфекцией, зарегистрированных в России (28821 человек).
За последние годы изменились пути передачи ВИЧ-инфекции, на первый план выходит половой гетеросексуальный путь. Парентеральное введение наркотиков как причина заражения ВИЧ сокращается после преобладания этого пути передачи во второй половине девяностых годов прошлого века и начале двухтысячных годов.
Одной из черт патогенеза ВИЧ-инфекции является гибель CD4 + Т-хелперов, концентрация которых медленно, но неуклонно снижается. У инфицированных ВИЧ CD4 + лейкоциты снижаются тогда, когда вирус прогрессирует. Низкий уровень клеток CD4 + значит, что у пациента снижен иммунитет. Синдром приобретенного иммунодефицита (СПИД) является терминальной стадией ВИЧ-инфекции и развивается у большинства пациентов при снижении числа CD4 + Т-лимфоцитов крови ниже 200 клеток/мл. СПИД - это комплекс вторичных заболеваний (B20-B24), развивающихся у инфицированных ВИЧ в процессе существенного снижения иммунитета, проявляющихся конкретными болезнями, в том числе туберкулезом.
Учитывая вышесказанное и неблагоприятную ситуацию по ВИЧ-инфекции, необходимо менять все разделы работы, прежде всего улучшить профилактику туберкулеза среди контингентов центров СПИДа. Наибольшее внимание необходимо уделить совместной работе противотуберкулезных медицинских организаций и центров СПИДа в субъектах Уральского, Сибирского, Приволжского и Крымского ФО.
Практически все впервые выявленные пациенты с туберкулезом (2014 г. - 95,2%; 2015 г. - 95,4%) и большая часть пациентов (2014 г. - 84,1%; 2015 г. - 84,3%), которые наблюдались в противотуберкулезной службе с активным туберкулезом на окончание года, были обследованы на антитела к ВИЧ (рис. 8).
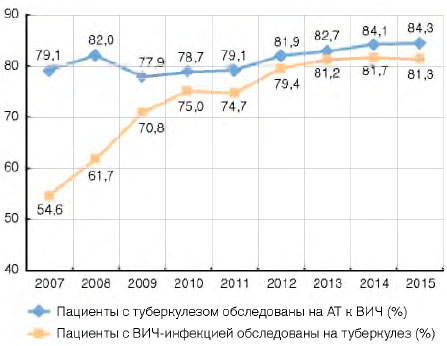
Рисунок 8. Обследование пациентов с ВИЧ-инфекцией на туберкулез и пациентов с туберкулезом на ВИЧ в России (проценты)
При этом надо отметить - пациенты, имеющие туберкулез, не подлежат обязательному медицинскому освидетельствованию на наличие ВИЧ-инфекции. Медицинское освидетельствование пациентов при подозрении на туберкулез и с установленным диагнозом туберкулеза в медицинских организациях должно проводиться добровольно при наличии информированного добровольного согласия на медицинское вмешательство освидетельствуемого лица или его законного представителя.
Несмотря на то что охват обследованиями на туберкулез среди пациентов с ВИЧ-инфекцией, состоящих на учете в центрах СПИДа, растет (2007 г. - 54,6%; 2014 г. - 81,7%; 2015 г. - 81,3%), можно констатировать: не выполняются федеральные нормативные документы[3], в соответствии с которыми пациенты с ВИЧ-инфекцией должны осматриваться на туберкулез 2 раза в год.
С помощью лучевого метода в 2015 г. осмотрено 80,9% ВИЧ-позитивных лиц (2014 г. - 80,6%), метода микроскопии мокроты - 11,9% (2014 г. - 12,3%), метода посева мокроты - 6,3% (2014 г. - 5,5%), метода ПЦР - 2,9% (2014 г. - 2,0%), морфологического метода - 0,8% (2014 г. - 1,0%).
В 2015 г. существенно выросла доля пациентов с ВИЧ-инфекцией, которым проводилась химиопрофилактика туберкулеза (ХП): среди впервые вставших на учет - в 31,1% случаев (2014 г. - 7,7%); в контингентах пациентов, состоящих на учете, - в 14,3% случаев (2014 г. - 5,3%) (рис. 9).
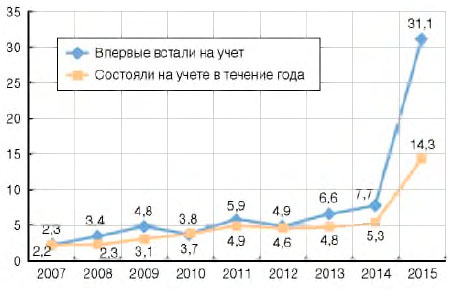
Рисунок 9. Химиопрофилактика туберкулеза инфицированных ВИЧ в России (проценты) среди лиц с ВИЧ-инфекцией
Значение имеет качество проведения ХП. Стадия заболевания или ее классификация определяет стратегию проведения ХП лицам с ВИЧ-инфекцией[4]. ХП назначается пациентам со сниженным иммунитетом при регистрации клеток CD4 менее 350 в 1 мкл. Лучшие результаты по снижению риска развития туберкулеза у больных ВИЧ-инфекцией отмечаются при одновременном приеме противотуберкулезных и антиретровирусных препаратов.
Эффективность противотуберкулезной ХП у пациентов с ВИЧ-инфекцией доказана в рандомизированных контролируемых исследованиях, в том числе в России. В Свердловской области[5] рассчитана экономическая эффективность ХП: 1 рубль, вложенный в полноценно проведенный курс ХП, экономит 220 руб., положенных для лечения туберкулеза у пациентов этой категории. Ни один пациент с ВИЧ-инфекцией, получивший полноценный курс ХП, туберкулезом в 2004-2010 гг. не заболел. Удалось к 2010 г. снизить у указанных контингентов вероятность заболевания туберкулезом в 5,8 раза и смертности от туберкулеза - в 10,6 раза.
Основным критерием эффективности ХП является отсутствие случаев развития активного туберкулеза у лиц, получивших ее, в течение двух последующих лет. О качестве проведения ХП в 2015 г. будем судить в 2016-2017 гг. по показателям заболеваемости туберкулезом контингентов центров СПИДа.
Другая важнейшая проблема профилактики туберкулеза - предотвращение заболеваемости туберкулезом среди детей с ВИЧ-инфекцией. Заболеваемость туберкулезом ВИЧ-позитивных детей в возрасте 0-14 лет (рис. 1) больше среднего показателя по России (постоянное население) в 58 раз (соответственно 683,9 на 100 тыс. пациентов с ВИЧ-инфекцией и 11,8 на 100 тыс. детей в среднем по России); детей в возрасте 15-17 лет - больше в 30 раз (соответственно 773,5 на 100 тыс. пациентов с ВИЧ-инфекцией и 25,5 на 100 тыс. детей в среднем по России).
Из 9532 детей с ВИЧ-инфекцией в возрасте 0-17 лет (на окончание 2015 г.) родились от матерей с ВИЧ-инфекцией 8794 (92,3%) ребенка.
Приказом по Свердловской области (2004 г.) было обеспечено проведение иммунизации детей, рожденных от матерей с ВИЧ-инфекцией или сомнительным результатом иммуноблота на ВИЧ, против туберкулеза вакциной БЦЖ-М в роддоме после принятия комиссионного решения о вакцинации. Через три года после начала действия приказа был проведен эпидемиологический анализ сплошным методом результатов[6]. Получены данные об уменьшении инфицированности МВТ и заболеваемости туберкулезом у детей, рожденных от матерей с ВИЧ-инфекцией.
Положительный опыт, полученный в Свердловской области, позволил убрать ВИЧ-инфекцию у матери из противопоказаний к проведению прививок БЦЖ-М новорожденному в роддоме[7].
На окончание 2015 г. в России от матерей с ВИЧ-инфекцией родилось 145287 детей. От матерей с ВИЧ-инфекцией в 2013-2015 гг. родилось 0,8% детей от числа всех родившихся живыми в роддомах России. Наиболее часто ВИЧ-инфекцию имели родившие в 2015 г. женщины в Иркутской (2,4%), Новосибирской (2,3%), Самарской (2,1%) и Свердловской (2,5%) областях. Родили детей 43% женщин, инфицированных ВИЧ. ВИЧ-инфекция в последующем подтверждена у рожденных матерями с ВИЧ-инфекцией детей: 2009 г. - в 6,7%; 2014 г. - в 6,2%; 2015 г. - в 6,1% случаев.
Тем не менее часть детей, родившихся от матерей с ВИЧ-инфекцией, вакциной БЦЖ в роддоме до сих пор не прививается. Национальный календарь профилактических прививок в полном объеме не выполняется, сокращается доля детей, привитых вакциной БЦЖ в роддомах России: 2005 г. - 89,1%; 2014 г. - 85,5%; 2015 г. - 84,6%.
Заключение
Эпидемическая ситуация по туберкулезу и ВИЧ-инфекции требует направить усилия на решение следующих проблем:
- совместно со специалистами центров СПИДа разобраться с кодированием случаев смерти при наличии туберкулеза у пациентов с ВИЧ-инфекцией;
- усилить меры профилактики ВИЧ-инфекции среди детей и профилактики туберкулеза среди пациентов с ВИЧ-инфекцией, состоящих на учете в центрах СПИДа;
- усовершенствовать нормативные правовые акты в сфере противодействия распространению ВИЧ-инфекции и туберкулеза среди ВИЧ-позитивных лиц в Российской Федерации;
- организовать мониторинг состояния заболеваемости туберкулезом больных ВИЧ-инфекцией в Российской Федерации, а также мероприятий, направленных на предотвращение распространения туберкулеза среди ВИЧ-позитивных лиц, на основании новых форм федерального статистического наблюдения и создания реестра/регистра пациентов с туберкулезом и ВИЧ-инфекцией;
- обеспечить рациональное использование противотуберкулезных препаратов для проведения химиопрофилактики туберкулеза у лиц, живущих с ВИЧ;
- обеспечить квалифицированную диагностику и контролируемое лечение туберкулеза у больных ВИЧ-инфекцией на всех этапах диспансерного наблюдения.
Читайте также:


