Трансплацентарные инфекции что это
8.3. ПУТИ РАСПРОСТРАНЕНИЯ ИНФЕКЦИИ
В зарубежной и отечественной литературе описано пять основных пу-тей проникновения возбудителей инфекции в организм плода (Анкирская А.С., 1985; Радзинский В. Е, 1992; Кира Е.Ф., 1996; Левицкая С. К., 1991):
1) восходящий (через шейку матки и оболочки плодного яйца);
2) трансплацентарный, или гематогенный (через плацентарный барьер к плоду);
3) нисходящий (из воспалительно измененных придатков матки, аппен-дикса);
4) интранатальный (при прохождении плода через инфицированные ро-довые пути матери);
Антенатально инфекционный агент попадает к плоду гематогенно (трансплацентарно) или через инфицированные околоплодные воды. Чаще при антенатальном заражении возбудители поступают в организм плода ге-матогенно. Вначале они с кровью матери поступают в плаценту, где возмож-но размножение возбудителя и последующее развитие воспалительного про-цесса (плацентита). Преодолев маточно-плацентарный барьер, возбудитель проникает к плоду и может привести к развитию генерализованной инфекции с поражением печени, легких, почек, головного мозга и других органов (Ан-кирская А.С., 1989; Айламазян Э.К., 1995; Есаулова Н.Е., 1996; Сидельникова В.М., 1996; Сидорова И.С., 1999; Михайлов А.В., Лаврова Д.Б., Коляченко Е.С., 2003). Следует отметить, что распространение возбудителей может происходить и по вартонову студню пуповины, чему способствует внесосу-дистый ток жидкости от плаценты к плоду (Mindel A., 1995).
Околоплодные воды могут быть инфицированы восходящим (из влага-лища) и нисходящим (из маточных труб) путём, а также самим плодом, ин-фицированным гематогенно и выделяющим возбудителя с калом и мочой с последующим инфицированием околоплодных вод. При синдроме инфици-рования амниона может произойти преждевременный разрыв околоплодных оболочек с последующим развитием эндометрита, инфекционных осложне-ний новорожденного (Анкирская А.С., 1985). Учитывая ведущую роль трансплацентарного (гематогенного) инфицирования при антенатальной ВУИ, важно отметить, что состояние барьерной функции плаценты в значи-тельной мере определяет возможность развития инфекции и количество по-павшего к плоду инфекционного агента. Известно, что фетоплацентарная не-достаточность резко увеличивает риск развития генерализованной ВУИ при наличии хронического очага или остром заболевании у беременной.
Гематогенный путь передачи инфекции характерен для цитомегалови-русной, энтеровирусной инфекции, вируса простого герпеса, ветряной оспы, а также наблюдается при листериозе, микоплазмозе, некоторой бактериаль-ной инфекции и приводит к тяжёлым диссеминированным поражениям фе-топлацентарной системы, жизненно важных органов плода (мозга, печени, лёгких) (Девис П. А., 1987; Лозовская Л. С., 1995; Самохин П. А., 1987; Си-макова М. Г., 1995).
Восходящий путь инфицирования характерен для условно - патогенной микрофлоры, грибковой инфекции, а также наблюдается при хламидиозе, микоплазмозе, листериозе, других инфекциях. При восходящем пути инфи-цирования микроорганизмы проникают через плодные оболочки в около-плодные воды, где происходит размножение возбудителя. При этом плод оказывается в инфицированной среде. Заражение внутренних полостей плода происходит при заглатывании и аспирации инфицированных вод (Гуртовой Б. Л., Анкирская А. С., 1994; Цинзерлинг А. В., 1986).
Нисходящий путь инфицирования менее характерен для ВУИ, хотя его риск высок при персистенции возбудителей в эндометрии и маточных трубах (хламидии, микоплазмы, уреаплазмы) (Радзинский В. Е., 1996; Тареева Т. Г., 1994).
Интранатальный путь инфицирования (заражение плода во время родов путём аспирации или заглатывания содержимого родовых путей матери) наиболее характерен для бактериальной инфекции (стрептококк группы В, E.сoli, стафиллококк, Proteus, клебсиелла, анаэробная флора), но возможен и для вирусной (ВПГ, ЦМВ) инфекции, грибов рода Кандида. Причем передача инфекции возможна как при наличии симптомов поражения в области шейки матки и вульвы, так и при бессимптомном выделении возбудителя (Адаске-вич В. П., 1996; Барашнев Ю. И., 1994; Кудашев Н. И., 1991; Carmack M. A., 1993).
Таким образом, при наличии у беременной урогенитальной инфекции внутриутробное инфицирование плода и новорожденного может произойти любым из вышеперечисленных путей.

Российская Академия Естествознания приняла участие в выставке BUCH WIEN 2019, (Австрия, Вена , 6-10 ноября 2019 года).

С 12 по 15 октября 2019 г. в г. Сочи состоялся заключительный очный этап VII международного конкурса научно-исследовательских и творческих работ учащихся "СТАРТ В НАУКЕ" и итоговое заседание педагогов высшей и средней школы в рамках научно-практической конференции "Современные проблемы школьного образования".

Российская Академия Естествознания (Международная ассоциация учёных, преподавателей и специалистов) приняла участие в 32-й Московской международной книжной выставке-ярмарке, г. Москва, ВДНХ, 4-8 сентября 2019 года.

Российская Академия Естествознания Приняла участие в выставке HONG KONG BOOK FAIR 2019, (КНР, Гонконг, 17-23 июля 2019 года).

Российская Академия Естествознания Приняла участие в выставке BOOKEXPO AMERICA 2019, (США, Нью-Йорк, 29-31 мая 2019 года).
… во время беременности они могут оказывать пагубное действие на все системы и органы плода, особенно на его центральную нервную систему, повышая риск выкидыша, мертворождения и врожденных уродств ребенка.
Трансплацентарные инфекции относятся к репродуктивно значимым инфекциям. Взбудителями трансплацентарных инфекций являются: Listeria monocytogenes, Treponema pallidum, Toxoplasma gondii, а также вирусы (краснухи, цитомегалии, герпеса 1, 2 типов, герпеса 3 типа-Varicella zoster, кори, парвовирус В19 и др.). Следует отметить, что выявление возбудителей той или иной инфекции у беременной не всегда говорит о его передаче плоду. Так известно, что в 100 % плоду передаются листерии, в 50-70 % хламидии, в 37 % стрептококки группы В, в 30 % микоплазмы, в 50 % - вирус цитомегалии при первичной инфекции во время беременности.
Для диагностики трансплацентарных инфекций отбор наиболее подходящего лабораторного метода происходит в зависимости от знания патогенеза той или иной инфекции. Если имеется в виду возможный трансплацентарный путь передачи возбудителя от женщины её плоду, то по большей части используют определение антител разных классов в сыворотке крови матери. Фактически при этом выясняется, была ли у женщины та или иная инфекция и как давно она была.
Наличие в крови специфических IgM-антител в отсутствии IgG-антител свидетельствует о ранней острой фазе заболевания и о необходимости начала лечения (токсоплазмоза, например) или прерывания беременности (при краснухе). Наличие специфических антител обоих классов говорит об острой инфекции в более поздней фазе. В этих случаях решение зависит от вида возбудителя, срока беременности и других обстоятельств, характеризующих ситуацию. Наличие у беременной лишь IgG-антител говорит о состоянии иммунитета. Отсутствие антител обоих классов свидетельствует о том, что инфекции в прошлом не было, т. е. имеется возможность первичного инфицирования во время беременности и возникновения внутриутробной инфекции плода со всеми её особенностями и последствиями. Для таких беременных показаны повторные серологические исследования, чтобы проследить возникшую первичную инфекцию, особенно опасную для плода.
Следует подчеркнуть, что при определении IgM-антител у беременных довольно часто по разным причинам наблюдаются ложноположительные реакции. В таких случаях динамика титров IgG-антител в сыворотках крови, взятых с интервалом 10-14 дней, в частности нарастание в 4 и более раз, служит подтверждением заболевания у матери. Особенно важно при наличии IgG-антител определение индекса авидности.
Авидностью антител называется прочность связи между антителом и антигеном. Определение авидности специфических IgG оказывается особенно полезным для диагностики первичной инфекции. Имеет значение факт, что первичный IgG иммунный ответ на инфекцию характеризуется антителами с низкой авидностью, которые которые образуют непрочные соединения в комплексе антиген-антитело. Если испытуемая сыворотка содержит менее 30-60% высокоавидных антител (то есть индекс авидности менее 30-60%), это указывает на свежую первичную инфекцию. Показатель авидности, равный или превышающий 60%, свидетельствует о наличии в сыворотке высокоавидных антител – маркеров перенесенной в прошлом инфекции. Следовательно, определение авидности антител является высокоинформативным диагностическим методом, использование которого в комплексе с другими серологическими тестами позволяет существенно улучшить качество диагностики инфекций. Исследование авидности антител позволяет точно диагностировать стадию инфекции, определить, острая инфекция или перенесенная. От этого зависит, лечить или не лечить пациента.
Такми образом, об инфекции, впервые возникшей во время беременности, свидетельствует определение низкоавидных IgG (ниже 30 %). Важным для беременных является выявление иммунного ответа и по возможной интерпретации результатов исследований при контакте беременной с больным, имеющим сыпь.
Существует следующий алгоритм обследования женщин, планирующих беременность, и алгоритм обследования женщин, встающих на учёт по беременности.
( 1 ) При планировании беременности необходимо обследование на наличие в сыворотке крови только IgG к возбудителям, составляющим TORCH (Т - токсоплазмоз, R - rubella (краснуха), С - цитомегалия, Н - герпес) - синдром.
Диагноз токсоплазмоза ставиться на основании клинических данных и данных лабораторного обследования (определение антител к Toxoplasma gondii в крови). Антитела класса IgM к Toxoplasma gondii в крови появляются спустя 2 – 4 недели после заражения и исчезают через 3 – 9 месяцев. Далее появляются антитела класса IgG и их титр постепенно повышается, а спустя 2 – 5 месяцев после заражения достигает пика.
Диагноз краснухи ставиться на основании клинических данных и данных лабораторного обследования (определение антител к вирусу краснухи в крови). Начальная иммунная реакция организма на инфекцию – синтез антител класса IgM, высокие уровни которых появляются в крови через 2 недели после заражения и сохраняются в течение 1 – 2 месяцев, антитела IgG появляются приблизительно через неделю после IgM и достигают плато спустя 6 – 10 недель, потом прогрессивно уменьшаются и далее сохраняются всю жизнь. Исследование антител IgM и IgG к вирусу краснухи полностью обеспечивает диагностику острого заболевания, кроме того, определение антител IgG позволяет судить о напряженности иммунитета после прививки. Контроль сероконверсии после прививки необходимо проводить не ранее чем через 8 – 10 недель.
Диагноз цитомегаловирусной инфекции ставиться на основании клинических данных и данных лабораторного обследования (определение антител к цитомегаловирусу в крови). После заражения цитомегаловирусом через несколько недель повышается титр антител класса IgM. Уровень IgM к ЦМВ обычно увеличивается в течение нескольких недель и уменьшается медленно через 4 – 6 месяцев. Иногда антитела класса IgM к цитомегаловирусу могут циркулировать в крови в течение многих лет. Антитела класса IgG появляются в крови через 1 – 2 недели после появления IgM-антител.
У большинства людей, зараженных вирусом простого герпеса, инфекция протекает бессимптомно, поэтому необходима серологическая диагностика. Антитела класса IgM к вирусу простого герпеса обнаруживаются спустя одну неделю после инфекции, обычно это показатель недавней или текущей инфекции. Антитела класса IgG появляется спустя 2 – 3 недели после инфицирования и их титр снижается через несколько месяцев. У пациентов с рецидивом заболевания чаще титр антител класса IgG не повышается.
( 2 ) При постановке на учёт по беременности необходимо провести серологическое обследование женщин на наличие IgG, IgG-авидность и IgM в случае, если женщина не обследована при планировании беременности, при отсутствии IgG и при клинических ситуациях, например, при контакте беременной с больным с сыпью, при карантине по краснухе и др.
До сих пор неизвестные факторы, которые препятствуют репликации вируса РРСС или блокируют ее в эндометрии, и недостаточное количество восприимчивых клеток в плаценте могут объединить свои силы и вызвать резистентность к плацентарному / трансплацентарному заражению вирусом РРСС за 90 дней до беременности.
Репродуктивные проблемы, индуцированные вирусом репродуктивно-респираторного синдрома свиней (РРСС), характеризуются эмбриональными случаями смерти, выкидышами на поздних сроках, ранним опоросом и увеличением числа погибших и слабых плодов. Последние данные показывают, что эндометрий и плацента участвуют в переходе вируса РРСС от матери к плоду, и что репликация вируса в эндометрических / плацентарных тканях может быть фактической причиной смерти плода. Лучшее понимание этих явлений может обеспечить использование превентивных стратегий.
Присутствие клеток - мишеней вируса РРСС в эндометрии и плаценте может быть неотъемлемой частью перехода вируса от матери к плоду. В соответствии с этим, наибольшее количество CD (кластеров дифференцировки)163 + и Sn + клетки (клетки-мишени для заражения вирусом РРСС) наблюдается в эндометрии и плаценте, которые собраны на 90-110-й день беременности, чем на более ранних стадиях. Обилие клеток, которые очень восприимчивы к вирусу в плаценте в конце беременности, может частично объяснить, почему врожденная инфекция вирусом РРСС в основном ограничивается концом беременности. Предыдущий эксперимент по данной проблеме показал, что эндометриальная среда может также играть важную роль в создании плацентарных и трансплацентарных инфекций вирусом РРСС. Клетки, положительные на вирус РРСС, не наблюдались в эндометриальных тканях, прилегающих к одиннадцати плодам у одной свиноматки, которая была интраназально привита вирусом РРСС на70-й день беременности, а образцы были взяты на анализ на 80-й день беременности, несмотря на материнскую виремию и наличие внутри матки CD163 + и Sn + клетки. В противоположность этому, вирус РРСС эффективно реплицировался в эндометрии / плаценте, которые были получены от свиноматок, интраназально привитых вирусом РРСС на 90-й день беременности, а образцы были взяты на анализ на 100-й день беременности. В целом, до сих пор неизвестные факторы, которые препятствуют репликации вируса РРСС или блокируют ее в эндометрии, и недостаточное количество восприимчивых клеток в плаценте могут объединить свои силы и вызвать резистентность к плацентарному / трансплацентарному заражению вирусом РРСС за 90 дней до беременности.

В недавнем исследовании были выявлены РРСС - положительные и апоптотические клетки, локализованные и количественно определенные в эндометрии / плаценте от трех свиноматок, привитых на 90-й день беременности и умерщвленных через 10 дней. На 10 дней после инокуляции исследуемые свиноматки были виремичными и вирус РРСС, передаваемый от матери к плоду, был обнаружен во всех из них. У привитых свиноматок репликация вируса РРСС была обнаружена в эндометрии и плаценте посредством специального иммунофлуоресцентного окрашивания. Число РРСС-положительных клеток в плаценте (1-289 / 10 мм2 ткани) была значительно выше, чем в эндометрии (1-16 / 10 мм2 ткани; р = 0,004). Количество апоптотических клеток было значительно выше в РРСС-положительном эндометрии от привитых свиноматок по сравнению с вирус-отрицательными тканями от контрольных свиноматок (рисунок 1). Количество апоптотических клеток значительно увеличилось в РРСС-положительных плацентах по сравнению с РРСС - отрицательными плацентами. Главный вывод, полученный из исследования, состоит в том, что вирус РРСС реплицируется в эндометрии / плаценте и вызывает апоптоз локальных клеток при поздних сроках беременности. Уже на 20-й день после инокуляции в вирус-положительных тканях наблюдаются тяжелые гистологические повреждения, которые варьируются от локального разъединения эпителия матки и трофобласта до полной деградации плацентарной зародышевой мезенхимы (Рисунок 2). Эти гистологические поражения несовместимы с жизнью зародышей, так как структурная целостность матери и плода в пределах трансплацентарного барьера имеет решающее значение для внутриутробного газообмена (O2 / CO2), кормления и очистки токсичных метаболитов у потомства.

Рисунок 1. Количественные показатели апоптотических клеток в эндометрии и плаценте, полученных от свиноматок, инокулированных вирусом РРСС на 90-й день беременности и от неинокулированных животных
Образцы у животных были взяты на анализ на 100-й день беременности. Сплошные и пунктирные линии показывают медианные и средние значения, соответственно. Каждая прямоугольная диаграмма отражает 25 - 75% наблюдений. Черточки ниже и выше графика представляют собой 10-й и 90-й процентили. Точки выше или ниже черточек каждой прямоугольной диаграммы представляют собой статистические выбросы, которые не включены в предел между 10 и 90% наблюдений. Различия считались статистически значимыми при p ≤ 0.05. (Карнийчук и др., 2011).
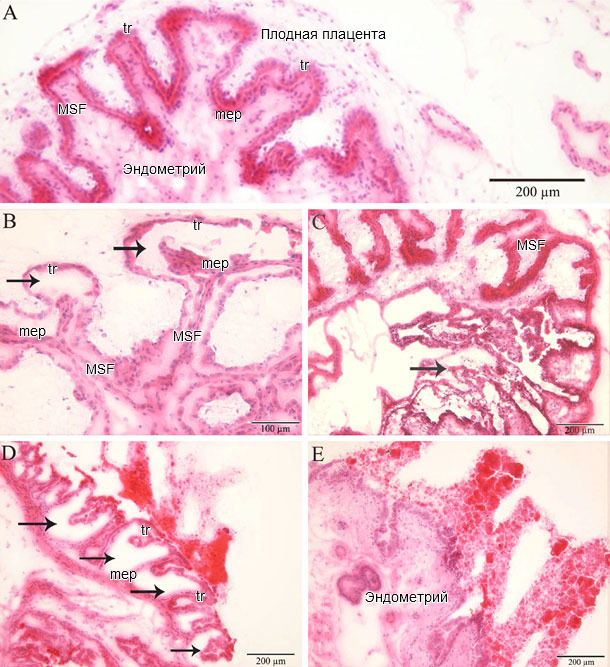
Рисунок 2. Гистопатология в эндометрии и плаценте
(A) Эмбриональные имплантации сайтов из РРСС - отрицательных плодов без микроповреждений (MSF: вторичная складка беременной свиноматки; mep: эпителий матки; tr: трофобласт). Эмбриональные имплантации сайтов из РРСС - положительных плодов с микроповреждениями: (B) фокальный отрыв трофобласта от эпителия матки; (C) фокальная дегенерация плодной плаценты; (D) мультифокальная дегенерация плодной плаценты; и (E) полная дегенерация плодной плаценты. (Карнийчук и др., 2012).
В настоящее время вакцинация считается основным методом лечения и контроля инфекции вирусом РРСС. В недавнем исследовании прошла испытание экспериментальная инактивированная вакцина против вируса РРСС, полученная с использованием новой оптимальной вирусной процедуры инактивации и использованная с подходящим адъювантом. Результаты показали, что новая инактивированная вакцина способна стимулировать гуморальную иммунную реакцию, нейтрализующую вирус, и немного уменьшать длительность виремии у ремонтных свинок. Она также уменьшает количество РРСС - положительных плодов и улучшает их выживаемость. Положительные эффекты, скорее всего, достигаются за счет сокращения передачи вируса от эндометрии (основной сайт для репликации вируса РРСС вплоть до инфекции продуктов зачатия) до плаценты, так как количество РРСС - положительных клеток в плацентах было значительно выше у невакцинированных по отношению к вакцинированным ремонтным свинкам. Эта вакцина может быть рекомендована для использования в качестве самостоятельного средства или в комбинации с другими вакцинами на эндемически зараженных фермах, чтобы уменьшить потери из-за инфекции вирусом РРСС у беременных свиноматок. Цель заключается в том, чтобы активировать гуморальную иммунную реакцию, нейтрализующую вирус, до 80-го дня беременности, когда свиноматки становятся восприимчивыми к плацентарной / трансплацентарной инфекции. Вакцинация свинок живой вакциной перед осеменением или на ранней стадии беременности с последующей реиммунизацией при помощи новой инактивированной вакцины может предложить новые перспективы для профилактики нарушений репродуктивной функции, индуцированных вирусом РРСС.

Цитомегаловирусная инфекция – широко распространенная вирусная инфекция, характеризующаяся многообразием проявлений от бессимптомного течения вплоть до тяжелейших генерализованных форм с поражением внутренних органов и центральной нервной системы. Во время трансплацентарной передачи инфекции возможно поражение плода.
Уровень инфицирования цитомегаловирусной инфекцией и степень зараженности организма зависит от социально-экономических условий, этнической принадлежности, практики медицинского обслуживания новорожденных и детей младшего возраста, времени вступления в половые отношения.
Доля носителей ЦМВ в России составляет около 90%.
Попадая в клетки человеческого организма, цитомегаловирус способен оставаться в нем пожизненно.
Возбудитель (Cytomegalovirus hominis) относится к вирусам герпеса (семейство Herpesviridae)
Резервуаром и источником инфекции является только человек. Вирус может находиться в слюне, молоке, моче, испражнениях, семенной жидкости, в секрете шейки матки.
У 20-30% здоровых беременных женщин ЦМВ присутствует в слюне, 3-10 % - в моче, 5-20% - в цервикальном канале или вагинальном секрете.
Кровь около 1% доноров содержит цитомегаловирус.
Хотя, вирусные частицы могут быть обнаружены по всему телу, цитомегаловирус, чаще всего, ассоциирован со слюнными железами.
Cпособы передачи инфекции
Цитомегаловирусная инфекция распространяется не только через слюну при близких контактах, но и во время полового контакта, через кровь, от беременной матери плоду, а также контактно-бытовым путем.
Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности. Возбудитель, проникший в плод через кровь в ранние сроки беременности, вызывает формирование врожденных пороков развития.
При наличии инфекции в канале шейки матки у беременной, заражение плода может происходить в родах, во время прохождения плода по родовым путям.
Основной путь заражения ребенка до года – передача вируса через грудное молоко.
Источником заражения детей до 5-6 лет являются матери, выделяющие вирус со слюной или мочой.
Дети, находящиеся в организованных коллективах заражаются чаще контактно-бытовым путем.
Заражение в возрасте 16-30 лет происходит, как правило, при близком контакте через поцелуи и половым путем.
Переливание крови и другие манипуляции с кровью также могут приводить к заражению цитомегаловирусом.
Симптомы цитомегаловирусной инфекции
В здоровом организме вирус никак себя не проявляет, но может быть смертельно опасен для людей с иммунодефицитами: для ВИЧ-инфицированных, больных, после трансплантации органов, а также ожидающих трансплантацию, новорождённых.
При врожденной цитомегаловирусной инфекции характер поражения плода зависит от срока его заражения. Особенно опасно острое инфицирование матери в первые 20 недель беременности.
К чему может привести заражение в ранние сроки беременности?
Внутриутробная гибель плода;
Грубые врожденные пороки (анэнцефалия, микроцефалия, гидроцефалия, нарушение строения легких, бронхиального дерева, аномалии строения почек и др.).
Врожденные пороки в большинстве случаев несовместимы с жизнью.
При заражении ЦМВ в более поздние сроки беременности формирования пороков развития не происходит.
К чему приводит заражение ребенка цитомегаловирусом во время родов?
Клинические признаки, как правило, появляются через 1-2 месяца после родов.
Поражение легких (пневмония);
Увеличение печени, селезенки;
Поражение желудочно-кишечного тракта;
Заболевание может носить длительный рецидивирующий характер.
Максимальная летальность от цитомегаловирусной инфекции приходится на 2-4 месяц.
Профилактика цитомегаловирусной инфекции
Во время консультирования беременных женщин, или планирующих беременность необходимо информировать о главных источниках и путях инфицирования (половые контакты с инфицированными ЦМВ партнерами, физический контакт при ежедневном уходе за ребенком дома или профессиональный контакт с детьми младшего возраста в стационарах, домах ребенка, дошкольных учреждениях).
Для снижения риска первичного заражения ЦМВ беременным женщинам, использовать барьерные контрацептивы при половых контактах, соблюдать правила личной гигиены (мыть руки после прикосновения к дверным ручкам, прикосновения к игрушкам, испачканными слюной , мочой ребенка), не рекомендуется доедать или допивать за детьми, использовать совместную посуду, нельзя облизывать соску. Необходимо избегать поцелуев в губы детей грудного возраста, которые могут выделять вирус со слюной.
При планировании переливания крови недоношенному ребенку или взрослому человеку с ослабленной иммунной системой, необходимо осуществлять проверку крови и ее компонентов на наличие ДНК ЦМВ.
Герпес — вирусное заболевание с характерным высыпанием сгруппированных пузырьков на коже и слизистых оболочках. Это наиболее распространенное вирусное заболевание, возбудителем которого является вирус простого герпеса (ВПГ). Семейство вирусов «Herpesviridae« может вызывать опасные для жизни болезни, инфекции, рецидивирующие заболевания, трансплацентарные инфекции, которые могут быть причиной врожденных уродств у детей.
Миф 1. Герпес не заразен. С точностью да наоборот. Герпес передается воздушно-капельным (при кашле, чиханье, разговоре), контактным (при поцелуях, пользовании общей посудой, помадой) и половым путями. Возможно, также заражение ребенка от матери при прохождении через родовые пути. Обычно, это случается, если мать заразилась генитальным герпесом на третьем триместре беременности. При этом в ее организме не успевают произвестись антитела, которые она передает ребенку. А если есть повреждение плаценты, ребенок может заразиться в утробном периоде развития – такой герпес называется врожденным.
Миф 3. Если появились сыпи на губах, простуда пошла на убыль. Распространенная точка зрения, однако, не имеет ничего общего с действительностью. В действительности появление сыпи означает, что перенесенная респираторная инфекция ослабила иммунитет, и это дало вирусу герпеса возможность активно действовать.
Миф 5. Заразиться герпесом можно только при наличии сыпи. Действительно, в активной фазе болезни выделяется большее количество вирусных частиц и вероятность заражения более высокая. Но передача инфекции может быть в любой момент через невидимые микротравмы кожи и слизевых оболочек.
Миф 8. Наилучшее лечение – прижигание спиртом, йодом или зеленкой. Прижигание не влияет на вирус герпеса и его активность, а вот обжечь поврежденную кожу и слизистую оболочку таким способом очень легко. Лучше аккуратно смазать сыпи антисептиком, который не содержит спирта, чтобы не присоединилась гнойная инфекция. Проявления герпеса лечат специальными противовирусными препаратами, например, ацикловиром, который препятствует размножению вируса. При частых обострениях используют лекарства, которые стимулируют иммунитет.
Миф 9. Герпес – безопасное заболевание, и поражает только кожу. Вообще-то, герпес занимает второе место по смертности от вирусных инфекций, уступая только ОРВИ. Вирус простого герпеса встраивается в геном нервных клеток, поэтому сыпь возникает в местах нервных окончаний и сопровождается сильной болью. Теоретически герпес может оказаться везде, где есть нервная ткань, а значит – практически в любом органе. При снижении общего и местного иммунитета герпетическое воспаление может развиться в слизистой оболочке рта и гортани, роговице и конъюнктиве глаза, лимфатических узлах, внутренних половых органах, кишечнике, печени, почках, легких и центральной нервной системе. При поражении головного мозга большинство больных умирают или остаются инвалидами. Кроме того, при врожденном герпесе вероятны множественные изъяны развития и даже смерть младенца, а генитальный герпес значительно повышает риск относительно развития рака шейки матки у женщин и рака предстательной железы у мужчин.
Как не заразиться герпесом
- Сурово соблюдайте правила личной гигиены. Лабиальный герпес — инфекционное заболевание! Тщательным образом мойте руки с мылом до и после контакта с герпесом, после нанесения антивирусного крема.
- Не касайтесь руками глаз! Это особенно касается женщин, поскольку они делают макияж.
- Не используйте слюну для увлажнения контактных линз.
- Не касайтесь участков, пораженных герпесом! Невзирая на сильный зуд и боль, ни в коем случае не касайтесь герпетической сыпи, не целуйтесь, особенно с детьми, не пользуйтесь чужой помадой и никому не одалживайте собственную, не делите одну сигарету с приятелем.
- Не пытайтесь избавиться волдырей или снять струпья, во избежание попадания инфекции на другие участки тела.
- Откажитесь от орального секса. Оральный секс с герпесом губ может вызывать генитальный герпес у вашего партнера.
- Пользуйтесь отдельным полотенцем и посудой, не пейте из чужих стаканов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
При определении IgG и IgM антител к токсоплазмозу в сыворотке крови возможны следующие варианты результатов:
- +IgG, -IgM - свидетельствует о бессимптомном здоровом носительстве (до 30% взрослого населения). Данное сочетание антител в крови беременных женщин не представляет угрозы для плода.
- -IgG, +IgM либо +IgG, +IgM - первичное инфицирование, острое или субклиническое течение. Во время беременности данная ситуация указывает на возможность внутриутробного инфицирования. В сомнительных случаях необходимо повторить анализ через 7 - 14 дней для подтверждения сероконверсии.
- -IgG, -IgM - отсутствие инфицирования. Беременные женщины с таким результатом должны быть включены в группу риска и обследоваться каждый триместр.
Вероятность врождённого токсоплазмоза составляет 1 на 1000 - 3500 родившихся детей. Это возможно при свежем случае инфицирования менее чем за 6 месяцев до наступления беременности и во время беременности. По данным НЦ АгиП РАН до 5 - 7% женщин заражаются во время беременности. Риск внутриутробного заражения плода увеличивается от 17% в первом триместре до 80% - в третьем триместре в случае острого токсоплазмоза беременной. Тяжесть поражения плода находится в зависимости от срока инфицирования (стадии внутриутробного развития).
| Срок беременности (недели) | Риск заражения (%) | Исход |
| 0 - 8 | 17 | Тяжёлые аномалии развития, в/у гибель плода |
| 8 - 18 | 25 | Поражения ЦНС (гидроцефалия, кальцификаты в ткани мозга), печени, хориоретинит, судорожный синдром. |
| 18 - 24 | 65 | Нарушения функций различных органов (гепатоспленомегалия, желтуха, анемия, тромбоцитопения) |
| 24 - 40 | 80 | Субклинические проявления болезни с манифестацией через несколько лет (глухота, хориоретинит) |
Наиболее тяжёлые последствия возникают при заражении до 24 недель. При подтверждении первичного инфицирования матери в первые 8 недель рекомендуется прерывание беременности. В более поздние сроки необходимы дополнительные исследования (УЗИ, забор пуповинной крови плода путём кордоцентеза с целью определения специфических антител IgM класса) для выработки тактики лечения и решения вопроса о возможном прерывании беременности.
Возможны следующие сочетания IgG и IgM антител в сыворотке крови:
- +IgG, -IgM - свидетельствует о перенесённом заболевании и устойчивом иммунитете. Иммунитет вырабатывается в результате перенесённых клинически выраженных и бессимптомных форм. В последнее время появились данные, что иммунитет после перенесённой краснухи не такой прочный как считали ранее, так как взрослые иногда заболевают краснухой (5% случаев), несмотря на то, что болели ею в детстве. В таком случае в сыворотке крови наблюдается прирост вируснейтрализующих антител (IgG).
- -IgG, +IgM либо +IgG, +IgM - первичное инфицирование, острая форма или бессимптомное течение, которое наблюдается в 30% случаях. В данной ситуации велика опасность внутриутробного инфицирования. При заражении в первом триместре рекомендуется прерывание беременности. В сомнительных случаях анализ необходимо повторить через 7 - 14 дней для подтверждения сероконверсии.
- -IgG, -IgM - отсутствие иммунитета. По последним данным 10 - 20% женщин детородного возраста не имеют иммунитета к вирусу краснухи. Поэтому необходимо обследовать женщин до беременности и при отсутствии иммунитета рекомендовать вакцинацию. Беременные женщины, не имеющие IgG антител к вирусу краснухи, включаются в группу риска и обследуются каждый триместр.
| Срок беременности (недели) | Риск заражения (%) | Исход |
| 0 - 12 | 80 - 90 | 20% случаев - в/у гибель плода, самопроизвольное прерывание беременности. 80% случаев - врождённые аномалии развития, триада Грега. |
| 12 - 16 | 50 | Глухота, отставание в умственном развитии, дефекты скелета. |
| 16 - 40 | 30 - 35 | Гепатоспленомегалия, миокардит, тромбоцитопения и др. Субклинические проявления болезни с манифестацией в раннем постнатальном периоде. |
Для подтверждения диагноза врождённой краснухи можно исследовать кровь плода, полученную с помощью кордоцентеза, на наличие специфических IgM антител. Данные антитела могут определяться в сыворотке крови плода с 23 недели гестации и сохраняются в крови внутриутробно инфицированного ребёнка в течение 6 - 12 месяцев после рождения. Иммунитет после врождённой краснухи менее стоек, так как формирование иммунитета происходит в условиях незрелой иммунной системы плода.
Лабораторная диагностика ЦМВИ основана на определении специфических антител в сыворотке крови и других биологических жидкостях наряду с различными методами определения антигена и ДНК вируса. Наличие в крови специфических антител IgG и IgM класса зависит от формы и стадии ЦМВИ.
| | Первичная инфекция (активная стадия) | Латентная форма (неактивная стадия) |
||||
| Перс. | Реактивац. | Суперинф. | ||||
| Клинические симптомы | ± | - | - | ± | ± | |
| IgG антитела | ± | + | + | + | + | |
| IgM антитела | + | - | ± | ± | + | |
| Выделение ДНК вируса | + | ± | + | + | + | |
| Риск передачи от матери к плоду (в баллах) | 5 | 1 | 4 | 3 | 2 | |
Возможны следующие варианты сочетания IgG и IgM антител при ЦМВИ:
- -IgG, -IgM - отсутствие инфицирования. Наблюдается у 5 - 10% взрослого населения. Беременные женщины, не имеющие IgG антител к ЦМВ, включаются в группу риска и обследуются каждый триместр.
- ±IgG, +IgM - первичное инфицирование. Первичная ЦМВИ, возникающая у беременных в 1 - 4% случаях, сопровождается большим риском заражения плода, чем реактивированная.
- +IgG, ±IgM - персистирующая инфекция, реактивация. Можно рассматривать как косвенный признак вирусемии и обострения инфекции. Риск заражения плода составляет 0,5 - 2,5%. В большинстве случаев ЦМВИ протекает бессимптомно и при этом в анамнезе женщины имеются сведения о неблагоприятных исходах беременностей: выкидыши, мёртворождения, рождения детей с пороками развития.
- +IgG, -IgM - инфицированность, состояние ремиссии. Установлено, что наличие специфических IgG антител против ЦМВ в крови пациента указывает скорее на его инфицированность, чем на защищённость от инфекции. Данная ситуация не представляет непосредственной опасности для плода, но так как во время беременности развивается состояние физиологического иммунодефицита, в группу риска должны быть включены и серопозитивные и серонегативные женщины.
Лабораторная диагностика ВПГИ включает в себя определение специфических антител к ВПГ в сыворотке крови наряду с определением антигена ВПГ в клетках крови, осадка мочи, слюне. Так как ВПГ I и ВПГ II имеют общие антигенные детерминанты, раздельное определение антител возможно только с помощью моноклональных антител. Поэтому для скрининговых обследований удобнее определять суммарные IgG к ВПГ I и ВПГ II и суммарные IgM антитела. При постановке диагноза необходимо учитывать лабораторные данные и клинические симптомы.
Возможны следующие варианты при определении специфических антител к ВПГ:
- -IgG, -IgM - отсутствие инфицирования. Наблюдается у 5 - 10% взрослого населения. Беременные женщины, не имеющие IgG антител к ВПГ, включаются в группу риска и обследуются каждый триместр.
- ±IgG, +IgM - первичное инфицирование. Клинические симптомы выявляются в 33% случаев. Возможна трансплацентарная передача. Риск заражения ребёнка во время родов - 50 - 70%. ВПГ передаётся через плаценту в 10 раз реже чем цитомегаловирус.
- +IgG, ±IgM - персистирующая инфекция, реактивация. Как и при ЦМВИ, можно рассматривать как косвенный признак вирусемии и обострения инфекции. В данном случае во время беременности риск заражения плода составляет 5%. В большинстве случаев ВПГИ имеет атипичное течение, и при этом в анамнезе женщины имеются сведения о неблагоприятных исходах беременностей: выкидыши, мёртворождения, рождения детей с пороками развития. Женщины с таким анамнезом подлежат обследованию до беременности.
- +IgG, -IgM - инфицированность, состояние ремиссии. Установлено, что наличие специфических IgG антител к ВПГ, как и при ЦМВИ, в крови пациента указывает скорее на его инфицированность, чем на защищенность от инфекции. Данная ситуация не представляет непосредственной опасности для плода, но так как во время беременности развивается состояние физиологического иммунодефицита, в группу риска должны быть включены и серопозитивные и серонегативные женщины (возможно и первичное инфицирование и обострение ВПГИ). При необходимости обследуют обоих супругов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Читайте также:


