Систематика клещевого энцефалита статьи
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Бахвалова Валентина Николаевна, Чичерина Галина Сергеевна, Панов Виктор Васильевич, Глупов Виктор Вячеславович, Морозова Ольга Владимировна
Сравнительный анализ вирусоносительства и распределения генетических типов вируса клещевого энцефалита (ВКЭ) среди беспозвоночных (2 вида иксодовых клещей Ixodes persulcatus Schulze и Ixodes pavlovskyi Pomerantsev 1946) и позвоночных резервуарных хозяев (4 вида мелких грызунов: красная полевка Myodes rutilus Pallas, красно-серая полевка Myodes rufocanus Sundevall, полевая мышь Apodemus agrarius Pallas, лесная мышовка Sicista betulina Pallas и 1 вид насекомоядных обыкновенная бурозубка Sorex araneus L (1758)), доминирующих на территоррии Новосибирской области в 2009-2014 гг., вирусологическими и молекулярно-биологическими методами показал, что частоты детекции РНК и/или белка Е у млекопитающих (70,9±3,0%) существенно превышали уровни вирусофорности клещей (3,4±0,4). При циркуляции в природных популяциях 3 основных типов ВКЭ дальневосточного (ДВ), сибирского (Сиб) и европейского (Евр) в моноили политиповой формах у клещей преобладал Сиб (p научных работ по ветеринарным наукам , автор научной работы — Бахвалова Валентина Николаевна, Чичерина Галина Сергеевна, Панов Виктор Васильевич, Глупов Виктор Вячеславович, Морозова Ольга Владимировна
Distribution of the tick-borne encephalitis virus among naturally infected ixodid ticks and small mammals in the Novosibirsk region
Бахвалова В.Н.1, Чичерина Г.С.1, Панов В.В.1, Глупов В.В.1, Морозова О.В.2
распределение генетических типов вируса клещевого энцефалита среди спонтанно инфицированных иксодовых клещей и мелких млекопитающих на территории новосибирской области
Сравнительный анализ вирусоносительства и распределения генетических типов вируса клещевого энцефалита (ВКЭ) среди беспозвоночных (2 вида иксодовых клещей Ixodes persulcatus Schulze и Ixodes pavlovskyi Pomerantsev 1946) и позвоночных резервуарных хозяев (4 вида мелких грызунов: красная полевка Myodes rutilus Pallas, красно-серая полевка Myodes rufocanus Sundevall, полевая мышь Apodemus agrarius Pallas, лесная мышовка Sicista betulina Pallas и 1 вид насекомоядных - обыкновенная бурозубка Sorex araneus L (1758)), доминирующих на тер-риторрии Новосибирской области в 2009-2014 гг., вирусологическими и молекулярно-биологическими методами показал, что частоты детекции РНК и/или белка Е у млекопитающих (70,9±3,0%) существенно превышали уровни вирусофорности клещей (3,4±0,4). При циркуляции в природных популяциях 3 основных типов ВКЭ - дальневосточного (ДВ), сибирского (Сиб) и европейского (Евр) в моно- или политиповой формах у клещей преобладал Сиб (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Сравнение вирусофорности, нейровирулентности вирусных изолятов и распределение генетических типов ВКЭ у иксодовых клещей на территории Новосибирской области
Вид клеща Патогенность изолятов ВКЭ для лабораторных мышей Вирусо-форность (% = т1) Нейровирулентность изолятов ВКЭ от иксодовых клещей (lg LD50±m') Число образцов для мо- Частота типов ВКЭ среди клещей, положительных в ОТ-ПЦР-РВ
внутримоз-говые титры подкожные титры лекулярного типирования ДВ Сиб Евр смешанная инфекция разными типами ВКЭ
Ixodes Патогенный 1,8±0,3** 3,86±0,32 2,26±0,3 Патогенный 95,7±4,3 91,3±6,0 9,5±6,6 91,3±6,0
Pavlovskiy 28/1514 (п = 23) 22/23 21/23 2/21 21/23
Апатогенный 1,5±0,5 - - Апатогенный 14,3±14,3 85,7±14,2 28,5±18,4 14,3±14,3
22/1514 (п = 7) 1/7 6/7 2/7 1/7
Всего 3,3±0,5 - - Всего 76,7±7,9* 90,0±5,6 14,3±6,7 73,3±8,2
50/1514 (п = 30) 23/30 27/30 4/28 22/30
Ixodes Патогенный 0,8±0,4** 3,18±0,44 1,93±0,5 Патогенный 100,0 100,0 12,5±12,5 100,0
persulcatus 9/1146 (п = 8) 8/8 8/8 1/8 8/8
Апатогенный 2,8±0,5 - - Апатогенный 23,8±9,5 76,1±9,5 14,3±7,8 14,3±7,8
32/1146 (п = 21) 5/21 16/21 3/21 3/21
Всего 3,6±0,6 - - Всего 44,8±9,4* 82,8±7,1 13,8±6,5 37,9±9,2
41/1146 (п = 29) 13/29 24/29 4/29 11/29
Патогенный 1,4±0,2 3,64±0,25 2,12±0,25 Патогенный 96,8±3,2 93,5±4,5 9,7±5,4 93,5±4,5
37/2660 (п = 31) 30/31 29/31 3/31 29/31
Всего . Апатогенный 2,0±0,3 - - Апатогенный 21,4±7,9 78,6±7,9 17,9±7,4 14,2±6,7
54/2660 (п = 28) 6/28 22/28 5/28 4/28
Всего 3,4±0,4 - - Всего 61,0±6,4** 84,7±4,7** 14,0±4,6 55,9±6,5
91/2660 (п = 59) 36/59 51/59 8/59 33/59
Примечание. т1 - статистическая погрешность процента и инфекционного титра ^ LDJ0. *, ** - уровни статистической значимости различий; р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Детекция ВКЭ посредством комплекса вирусологических и молекулярно-биологических методов в 2660 имаго клещей двух видов выявила в среднем 3,4±0,4% инфицированных особей. При этом лишь 1,4±0,2% содержали патогенный для лабораторных мышей ВКЭ, РНК ВКЭ и белок оболочки вирионов Е, а остальные 2,0±0,3% не вызывали признаков КЭ у мышей. Частоты детекции ВКЭ у клещей Павловского и таежного статистически не различались, но частота обнаружений патогенного вируса по данным биопробы у клеща Павловского (1,8±0,3%) значимо превосходила (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
органы 33,7±2,1 35,0±1,2 52,7
клетки крови 31,8±1,1 39,6±1,0 Н.и.
Обыкновенная бурозубка Sorex araneus L.:
органы 40,5±2,3 29,8±2,6 29,0±2,5
(14,0-50,3) (25,6-48,1) (26,0-31,9)
Всего в мелких млекопитающих:
органы 36,0±1,3 36,0±1,4 36,9±10,0
(10,7-52,5) (22,9-48,1) (26,0-52,7)
Молекулярное типирование посредством ОТ-ПЦР-РВ и филогенетический анализ нуклеотидных последовательностей генов Е и NS1 изолятов РНК ВКЭ от клещей (см. рисунок) показали моно- или смешанные формы инфекции тремя основными типами ВКЭ. Анализ генетического состава ВКЭ у инфицированных иксодид обоих видов показал, что в среднем превалировала доля особей с Сиб-типом (84,7±4,7%), значимо (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
16/34 15/16 5/16 4/16
Лесная мышовка Sicista betulina Pallas:
органы 77,8±10,0 64,3±13,3 85,7±9,7 0 50,0±13,9
14/18 9/14 12/14 0/12 7/14
Обыкновенная бурозубка Sorex araneus L.:
органы 73,3±8,2 77,2±9,2 45,5±10,8 28,6±12,5 31,8±10,2
22/30 17/22 10/22 4/14 7/22
Всего в органах мелких млекопитающих (грызунов и насекомоядных) .
Всего в органах и крови мелких млекопитающих (грызунов и насекомоядных) .
59,5±4,0 91/153 62,1±3,2 144/232
64/91 78,5±3,4* 113/144
55/91 55,6±4,2 80/144
31/91 36,1±4,0 52/144
Примечание. '(A±m): А - % животных, содержащих РНК ВКЭ среди исследованных, m - статистическая погрешность (в %); * - уровень статистической значимости отличий p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
□ изолят ВКЭ 27 от Myodes rutilus _Васильченко L40361
* изолят 2452 от Ixodes persulcatus GQ423570
1-* изолят 2730 от Ixodes pavlovskyi JN993573
i *изолят 2432 от Ixodes persulcatus GQ423569 "изолят 2689 от Ixodes persulcatus JQ693478 100 г Абсеттаров AF091005 Найдорф NC 001672 К23 АМ600965
ОГЛ штамм NK-8-14(3)/9984 AF482348
Филогенетический анализ нуклеотидных последовательностей фрагмента гена Е изолятов ВКЭ от иксодовых клещей и мелких млекопитающих на территории Новосибирской области (выделенные жирным шрифтом и звездочкой), с использованием ПО Mega 6.06 (UPGMA, 1000 репликаций). Внешняя группа: штамм NK-8-14(3)/9984 вируса омской геморрагической лихорадки (ОГЛ) (номер доступа в GenBank AF482348), выделенный от гамазового клеща Androlaelaps casalis на территории Новосибирской обл. в 1991 г. Референсные штаммы трех основных генетических типов ВКЭ: Софьин (дальневосточного типа); Айна, Васильченко и Заусаев (сибирского типа); Абсеттаров, Найдорф и К23 (европейского типа).
мыши соответствовала инфицированности образцов их органов.
Молекулярное типирование посредством ОТ-ПЦР-РВ с генотипспецифичными флуоресцентными зондами показало моно- или смешанные формы инфекции ДВ-, Сиб- и Евр-субтипами ВКЭ (см. табл. 3). В среднем среди инфицированных млекопитающих в отличие от клещей значимо чаще (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Монотип ДВ 15/94 16,0±3,8 0 1 1 13 Н.и.
Монотип Сиб 1/94 1,1±1,1 0 0 1 0 Н.и.
ОТ-ПЦР - отрицательные 70/94 74, ±4,5 0 0 3 67 Н.и.
В с е г о . 94 1/94 1/94 8/94 84/94 Н.и.
1,1±1,1 1,1±1,1 8,5±2,9 89,4±3,2
Апатогенные гомогенаты органов мелких млекопитающих
Смесь ДВ- и Сиб-типов 17/130 13,1±3,0 0 1 7 9 Н.и.
Монотип ДВ 30/130 23,1±3,7 0 5 5 20 Н.и.
12/130 9,2±2,5 71/130 54,6±4,4
Примечание. 'X - абсолютное количество изолятов, содержащих РНК ВКЭ указанного генетического субтипа среди всех исследованных (n); 2(A±m): А - процент изолятов с ВКЭ указанного субтипа среди всех исследованных, m - статистическая погрешность (в %).
1,4 -2,6 мг, у нимф - 15,9-16,5 мг [4, 16]. Следовательно, при питании личинки могут быть инфицированы кровью мелких грызунов, содержащей до 624 молекул РНК ДВ-типа ВКЭ, нимфы - до 3960, Для Сиб-типа количества в 1000 раз меньше, поэтому возможно попадание лишь единичных геномных РНК как в личинки, так и в нимфы. Теоретическая возможность передачи ВКЭ разных типов с кровью диких грызунов неполовозрелым клещам подтверждает их резервуарную роль.
Изменения соотношений генетических типов при адаптациях к лабораторным мышам. Комплексное
(внутримозговое и подкожное) инфицирование новорожденных лабораторных мышей icR гомогена-тами клещей или органов диких мелких млекопитающих, содержащих ВКЭ, приводило к изменениям исходного генетического состава ВКЭ (табл. 4). При этом смешанный состав патогенных изолятов ВКЭ после введения в мозг лабораторным мышам изменялся в единичных случаях. В то же время апа-тогенные изоляты вирусной РНК, полученные из клещей и органов млекопитающих, претерпевали существенную трансформацию генетической структуры с изменением, исчезновением исходных типов
или даже появлением в мозге клинически здоровых мышей. Обращает на себя внимание одинаковый характер изменений исходного генетического состава апатогенного ВКЭ из клещей и органов млекопитающих - снижается доля образцов с РНК ВКЭ ДВ-типа и инфицированных смесью РНК двух типов, но увеличивается относительное количество образцов, содержащих моноинфекцию РНК ВКЭ Сиб-типа (см. табл. 4).
Вирусоносительство у диких мелких млекопитающих существенно превышало вирусофорность среди иксодовых клещей. В отличие от клещей в гомогенатах органов и крови млекопитающих, содержащих РНК и/или белок Е ВКЭ, патогенный для лабораторных мышей вирус выявлен только у единичных особей.
Молекулярно-генетический анализ показал, что на территории Новосибирской области среди клещей и мелких млекопитающих циркулируют 3 основных типа ВКЭ - дальневосточный, сибирский и европейский в моно- или политиповой форме.
Среди инфицированных клещей преобладал сибирский тип ВКЭ (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
3. Gritsun T.S, Lashkevich V.A., Gould E.A. Tick-borne encephalitis. Antiviral Res. 2003; 57 (1-2): 129-46.
4. Filippova N.A. Taiga Tick Ixodes Persulcatus Schulze (Acarina, Ixodidae): Morphology, Systematics, Ecology, Medical Importance. [Taezhnyy kleshch Ixodes Persulcatus Schulze (Acarina, Ixodidae): morfologiya, sistematika, ekologiya, meditsinskoe znachenie]. Leningrad: Nauka; 1985. (in Russian)
6. Panov V.V. Small mammals of forest recreation zone of Novosibirsk Scientific Center - as natural hosts of immature taiga ticks. In: Vlasov V.V., Repin V.E., eds. Tick-borne Infections in Siberian Region. [Infektsii, peredavaemye kleshchami v Sibirskom regione]. Novosibirsk: PH SB RAS; 2011: 35-50. (in Russian)
7. Bakhvalova V.N., Dobrotvorsky A.K., Panov V.V., Matveeva V.A., Tkachev S.E., Morozova O.V. Natural tick-borne encephalitis virus infection among wild small mammals in the southeastern part of western Siberia, Russia. Vector Borne Zoonot. Dis. 2006; 6 (1): 32-41.
8. Deryabin P.G., Lebedeva G.A., Loginova N.V. Neutralization reaction of togaviruses in mice and tissue cultures. In: Arboviruses (Methods of Laboratory and Field Research). [Arbovirysy (metody laboratornykh i polevykh issledovaniy] / Ed. S. Ya. Gayda-movich. Moscow: Nauka; 1986: 120-6. (in Russian)
9. Clarke D.H., Casals J. Techniques for hemagglutination and he-magglutination-inhibition with arthropod-borne viruses. Am. J. Trop. Med. Hyg. 1958; 7 (5): 561-73.
10. Morozova O.V., Grishechkin A.E., Bakhvalova V.N., Isaeva E.I., Podchernyaeva R.Ya. Changes in the reproduction of tick-borne encephalitis virus in cell cultures. Voprosy virusologii. 2012; 57 (2): 40-3. (in Russian)
11. Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular evolutionary genetics analysis version 6.0. Mol. Biol. Evolut. 2013; 30: 2725-9.
12. Lakin G.F. Biometry. [Biometriya]. Moscow: High School; 1980. (in Russian)
14. Chicherina G.S., M^rozova O.V., Panov V.V., Romanenko VN., Bakhvalov S.A., Bakhvalova VN. Comparative analysis of the tick-borne encephalitis virus (TBEV) infection of unfed adult ixo-did ticks Ixodes pavlovsky Pomerantsev 1946 and Ixodes persulcatus Schulze in the sympatria area of their natural habitats. Epidemi-ologiya i infektsionnye bolezni. 2015; 20 (1): 20-6. (in Russian)
15. Pogodina V.V., Frolova M.P., Erman B.A. Chronic Tick-borne Encephalitis. [Khronicheskiy kleshchevoy entsefalit]. Novosibirsk: Nauka; 1986. (in Russian)
16. Balashov Yu.S. Ixodid Ticks - Parasites and Vectors of Diseases. [Iksodovye kleshchi - parazity i perenoschiki infektsiy]. St. Petersburg: Nauka; 1998. (in Russian)
Сведения об авторах:
Чичерина Галина Сергеевна, мл. науч. сотр. лаб. патологии насекомых, chicherinagalina@bk.ru; Панов Виктор Васильевич, канд. биол наук, ст. науч. сотр. лаб. экологии сообществ позвоночных животных; Глупов Виктор Вячеславович, доктор биол. наук, зав. лаб. патологии насекомых, директор ФГБУН Институт систематики и экологии животных СО РАН, e-mail: skif@eco.nsc.ru; Морозова Ольга Владимировна, доктор биол. наук, вед. науч. сотр. лаб. иммунологии, e-mail: omorozova2010@gmail .com
Колпаков С.Л., Яковлев А.А
о методологии оценки эпидемиологической ситуации
Цель исследования - изучение методов оценки заболеваемости и разработка методики оценки эпидемиологической ситуации в субъекте РФ за календарный год. Условием объективной оценки является использование внешних критериев. Поэтому оценка той или иной административной территории проводится по распределению заболеваемости по отдельным субъектам Российской Федерации. В качестве критерия предлагается использовать среднюю заболеваемость субъекта РФ - медиану и ее доверительные границы с достоверностью 95%. Как инструмент градации оценочной шкалы рассматриваются как весь доверительный интервал, так и возможности перехода к центильному методу. Разработаны методические принципы оценки эпидемиологической ситуации. Основой является положение, что объективной в территориальном аспекте может быть оценка только роли стабильных факторов. На первом этапе оценивать эпидемическую обстановку следует по теоретической заболеваемости рассматриваемого года или по прогнозу. В последующем после проведения ретроспективного эпидемиологического анализа заболеваемости в субъекте и установления роли детерминант эпидемического процесса в показателе рассматриваемого года (внутренний контроль), можно провести корректировку и вновь оценить эпидемиологическую ситуацию.
Ключевые слова: оценка; заболеваемость; эпидемиологическая ситуация; эпидемиологический анализ; критерии.
Для цитирования: Эпидемиология и инфекционные болезни. 2015; 20 (4): 34-39.
Kolpakov S.L., YakovlevA.A.
about assessment of the methodology of the epidemiological situation
Pacific State Medical University, 2, Ostryakov Avenue, Vladivostok, Russian Federation, 690002
Objective: the study of methods for the assessment of the prevalence and development of methodology for evaluation of the epidemiological situation in the RF subjects during the calendar year. The condition of an objective evaluation is the use of external criteria. Therefore, the assessment of one or another administrative territory is performing accordingly to the distribution of morbidity rate in separate subjects of the Russian Federation. As a criterion there is proposed to use the average prevalence of the subject of the Russian Federation - the median and its confidence limits with 95% significance. As a tool for grading of the scale there are considered as the total confidence interval, as possibilities of transition to centile method. There were elaborated methodical principles of the evaluation of the epidemiological situation. The base is the position that the objective, in territorial aspect may be the estimation only of the role of the stable factors. At the first stage the epidemiological situation should be to assessed on the theoretical prevalence of the year under consideration or on the forecast. Later, after the performing of the retrospective epidemiological analysis of morbidity in the subject and establishing the role of the determinants of the epidemic process in the index of considered year (internal control) it is possible to make adjustment and newly re-assess the epidemiological situation.
Key words: evaluation; morbidity; epidemiological situation; epidemiological analysis; criteria.
For citation: Epidemiologiya i Infektsionnye Bolezni. 2015; 20(4): 34-39. (In Russ.)
Среди переносчиков инфекционных заболеваний человека клещи занимают второе место после комаров: на сегодня выявлено не менее трех вирусных, 22 бактериальные и несколько протозойных инфекций, которые переносятся иксодовыми клещами. Ситуация зачастую осложняется тем, что при укусах клещи способны передавать человеку одновременно разные виды бактерий, вирусов и простейших, вызывая смешанные инфекции, часто протекающие в более тяжелых формах. Дополнительный риск заражения возникает из-за возможной циркуляции патогенов в сельскохозяйственных и домашних животных (например, инфекционные агенты могут сохраняться в молочных продуктах), а также при переливаниях крови и трансплантации органов. Наиболее опасными среди инфекций, переносимых клещами, считаются клещевой энцефалит, иксодовый клещевой боррелиоз, эрлихиоз, риккетсиоз и бабезиоз. Для России наиболее социально значимыми инфекционными агентами являются боррелии и конечно же вирус клещевого энцефалита, о котором пойдет речь ниже.
Таежная инфекция
В 30-х гг. XX в. шло интенсивное освоение Дальнего Востока: строились дороги, вырубались леса, из-за напряженных отношений с Японией в тайге дислоцировались крупные военные части. Врачи, работавшие в то время в Приморском крае, стали регулярно сообщать о неизвестной тяжелой болезни, поражающей как местных жителей, так и военных. Заболевание, считавшееся новой разновидностью тяжелого гриппа, сопровождалось резким повышением температуры и часто приводило к параличам и даже гибели заболевших.
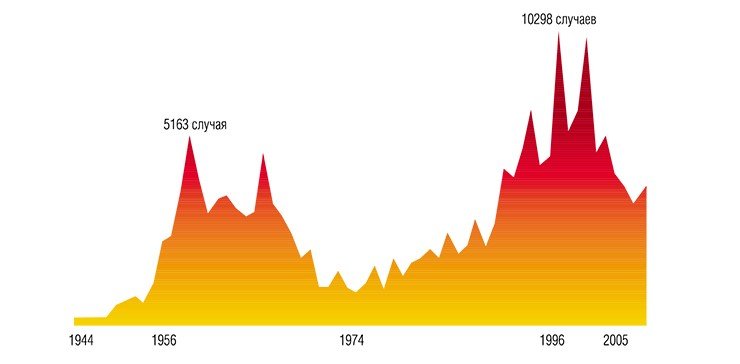
Правильно диагностировать неизвестную болезнь удалось лишь в 1935 г. местному врачу А. Г. Панову. Заболевание оказалось воспалением мозга, т. е. энцефалитом, похожим по симптомам на описанный ранее японский энцефалит. В 1936 г. врачи дальневосточной пастеровской станции пытались выделить возбудителя заболевания, вводя мышам в мозг эмульсию мозга людей, погибших от энцефалита. Но, несмотря на то, что у мышей появлялись признаки заболевания, исследования не увенчались успехом.
В январе 1937 г. военные медики обратились в Наркомздрав СССР, где и было принято решение об организации на Дальний Восток научной экспедиции под руководством Л. А. Зильбера. В тяжелых полевых условиях была развернута настоящая вирусологическая лаборатория. Ученые свою задачу выполнили: патоген, вызывающий тяжелые заболевания центральной нервной системы, был успешно выделен и описан. Кроме того, была четко установлена определяющая роль иксодовых клещей в передаче инфекционного агента. Выяснилось, что источником заражения клещей служили дикие позвоночные животные, на основе чего были разработаны рекомендации по необходимым профилактическим мерам.
К сожалению, это поистине блестящее открытие, ставшее важной вехой в истории вирусологии, не обошлось без жертв среди самих участников научной экспедиции. Так, М. П. Чумаков – будущий академик и создатель Института по изучению полиомиелита – перенес тяжелейшую форму инфекции, перешедшую у него в хроническую пожизненную форму; последствием заболевания у В. Д. Соловьева стала шестимесячная слепота.
Опасный сосед
Что на сегодня известно о вирусе клещевого энцефалита (ВКЭ)? Вирус относится к достаточно старому в эволюционном плане семейству флавивирусов (Flaviviridae), включающему более 70 вирусов животных и человека, в том числе такие опасные, как вирус желтой лихорадки, японского энцефалита, вирус лихорадки Денге и вирус гепатита C.

Лев Александрович ЗИЛЬБЕР (1894—1966) – один из основоположников медицинской науки в СССР. С его именем связаны фундаментальные исследования изменчивости у бактерий и природы иммунитета, организация первых в стране вирусологических центров, создание и экспериментальная разработка вирусо-генетической теории происхождения опухолей, а также совершенно нового направления – иммунологии рака.
За работу по выявлению возбудителя и переносчика весенне-летнего энцефалита в 1937 г. был награжден премией Наркомздрава СССР, но в том же году арестован по ложному обвинению, что экспедиция, которую возглавлял Зильбер, тайно распространяла японский энцефалит на Дальнем Востоке, и освобожден лишь через полтора года. В короткий промежуток времени между освобождением и новым арестом работал над монографией об эпидемических энцефалитах, подготовил несколько статей.
Основным природным резервуаром ВКЭ служат мелкие млекопитающие (полевки, мыши, насекомоядные). Вирус способен заражать животных и размножаться в их организме, однако заболевание протекает у них зачастую без видимого вреда для здоровья. Переносчиками вируса являются клещи, питающиеся кровью лесных зверьков, – европейский лесной клещ, таежный, луговой клещи, а также ряд других, более редко встречающихся видов. ВКЭ может размножаться и в их организме. Точно не известно, был ли вирус первоначально связан только с клещами, или только с позвоночными животными, но в процессе эволюции он приспособился к существованию в организмах как тех, так и других.
В настоящее время вирус клещевого энцефалита встречается в лесных регионах по всей территории Евразии от Атлантического океана до Тихого, причем в целом область его распространения совпадает с ареалами европейского лесного и таежного клещей. В последние десятилетия ареал ВКЭ неуклонно расширяется, что связано с усилением хозяйственной деятельности человека. Так, заброшенные лесные вырубки зарастают мелкими кустарниками и заболачиваются, что создает идеальные условия для обитания мелких млекопитающих и связанных с ними клещей.
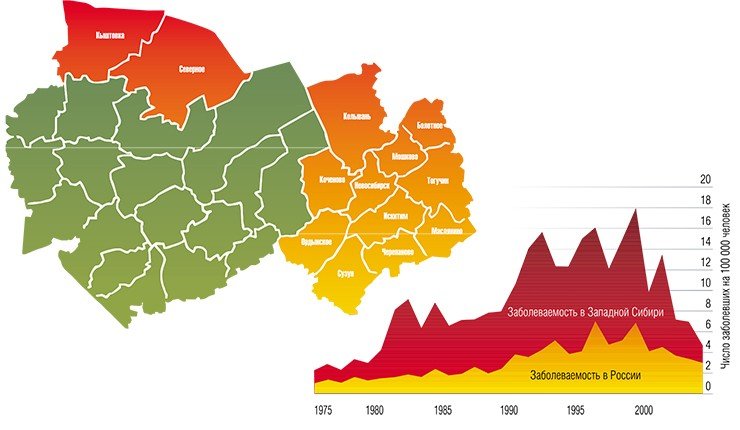
Кроме того, все большее число людей предпочитает проводить свободное время на природе, отдыхая или работая на приусадебных участках. В той же Новосибирской области около 75% населения проживает на территории, условия которой благоприятны для жизни клещей, здесь же сосредоточена и основная масса летних оздоровительных учреждений, зон массового отдыха, садово-дачных участков.
В Институте химической биологии и фундаментальной медицины были исследованы 95 штаммов вируса клещевого энцефалита из коллекции Института систематики и экологии животных СО РАН, выделенных от взрослых особей таежного клеща, собранных с растительности в восточной части Новосибирской области в 1980—2001 гг.
Анализ нуклеотидных последовательностей фрагмента гена Е, кодирующего белок оболочки вируса, показал, что все штаммы соответствуют сибирскому генетическому типу.
С другой стороны, в крови людей, госпитализированных с подозрением на клещевые инфекции, в совместных исследованиях с новосибирскими медиками были обнаружены изоляты ВКЭ, относящиеся к дальневосточному генетическому типу.
Ранее считалось, что этот тип вызывает только тяжелые формы заболевания, тогда как сибирский – преимущественно хронические. Наши исследования, подтвержденные данными других авторов, показали, что вирус дальневосточного генетического типа способен вызывать различные формы клещевого энцефалита, начиная от самых тяжелых и заканчивая стертыми, никак не проявляющимися.
Геном вируса клещевого энцефалита был расшифрован в 1989—1990 гг. практически одновременно в нашей стране (в том числе и в Институте химической биологии и фундаментальной медицины СО РАН (Pletnev et al., 1990)) и за рубежом (Mandl et al., 1989). На сегодня выделено три генетических типа вируса, различающихся по своим свойствам: дальневосточный, сибирский и западноевропейский. Такая привязка генетического типа к географическому местоположению достаточно условна, поскольку в одном регионе могут встречаться штаммы, относящиеся к разным типам.
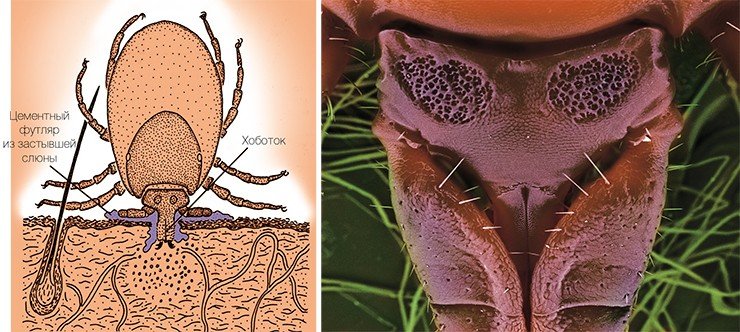
Для вируса клещевого энцефалита, как и для большинства других вирусных инфекций, не существует высокоспецифических методов лечения – в этом заключается его опасность. Лечение всех вирусных заболеваний направлено в основном на стимуляцию иммунитета и устранение внешних симптомов заболевания, а дальше организм должен сам справляться с инфекцией. ВКЭ опасен еще и тем, что способен вызывать хронические формы заболевания, а его последствиями могут быть параличи и инвалидность. Поэтому важнейшим делом в исследовании этого инфекционного агента является разработка методов диагностики и профилактики заболевания.
Диагностика и профилактика
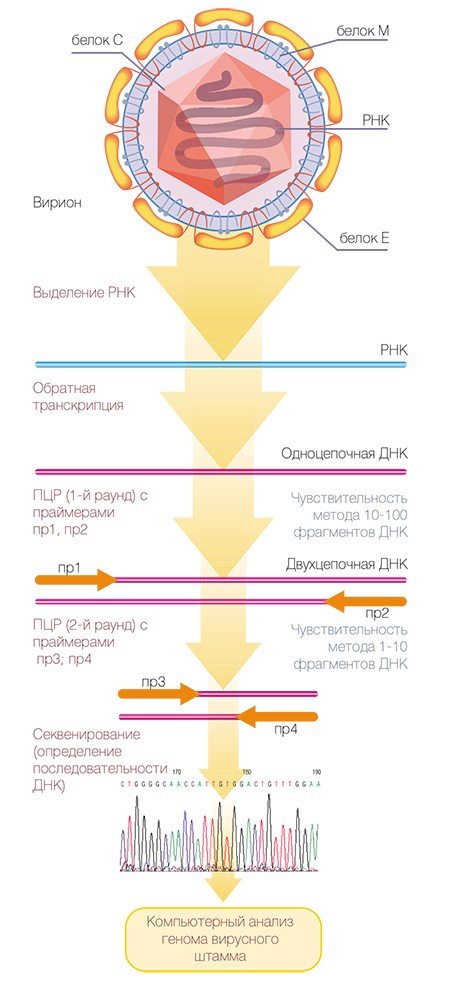
В клинической диагностике вируса клещевого энцефалита наиболее распространены серологические методы, с помощью которых в крови пациента определяют наличие антител, специфических защитных белков, или наличие самого агента. Однако чувствительность этих методов не слишком высока, к тому же существует вероятность ошибки из-за возможных перекрестных реакций с другими патогенами. Кроме того, с их помощью невозможно получить подробную характеристику самого возбудителя (например, определить его генетический тип).
Молекулярно-генетические методы, направленные на специфическое распознавание генетического материала вируса, обладают более высокой чувствительностью. Особенно это относится к методу полимеразной цепной реакции** (ПЦР), благодаря которой можно размножить, а потом идентифицировать ничтожное количество наследственного материала вируса, что позволяет провести диагностику в течение первых дней после заражения. Однако при некоторых обстоятельствах достоинства могут переходить в недостатки: генодиагностика ВКЭ молекулярно-генетическими методами благодаря высокой чувствительности может также приводить к ошибкам, обусловленным многочисленными новыми мутациями вирусных геномов, а кроме того, предъявляет высокие требования к чистоте экспериментов.

Живые вакцины
Живые вакцины – способ стимуляции иммунитета введением в организм ослабленных вирусов, открытый еще в 1796 г. английским врачом Э. Дженнером. С тех пор была получена живая вакцина против вируса желтой лихорадки, отличающаяся от высокопатогенных штаммов многочисленными заменами нуклеотидов в геноме; продолжаются поиски ослабленных штаммов флавивирусов Денге, Западного Нила и Лангат для разработки на их основе живых вакцин.
Были предприняты попытки создания живой вакцины и против вируса клещевого энцефалита. В 1957 г. в качестве такой живой вакцины было решено использовать ослабленный штамм флавивируса Лангат, вызывающий в организме выработку антител, подобных антителам к ВКЭ. Однако выяснилось, что при внутримозговом введении этот штамм сам становится патогенным и вызывает энцефалиты и атрофию участков мозга без внешних клинических проявлений. В дальнейшем были обнаружены ослабленные штаммы самого ВКЭ, но, к сожалению, все они оказались генетически нестабильными.
Вот трагический пример использования живых вакцин против ВКЭ. В 1969 г. от больного, у которого после укуса клеща в течение 4 лет не было клинических проявлений заболевания, но в крови сохранялись высокие титры антител, был выделен ослабленный штамм вируса клещевого энцефалита. Лабораторные исследования выявили его низкую нейровирулентность, после чего были проведены клинические испытания на добровольцах, давшие положительные результаты. В конечном счете ослабленным штаммом ВКЭ было иммунизировано около 650 тыс. человек. Однако 35 вакцинированных получили тяжелые осложнения в виде менингитов и менингоэнцефалитов, причем у 22 из них тяжелые последствия заболевания остались на всю жизнь, а один человек умер. Использование этого штамма в качестве живой вакцины было прекращено (Timofeev, Karganova, 2003).
ДНК-копии
С помощью подобных манипуляций были созданы живые химерные вакцины, содержащие, например, часть генов вируса желтой лихорадки и часть генов других флавивирусов. При этом в функционально важные участки их геномов были введены точечные мутации, вызывающие ослабление патогенности (Pletnev et al., 2006).
Тем не менее в настоящее время применение ослабленных живых вакцин, в том числе и против ВКЭ, ограничено, поскольку существует вероятность превращения ослабленных штаммов в высокопатогенные штаммы дикого типа. Это происходит потому, что в клетке-хозяине отсутствуют системы коррекции мутаций, которые могут возникнуть в вирусной РНК. Гарантией безопасности таких вакцин могла бы служить утрата больших фрагментов вирусных геномов, однако это приводит к значительному снижению жизнеспособности самих вирусов-мутантов.
Нужно отметить, что исследования флавивирусов, как и многих других патогенов, осложняются их высокой инфекционностью, следствием которой являются строгие требования безопасности, а также дороговизной самих вирусных препаратов. И в этом смысле использование неинфекционных ДНК-копий генома ВКЭ является очень перспективным направлением.
В ИХБФМ был получен ряд генно-инженерных ДНК, содержащих в том числе и полноразмерную ДНК-копию генома вируса клещевого энцефалита (Dobrikova et al., 1996). Конструирование подобных стабильных ДНК-копий вирусных геномов открывает широкие возможности для исследования хода размножения вируса в клетках, изучения функций отдельных вирусных белков и их комплексов.
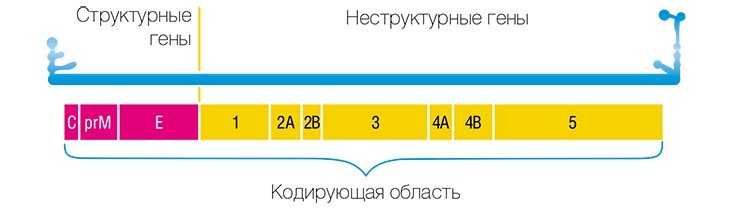
Иммунизация генами
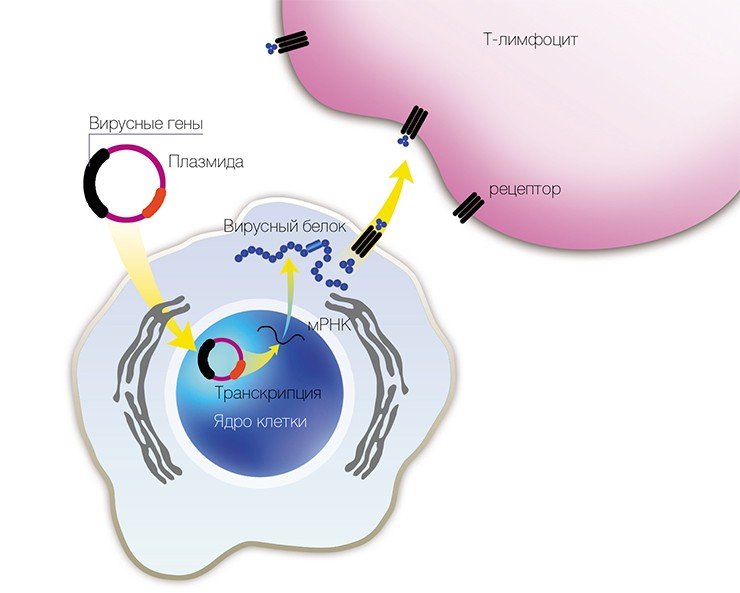
В 1993 г. появился новый подход к профилактике инфекционных заболеваний – генная иммунизация, основанная на прямом введении в организм генно-инженерной ДНК, рекомбинантных плазмид (векторов-переносчиков), содержащих не весь геном, но отдельные гены возбудителя заболевания.
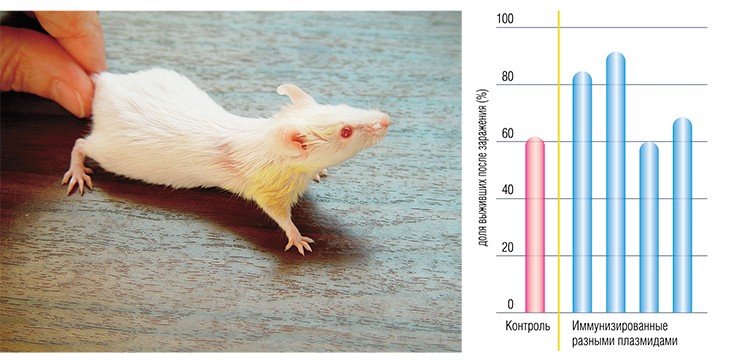
Учеными из ИХБФМ были сконструированы четыре таких плазмиды, содержащие различные гены одного из штаммов вируса клещевого энцефалита. Для оценки эффекта генной иммунизации привитых мышей заражали летальными дозами того же штамма ВКЭ. В результате оказалось, что некоторые плазмиды обладают определенным защитным эффектом.
В качестве вакцин против вирусных заболеваний ученые предполагают использовать генно-инженерные плазмиды, в которые встроены отдельные гены вирусов
Чтобы изучить возможные нежелательные эффекты этих вакцин, плазмиды вводили в различные клеточные культуры. В результате выяснилось, что при увеличении времени культивирования клеток до нескольких месяцев наблюдалась существенная модификация плазмид и встраивание их в хозяйский геном.
Таким образом, несмотря на положительные результаты генной вакцинации, вопрос о применении ДНК-вакцин в настоящее время остается открытым, поскольку препятствием к их использованию также является проблема безопасности. Возможно, преодолеть это препятствие удастся созданием РНК-вакцин с аналогичным принципом действия, для которых не существует риска интеграции в ДНК-геном хозяйской клетки. Но это уже задачи будущих исследований.
Возможно ли полностью избавиться от ВКЭ, например, уничтожив его основных переносчиков, иксодовых клещей? В свое время такая попытка была сделана с использованием печально известного ДДТ, но последствия массовой обработки лесов сильнейшим ядом были поистине ужасающими.
Читайте также:


