Реферат диагностика инфекционного эндокардита
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Инфекционный эндокардит (ИЭ) – это воспалительное заболевание инфекционной природы, при котором на клапанах, пристеночном эндокарде или на эндотелии крупных сосудов формируется патологический процесс в виде вегетаций, представляющих собой конгломерат из фибрина, тромбоцитов и микробных тел.
по клиническому течению:
острый (более выражены симптомы, плохой прогноз);
подострый (затяжной) (менее вирулентные м/о, прогноз лучше);
по наличию предрасполагающего морфологического субстрата:
первичный (30-40%) – на неизмененных клапанах сердца или пристеночном эндокарде;
вторичный (на эндокарде, измененном вследствие врожденных или приобретенных нарушений, в т.ч. при кардиохирургических вмешательствах – протезировании клапанов):
ранний ИЭ протезированного клапана (1-2 месяца после операции);
поздний ИЭ протезированного клапана.
заболеваемость – от 1 до 6 случаев на 100 000 населения;
мужчины болеют в 2-3 раза чаще женщин;
Частота выявления отдельных возбудителей:
viridans – 35% (широко представлен в полости рта и глотки, клеточные белки их стенки способны связываться с эндокардом, длительно персистируют),
faecalis – 10% (слизистая ЖКТ и мочеполовой системы);
aureus – 23% (кожа, слизистая носа; высоковирулентны, плохой прогноз, вызывают ранний ИЭ протезированных клапанов, а также у наркоманов),
характерное поражение сосудов: эмболии, септические инфаркты легких, микотические аневризмы, внутричерепные кровотечения и т.д.;
иммунные феномены: ГН, обнаружение ревматоидного фактора в сыворотке крови, ложноположительная RW (синтез антикардиолипиновых антител);
данные микробиологического исследования: положительный результат посева крови с выделением возбудителя, способного вызвать ИЭ.
С чем проводится:
симптом лихорадки неясного генеза;
системные болезни соединительной ткани (например, СКВ);
миксома левого предсердия (необходима ЭХО-КГ);
различные инфекции и т.д.
I. Медикаментозная терапия:
II. Хирургическое лечение.
основополагающее направление – антибактериальная терапия.
Основные принципы антибактериальной терапии:
применение антибиотиков с бактерицидным действием;
парентеральное введение (лучше всего в/в) препаратов с соблюдением рекомендуемых интервалов между инъекциями с целью поддержания оптимальной концентрации препарата в крови;
использование комбинаций препаратов, обладающих аддитивным эффектом;
достаточная длительность лечения (зависит от возбудителя, но не менее 4 недель);
назначение антибиотиков с учетом чувствительности к ним возбудителей.
наиболее вероятный возбудитель – Streptococcus (например, после стоматологических манипуляций):
бензилпенициллин 16-18 млн. ЕД/сут в/в (или ампициллин 2 г в/в через 4 часа) + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов.
если предполагаем, что возбудитель – Staphylococcus:
оксациллина натриевая соль (или ампициллин) 2 г в/в через 4 часа + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов.
Схема резерва (№3):
ванкомицин 15 мг/кг (но не более 1 г) в/в каждые 12 часов + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов.
Терапия ИЭ стрептококковой этиологии:
либо схема №1, либо №3, либо:
цефалоспорин III поколения (цефтриаксон 2 г в/в 1 раз в сутки) + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов.
Применяемая схема должна дать клинический эффект в течении 3-5 суток, в противном случае препараты необходимо заменить.
Терапия ИЭ стафилококковой этиологии:
Эндокардит собственных клапанов
оксациллина натриевая соль (или ампициллин) 2 г в/в через 4 часа (цефазолин 2 г в/в через 8 часов или цефтриаксон 2 г в/в 1 раз в сутки);
ванкомицин 15 мг/кг (но не более 1 г) в/в каждые 12 часов + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов;
Эндокардит протезированных клапанов
оксациллина натриевая соль 2 г в/в через 4 часа (цефазолин 2 г в/в через 8 часов или цефтриаксон 2 г в/в 1 раз в сутки) или ванкомицин 15 мг/кг (но не более 1 г) в/в каждые 12 часов + гентамицина сульфат 1 мг/кг (max 80 мг) в/в через 8 часов + рифампицин 300 мг внутрь 3 раза в сутки.
В начальной стадии ИЭ ГКС не применяются, а позже, когда уже включаются иммунные механизмы (не инфекционные), например, при артрите, экссудативном васкулите, – по 1 мг/кг/сут. Назначение НПВС многие считают нецелесообразным.
Применение гепарина дискутабельно: в основном используют как антикомплементный препарат, а также при ГН.
Симптоматическая терапия: лечение сердечной недостаточности (ИАПФ, диуретики и др.), антиаритмики.
выраженная сердечная недостаточность;
неконтролируемая инфекция (безуспешное лечение в течение 10-14 дней);
наличие внутрисердечного абсцесса и/или фистулы;
рецидивирующие эмболии (из-за крупных вегетаций);
наличие гнойного перикардита (необходимо дренировать);
При эндокардите протезированных клапанов:
нарушение функции и/или фиксации протеза.
все стоматологические манипуляции, способные вызвать травматизацию слизистой;
тонзиллэктомия и аденоидэктомия;
хирургические операции связанные с травматизацией слизистой пищеварительной трубки, мочеполового тракта;
вскрытие и дренирование любых инфицированных тканей;
роды в случае наличия инфекции.
больным с протезами клапанов;
больным с ревматическими и неревматическими поражениями сердца;
при ПМК с регургитацией;
при гипертрофический кардиомиопатии с обструкцией.
амоксициллин 2 г внутрь за 1 час до манипуляции и затем через 6 часов после нее;
ампициллин в/м или в/в в дозе 2 г за 30 мин до манипуляции и 1 г через 6 часов после нее;
клиндамицин 600 мг за 1 час до манипуляции;
азитромицин 500 мг за 1 час до манипуляции;
Радужный Н.Л. Внутренние болезни Мн: ВШ, 2007, 365с
Пирогов К.Т Внутренние болезни, М: ЭКСМО, 2005
Сиротко В.Л, Все о внутренних болезнях: учебной пособие для аспирантов, Мн: ВШ, 2008 г.
Инфекционный эндокардит (ИЭ) – это поражение эндокарда с преобладанием его альтеративно–деструктивных изменений, которое служит источником бактериемии и эмболии и вызывается различными неспецифическими возбудителями.
Мочевой синдром и причины его возникновения. Заболевания почек. Основные показатели цвета мочи. Методы диагностики и диагностические критерии хронического пиелонефрита, амилоидоза. Степень протеинурии и ее виды. Изолированная лейкоцитурия. Гематурия.
Министерство здравоохранения РФ Тюменская Государственная Медицинская Академия Л.Ф. Руднева Диагноз и дифференциальный диагноз приобретенных пороков сердца.
Клинические формы и общая характеристика подклапанного стеноза, основные причины и предпосылки его возникновения, этапы и факторы развития. Описание комбинированных пороков сердца, методика их диагностирования и определения опасности, схема лечения.
Понятие ОРЛ. Факторы, способствующие снижению заболеваемости острой ревматической лихорадкой. Причины роста заболеваемости. Особенности клинических проявлений ревматического кардита. Дифференциальная диагностика ревматической лихорадки и формы лечения.
Классификация и анализ пороков сердца.
Особенности течения инфекционного эндокардита. Основные патогенетические факторы. Особые формы инфекционного эндокардита, его рабочая классификация по происхождению и течению. Большие и малые критерии заболевания, особое место тейкопланина в его лечении.
Нижегородская Государственная Медицинская Академия Кафедра госпитальной терапии РЕФЕРАТ Инфекционный эндокардит. Выполнил: студент 39 группы VI курса
Пневмония - острое инфекционное заболевание преимущественно бактериальной этиологии. Очаговое поражение респираторных отделов легких, внутриальвеолярная экссудация. Критерии оценки тяжести пневмонии, риск летального исхода. Антибактериальная терапия.
Причины аортальной недостаточности. Патофизиология, клиника и диагностика. Ревматическая природа митральной недостаточности. Исследование и признаки гипертрофии миокарда. Заменители клапанов сердца, их достоинства и недостатки. Малоинвазивная хирургия.
Министерство здравоохранения РФ Тюменская Государственная Медицинская Академия Л.Ф. Руднева Инфекционные эндокардиты. Кардиомиопатии. Миокардиты.
Эпидемиология и этиология инфекционного эндокардита. Симптомы поражения клапанов сердца. Клиническая картина инфекционного эндокардита. Бактериологическое исследование крови. Рабочая классификация инфекционного эндокардита. Его диагностика и лечение.
Острая ревматическая лихорадка - постинфекционное осложнение острого тонзиллита либо фарингита, вызванных бета-гемолитическим стрептококком альфа /БГСА/, аутоиммунного ответа на антигены БГСА и перекрестной активностью со схожими антигенами человека.
Пролапс митрального клапана (ПМК) - что это такое? Все, наверное, знают о наличии в сердце камер (в которых накапливается кровь), соединенных между собой отверстиями, которые закрываются клапанами.
Характеристика этиологии и патогенеза эндокардита, который представляет собой воспалительное заболевание эндокарда. Особенности ревматического и септического эндокардита. Лечение и профилактика миокардита - воспалительного заболевания сердечной мышцы.
Поражения сердечного клапана (клапанов), створки которого оказываются неспособными к полному раскрытию (стеноз) клапанного отверстия или к смыканию (недостаточность клапана) или к тому и другому (комбинированный порок).
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Инфекционный эндокардит (ИЭ) – это воспалительное заболевание инфекционной природы, при котором на клапанах, пристеночном эндокарде или на эндотелии крупных сосудов формируется патологический процесс в виде вегетаций , представляющих собой конгломерат из фибрина, тромбоцитов и микробных тел.
по клиническому течению:
острый (более выражены симптомы, плохой прогноз);
подострый (затяжной) (менее вирулентные м/о, прогноз лучше);
по наличию предрасполагающего морфологического субстрата:
первичный (30-40%) – на неизмененных клапанах сердца или пристеночном эндокарде;
вторичный (на эндокарде, измененном вследствие врожденных или приобретенных нарушений, в т.ч. при кардиохирургических вмешательствах – протезировании клапанов):
ранний ИЭ протезированного клапана (1-2 месяца после операции);
поздний ИЭ протезированного клапана.
заболеваемость – от 1 до 6 случаев на 100 000 населения;
мужчины болеют в 2-3 раза чаще женщин;
Частота выявления отдельных возбудителей:
viridans – 35% (широко представлен в полости рта и глотки, клеточные белки их стенки способны связываться с эндокардом, длительно персистируют),
faecalis – 10% (слизистая ЖКТ и мочеполовой системы);
aureus – 23% (кожа, слизистая носа; высоковирулентны, плохой прогноз, вызывают ранний ИЭ протезированных клапанов, а также у наркоманов),
epidermidis – Грам– бактерии (Pseudomonas aeruginosae, Klebsiella, Escherichia coli, Proteus) Грибы (чаще при иммунодефицитных состояниях: прием цитостатиков, ГКС, злокачественные опухоли, в/в наркотики, протезы, длительно стоящий в/в катетер) Candida , Aspergillus , Hystoplasma );
Полимикробная флора ПАТОГЕНЕЗ
повреждение эндокарда или эндотелия сосудов (при этом обнажается соединительная ткань, выделяются БАВ, стимулируется адгезия, образование тромбов; лейкоциты с фибрином образуют небактериальные вегетации, свойственные эндокардиту Либмана-Сакса);
проникновение возбудителя в кровь при нарушении целостности кожных покровов или слизистых оболочек (в организме часто бывает транзиторная бактеремия – при удалении зуба, повреждении десны при чистке зубов и т.д.; м/о чаще грамотрицательные, но они редко закрепляются в вегетациях; механизм прилипания м/о к вегетациям связан с фибринонектином и коллагеном 4-го типа, которые способствуют адгезии);
нарушение естественных защитных сил организма (м/о, попавшие в вегетации, не доступны для клеток иммунитета, т.к. покрыты фибрином и тромбоцитами; они находятся в неактивном состоянии; по мере роста вегетаций происходит разрушение клапана, развиваются пороки сердца, проявляющиеся недостаточностью клапана).
Причины вторичного ИЭ (предшествуют повреждению эндотелия):
врожденные или приобретенные аномалии сердца, наиболее часто:
ДМЖП (дефект межжелудочковой перегородки);
ОАП (открытый артериальный проток);
даже корригированный ВПС является фактором риска для ИЭ (!);
ревматический порок сердца вследствие ОРЛ;
дегенеративные поражения сердца (в первую очередь атеросклеротическое, чаще поражается аортальный клапан; возможно развитие ИЭ на измененном эндокарде в месте крупноочагового инфаркта миокарда или аневризмы);
имплантация инородных тел (искусственные клапаны).
Процесс чаще поражает митральный и аортальный клапаны (пороки чаще по типу недостаточности), что вызывает перегрузку миокарда и приводит к сердечной (чаще левожелудочковой) недостаточности. Инфекция может распространяться на кольцо клапана и на миокард, вызывая его абсцессы. Вегетации могут разрушаться, тогда их фрагменты попадают в кровоток, вызывая эмболию как большого, так и малого круга кровообращения. Вследствие длительного персистирования инфекции и воспалительного процесса истончаются стенки сосудов, а также начинаются аутоиммунные воспалительные процессы из-за избыточного ответа организма. При повреждении эндокарда обнажаются молекулы, к которым образуются аутоантитела – ревматоидные факторы (к Fc -фрагменту IgG ), антинуклеарные антитела, криоглобулины. Они соединяются с антигенами, образуя иммунные комплексы, которые откладываются с субэндотелиальном слое сосудов, туда же стремится и комплемент, что приводит к аутоиммунному васкулиту. Чаще поражаются почки (гломерулонефриты), может быть миокардит, перикардит, артрит. При пристеночном расположении эмбола возможна микотическая аневризма сосуда – истончение и выбухание его стенки.
1. Общеинфекционный синдром (самый частый) :
повышение температуры ( персистирующий характер, чаще субфебрильная, реже лихорадка с ознобом и потоотделением);
симптомы интоксикации: слабость, утомляемость, снижение работоспособности, потеря массы тела, ухудшение аппетита, головная боль;
артралгии и миалгии (40-50%);
лимфаденопатия (генерализованная, л/у незначительно увеличены, безболезненны).
2. Синдром поражения сердца:
Включает прямые и косвенные признаки формирующегося порока сердца .
Прямые – в первую очередь, шумы :
аускультацию необходимо производить внимательно, несколько раз в сутки, в течение несколько дней;
играет роль не столько изменение старого шума, сколько появление новых шумов;
при митральной недостаточности – систолический шум, максимальный на верхушке;
при аортальной недостаточности – диастолический, по левому краю грудины;
может наблюдаться не только недостаточность, но и относительный стеноз вследствие слипания стенок клапана при воспалении;
будут также симптомы сердечной недостаточности (обычно левожелудочковой, т.к. чаще поражаются аортальный и митральный клапаны (75% и 50% соответственно) в то время как трикуспидальный – только в 25% случаев;
в течение первого месяца ИЭ при отсутствии вегетаций на ЭхоКГ доверяем только аускультации.
дилятация различных камер сердца вследствие перегрузки;
расширение левых границ сердца;
приглушение I тона;
снижение диастолического давления при артериальной недостаточности;
Инфекционный эндокардит считается одной из наиболее важных проблем клинической медицины, и в первую очередь кардиологии. На протяжении последних 10 лет отмечено увеличение числа больных с данной патологией всем мире [10,с.8-13]. Инфекционный эндокардит, несмотря на значительный прогресс современных инструментальных и лабораторных методов диагностики, а также медикаментозных и хирургических методов лечения, остается тяжелым инвалидизирующим заболеванием, нередко приводящим к летальному исходу. Ранняя диагностика, которая основывается на клинических, эхокардиографических и лабораторных критериях, является важной предпосылкой для успешного лечения инфекционного эндокардита. Предпочтения клиницистов в отношении значимости каждой из этих групп критериев в разные годы менялись. В течение многих лет на первом месте стояли клинические симптомы: лихорадка, появление нового шума регургитации, спленомегалия, озноб, васкулиты, тромбоэмболии, гломерулонефрит. Подобная симптоматика, как правило, указывает на генерализацию процесса. В прошлом клиническая картина была единственным критерием постановки диагноза, что, к сожалению, не позволяло проводить по-настоящему раннюю диагностику. Благодаря усовершенствованию лабораторной диагностики стала очевидной зависимость характера течения заболевания от типа возбудителя, была изучена роль грибковых поражений, вследствие чего от названия заболевания "бактериальный эндокардит" перешли к термину "инфекционный эндокардит". Появление двухмерной и допплер-эхокардиографии и вслед за ними чреспищеводной эхокардиографии дало врачам возможность оценивать морфологическую картину заболевания, что стало новым этапом в изучении инфекционного эндокардита. Результаты эхокардиографического исследования оказались настолько информативными, что это дало основание поставить эхокардиографические критерии диагностики инфекционного эндокардита на первое место (критерии Duke, 1994). За последние годы диагностика инфекционного эндокардита улучшилась, преимущественно за счет усовершенствования метода ультразвуковой диагностики сердца (эхокардиографии), увеличения числа исследований в популяции и совершенствования лабораторной диагностики. В большинстве работ, посвященных проблеме ультразвуковой диагностики инфекционного эндокардита, исследование параметров центральной гемодинамики проводили с использованием двухмерного режима для оценки вегетации и М - режима для расчета основных параметров гемодинамики. Метод допплер - эхокардиографии использовали в основном для оценки степени клапанной регургитации. Однако, различные варианты допплер -эхокардиографии, такие как цветовой, непрерывно - волновой, импульсно - волновой и тканевой импульсный допплер позволяют неинвазивно оценить степень поражения клапанного аппарата, степень нарушения систолической и диастолической функций желудочков, рассчитать давление в правых отделах сердца и детально оценить состояние центральной гемодинамики. Возможности использования режима тканевого импульсного допплера у больных с инфекционным эндокардитом практически не описаны. Все вышесказанное и определяет актуальность данной темы. Кроме того, своевременная диагностика инфекционного эндокардита и его осложнений позволяет выбрать правильную тактику ведения больного. 1.Определение инфекционного эндокардита Инфекционный эндокардит (ИЭ) - заболевание, характерные признаки которого известны в течение многих веков. Тем не менее до настоящего времени существуют проблемы, связанные с его диагностикой и лечением. ИЭ поражает, главным образом, клапаны сердца и приводит к их локальному разрушению с формированием регургитации. Наиболее грозное экстракардиальное осложнение - эмболия, в частности артерий головного мозга. Диагноз устанавливают на основании положительного результата посева крови и обнаружения вегетаций при ЭхоКГ. Необходимое условие развития ИЭ - повреждение эндокарда или эндотелия. Образование вегетаций может вызывать развитие недостаточности клапана или, реже, его обструкцию. Бактериальная инвазия также способна приводить к прямому повреждению клапанных структур с образованием дефектов или разрывов створки и хорд, а также к формированию фистул между полостями сердца или околоклапанного абсцесса.
Эхокардиографическое исследование представляет собой очень ценный метод диагностики у больных с подозреваемым или установленным инфекционным эндокардитом. Оно особенно важно у больных со стертой клинической картиной и отрицательными результатами посевов крови. Подобно тому как отрицательный результат посева крови может быть следствием несоблюдения правил забора крови, так и результаты эхокардиографического исследования могут зависеть от целого ряда объективных и субъективных факторов. Метод ультразвукового двухмерного исследования сердца позволяет косвенным образом судить об остроте инфекционного эндокардита по характеру вегетаций, тяжести поражения клапана и подклапанных структур, эхогенности вегетаций и их мобильности. В целом эффективность диагностики инфекционного эндокардита во многом зависит от настойчивости клинициста при поиске лабораторных и эхокардиографических критериев. Клинические, лабораторные и эхокардиографические методы обследования успешно дополняют друг друга.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
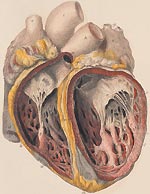
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:


