Рассеянный склероз инфекционный мононуклеоз у

Рассеянный склероз – это болезнь, при которой своя собственная иммунная система поражает защитную оболочку нервных волокон (миелин) головного и спинного мозга. Это нарушает передачу сигналов между мозгом и другими частями тела, а также нарушает состояние самих нервных волокон. Проявления этой болезни могут быть очень разными в зависимости от места повреждения и количества поврежденных нервных волокон. Особенностью рассеянного склероза является предрасположенность к заболеванию у молодых активных людей, в остальном обычно практически здоровых. Рассеянный склероз является второй по частоте (после травмы) причиной развития инвалидности у молодых людей. Некоторые пациенты с тяжелым рассеянным склерозом совсем не могут передвигаться, у других пациентов может длительно не возникать совсем никаких симптомов. Возможности эффективного лечения рассеянного склероза за последние 5 лет значительно расширились. Неврологи Европейского медицинского центра предлагают пациентам с рассеянным склерозом опыт и возможности западноевропейской медицины в Москве.
Симптомы и течение рассеянного склероза
Чаще всего при рассеянном склерозе возникают следующие симптомы:
онемение или слабость в конечностях, которые обычно возникают одномоментно на одной стороне тела или в ногах и туловище;
частичное или полное нарушение зрения, обычно одномоментно одним глазом, часто с болью при движениях глазами;
двоение перед глазами или нечеткость зрения;
ощущение электрического прострела в спине, возникающее при определенных движениях шеей, особенно при наклоне головы вперед;
нарушение координации и неустойчивость походки;
нарушение мочеиспускания и дефекации.
У большинства пациентов с рассеянным склерозом течение болезни волнообразное: атаки заболевания возникают на несколько дней или недель. Обычно после атаки симптомы стираются или полностью исчезают, и наступает период ремиссии, который может длиться месяцами и даже годами. У 60-70% пациентов с волнообразным течением в какой-то момент симптомы начинают неуклонно прогрессировать без ремиссий, обычно нарушая прежде всего походку – такое течение называют вторично-прогрессирующим. У некоторых пациентов с рассеянным склерозом течение прогрессирующее, без возникновения атак с самого начала заболевания – такое течение называется первично-прогрессирующим.
При прогрессировании заболевания со временем у пациентов с рассеянным склерозом могут развиваться следующие проблемы:
спазмы в мышцах и напряжение мышц (спастичность), мешающие движениям;
парализация верхних и нижних конечностей;
нарушение самостоятельного передвижения и самообслуживания;
нарушения мочеиспускания, дефекации и половой функции;
снижение памяти, интеллектуальных функций, речи и эмоциональные нарушения, такие как депрессия;
Факторы риска возникновения рассеянного склероза:
Обследование при рассеянном склерозе
- Консультация врача-невролога с подробным сбором истории заболевания и осмотром.
- Лабораторные исследования крови для исключения некоторых инфекционных, воспалительных и системных заболеваний, которые могут давать симптомы, похожие на рассеянный склероз.
- Люмбальная пункция, при которой берется небольшое количество жидкости из спинального канала для лабораторного исследования. Это позволяет выявить характерные для рассеянного склероза изменения клеточного и биохимического состава ликвора, обнаружить особый патологический тип синтеза антител (олигоклональные антитела) и исключить вирусные инфекции и другие состояния, похожие на рассеянный склероз.
- Магнитно-резонансная томография может выявить очаги поражения головного и спинного мозга. При проведении этого исследования может потребоваться введение внутривенного контрастного вещества, которое может помочь определить очаги поражения в активной фазе.
- Вызванные потенциалы мозга помогают выявить нарушение функции проводящих путей в нервной системе через зрительные и слуховые проводящие пути и через чувствительные и двигательные пути между головным мозгом и конечностями.
В EMC разработана комплексная программа диагностики для пациентов с подозрением на рассеянный склероз. В нее включены консультации специалистов и все основные виды инструментальных и лабораторных исследований, рекомендованные международными протоколами.
Лечение рассеянного склероза в EMC
Врачи Клиники неврологии Европейского медицинского центра имеют большой опыт применения не только обычных методов лечения, но и нестандартных и продвинутых схем лечения, применяемых в ведущих центрах лечения рассеянного склероза в Европе и США. В лечении демиелинизирующих заболеваний мы применяем все самые эффективные известные лекарства, такие как финголимод, диметилфумарат, натализумаб, митоксантрон, ритуксимаб, окрелизумаб, алемтузумаб и другие. Мы применяем только эффективные схемы других видов лечений, в том числе плазмообмен. Большое внимание уделяется лечению симптомов, которые могут нарушать функции и качество жизни пациентов с рассеянным склерозом, таких как нарушение ходьбы, спастичность, болевой синдром, утомляемость, тазовые нарушения, нарушение глотания и речи, когнитивные нарушения, депрессия, нарушение сна и другие. Для этого в нашей команде вместе с неврологами работают вместе реабилитологи и физиотерапевты, нейрохирурги (функциональная нейрохирургия, лечение спастичности), офтальмологи, логопеды, нейропсихологи, психологи, психотерапевты и психиатры, диетологи, эндокринологи, урологи и другие специалисты. Мы готовы предложить нашим пациентам самое эффективное и безопасное лечение заболевания и внимательное ответственное ведение.
Перед первой консультацией с врачом рекомендуем подготовиться, ответив на несколько важных вопросов.
Инфекционный мононуклеоз является полиэтиологичным заболеванием и может вызываться различными лимфотропными инфекциями. В соответствии с МКБ 10 выделяют ИМ, вызванный гамма-герпесвирусом (вирусом Эпштейна-Барр (ВЭБ) или герпесвирусом 4-го типа), цитомегаловирусный ИМ, ИМ другой этиологии (на фоне аденовирусной инфекции, токсоплазмоза; инфекции, вызванной герпесвирусом 6-го или 7-го типа; в острую стадию ВИЧ-инфекции и т.д.) и ИМ неуточненной этиологии (в тех случаях, когда у пациентов с клиническими признаками ИМ не удается обнаружить ни один из известных возбудителей данного заболевания). Однако, как правило, если отдельно вопрос этиологии ИМ не оговаривается, это заболевание связывают с ВЭБ-инфекцией (ВЭБИ). Считается, что более 80-95% всех случаев типичного ИМ ассоциировано с ВЭБИ.
ВЭБ обладает тропизмом к различным клеткам, но основной мишенью для него являются В-лимфоциты и дендритные клетки, несущие на себе рецептор CD21 (или CR2 – рецептор для C3d компонента системы комплемента). Кроме В-лимфоцитов, поражается эпителий слизистой носоглотки и протоков слюнных желез. В определенных ситуациях могут инфицироваться Т-лимфоциты и NK-клетки, моноциты/макрофаги, нейтрофилы, миоэпителиальные и гладкомышечные клетки. Как и при других инфекционных заболеваниях, вызывающихся лимфотропными вирусами, исходы острой ВЭБ-инфекции (ВЭБИ) могут быть разными и являются интегративным показателем взаимодействия вируса и иммунной системы человека.
В организме человека ВЭБ может находиться в двух состояниях: в фазе активной инфекции и в латентном состоянии. Активная фаза ВЭБИ характеризуется значительным накоплением вирусных частиц, гибелью пораженных клеток, выходом вируса во внеклеточное пространство и инфицированием доступных для ВЭБ чувствительных клеток. Такой вариант развития вируса касается, в первую очередь, эпителиальных клеток ротоглотки и в значительно меньшей степени – В-лимфоцитов. Этот процесс имеет место при острой инфекции и при обострении хронической. Именно в этом цикле жизнедеятельности вируса возможно подавление его активности с помощью противовирусных препаратов, блокирующих вирусную ДНК-полимеразу и обрывающих синтез вирусной ДНК (ацикловир, валацикловир, ганцикловир, фоскарнет и др.).
При отсутствии адекватного контроля со стороны основных факторов противовирусного иммунитета (цитотоксические лимфоциты, NK-клетки, Th1-зависимые механизмы иммунного ответа) возможна неконтролируемая пролиферация ВЭБ(+) В-лимфоцитов (т.е. клеток, несущих чужеродную генетическую информацию). Потенциально это может привести к развитию В-клеточной лимфопролиферативной болезни (нередко проявляющейся малигнизацией, особенно у людей с исходным иммунодефицитом). ВЭБ-ассоциированными более чем в половине случаев являются лимфома Беркитта (в странах Африки), назофарингеальная карцинома, смешанно-клеточная лимфома Ходжкина, ряд опухолей у больных со СПИД-ом (лимфомы головного мозга, гладко-мышечная опухоль, плазмобластная лимфома, ходжкинская лимфома им др.), внеузловая NK/T-лимфома, NK-лейкемия и др.
Кроме того, ВЭБ способен вызывать поликлональную стимуляцию В-лимфоцитов, что в ряде случаев может привести к развитию аутоиммунных заболеваний (иммунные цитопении, рассеянный склероз и некоторые другие).
В тех случаях, когда происходит значительное (по экспансии и уровню вирусной нагрузки) инфицирование клеток, участвующих в защите от вируса, развиваются тяжелые, угрожающие жизни человека варианты течения ВЭБИ. Преимущественное инфицирование CD8+ лимфоцитов приводит к развитию гемофагоцитарного синдрома. В основе формирования двух вариантов хронической активной ВЭБИ лежит поражение соответственно CD4+ лимфоцитов или NK- клеток. Значительно более редкими формами хронической ВЭБИ (ХВЭБИ) являются интерстициальная пневмония, поражения ЦНС, аневризмы коронарных артерий (как при болезни Кавасаки). Одним из необычных проявлений хронической ВЭБИ является гиперчувствительность к укусам комаров.
Хорошо известно, что у детей раннего возраста острая ВЭБИ в большинстве случаев протекает субклинически или в стертой форме, без развития клиники ИМ. По некоторым данным, наиболее распространенной формой первичной ВЭБИ у детей является ОРИ, на долю которой приходится более 40 % всех случаев. Однако этот вариант течения острой ВЭБИ не имеет каких-либо специфических проявлений и обычно не верифицируется. Наиболее известным вариантом острой ВЭБИ и вторым по частоте (около 18 % всех случаев инфекции) является ИМ, имеющий очень специфические клинические проявления. Эта форма острой ВЭБИ считается характерной, в первую очередь, для подростков и молодых людей.
Таким образом, главное, что следует помнить про патогенез ИМ – в основе развития заболевания лежит индуцированное вирусом иммунное воспаление (иммуно-патологический процесс), протекающее с поражением ВЭБ-инфицированных клеток, в первую очередь В-лимфоцитов и эпителиоцитов слизистой небных миндалин. В период разгара ИМ около 10-20 % всех циркулирующих в периферической крови В-лимфоцитов. С учетом того, что в периферической крови в каждый момент времени находится всего 0,2-2% всех лимфоцитов организма человека, основным местом поражающего действия вируса являются лимфоидные органы, а в них — В-зоны (где находятся В-лимфоциты) и дендритные клетки.
По мере выздоровления количество ВЭБ(+) В-лимфоцитов уменьшается до определенного стабильного минимального уровня и в последующем сохраняется пожизненно. В крови здоровых людей содержится от 1 до 50 инфицированных ВЭБ-ом клеток на один миллион В-лимфоцитов. При этом у здоровых носителей около 5% периферических мононуклеарных клеток (в первую очередь, Т-лимфоцитов) направлены против ВЭБ, что говорит о значимости для организма человека постоянного контроля над этой инфекцией.
При благоприятном течении острой ВЭБИ по мере снижения вирусной и антигенной нагрузки параллельно с этим основная часть активированных Т-лимфоцитов, выполнивших свою функцию, погибает по механизму апоптоза, а остальные превращаются в клетки памяти.
Клинические проявления ИМ складываются из признаков синдрома системного воспалительного ответа (ССВО), поражений лимфоидных органов и ангины. Манифестация происходит, как правило, бурно с резкого повышения температуры, появления признаков интоксикации (чаще умеренно выраженных), болей в горле, заложенности носа без насморка (вследствие аденоидита) и храпа во сне. Увеличиваются шейные (прежде всего, заднешейные) и подчелюстные лимфоузлы, и нередко может отмечаться генерализованная лимфоаденопатия. Иногда лимфоаденопатия предшествует появлению развернутой клиники ИМ, опережая ее на 5-7 дней. Часто, но не всегда, образуются налеты на миндалинах, которые могут плохо сниматься шпателем (т.к. представляют собой не только компоненты воспалительного экссудата, но и погибший эпителий слизистой). Более чем у половины больных определяется увеличение печени и/или селезенки. Важным в дифференциальной диагностике между банальной стрептококковой ангиной (требующей антибактериальной терапии) и экссудативным тонзиллитом при ИМ является отсутствие или незначительная боль в горле. Т.е. когда налетына миндалинах – большие, а горло не болит, это должно заставить задуматься врача о ИМ.
Развитие всех клинических проявлений ИМ происходит в течение нескольких суток. В эти сроки симптоматика может нарастать и дополняться. Важно помнить, что развернутая клиника ИМ, все перечисленные симптомы у одного больного встречают редко. Обычно один или несколько симптомом отсутствуют. И в этом случае следует подтверждать диагноз лабораторно.
Как правило, большинство врачей ориентируется на наличие в общем анализе крови (ОАК) атипичных мононуклеаров (АМ) в количестве >10%. Это действительно позволяет констатировать ИМ. Однако, следует помнить, что АМ появляются в крови не сразу, часто с 4-5-го дня болезни, а иногда только на второй неделе заболевания. Кроме того, примерно у 5% пациентов они могут вовсе отсутствовать. В этом случае следует ориентироваться на клинические проявления и наличие в ОАК преобладания лимфоцитов и моноцитов: наличие у ребенка ангины, которая сопровождается лимфоцитозом должно навести врача на мысль о том, что ангина какая-то специфическая.
Банальные стрептококковые тонзиллиты обычно вызывают выраженные воспалительные изменения в ОАК (лейкоцитоз, нейтрофилез, выраженный сдвиг лейкоцитограммы влево, когда молодые формы нейтрофилов составляют 15-20% и более). При ИМ небольшой сдвиг формулы крови влево тоже часто имеет место (обычно в пределах 6-12%, как одно из проявлений ССВО), однако при этом отмечается лимфомоноцитоз. Кроме того, некоторые инфекции, способные протекать с мононуклеозоподобным синдромом (аденовирусная, например), не сопровождаются лимфоцитозом в лейкоцитограмме, а протекают с нейтрофилезом или нормоцитозом [Melon2005].
Следует помнить, что тяжелое поражение печени с развитием желтушной формы гепатита (и иногда даже фульминантного гепатита) связано не с вирусным цитолизом гепатоцитов (ВЭБ не имеет тропизма к этим клеткам), а с инфицированием в печени местных Т- и T/NK-лимфоцитов, которые и вызывают поражение гепатоцитов (клеточно-опосредованный цитолиз).
В качестве дополнительных лабораторных тестов для доказательства ВЭБИ могут быть использованы:
- методы определения титра гетерофильных антител (у нас – это реакция Пауль-Буннеля, за рубежом – monospot test). Диагностическая значимость его невелика, но в определенных ситуациях это исследование помогает в диагностике. Основным его достоинством является то, что гетерофильные антитела обнаруживаются при первичном ВЭБ-ассоциированном ИМ и не определяются при ИМ другой этиологии. Недостатком метода является его частый ложноотрицательный ответ у дошкольников и младших школьников,
- серологические методы: обнаружение IgM к капсидному антигену (viral capsid antigen) и IgG к раннему антигену ВЭБ (Epstein-Barr early antigen), соответственно анти-VCA IgM и анти EB EA IgG,
- определение ДНК ВЭБ методом ПЦР в крови (плазме или сыворотке), что всегда свидетельствует об активной репликации вируса (в отличие от ее обнаружения в мононуклеарах – в основном, в В-лимфоцитах - периферической крови).
Показанием к назначению АБТ могут быть и некоторые осложнения ИМ. Так вследствие аденоидита повышается вероятность развития отитов и синуситов. Поэтому наряду с применением средств улучшающих носовое дыхание (об этом речь пойдет ниже) в комплексную терапию следует включать и АБ, эффективны в отношении наиболее вероятных этиологических факторов этих осложнений (пневмококк, гемофильная палочка): цефалоспорины 2-3-го поколения, при их непереносимости – азитромицин.
В ситуации, когда налеты на миндалинах есть, а воспалительные изменения в общем анализе крови отсутствуют (лимфомоноцитоз с нейтропенией и отсутствием или незначительным – до 10-12% молодых форм нейтрофилов – сдвигом лейкоцитограммы влево) и уровень СРБ невысокий (до 50-70 мг/л), боль в горле незначительная или отсутствует высока вероятность участия в воспалении нормальной анаэробной флоры , активировавшейся на фоне заболевания. В этом случае можно попытаться включить в схему терапии метронидазол 7,5-10 мг/кг 3 раза в день на 7-10 дней (с оценкой эффекта через 3-4 дня: если налеты не уменьшились или уменьшились незначительно, препарат стоит отменить).
Однако при хронических ВЭБ-ассоциированных заболеваниях, при которых вирус находится в литическом цикле развития, противовирусные препараты могут иметь эффект (волосатая лейкоплакия языка, хроническая активная ВЭБИ).
Кроме того, включение противовирусных препаратов, возможно, будет полезным при тяжелых атипичных формах острой ВЭБИ, протекающих с поражением внутренних органов (фульминантный гепатит, кардит, пульмонит) и ЦНС (энцефалит, менингоэнцефалит). По-видимому, это связано с тем, что развитие этих вариантов острой ВЭБИ обусловлено поражением вирусом нетипичных для этой инфекции клеток (CD8+ цитотоксических лимфоцитов, CD4+ клеток, NK-клеток, моноцитов/макрофагов).
Больше всего вопросов в лечении ИМ возникает в отношении применения глюкокортикостероидов (ГКС). В 50-60-х годах прошлого века эти препараты применялись широко и, как считалось, с хорошим эффектом. Затем в связи с потенциально онкогенными свойствами ВЭБ, иммуносупрессивным действием ГКС и неясными последствиями действия двух этих факторов на организм каждого конкретного больного, от применения ГКС при неосложненном течении ИМ отказались. Однако и в наше время проводятся исследования по оценке влияния ГКС на пациентов с ИМ. Существуют работы, в которых показывается как эффективность этих препаратов (по крайней мере, кратковременная и в отношении некоторых симптомов), так и отсутствие влияния ГКС на степень выраженности и продолжительность сохранения симптоматики ИМ.
Мнение автора этой статьи совпадает с мнением первой группы ученых, т.к. я неоднократно видел клинический эффект от применения ГКС у детей с ИМ. Исходя из патогенеза заболевания, такого эффекта ГКС следует ожидать. Другое дело, надо ли всем детям с ИМ назначать ГКС? Однозначно – нет! ИМ - это самолимитирующееся заболевание, которое в подавляющем большинстве случаев заканчивается выздоровлением в течение 7-14 дней (здесь речь идет об острых проявлениях инфекции, т.к. остаточные явления в виде полиаденопатии, гепатолиенального синдрома, гипертрофии миндалин могут сохраняться от нескольких недель до нескольких месяцев). Показаниями к назначению ГКС должны быть только тяжелые формы ИМ, сопровождающиеся тяжелой обструкцией верхних дыхательных путей (обычно, верхних в виде тяжелого аденоидита), различными цитопениями, поражениями нервной системы. Причем, если ГКС назначаются, это не должно быть одно-двукратное введение. Обычно рекомендуется 7-14-дневный курс терапии: в течение половины этого срока назначают ГКС из расчета 1 мг/кг/сут по преднизолону (максимум – 60 мг/сут), внутрь, а затем в течение оставшегося срока дозу постепенно снижают вплоть до отмены. В некоторых случаях при неэффективности обычных доз ГКС прибегают к пульс-терапии метилпреднизолоном (15-30 мг/кг, в/вено, в течение часа, 1 раз в день, 3 дня подряд) с последующей постепенной отменой (ежедневно доза снижается на 50% вплоть до отмены).
В русскоязычной литературе последние годы широко обсуждался вопрос о применении. Если исходить из представленных выше данных о патогенезе ИМ, становится понятным, что в острый период заболевания нет необходимости в дополнительной иммуностимуляции уже развившегося иммуноопосредованого воспаления. Такая необходимость может возникнуть в периоде поздней реконвалесценции (с 3-й недели до 3-х месяцев), т.к. в это время у людей, перенесших ИМ, развивается вторичный иммунодефицит, выраженный в разной степени. Резюмируя ту информацию, которая есть в литературе по применению иммуностимуляторов, следует сказать, что при наличии клинических признаков вторичного иммунодефицита (ребенок стал чаще и дольше болеть разными инфекционными заболеваниями после перенесенного ИМ) может возникнуть необходимость в иммунокоррекции. Но в настоящее время нет надежных и доступных методов оценки эффективности разных иммуностимуляторов у конкретного ребенка. Поэтому с учетом различной чувствительности иммунной системы ребенка к разным иммуномодуляторам, подбирать такую терапию придется эмпирически и без гарантии успеха. Успокаивает только то, что у большинства детей в течение 1,5-4 месяцев изменения в работе иммунной системы нивелируются. Хотя с учетом возможности формирования активной хронической ВЭБИ вопрос о необходимости и тактике применения иммуномодуляторов остается открытым.
Говоря о поражении печени при ИМ, нельзя обойти стороной и вопрос о правильном питании таких пациентов. Нередко в нашей литературе указывают на необходимость назначения молочно-растительной диеты. Серьезных исследований по этому вопросу не поводилось. На самом деле для этого нет никаких оснований и ориентироваться нужно только на потребности ребенка, его пищевые пристрастия, аппетит и переносимость пищи. Естественно, какие-то разумные ограничения должны быть (не запрещение, а ограничение жирных и жареных продуктов, острых блюд и т.д.), однако такой образ питания полезен не только больному, но и здоровому человеку. Таким образом, пациент с ИМ должен просто правильно питаться без больших ограничений. Только больные с тяжелыми желтушными формами ИМ будут нуждаться в более строгой диете, как и больные с аналогичными формами вирусных гепатитов.
Основное же место в лечении больных с ИМ занимает симптоматическая терапия. При высокой лихорадке назначают жаропонижающие препараты (у детей это обычно парацетамол 10-15 мг/кг до 4 раз в сутки и ли ибупрофен 5-10 мг/кг до 3 раз в сутки), лучше чередуя для сохранения эффекта. При выраженных болях в горле применяют ибупрофен в той же дозе 3 раза в день, не зависимо от температуры. Полоскать рот достаточно просто водой после каждого приема пищи (применение местных антисептиков не влияет на скорость выздоровления и выраженность клинической симптоматики). Тем пациентам, которым субъективно становится легче после соляно-содовых полосканий, не стоит запрещать это делать.
Таким образом, в основе клинической манифестации ИМ лежит иммунопатологическое воспаление, индуцированное ВЭБ-ом и опосредованное, прежде всего, факторами клеточного иммунитета. Заболевание в большинстве случаев протекает благоприятно и самостоятельно заканчивается выздоровлением. Основную роль в лечении больных с ИМ играет симптоматическая терапия, направленная на облегчение симптомов болезни. Применение антибиотиков должно быть хорошо обоснованным. Наличие налетов на миндалинах не является достаточным основанием для АБТ. В тяжелых и осложненных случаях терапия дополняется назначением короткого курса ГКС. Они показаны пациентам с обструкцией дыхательных путей, с различными цитопениями, с поражением нервной системы. Назначение Н1-блокаторов, витаминов, гепатопротекторов, местных антисептиков и т.д. в подавляющем большинстве случаев не требуется. Никакая специальная диета детям с ИМ, как правило, не нужна.
КУДИН Александр Петрович, к.м.н., доцент, зав.отделением № 5 УЗ ГДИКБ.

Дата публикации: 18.11.2018 2018-11-18
Статья просмотрена: 1334 раза
Ключевые слова: инфекционный мононуклеоз, взрослое население, особенности клинического течения.
Инфекционный мононуклеоз — острое вирусное заболевание, которое характеризуется лихорадкой, поражением ротоглотки, лимфатических узлов, печени, селезенки и своеобразными изменениями состава крови, вызванное вирусом Эпштейна-Барр [3, с. 40].
Проблема инфекционного мононуклеоза в настоящий момент представляет интерес в связи с увеличением заболеваемости [2, с. 11].
Эпштейн — Бaр вирусная инфекция широко распространена среди взрослого и детского населения. По данным ВОЗ вирусом Эпштейн — Барра инфицированы от 16 до 800 человек на 100 тысяч населения. Уровень инфицированности взрослого населения приближается к 100 %, а детского составляет около 50 %. Вирус Эпштейн — Барра пожизненно циркулирует в организме более 95 % взрослого населения и является триггером различных заболеваний [4, с. 187].
Инфекционный мононуклеоз является антропонозной инфекцией. Вирус Эпштейн–Барра выделяется из организма больного или вирусоносителя. Передача инфекции осуществляется воздушно-капельным путем, в основном, через слюну, часто через поцелуи. Дети часто заражаются через игрушки, загрязненные слюной больного или вирусоносителя. Возможен также трансфузионный и половой пути передачи инфекции.
Первичная инфекция чаще возникает в детском возрасте и протекает в виде инфекционного мононуклеоза или может протекать бессимптомно. Вирус Эпштейн — Барра поражает эпителиальные клетки верхних дыхательных путей, слюнные железы, тимус, В-лимфоциты. Длительная персистенция вируса в организме человека вызывает развитие дисбаланса клеточной иммунной системы и является фактором иммуноопосредованных болезней и онкогематологических заболеваний [1. с. 66].
Возможность развития угрожающих осложнений (миокардит, полинейропатия, тромбоцитопатия) и генерализация процесса у иммунокомпрометированных лиц побуждают ученых к изучению этого инфекционного заболевания [5, с 723].
Цель исследования — анализ клинико-лабораторных особенностей инфекционного мононуклеоза у взрослых.
Результаты исследования.
Был произведен анализ 70 историй болезней взрослых пациентов, находившихся на лечении в Областной клинической инфекционной больнице им. Н. А. Семашко, среди них 44 лиц мужского пола, 26 — женского. Средний возраст 27,9±1,4 года.
Анализируя даты поступления больных в стационар отмечено, что наибольший пик возникновения заболевания приходится на осенне-весенний период (рисунок 1).
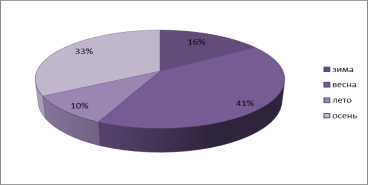
Рис. 1. Сезонность возникновения инфекционного мононуклеоза.
Эпидемический контакт прослеживался у 19 человек, что составляет 32 % (больные указывали на семейный контакт с больным инфекционным мононуклеозом).
У всех больных наблюдалась средняя степень тяжести заболевания.
Проведенный анализ клинико-лабораторных данных показал, что лихорадка наблюдалась у всех пациентов: у 37 (52,8 %) пациентов — фебрильная, у 33 (47,2 %) пациентов — субфебрильная, длительность лихорадки составляла в среднем 7,4±0,6 дней.
Полилимфоаденопатия у 14 пациентов (20 %). Увеличение переднешейных лимфатических узлов у 41 (58,6 %), заднешейных у 48 (68,5 %), затылочных у 4 (5,7 %) пациентов, подчелюстные лимфатические узлы пальпировались у 5 (7,1 %) больных. Лимфатические узлы плотные, эластичные, не спаяны между собой и с окружающей клетчаткой.
Гепатомегалия отмечалась у 46 (65,7 %) пациентов, печень выступала из-под реберной дуги в среднем на 2–3 см. Желтушность кожи и склер отмечалась у 4 пациентов (5,7 %).
У 63 (90 %) пациентов отмечалось поражение зева: у 42 катаральная ангина (60 %), у 14 язвенно-некротическая с фибриновыми пленками (20 %).
Затрудненное носовое дыхание отмечали 43 (61,4 %) больных, храпящее дыхание 22 (31,4 %), пастозность лица отмечена у 11 (15,7 %).
Среди других симптомов, которые нечасто наблюдаются при инфекционном мононуклеозе, у 9 (12,8 %) пациентов была зарегистрирована пятнисто — папулезная сыпь, локализованная на туловище, которая появилась на 4–7 день болезни;
При лабораторном обследовании пациентов у 61,4 % отмечался умеренный лейкоцитоз, ускорение СОЭ у 64,3 %. Появление в общем анализе крови атипичных мононуклеаров ( инфекционный мононуклеоз, взрослое население, особенности клинического течения
Похожие статьи
При стоматоскопии пациентов с жалобами на сухость в полости рта не исключена роль хронической инфекции вирусами гепатитов.
При первичном осмотре у врача-стоматолога необходимо дифференцировать инфекционный мононуклеоз.
Синдром Гийена-Барре (СГБ) — острая воспалительная демиелинизирующая полирадикулоневропатия аутоиммунной этиологии, характеризующаяся периферическими параличами и в большинстве случаев белково-клеточной диссоциацией в ликворе.
Актуальность проблемы. Паротитная вирусная инфекция (ПВИ) является повсеместно распространенным заболеванием с высоким уровнем поражения населения. Социальная значимость паротитной вирусной инфекции определяется, в основном.
Заболевания, сопровождающиеся экзантематозными высыпаниями являются распространенной патологией среди детей грудного и раннего детского возраста. Целью исследования являлось определение этиологии внезапной экзантемы у детей.
Длительность стационарного лечения больных паротитной инфекцией при легкой форме
Сопутствующие заболевания как гастрит, бронхит, анемия, инфекция мочевыделительных
Проблема рожи как инфекционного заболевания поражающего преимущественно лиц.
РС развивается вследствие воздействия многих инфекционных агентов, широко распространенных в популяции (вирус Эпштейна–Барр ‒ вызывающий инфекционный мононуклеоз, вирус кори, вирус простого герпеса, вирус герпеса типа 6, ветряная оспа.
Ключевые слова: хронический эндометрит, инфекционно-воспалительные заболевания, микробный фактор, воспаление слизистой оболочки матки. На сегодняшний день остается актуальной проблема инфекционно-воспалительных заболеваний в генезе репродуктивных.
Острые кишечные инфекции являются одними из наиболее частых инфекционных заболеваний у детей. Не смотря на то, что ведущим этиологическим фактором являются вирусы, имеет место как спорадическая заболеваемость вирусными диареями.
Таким образом, в структуре инфекционных и паразитарных заболеваний грипп и острые респираторные вирусные инфекции составили
Девять пациентов имели как до, так и после лечения по 1–2 эпизода острых респираторных заболеваний в год, 16 детей — по 3–4 эпизода.
Читайте также:


