Прионы как инфекционные агенты

Фото: M24.ru/Евгения Смолянская
За свою историю человечество сталкивалось с огромным количеством войн, эпидемий, стихийных бедствий и других катаклизмов. В XXI веке, когда с эпидемиями, казалось, было покончено, у человечества появился новый вызов – прионы. Что это такое, чем они грозят людям и почему прионами так интересуются ученые всего мира – в материале M24.ru.
Ты помнишь, как все начиналось
В двадцатые годы прошлого столетия врачи столкнулись с новым и неизведанным доселе заболеванием. Немецкий невропатолог Ганс Герхард Крейтцфельдт наблюдал в своей клинике одну пациентку – 20-летнюю девушку. На начальной стадии болезни у нее была нарушена чувствительность в руках и ногах, быстро прогрессировали расстройства памяти, нервной деятельности, больная все чаще впадала в бессознательное состояние. Через несколько месяцев девушка умерла от расстройств дыхания и сердечной деятельности. Невропатолог, который в будущем станет видным нацистским врачом и будет принимать участие в программе "Эвтаназия", задокументировал ход болезни.
Спустя несколько месяцев доктор Альфонс Мария Якоб из Гамбурга столкнулся с тремя аналогичными пациентами. Молодые люди страдали от расстройств нервной деятельности, глотания, практически не осознавали происходящее вокруг и вскоре умерли. При вскрытии Якоб увидел интересное явление, которое раньше врачам наблюдать не приходилось, – поражен у больных был только мозг. Была зафиксирована массовая гибель клеток серого вещества головного мозга, а сохранившиеся нейроны отличались необычным набуханием. Ни в одном другом органе не было зафиксировано никаких патологических изменений. В память о двух первооткрывателях заболевание получило название болезни Крейтцфельдта – Якоба.
В те далекие годы вирусология как наука находилась еще в зачаточной стадии. Поэтому заболеванию было суждено долгое время оставаться в забвении. Этому поспособствовали Великая депрессия и Вторая мировая война. И лишь в пятидесятые годы прошлого века ученые начали активно интересоваться, что же все-таки происходит с людьми, которым не посчастливилось подхватить болезнь Крейтцфельдта – Якоба.
В то же время ученые открывают еще два заболевания, которые по своим симптомам и течению весьма и весьма напоминают описанный выше страшный недуг – куру и скрейпи. Первая болезнь была распространена среди народности форе на острове Папуа – Новая Гвинея, а вторым страдали овцы по всему миру. Но важным оказалось другое: симптомы болезней несколько отличались от болезни Крейтцфельдта – Якоба, но характер поражений был практически идентичен – образование пустот в тканях головного мозга и массовая гибель нервных клеток.
Казалось бы, все ясно. Имеется болезнь, ее вызывает какой-то вирус или бактерия, давайте разберемся, кто является возбудителем и устраним причину. Но не тут-то было! Все оказалось не так просто.

"Познавательные фильмы": Вакцины
Исследования
Ученым удалось достаточно быстро установить, почему болеют папуасы. Выяснилось, что заболевают только те из них, кто участвовал в ритуальном поедании тел погибших от куру родственников. Согласно местным верованиям того времени, дети должны были обязательно отведать мозга умершего, считалось, что от этого у них прибавится ума. Неизвестно, прибавлялось ли у детей от этого ума, но все малолетние, участвовавшие в таких трапезах, обязательно оказывались зараженными куру.
Особенно масштабные исследования развернулись с агентом скрейпи. Для начала определили его размеры, они оказались стандартными для вирусов – 17–27 нанометров. После этого вирусологи всего мира стали разбираться в свойствах неизвестного возбудителя заболевания, и тут их ждали сюрпризы. Оказалось, что инфекционный агент совершенно невосприимчив к формалину, пепсину и трипсину, не реагирует на ферменты, разрушающие ДНК и РНК, устойчив к кипячению, ультрафиолетовому излучению и. проникающей радиации! С такими вирусами ученым сталкиваться еще не приходилось.

Фото: M24.ru/Александр Авилов
Больше того, возбудителя заболевания никак не удавалось увидеть в электронный микроскоп, что было уж совсем странно. В то время ученые уже умели распознавать вирусные частицы намного мельче, чем 17 нанометров, но вирус скрейпи (почесуха) так никто и не увидел – наблюдали лишь фрагменты клеточных мембран.
Еще одной интересной загадкой оказалось всякое отсутствие иммунного ответа организма больных. Организм людей, больных куру, и овец, страдавших от скрейпи, никак не реагировал на течение заболевания. При обычных болезнях, вроде гриппа и простуды, в организме увеличивается синтез интерферона (отвечает за иммунитет), что ведет к быстрому выпуску антител, которые соединяются с вирусными частицами и растворяют их. Ученые пытались обнаружить признаки хоть каких-либо антител, но потерпели неудачу.
Отчаявшиеся исследователи начали выдвигать гипотезы, что возбудителем является не вирус, а молекула полисахарида или же белка, но подтверждения эта версия так и не нашла. Ученые топтались на месте, пока в 1982 году американский невролог Стэнли Прузинер не заявил об открытии нового класса инфекционных агентов – прионах.
Что такое прион
До открытия прионов считалось, что болезни человека и животных могут вызываться исключительно живыми организмами или хотя бы вирусами, содержащими нуклеиновую кислоту. Однако все оказалось не так просто. Прион – это особый вид белка, который присутствует в любом человеческом организме.
Выяснилось, что либо под воздействием непонятных факторов, либо из-за мутаций в организме некоторых людей нормальный прионный белок, входящий в состав клеточных мембран, заменяется "неправильным". Второй вид прионного белка имеет другую структуру, вызывает гибель клеток, но самое интересное – способен самостоятельно размножаться (без каких-либо ДНК и РНК!) и менять нормальные прионы в соседних клетках на дефектные.

"Познавательный фильм": Вирусы и защита от эпидемий
Таким образом, прионы оказались единственным видом инфекционных агентов, которых никак нельзя причислить к живым существам. Ведь, по своей сути, они не содержат никакой генетической информации и самостоятельно синтезируются организмом.
Естественно, исследователей заинтересовал самый главный вопрос – а зачем вообще в человеческом организме нужны прионы? В настоящее время известно уже достаточно много прионных болезней. Все они являются экстремально редкими, самая распространенная – болезнь Крейтцфельдта – Якоба – наблюдается у одного из миллиона человек. Также известно о синдроме Герстманна – Штраусслера – Шайнкера, фатальной семейной бессонице и куру. Некоторые исследователи включают в группу прионных заболеваний человека также болезнь Альперса у детей, амиотрофический лейкоспонгиоз (описан белорусскими учеными в конце прошлого века, болели работники одной из ферм) и спонгиоформный миозит (мышечное истощение).
Все эти заболевания являются смертельными, и лекарств от них пока не предложено. Но все же зачем организм синтезирует прионы? Какую он отводит роль для них?
Зачем нужны прионы?
В 70-е годы прошлого века два английских исследователя – Паттисон и Джебет – изучали на мышах действие вещества под названием купризон. В нормальных условиях оно связывает в организме ионы меди. Животным включили купризон в обязательную диету с целью посмотреть, какое действие он произведет на грызунов. И поразились! После 30 с лишним дней купризоновой диеты совершенно здоровые до этого мыши превратились в тяжелобольных. Причем все признаки заболевания полностью отвечали симптомами скрепи. Часть мышей, участвовавших в эксперименте, вскрыли и посмотрели – оказалось, что в головном мозгу животных произошли абсолютно те же изменения, что и при прионных болезнях.
Возник вопрос: а что если купризон мышам больше не давать? Попробовали – и через несколько дней грызуны выздоровели. Уже через 30 дней у них исчезли и вызванные купризоном изменения в мозговой ткани.
Спустя много лет было выяснено, что прионы весьма и весьма похожи на положительно заряженные частицы двухвалентной меди. И изменения, которые они вызывают в организме, практически идентичны. Таким образом, исследователи сделали вывод о том, что в нормальном состоянии прионы отвечают за оборот металлов, в частности меди. Но эти данные пока остаются лишь гипотезой.

Фото: ТАСС/Станислав Красильников
Еще одна группа американских исследователей принялась копать в другом направлении. Им удалось получить данные, что прионы помогают клеткам мозга прикрепляться друг к другу и участвуют в передаче сигналов внутри клетки. Это означает, что отсутствие прионов или их дефекты не позволяют клеткам мозга получать сигнал о других клеток, что ведет к развитию тяжелых нарушений в работе нервной и других систем организма.
Но самым интересным является предположение о том, что прионы участвуют в механизмах клеточного старения. Не секрет, что долгое время прионные болезни относили к группе старческих болезней, потому что вызываемые ими изменения весьма сходны с другими заболеваниями (вроде болезни Пика, Альцгеймера и других неврологических недугов). Наличие прионной инфекции как бы подталкивает организм к ускоренному старению. Естественно, это ставит очень важный вопрос: если лекарство от таких болезней будет найдено, не станет ли оно своеобразным ключом к долголетию или даже бессмертию организма? Но ответ на этот вопрос пока дать невозможно, поскольку функции прионов изучены еще недостаточно хорошо.
Способы заражения
В заключение поговорим о способах заражения. Их четыре. В первом и самом распространенном случае заболевание возникает как бы из ниоткуда. То есть жил себе человек, да вдруг взял и заболел. Этот путь возникновения болезни называется спорадическим и, кстати сказать, является наиболее распространенным. По нынешним представлениям, это происходит спонтанно под действием каких-то пока не установленных факторов.
Второй способ – наследственный. Некоторые виды болезней являются семейными и возникают из-за мутаций. В свою очередь, гены передаются потомству. Известно около 40 семей, страдающих фатальной бессоницей. Каждый десятый страдающий болезнью Крейтцфельдта – Якоба – страдает семейной формой этого заболевания.
Фото: M24.ru/Михаил Сипко
Третий способ – ятрогенный. Это означает, что заражение прионами произошло по вине медицинских работников при проведении каких-либо оперативных вмешательств. Однако описаны лишь несколько таких случаев, и все они произошло в 70-е годы прошлого века, когда о свойствах прионов еще никто не знал. Так, одна женщина заболела после того, как ей пересадили роговицу глаза от страдавшего болезнью Крейтцфельдта – Якоба мужчины.
А вот последний способ наиболее коварен и опасен. Дело в том, что человек восприимчив к прионам, которые поражают крупный рогатый скот. И при употреблении в пищу мяса больных животных заболевают и люди – у них развивается болезнь Крейтцфельдта – Якоба. В девяностые годы прошлого века настоящая эпидемия этого страдания разразилась в Англии.
Лечения пока нет. Однако ученые уже выяснили, что некоторые виды прионов разлагаются лишайниками, другим удалось описать особые антиприонные антитела (к инфекционным прионам).
Иными словами, перед исследователями стоит весьма непростая задача, которая не только поможет найти лекарство от тяжелых заболеваний, но и, возможно, поможет открыть секрет долголетия. Для этого нужно только одно – понять прионы.

Прототипом прионной болезни было трансмиссивное нейродегенеративное заболевание овец — таинственная смертоносная скрейпи (или почесуха овец). Ранние исследования показали, что агент скрейпи необычайно устойчив к лечению, которое нейтрализует другие патогены, и может годами оставаться на пастбищах. То, что агент скрейпи проявляет устойчивость, в частности, к радиации, привело к тому, что в 1960-х годах Дж. С. Гриффит и Тиквах Альпер предположили, что он представляет собой новый класс патогенов, который не имеет собственного нуклеинового генома и может быть аномальной самовоспроизводящейся формой белка или мембраны. Между тем описания патологии мозга, вызванной человеческой болезнью куру в Папуа — Новой Гвинее, которые выполнил Карлтон Гайдушек, привели Уильяма Хэдлоу к мысли, что куру похожа на скрейпи овец, и Хэдлоу порекомендовал, чтобы куру испытали на передаваемость от людей к другим приматам. Гайдушек успешно проделал эту работу и показал, что люди племени форе заболевали куру во время ритуальных каннибалистских праздников. Яркой особенностью куру и других прионных заболеваний, часто скрывавшей их причины, является длительный инкубационный период между заражением и появлением клинических признаков, который у людей может превышать четыре десятилетия.

Моя лаборатория в сотрудничестве с Питером Лэнсбери показала, что связанные с заболеваниями формы PrP сами могут вызвать трансформацию нормальных молекул PrP в аномальные формы. В этих реакциях превращения мы выявили поразительные биохимические особенности, которые помогли объяснить характеристики известных штаммов прионов и барьеры их передачи между разными видами. Однако, чтобы однозначно доказать, что прионы состоят из повторно свернутых агрегатов PrP и им не нужны специфически-прионные нуклеиновые кислоты, потребовалось разработать методы непрерывной бесклеточной амплификации прионов или реакции образования прионов de novo. Они первоначально были созданы лабораториями Сото, Супаттапоне и Прузинера в 2000-х годах; до того времени было трудно полностью исключить вероятность того, что эти заболевания вызваны неопознанными вирусами.

К сожалению, многие из стандартных методов, на которых долгое время базировались исследования обычных патогенов, — генетика патогенов, серология, рентгеноструктурный анализ, спектроскопия ядерного магнитного резонанса (ЯМР) — чрезвычайно трудно применить к прионам. Без каких-либо специфических патогенных генов, которые можно было бы секвенировать или подвергнуть мутации, многие стандартные генетические и обратные генетические подходы к выявлению структуры и функции патогенов не работают. Поскольку прионы состоят из белков организма-хозяина, иммунный ответ хозяина на патоген очень мал; таким образом, провести простое серологическое обнаружение прионных инфекций, основанное на взаимодействии с антителами, очень сложно. Кроме того, прионы млекопитающих, как правило, плотно упакованы, сильно гликозилированы и связаны с другими молекулами организма-хозяина, и поэтому даже специфические прионные конформационные эпитопы (поверхности, распознаваемые антителами) на агрегатах PrP трудно обнаружить и использовать. Все попытки определить трехмерные структуры прионов на протяжении уже долгого времени заходят в тупик, так как очищенные прионы имеют агрегированный, но некристаллический характер.
В течение многих лет единственным способом обнаружения и анализа прионов млекопитающих был биоанализ животных, который даже на самых быстрых моделях — грызунах — длился от нескольких месяцев до одного года. В конкретном организме разные штаммы обычно можно различить по периодам инкубации, невропатологическим паттернам и биохимическим признакам связанных с болезнью отложений PrP или прионов.
К счастью, в последнее время были разработаны мощные бесклеточные амплификационные анализы прионов, такие как циклическая амплификация прионной формы белка (PMCA), вибрационно-индуцированный конверсионный анализ в режиме реального времени (RT-QuIC) и анализ клеток скрейпи. Эти методы основаны на присущем прионам механизме репликации. И PMCA, и RT-QuIC чрезвычайно чувствительны: они могут усилить присутствие прионов в триллион раз, почти до точки обнаружения нескольких прионных частиц. Реакции PMCA распространяют инфекцию прионов, тем самым отражая и освещая многие аспекты прионной биологии, в то время как анализы RT-QuIC, как правило, не распространяют полностью инфекционные прионы, но обеспечивают более быстрые, более практичные и более высокопроизводительные методы их обнаружения, и, таким образом, они стали самыми современными инструментами в диагностике прионных заболеваний. Как PMCA, так и RT-QuIC в некоторых случаях помогают различать важные штаммы прионов у определенных видов организмов-хозяев.
В выявлении базовой структуры прионов наблюдается медленный прогресс. При помощи полупроводниковых ЯМР-исследований была обнаружена молекулярная архитектура некоторых прионов грибов и прионоподобных фибриллярных структур PrP млекопитающих. Электронная кристаллография, дифракция волокон и криоэлектронные микроскопические исследования помогли описать ключевые структурные ограничения прионов млекопитающих, но применение этих и, возможно, других структурных биологических методов еще нужно улучшить.

Разобраться в структуре и механизмах репликации прионов млекопитающих, по крайней мере на молекулярном уровне, крайне сложно. Сначала нужно объяснить, как неправильно свернутые белки могут распространяться в роли патогенов, не перенося своего собственного нуклеинового генома. Затем следует также объяснить, как белки с единой последовательностью аминокислот, такие как PrP того или иного животного-хозяина, могут образовывать разные штаммы прионов, которые исправно распространяются и вызывают различные фенотипы болезни без генетических мутаций, объясняющих вариации штаммов в обычных патогенах.
Множество исследований указывает на то, что прионы млекопитающих — это упорядоченные скопления нескольких молекул PrP, плотно упакованных и часто фибриллярных или нитевидных. Молекулы PrP (мономеры) в прионах по сравнению с нормальными свободными молекулами PrP пересвернуты практически полностью. Когда правильные молекулы PrP включаются в растущие прионные агрегаты, эти агрегаты вызывают их рефолдинг, причем прионы действуют как штамм-специфические шаблоны или затравки, которые каким-то образом придают свои собственные аберрантные формы каждой входящей молекуле, контролируя стабильную репликацию своего штамма.
За рамками этого грубого описания детали структуры и распространения прионов на молекулярном уровне остаются неясными. Также нерешенным остается вопрос о том, как прионы распространяются за пределы исходного места заражения в организме-хозяине. Существующие данные свидетельствуют о том, что наиболее эффективная межклеточная передача прионов связана с мембранозными структурами, такими как экзосомы или туннелирующие нанотрубки, — скорее всего, потому, что прионы обычно связаны с мембранами липидными якорями; однако возможность этих мембранных структур способствовать распространению прионов in vivo еще предстоит определить. Очень важно понять механизмы распространения прионов, поскольку способности различных неправильно свернутых белковых агрегатов распространяться внутри и между клетками, тканями и индивидами определяют то, действуют ли они как инфекционные патогены или являются относительно безобидными сбоями белкового метаболизма.
Многие виды млекопитающих, включая людей, низших приматов, крупный рогатый скот, овец, коз, оленей, лосей, кошек, норок, грызунов и различных экзотических копытных, восприимчивы к прионным заболеваниям PrP. Но такими являются не все виды: собаки и лошади, судя по всему, представляют собой заметные исключения. Разные виды обычно экспрессируют несколько разные нормальные молекулы PrP, и различия в аминокислотной последовательности PrP могут сильно влиять на восприимчивость хозяина к входящим прионным инфекциям. Например, люди, как известно, до некоторой степени восприимчивы к губчатой энцефалопатии крупного рогатого скота (ГЭКРС), но, по-видимому, устойчивы к скрейпи овец и, насколько нам известно, хронической изнуряющей болезни оленей. По какой-то причине лесные полевки и беличьи обезьяны необычайно восприимчивы к широкому спектру прионных инфекций других видов.
Механизмы, с помощью которых прионные инфекции вызывают нейродегенеративные заболевания, нам пока неизвестны. Агрегаты различных прионных штаммов в организмах-хозяевах разных видов могут накапливаться преимущественно в разных областях центральной нервной системы и вызывают ряд невропатологических расстройств. Очевидно, что конечным эффектом по крайней мере частичного повреждения является сбой в работе нейронов и их потеря, что вызывает множество клинических симптомов и приводит к летальному исходу. Известно, что ряд нейрофизиологических процессов и путей нарушается, но многое еще предстоит определить относительно того, связаны ли такие нарушения с прямой или косвенной токсичностью прионов и в какой степени та или иная недостаточность или комбинация недостаточностей наиболее ответственна за кончину больного.

У людей причины прионных заболеваний могут быть генетическими (из-за специфических мутаций гена PrP), приобретенными (вызванными заражением — например, воздействием куру, ГЭКРС или другим содержащим прионы материалом) или спорадическими (неизвестного происхождения; обычно предполагается, что они обусловлены спонтанным образованием прионов у конкретного индивидуума). Подавляющее большинство прионных заболеваний человека являются спорадическими, и среди них наиболее распространена спорадическая болезнь Крейтцфельдта — Якоба (sCJD), заболеваемость которой в год во всем мире составляет примерно один случай на миллион населения. Ряд различных мутаций в гене PrP может вызывать множество семейных прионных заболеваний, при этом некоторые мутации являются полностью пенетрантными (всегда вызывающими болезнь у носителей мутации), а другие — менее пенетрантными. Клинические симптомы и прогрессирование болезни могут заметно различаться в разных организмах-хозяевах и при разных типах прионных заболеваний, но могут включать деменцию, расстройство координации, бессонницу, галлюцинации, жесткость мышц, спутанность сознания, усталость и затрудненность речи.
В последнее время были достигнуты значительные успехи в том, чтобы точно и относительно неинвазивно диагностировать прионные заболевания человека у живых пациентов на основе новых прион-специфических тестов мазков из носа, спинномозговой жидкости, крови, мочи или кожи. Например, RT-QuIC-тестирование спинномозговой жидкости и/или материалов назальной щеточной биопсии может достигать 100% точности при диагностике спорадической болезни Крейтцфельдта — Якоба. Эти тесты выгодны потому, что измеряют возбудителей прионной болезни, но они еще не полностью проверены и не рекомендованы официально такими организациями, как ВОЗ. В остальном диагностика спорадических прионных заболеваний у людей зависит в первую очередь от совокупности клинических признаков, результатов сканирования мозга, электроэнцефалограмм и других биомаркеров, которые вместе могут иметь высокую диагностическую чувствительность, но не полностью специфичны для прионных болезней.
Несмотря на описанные выше недавние успехи в разработке новых прионных тестов, действующие руководящие принципы таковы: для окончательной диагностики спорадического или приобретенного прионного заболевания необходимо невропатологическое исследование тканей головного мозга, полученных в результате биопсии (что редко) или аутопсии. Полагаю, в скором времени эти рекомендации будут изменены, в них будут включены новые, менее инвазивные прижизненные тесты для выявления прионов. К сожалению, несмотря на то, что этот прогресс в раннем диагностировании прионных болезней должен улучшить перспективы разработки и применения терапевтических средств, в настоящее время доступных методов лечения, которые доказали бы свою эффективность в клинических испытаниях, не существует.

Действительно, последний вопрос представляет собой важный рубеж в изучении многих заболеваний, связанных с неправильным образованием белков, особенно тех, которые связаны с патогенным накоплением аномальных фибриллярных белковых отложений (например, амилоидных фибрилл и бляшек). Эти болезни включают в себя болезни Альцгеймера, Паркинсона и Гентингтона, а также боковой амиотрофический склероз, лобно-височные деменции, хроническую травматическую энцефалопатию и диабет второго типа. Различные белки организма-хозяина образуют скопления при этих и многих других заболеваниях, но, как и прионы, такие скопления обычно растут за счет включения в затравку нормальных растворимых молекул белка. Таким образом, потенциал для прионоподобного распространения белков существует на молекулярном уровне. Также растет количество доказательств того, что множество различных связанных с болезнями белковых отложений может расти и распространяться так же, как и прионы, вызывая патологии после инокуляции в локализованные участки у подопытных животных.
Результаты этих исследований поднимают насущные вопросы о том, могут ли многочисленные заболевания, основанные на повторном фолдинге белка, — а они зачастую гораздо более распространены, чем прионные заболевания, основанные на PrP, — быть переданы людям или животным в реальных условиях. Болезнь Крейтцфельдта — Якоба передается между людьми через трансплантацию тканей, инъекции гормонов, полученных от трупов, переливание крови и зараженные медицинские инструменты. Вторым фактором в таких ятрогенных передачах является тот факт, что прионы часто не полностью инактивируются стандартными процедурами клинической дезинфекции.
Еще предстоит установить, могут ли быть определены другие типы потенциально прионоподобных, ассоциированных с болезнями агрегатов белка, которые также могут быть устойчивы к инактивации и при этом способны инициировать или ускорять патогенные процессы у людей. Я не знаю никаких эпидемиологических указаний на то, что это так, но дальнейшее тщательное изучение этого вопроса кажется оправданным.
Виктор Моисеевич Ройхель, д. м. н., ведущий научный сотрудник
Института полиомиелита и вирусных энцефалитов им.М.П.Чумакова РАМН.
Головной мозг человека, погибшего от болезни Крейтцфельдта-Якоба. Видны явные патоморфологические изменения: уменьшение объема и массы мозга, истончение извилин полушарий большого мозга, преимущественно лобных и теменных долей со значительным расширением борозд в этих областях. (В.А.Зуев, И.А.Завалишин, В.М.Ройхель, 1999.)
Горизонтальный срез головного мозга человека, умершего от спорадической формы болезни Крейтцфельдта-Якоба. Заболевание привело к сужению коры мозга в лобной, теменной, височной и затылочной долях, а также произошло некоторое уменьшение объема базальных ядер и таламуса и умеренное расширение желудочков мозга. (В.А.Зуев, И.А.Завалишин, В.М.Ройхель, 1999.)
Микрофотография губкообразных изменений в коре большого мозга, вызванных прионами (болезнь Крейтцфельдта-Якоба).
1- микровакуоли, 2 - погибающие нейроны с глиальными узелками, 3 - гипертрофия астроцитов, 4 - сморщенный нейрон, в котором уменьшились по объему цитоплазма и ядро, 5 - нейрон, в котором скопилось много липофусцина и произошло смещение ядра. Увел. ґ 400. (В.А.Зуев, И.А.Завалишин, В.М.Ройхель, 1999.)
Микрофотография конечной фазы губкообразных изменений в коре большого мозга: некоторые вакуоли слились и образовали более крупные полости, нейроны уже погибли. Увел. ґ 100.
Поскольку уже ни у кого не вызывает сомнений, что возбудителями ТГЭ могут быть только прионы, такие заболевания принято называть прионными [7]. Практический интерес к этим смертельно опасным инфекциям безусловно связан с событиями последнего времени и увеличивающейся вероятностью встречи с этими болезнями. Теоретический же интерес к проблеме обусловлен результатами молекулярно-биологических исследований прионов - новых и необычных возбудителей тяжелых заболеваний человека и животных, которые, как выяснилось, могут возникать не только в результате инфекции, но и спорадически и даже передаваться по наследству.
Структура прионных белков
Над выяснением структуры и химической природы возбудителей ТГЭ трудилось немало специалистов в течение, по крайней мере, полувека. В результате появилось большое количество разнообразных гипотез, многие из которых теперь имеют лишь историческое значение. Удача улыбнулась группе исследователей из Калифорнийского университета (США), работающих под руководством Прузинера. Главная их заслуга в том, что им удалось выяснить белковую природу прионов. Разработанная американскими учеными многоступенчатая система выделения исходного инфекционного материала позволила получить препараты, очищенные в 100-1000 раз. Агент оставался устойчивым к воздействию реагентов, инактивирующих нуклеиновые кислоты, что указывало на их отсутствие в его составе. Изучение очищенного препарата показало, что он обладает молекулярной массой около или меньше 50 кДа. В результате дальнейшей очистки приона выяснилось, что его основной компонент - мажорный белок с молекулярной массой 27-30 кДа, обозначаемый как РrР 27-30.
По физико-химической характеристике РrР 27-30 - сиалогликопротеин (олигосахаридсодержащий мембранный белок с остатками сиаловой кислоты, которые придают молекуле отрицательный заряд) и первый идентифицированный структурный компонент приона. Обнаружение РrР 27-30 на этапе развития инфекции, т.е. до появления патологических изменений в тканях, - свидетельство того, что этот белок не может быть вторичным продуктом патологической реакции. Так стало очевидным, что РrР 27-30 играет центральную роль в патогенезе заболевания.
При дальнейшем изучении прионов, выделенных из головного мозга зараженных скрепи животных, были обнаружены частицы в виде стержней диаметром 10-20 нм и длиной 100-200 нм. По ультраструктуре они напоминали амилоид (аномальный белок, который обычно образуется при хронических заболеваниях, например туберкулезе легких, костей и т.д.) и, видимо, представляли собой полимерную форму приона: каждый стержень содержал около тысячи молекул приона.
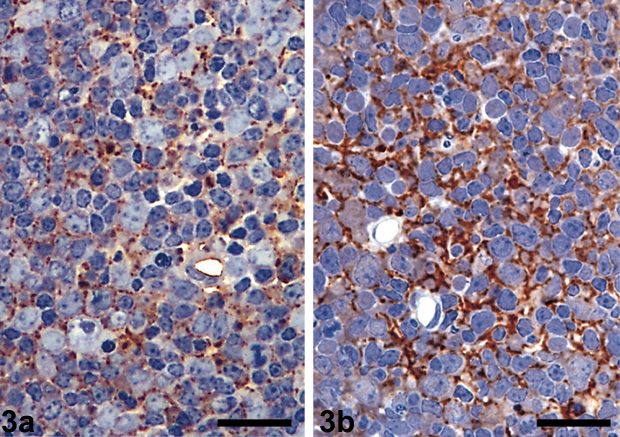
Важным шагом, имеющим как теоретическое, так и методическое значение, было получение антител при использовании в качестве антигена высокоочищенных прионов скрепи. В сыворотках кроликов, которым вводили РrР 27-30, обнаружены антитела не только к нему, но и к другим белкам, отличающимся более низкой молекулярной массой. Очевидно, эти белки либо обладают одинаковой антигенной детерминантой (областью антигена, комплементарной антителу) с РrР 27-30, либо они - продукт его расщепления. При помощи изготовленной антисыворотки с пероксидазной меткой удалось выявить локализацию прионов в определенных отделах головного мозга зараженных животных (табл.2). Согласно ранее полученным данным, структуры, связанные с меченой антисывороткой, обладали характеристикой амилоидных бляшек. Использование антисыворотки к синтетическому пептиду, соответствующему N-концевой части приона, позволило провести индикацию белка скрепи-ассоциированных фибрилл в головном мозге, селезенке и лимфатических узлах зараженных животных. При этом положительные результаты были получены на ранних этапах инкубационного периода.
Определение аминокислотной последовательности РrР 27-30 позволило в 1985 г. идентифицировать кодирующий его ген Prnp. Оказалось, что этот ген содержится в геномах не только инфицированных скрепи животных, но и здоровых. Соответственно мРНК для РrРС была выявлена в головном мозге и в других тканях как инфицированных, так и контрольных животных. Используя соответствующую антисыворотку, удалось показать, что в тканях незараженных животных содержится белок, родственный РrР 27-30, но отличающийся от него чувствительностью к обработке протеазой К.
Были изучены также некоторые другие характеристики прионов скрепи и болезни Крейтцфельдта-Якоба. В частности, было подтверждено предположение о том, что инфекционная частица агента содержит две молекулы РrР и что так называемые семейные формы (т.е. с наследственной предрасположенностью) прионных заболеваний связаны с конкретными мутациями в гене Prnp. Например, мутация, вызывающая замену пролина на лейцин в 102-м положении РrР, оказалась связана с развитием синдрома Герстманна-Штреусслера-Шейнкера, а замена аспарагиновой кислоты на аспарагин (мутация в 178-м кодоне) может быть связана как с болезнью Крейтцфельдта-Якоба, так и со смертельной семейной бессонницей. К сегодняшнему дню известно уже о 20 мутациях в гене Prnp человека, связанных с семейными формами прионных заболеваний.
Во второй половине 90-х годов, когда уже была определена аминокислотная последовательность РrР и выявлен ген Prnp, начались интенсивные поиски причин патогенности прионов. С помощью современных методов молекулярно-генетического анализа были получены новые данные о возможных вариантах состава и конформации (укладки) полипептидной цепи РrР. В частности, было установлено, что конверсия нормального прионного белка в его инфекционную изоформу - посттрансляционный процесс [8]. Анализ вторичной структуры РrРSc показал, что этот переход характеризуется большими структурными изменениями самого приона. Клеточный белок содержит 42% a -спиралей и почти не содержит b -тяжей (всего около 3%), в то время как в его инфекционной форме выявляется 30% a-спиралей и 43% b -тяжей [9]. В экспериментальных исследованиях было подтверждено, что обработка неинфекционного белка реагентами, снижающими образование b -тяжей, также приводила к уменьшению инфекционности перерожденного приона. Одновременно снижалась и устойчивость РrРSc к действию протеазы К, чувствительность к которой считается маркером, отличающим РrРC от РrРSc.
Таким образом, в результате разносторонних исследований были получены и систематизированы имеющие принципиальное значение данные о структуре и физико-химических свойствах прионных белков. Анализ этих сведений создал необходимые предпосылки для дальнейшего углубленного изучения биологических особенностей прионных белков и механизма развития вызываемых ими заболеваний людей и животных.
Несмотря на обилие результатов в изучении прионных белков, роль PrPC в живом организме до конца не известна. Ясно одно – этот белок жизненно необходим и эволюционно консервативен, поскольку обнаружен у многих млекопитающих, птиц и даже у низших эвкариот. Так, при анализе первичной структуры РrРС было выявлено, что 80% последовательностей РrРС у разных видов животных идентичны, исключение составлял лишь куриный РrРС, где идентичность последовательностей по отношению к другим видам составляла всего 30%. Тем не менее 24 аминокислотные последовательности, располагающиеся между 112-м и 135-м аминокислотными остатками, содержатся в геномах всех млекопитающих, а также кур.
В последние годы появились данные, свидетельствующие о роли клеточного белка в регуляции сна, и более того - возникновение смертельной семейной бессонницы связывают с нарушением нормальной функции этого белка [12]. В исследованиях in vitro было показано, что PrPC вовлекается в процессы регуляции содержания внутриклеточного Са 2+ в нейронах [13]. Уже доказанным можно считать и значение нормального клеточного приона в сохранении резистентности нейронов и астроцитов к окислительному стрессу, и участие этого белка в метаболизме меди в головном мозге [14]. А совсем недавно были получены данные об участии PrPC в трансдукции сигналов в нервной ткани [15]. Этот список можно было бы продолжить, но и так ясно, что представления о биологической значимости PrPC в последние годы существенно расширились.
Теперь стало известно, что PrPC синтезируется в эндоплазматической сети и довольно быстро деградирует (всего за 5-6 часов). Синтезированный PrPC, проходя через аппарат Гольджи, транспортируется на поверхность клетки, где он связывается с гликофосфатидилинозитолом и в дальнейшем переносится вдоль аксона при помощи быстрого и активного (антероградного) транспорта. В отличие от PrPC инфекционный прионный белок первично аккумулируется в клетках, накапливаясь в цитоплазматических везикулах. Дальнейшее его накопление в синаптических структурах и связанная с этим дезорганизация синапсов, очевидно, становится причиной глубоких неврологических дефектов и деменции.
Получение новых данных позволило заключить, что прионные болезни - нейродегенеративные, в возникновении которых фундаментальную роль играют конформационные изменения прионов, а сам механизм развития болезни беспрецедентен.
1. Кемпбелл П.Н. // Вопр. биол., мед. и фармац. химии. 1998. №4. С.34-40.
2. Hill A., Debruslais M., Joiner M. et al. // Nature. 1997. V.389. P.448-450.
3. Calza L., Manfredi R., Chiodo F. // Recenti Prog. Med. 2001. V.92. P.140-149.
4. Sigurdsson P. // British Veterinary J. 1954. V.110. P.341-354.
5. Зуев В.А. Медленные вирусные инфекции человека и животных. М., 1988.
6. Prion Biology and Diseases / Ed. S.B.Prusiner. N.Y., 1999.
7. Зуев В.А., Завалишин И.А., Ройхель В.М. Прионные болезни человека и животных. М., 1999.
8. Pan K., Baldwin M., Nguyen J. et al. // Proc. Natl. Acad. Sci. 1993. V.90. P.10926-10966.
9. Smith C., Collinge J. // Essay Biochem. 1995. V.29. P.157-174.
10. Cohen F.E., Pan K.M., Huang Z. et al. // Science. 1994. V.264. P.530-531.
11. Jarrett J.T., Lansbury P.T. // Cell. 1993. V.73. P.1055-1058.
12. Tobler I., Deboer Т., Fisher M. // J. Neurosci. 1997. V.17. P.1869-1879.
13. Herms J., Tings Т., Dunker S. et al. // J. Neurobiol. Dis. 2001. V.8. P.324-330.
14. Brown D. // J. Brain Res. Bull. 2001. V.55. P.165-173.
15. Martins V., Mercadante A., Cabral A. et al. // Braz. J. Med. Biol. Res. 2001. V.34. P.585-595.
16. Ройхель В.М. Патогенез и диагностика некоторых медленных прионовых нейроинфекций: Автореферат на соискание ученой степени доктора медицинских наук. М., 1997.
17. Brown P. // J. Microsci Res. Tech. 2001. V.54. P.71-80.
Читайте также:


