Препараты повышающие иммунитет при цитомегаловирусной инфекции
Цитомегаловирусная инфекция: враг детей и женщин номер 1
Скрытыми носителями коварных цитомегаловирусов является от 50 до 90 % жителей разных стран. В России им поражено около 80% взрослых людей.
Однако болеют немногие - лишь те, у кого ЦМ-вирусы активизировались под воздействием различных неблагоприятных факторов( спровоцировать активизацию ЦМВ может любая другая сторонняя инфекция, например грипп, а также стресс, переутомление, переохлаждение, гормональные перемены при беременности, месячных, в переходном периоде)- или те, кто заразился впервые активированным вирусом. Большинство людей даже не подозревают о том, что являются носителям цитомегаловируса и не догадываются, кто их заразил. Однако эта инфекция исподволь, незаметно подтачивает здоровье и защитные силы организма: способствует снижению иммунитета, нарушениям в работе нервной системы, печени и селезенки.
 |
Способы передачи
Болезнь передается при половом контакте, а также воздушно-капельным, контактным, бытовым путем, при переливании крови, а также от матери к плоду во время беременности или при родах или при вскармливании младенца зараженным грудным молоком. Дети часто заражаются в детских учреждениях через общую посуду, игрушки, которые в юные годы принято тянуть в рот по очереди, взрослые - через поцелуи и половые контакты. ЦМ- вирусы обнаруживаются практически во всех средах человеческого организма: слюне(здесь их концентрация особенно велика), моче, крови, молоке, сперме, секретах влагалища, шейки матки и уретры, спинномозговой жидкости. Важная особенность цитомегаловирусов - их пожизненное сохранение в тканях носителя, так как эти вирусы ускользают от действия защитных сил человеческого организма, а лекарств, разрушающих ЦМ- вирусы, пока не создано.
Проявление цитомегаловирусной инфекции
Обострение цитомегаловирусной инфекции или проявление первичного заражения часто выглядит как проявление ОРЗ или ангины: повышается температура, появляются насморк, отеки и боли в горле, увеличиваются шейные лимфоузлы. Однако увеличиваются также и селезенка и печень. Могут отмечаться мышечные и головные боли. От обычного ОРВИ цитомегаловирусная инфекция отличается и длительностью течения - до 4-6 недель. При нормальном иммунитете спустя месяц- полтора наступает выздоровление(однако вирус остается в организме в дезактивированном состоянии).При ослабленном иммунитете возможны осложнения в виде желтухи, печеночной недостаточности, поражения глаз, легких, пищеварительной системы и тяжелых поражений головного мозга, которые могут приводить к смерти.
Диагностика и лечение цитомегаловирусной инфекции
Основной метод диагностики цитомегаловируса – выявление антител к нему в крови.
 |
Как уже говорилось, ни один из современных методов лечения не позволяет полностью избавиться от этого вируса. При бессимптомном течении инфекции у лиц с нормальным иммунитетом нет необходимости в каком-то специфическом лечении. Поэтому выявление цитомегаловируса или антител к нему у лиц с нормальным иммунитетом не является показанием к приему противовирусных препаратов или иных средства поддержки организма в борьбе с инфекцией. Лечение цитомегаловируса у лиц с ослабленным иммунитетом сводится к приему специальных препаратов, стимулирующих работу иммунной системы, в том числе средств народной медицины. При всей кажущейся простоте это значительно улучшает самочувствие и ускоряет поправку. Тем не менее самолечение ЦМВ- инфекции недопустимо! Курс лечения, конкретные лекарства и их дозировку должен назначат только квалифицированный специалист в зависимости от тяжести симптомов, возраста, сопутствующих хронических заболеваний.
Цитомегаловирусы- враг беременных № 1
Наибольшую опасность для плода представляет ситуация, когда ЦМ- вирусом впервые заражается уже беременная женщина. Если же в организме будущей матери вирус был обнаружен до наступления беременности, это не так опасно для ребенка, как первичное заражение женщины при вынашивании плода - даже в том случае, если у беременной произошел рецидив болезни, так как в организме успели сфомироваться антитела, противостоящие заразе и защищающие мать и дитя.
При заражении плода во время беременности возможно развитие тяжелой врожденной цитомегаловирусной инфекции. Последняя приводит к серьезным поражениям центральной нервной системы и внутренних органов. Вследствие чего плод или погибает (что обычно кончается выкидышем), или погибает уже после выкидыша, а если рождается живым, у него наблюдаются множественные порки развития(наиболее часто отмечаются умственная отсталость вследствие поражения мозга или тугоухость, или врожденная слепота. Хотя могут быть и такие нарушения в работуеорганов, которые вовсе несовместимы с жизнью). Врожденная цитомегаловирусная инфекция наблюдается почти исключительно у детей, матери которых во время беременности впервые заражаются цитомегаловирусом. Тем не менее развитие врожденной ЦМВ - инфекции возможно и в том случае, если у женщины во время беременности произошло обострение инфекции(или даже без оного и она является не более чем носителем ЦМ-вируса). Именно поэтому ЦМВ- инфекция наряду с простым герпесом, краснухой и токсоплазмозом включена в группу болезней, на наличие которых женщине необходимо обследоваться еще до зачатия. Естественно, делать это нужно вместе с отцом будущего ребенка, так как тот, сам того не желая, также может передать вместе со спермой или отделяемым уретры заболевания, которые могут привести к тяжелым порокам развития или даже гибели плода.
Если развития тяжелой врожденной ЦМВ - инфекции у плода не наступило, такая беременность часто кончается рождением недоношенного ребенка, также уже инфицированного цитомегаловирусом. Если такой ребенок рождается живым, у него увеличены печень и селезенка, нарушен состав крови ( отмечается анемия и т.д.). Нередко отмечаются и поражения нервной системы, которые не столь очевидны, как при рождении ребенка с тяжелой патологией(например, они могут проявляться как приступы судорог), или даже вовсе не проявляться, но потом, спустя годы, выразиться как пусть не явный дебилизм, но все же отставание в умственном развитии и/или нарушениях психики. Если при развитии плода был затронут зрительный нерв, на 2-5 году жизни может начаться ухудшение зрения. Если слуховой нерв - слуха. Однако если у новорожденного выявили ЦМВ, это не означает обязательного стопроцентного проявления у него каких-то нарушений в развитии. Тем не менее такой ребенок должен обязательно находиться под диспансерным наблюдением с целью своевременного начала лечения при позднем развитии болезни.
Если ребенок заразился при и родах, это грозит воспалением легких, нарушениями в работе желудочно – кишечного тракта, поражением эндокринных желез, которые отвечают за нормальную работу всего организма (гипофиз, надпочечники). Снизить риск заражения ребенка при родах поможет операция кесарева сечения.
Большую опасность этот вирус представляет и для грудничков, так как у них еще не успела сформироваться и отладиться иммунная система, защищающая организм(симптомы проявления инфекции те же, что и у малыша, заразившегося в процессе родов).
Поэтому всем женщинам, планирующим обзаведение потомством, так важно еще до зачатия пройти комплексное обследование на наличие скрытых инфекций. Да, ЦМВ пока не лечится, но специальные препараты, повышающие иммунитет, помогут родить здорового ребенка – даже если вы заражены.
Профилактика цитомегаловирусной инфекции
сводиться прежде всего к соблюдению правил гигиены(отдельное полотенце, своя мочалка и зубная щетка у каждого члена семьи и т.д.) и отказу от случайных половых связей.
Очень важен и здоровый образ жизни, не допускающий снижение иммунитета у членов семьи, что может способствовать как активизации ЦМ- вирусов в организме носителя, так и облегчить заражение здорового человека.
В настоящее время самым точным методом исследования в диагностике фазы ЦМВ является иммуноблоттинг. Данный анализ Вы можете выполнить в нашем медицинском центре. Записаться к врачу-иммунологу Вы можете по телефонам:
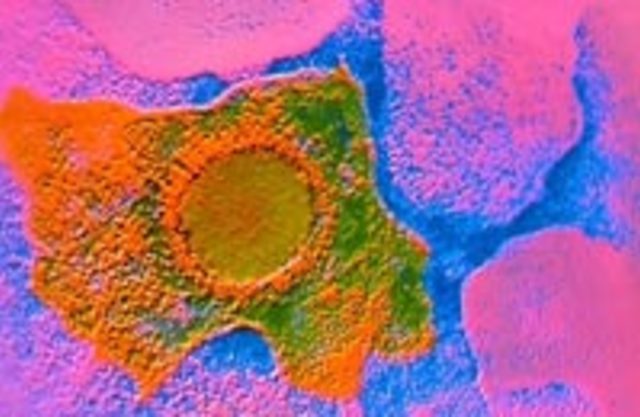

Цитомегаловирусная инфекция – это заболевание, передающееся половым путем, через слюну, материнское молоко, при беременности (от матери к ребенку), через общую мочалку, полотенце, посуду и т.д. К концу жизни инфицированными этим вирусом оказывается практически сто процентов людей. В большинстве случаев он никак себя не проявляет, но при снижении иммунитета активируется и вызывает болезнь. Вирус может начать действовать в любой части организма, поэтому четкой симптоматики у инфекции нет.
Искоренить вирус нельзя, можно лишь уменьшить его активность. Особенно внимательно к этому вирусу и к его поведению в организме нужно относиться женщинам беременным или планирующим зачать ребенка, поскольку цитомегаловирусная инфекция может вызвать повреждение плода.
Что это такое?
Неутешительные цифры : к 1 году заражен каждый пятый, к 35 годам — 40 процентов населения, а к 50 — все сто. Цитомегаловирусная инфекция считается одним из самых распространенных инфекционных заболеваний.
Возбудитель болезни — Cytomegalovirus hominis — вирус из того же семейства, что и вирус герпеса.
Что происходит?
Оказавшись в клетках человека, цитомегаловирус остается в них навсегда. Независимо от того, каким путем произошло заражение, проявления болезни всегда будут примерно одинаковы. А точнее, никаких проявлений не будет. У большинства инфицированных болезнь протекает в скрытой форме.
Для того чтобы цитомегаловирус активизировался, необходимо снижение иммунитета. Иногда хватает банального авитаминоза, но чаще нужно что-нибудь экстраординарное. Например, СПИД) или прием особых лекарств, понижающих иммунитет (чаще всего они применяются для лечения онкологических заболеваний).
Если цитомегаловирус повреждает слизистые оболочки носа, появляется насморк. При повреждении внутренних органов появляется слабость, поносы-запоры и другие неясные признаки, с которыми, как правило, к врачу не ходят. Тем более, что они через несколько дней сами собой исчезают.
Бывает, что цитомегаловирус поселяется на мочеполовых органах. И тогда у женщин воспаляется матка (эндометрит), шейка матки (цервицит), влагалище (вагинит) и т.п. У мужчин инфекция мочеполовых органов обычно протекает бессимптомно.
Заражение цитомегаловирусом представляет опасность для беременных женщин, поскольку инфекция может передаться развивающемуся эмбриону. Впрочем, если женщина заразилась давно, и инфекция не обостряется, вероятность того, что вирус покалечит будущего ребенка, чрезвычайно низкая. Но при заражении во время беременности, эта вероятность возрастает.
Диагностика и лечение
Самому заподозрить у себя цитомегаловирусную инфекцию практически невозможно. Из всех существующих заболеваний эта болезнь больше всего похожа на банальное ОРЗ. Так же повышается температура, течет из носа и болит горло. Могут увеличиться лимфатические узлы, селезенка и печень. Правда, в отличие от ОРЗ цитомегаловирусная инфекция длится дольше: 1 — 1,5 месяца.
В некоторых случаях единственным признаком болезни является воспаление слюнных желез, в них цитомегаловирус чувствует себя комфортнее всего.
Анализ на цитомегаловирус необходимо делать женщинам, желающим забеременеть.
Цитомегаловирусная инфекция неизлечима. Однако существуют лекарства, позволяющие контролировать количество вируса в организме, сдерживать его развитие. Больным повышают иммунитет и назначают специальные противовирусные препараты.
Эти же мероприятия проводятся при обнаружении цитомегаловируса у беременной или собирающейся забеременеть женщины на протяжении всего периода вынашивания ребёнка и лактации. Используется весь комплекс препаратов, повышающих иммунитет, а также применяются подавляющие размножение вируса препараты интерферона. Инфицированная беременная женщина должна с интервалом 10-12 дней сдавать анализы. Также следует постоянно следить за состоянием эмбриона.
Тщательно подобранная мощная терапия и строгое выполнение рекомендаций врача позволяют значительно снизить риск передачи инфекции ребёнку, который впрямую зависит от активности вируса в организме матери.
(цитомегалия)
, MD, Brigham and Women’s Hospital, Harvard Medical School
Last full review/revision February 2018 by Kenneth M. Kaye, MD
Цитомегаловирус (герпесвирус человека тип 5) передается через кровь, или другие биологические жидкости, а также с пересаженными при трансплантации органами. Инфекция может быть приобретена трансплацентарно или во время рождения.
Распространенность увеличивается с возрастом; у 60–90% взрослых имеется цитомегаловирусная инфекция (результат длительно существующей латентной инфекции). Группы с низким социально-экономическим статусом склонны иметь более высокую распространенность.
Врожденная ЦМВ-инфекция может быть как бессимптомной, так и вызвать выкидыш, мертворождение или смерть после родов. Осложнения включают обширное поражение печени и ЦНС.
Приобретенные инфекции являются часто бессимптомными.
Острое заболевание с лихорадкой, которое называется ЦМВ-мононуклеозом, может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом, сходным с инфекционным мононуклеозом, вызванным вирусом Эпштейна–Барр (ВЭБ).
Постперфузионный синдром (после переливания) может развиться через 2–4 недели после переливания препаратов крови, содержащих цитомегаловирус. Это состояние сопровождается лихорадкой, длящейся 2–3 недели, и такими же проявлениями, как при цитомегаловирусном мононуклеозе.
У пациентов с ослабленным иммунитетом цитомегаловирус – главная причина заболеваемости и смертности. Болезнь часто следует после реактивации скрытого вируса. Легкие, ЖКТ или ЦНС могут быть поражены. На последней фазе СПИДа цитомегаловирусная инфекция вызывает ретиниту 40% пациентов и обуславливает видимые при помощи специальной аппаратуры нарушения сетчатки глаз. Язвенное поражение ободочной кишки (с болью в животе и крово-течениями ЖКТ) или пищевода (с дисфагией) может иметь место.
Диагностика
Обычно клиническая оценка
Обнаружение антигенов или ДНК ЦМВ
Культура мочи у младенцев
Часто биопсия у пациентов с ослабленным иммунитетом
ЦМВ-инфекцию можно подозревать у следующих категорий лиц:
Здоровые люди с мононуклеозоподобными синдромами
Пациенты с иммунодефицитом и симптомами нарушений ЖКТ, ЦНС или сетчатки
Новорожденные с системным заболеванием
Цитомегаловирусный мононуклеоз можно иногда дифференцировать от инфекционного мононуклеоза по отсутствию фарингита, отрицательному результату исследования на гетерофильные антитела и серологическому исследованию. Цитомегаловирусная инфекция может быть дифференцирована от вирусного гепатита по серологическому анализу на гепатит. Лабораторное подтверждение первичной цитомегаловирусной инфекции необходимо только для того, чтобы дифференцировать ее от других, особенно поддающихся лечению состояний или серьезного заболевания.
При сероконверсии происходит появление антител к цитомегаловирусу, что указывает на развитие новой ЦМВ-инфекции. Однако в организме человека с ослабленным иммунитетом многие формы ЦМВ-заболеваний обусловлены реактивацией скрытой инфекции. Реактивация цитомегаловируса может привести к распространению вируса в мочу, другие жидкости тела или ткани, но наличие ЦМВ в жидкостях тела или тканях не всегда указывает на болезнь, а может просто представлять собой распространение вируса по организму. Поэтому биопсия, доказываюшая наличие вызванных цитомегаловирусом отклонений, часто необходима, чтобы подтвердить поражение того или иного органа. Количественное обнаружение антигена цитомегаловируса или ДНК в периферической крови может также быть очень полезным, потому что повышенные или прогрессирующие титры цитомегаловируса очень часто наводят на размышления об актуальном инфекционном процессе.
Диагноз у ЦМВ-инфекции у младенцев может быть сделан при посеве мочи.
Лечение
При тяжелой болезни – противовирусные средства (например, ганцикловир, валганцикловир, фоскарнет, цидофовир)
Ретинит, вызванный цитомегаловирусом, который в основном встречается у больных СПИДом, лечат системными противовирусными средствами.
Препараты против цитомегаловируса используются, чтобы лечить тяжелую болезнь, а не ретинит, но являются менее последовательно эффективными, чем при ретините.
Препараты, применяемые для лечения ЦМВ-ретинита при индукционных и поддерживающих схемах терапии включают
Ганцикловир или валганцикловир
Фоскарнет, с ганцикловиром или без него
Цидофовир (в РФ не зарегистрирован)
Большинство пациентов, получают индукционную терапию одним из следующих препаратов:
Ганцикловир назначают по 5 мг/кг внутривенно каждые 12 часов в течение 2 - 3 недель
Валацикловир 900 мг перорально каждые 12 ч в течение 21 дня
Если индукция терпит неудачу не один раз, должен использоваться другой препарат.
Поддерживающая (супрессивная) терапия назначается после индукции и состоит из:
Ганцикловир 5 мг/кг внутривенно 1 раз/день
Валганцикловир 900 мг перорально 1 раз/день
В качестве альтернативы можно давать фоскарнет с или без ганцикловира. Дозировка такова:
Индукция: Фоскарнет по 60 мг/кг внутривенно каждые 8 часов в течение 2-3 недель
Поддерживающяя терапия: Фоскарнет по 90-120 мг/кг внутривенно 1 раз в день
Отрицательные воздействия внутривенного фоскарнета являются существенными и включают нефротоксичность, симптоматическую гипокальцимию, гипомагниемию, гиперфосфатемию, гипокалиемию и воздействие на ЦНС. Комбинированная терапия ганцикловиром и фоскарнетом увеличивает и эффективность, и отрицательные воздействия.
Терапия цидофовиром - однин из альтернативных методов лечения. Она состоит из
Индукции: Цидофовир по 5 мг/кг внутривенно 1 раз в неделю в течение 2 недель
Поддерживающей терапии: Цидофовир по 5 мг/кг внутривенно 1 раз в две недели
Эффективность цидофовира такая же, как ганцикловира или фоскарнета. Существенные отрицательные воздействия, включая почечную недостаточность, ограничивают использование цидофовира. Данный препарат может вызвать воспаление радужной оболочки или гипотонию глаз (внутриглазное давление ≤ 5 мм рт. ст.). Потенциал для нефротоксичности может быть уменьшен, если давать пробенецид и проводить предварительную гидратацию с каждой дозой. Однако отрицательные воздействия пробенецида, включая сыпь, головную боль и лихорадку, могут быть достаточно существенными, чтобы его не использовать.
При любой из схем лечения лечащий врач может рассматривать возможность прекращения терапии у ВИЧ-инфицированных пациентов, которые принимают антиретровирусную терапию (АРТ) и имеют количество CD4 ≥ 100 клеток/мкл в течение 3 месяцев.
Интравитреальная противовирусная терапия должна использоваться в сочетании с системной терапией у пациентов с ЦМВ-ретинитом, при котором прогрессивно ухудшается зрение (т.е. заболевания зрительного нерва или возле него, макулы). Даже пациенты, получающие глазные инъекции, нуждаются в системной терапии, чтобы предотвратить развитие цитомегаловирусной инфекции в другом глазу и тканях, расположенных вне глаза.
Доведение количества CD4 до > 100 клеток/ мкл с помощью системной антиретровирусной терапии должно предотвратить потребность в глазных имплантах и химиопрофилактике.
Профилактика
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции у пациентов после трансплантации органов или реципиентов гемопоэтических клеток, инфицированных ЦМВ и с риском развития ЦМВ инфекции. Используемые препараты включают ганцикловир, валганцикловир и фоскарнет.
Основные положения
60–90% взрослых людей имеют латентную цитомегаловирусную инфекцию.
У здоровых детей и взрослых, как правило, проявляются легкие, неспецифические симптомы или иногда синдром, подобный мононуклеозу.
Врожденная инфекция может привести к мертворождению или тяжелым, иногда фатальным постнатальным осложнениям, включая обширное повреждение печени или ЦНС.
У пациентов с тяжелым иммунодефицитом могут развиться тяжелые формы заболевания, с поражением сетчатки, легких, ЖКТ или ЦНС.
Противовирусные препараты могут помочь в лечении ретинита, но менее эффективны в случае повреждения других органов.
Пациентам после трансплантации с риском развития цитомегаловирусной инфекции требуется прием профилактических противовирусных препаратов или тщательный мониторинг для раннего диагностирования инфекции.

- Описание
- Рекомендации
- Отзывы 0
Действующее вещество: панавир (полисахариды побегов Solanum tuberosum)200 мкг,
Вспомогательные вещества: натрия хлорид 0,045 г, вода для инъекций до 5 мл,
ПАНАВИР является противовирусным и иммуномодулирующим средством. Повышает неспецифическую резистентность организма к различным инфекциям и способствует индукции интерферона.
- герпесвирусные инфекции различной локализации, в т.ч. рецидивирующий генитальный герпес, герпес зостер и офтальмогерпес,
- вторичные иммунодефицитные состояния на фоне инфекционных заболеваний,
- цитомегаловирусная инфекция, в т.ч. у пациенток с привычным невынашиванием беременности. Может применяться у женщин с хронической вирусной инфекцией и интерферонодефицитным состоянием на этапе подготовки к беременности,
- папилломавирусная инфекция (аногенитальные бородавки) в составе комплексной терапии,
- язвенная болезнь желудка и двенадцатиперстной кишки у пациентов с длительно нерубцующимися язвами и симптоматическими язвами гастродуоденальной зоны в составе комплексной терапии,
- клещевой энцефалит с целью снижения вирусной нагрузки и снятия неврологической симптоматики (анизорефлексия, снижение рефлексов, болезненность точек выхода черепно-мозговых нервов, нистагм) в составе комплексной терапии,
- ревматоидный артрит в сочетании с герпесвирусной инфекцией у иммунокомпрометированных больных (для усиления анальгетического и противовоспалительного эффекта основной терапии) в составе комплексной терапии,
- ОРВИ и грипп в составе комплексной терапии,
- хронический бактериальный простатит в составе комплексной терапии.
- индивидуальная непереносимость,
- наличие аллергии к составным компонентам препарата: глюкозе, маннозе, рамнозе, арабинозе, ксилозе,
- период лактации,
- детский возраст до 12 лет.
Применение во время беременности возможно только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода.
При необходимости применения препарата в период лактации грудное вскармливание на период применения препарата следует прекратить.
Препарат переносится хорошо, возможные осложнения могут быть связаны с индивидуальной непереносимостью и повышенной чувствительностью к составляющим препарата.
В/в струйно медленно. Терапевтическая доза препарата составляет 200 мкг действующего вещества (содержимое 1 ампулы или 1 флакона).
Для лечения герпесвирусных инфекций и клещевого энцефалита применяют двукратно с интервалом 48 или 24 ч. При необходимости курс лечения можно повторить через 1 месяц.
Для лечения цитомегаловирусной и папилломавирусной инфекций применяют трехкратно в течение первой недели с интервалом 48 ч и двукратно в течение второй недели с интервалом 72 ч.
Для лечения язвенной болезни желудка и двенадцатиперстной кишки в фазе обострения и симптоматических язв гастродуоденальной зоны применяют 5 в/в инъекций через день в течение 10 дней.
Для лечения ревматоидного артрита в сочетании с герпесвирусной инфекцией у иммунокомпрометированных больных, применяют 5 в/в инъекций с интервалом 2448 ч, в случае необходимости курс можно повторить через 2 месяца.
Для лечения ОРВИ и гриппа применяют 2 в/в инъекции с интервалом 1824 ч.
Для лечения больных с хроническим бактериальным простатитом применяют 5 в/в инъекций с интервалом 48 ч.
Применение в педиатрии: Панавир назначается детям с 12 лет в дозе 100 мкг в/в 1 раз в сутки. Для лечения герпесвирусных инфекций и клещевого энцефалита применяют двукратно с интервалом 48 или 24 ч. При необходимости через 1 мес курс лечения можно повторить. Для лечения цитомегаловирусной и папилломавирусной инфекций применяют трехкратно в течение первой недели с интервалом 48 ч и двукратно в течение второй недели с интервалом 72 ч.
При передозировках возможно обратимое нарушение функций почек и селезенки
при использовании на этапе подготовки к беременности способствует снижению частоты репродуктивных потерь при цитомегаловирусной и герпесвирусной инфекциях.
При помутнении раствора препарат считается непригодным к применению.
Отпускается по рецепту
В защищенном от света месте, при температуре 2-25 C
Высокомолекулярный иммуномодулятор Полиоксидоний обладает широким спектром фармакологического воздействия на организм. Это воздействие состоит из иммуномодулирующего, антиоксидантного, детоксицирующего и мембранопротекторного эффекта.
Иммуномоделирующий эффект полиоксидония заключается в:
- повышении способности нейтрофилов поглощать и убивать поглощённый Staph . aureus , причём полиоксидоний повышает киллинг бактерий нейтрофилами периферической крови как здоровых доноров, так и больных хронической грануломатозной болезнью;
- иммуномодулирурующем эффекте на продукцию противовоспалительных цитокинов мононуклерами периферической крови здоровых доноров, что проявляется в понижении повышенных и повышении пониженных уровней ИЛ-1, ИЛ-6, ФНО;
- усилении цитотоксической активности NK -клеток, особенно при их исходно пониженных уровнях;
- активации резидентных макрофагов ретикуло-эндотелиальной системы, что ведёт к более быстрой элиминации из организма чужеродных частиц;
- повышении естественной резистентности организма к экспериментальным бактериальным и вирусным инфекциям;
- усилении антителообразования к Т-зависимым и Т-независимым антигенам как животного, так и микробного происхождения.
Полиоксидоний активирует иммунные реакции у животных с тяжелыми формами иммунодефицитов, в частности усиливает антителообразование у:
- мышей с врожденной аплазией тимуса (мыши nude );
- мышей с искусственно созданным дефицитом Т-системы иммунитета (В-мыши);
- мышей с искусственно индуцированной введением циклофосфамида деструкцией В-системы иммунитета;
- старых мышей, характеризующихся возрастным иммунодефицитом.
Детоксицирующие свойствами полиоксидония проявляются в его способности понижать в крови концентрацию токсических веществ, например у больных с ожоговой болезнью уровень липополисахарида энтеробактерий. У больных с острым панкреонекрозом полиоксидоний существенно снижает уровень малонового диальдегида и диеновых кислот. Детоксицирующие свойства полиоксидония связаны с его высоким молекулярным весом и наличием на поверхности молекулы большого количества различных активных групп. Поэтому он активно адсорбирует на своей поверхности циркулирующие в крови, как растворимые токсические субстанции, так и микрочастицы.
Антиоксидантные свойства полиоксидония проявляются в:
- перехвате в водной среде активных форм кислорода: супероксидного аниона, перекиси водорода, гидроксильного радикала;
- уменьшении концентрации каталитически активного двухвалентного железа, что ведёт к ингибиции перекисного окисления липидов;
- подавлении спонтанной и индуцированной люминол- и люцегенинзависимой хемилюминесценции.
Мембранопротекторные свойства полиоксидония проявляются в защите клеток от повреждающего действия ряда токсических веществ.
Клиническое применение иммуномодуляторов. Выше отмечалось, что существует 3 основные группы заболеваний иммунной системы: иммунодефициты, аллергические и аутоиммунные процессы. Рассмотрим вопрос, при каких заболеваниях является целесообразным применение иммуномодуляторов.
Аллергические заболевания. При аллергических заболеваниях использование иммуномодуляторов является целесообразным в тех случаях, когда эти заболевания осложнены какими-либо проявлениями вторичной иммунной недостаточности: например, атопический дерматит с пиодермией, бронхальная астма с явлениями хронического гнойно-обструктивного бронхита, рецидивирующей герпетической или цитомегаловирусной инфекции и т.д. Как видно из приведенных примеров, в этих случаях эффект иммуномодуляторов направлен на ликвидацию у больного с аллергическим процессом, инфекционного очага. В ряде случаев это может существенно улучшить клиническую картину основного заболевания. Например, применение иммуномодулирующей терапии у больных с бронхиальной астмой может удлинять продолжительность ремиссии до 1-го года. Однако во всех этих случаях иммуномодулирующая терапия не направлена на основную причину заболевания, т.е. не является этиотропной. Как известно, при аллергических заболеваниях происходит активация Th 2-клеток и повышена продукция цитокинов: ИЛ-4, ИЛ-5, ИЛ-13. ИЛ-5 способствует созреванию эозинофилов и их активации. ИЛ-4/ИЛ-13 индуцируют В-клетки к синтезу IgE . Следовательно, с иммунологических позиций причиной аллергического процесса, если не главной, то очень существенной, является повышенная активность Th 2-клеток. Отсюда, становится очевидным, что одним из направлений в иммуномодулирующей терапии этих процессов является применение препаратов, снижающих активность Th 2- и повышающих активность Th 1-клеток, т.е. иммуномодуляторов. Однако, в настоящее время не существует препаратов с доказанной селективной способностью изменять баланс Th 1/ Th 2-клеток в указанном направлении и разрешенных к медицинскому применению при аллергиях.
Аутоиммунные заболевания. При аутоиммунных заболеваниях в настоящее время достаточно широко применяются иммунотропные препараты, относящиеся к группе иммунодепрессантов и направленные на подавление аутоиммунного воспалительного процесса. Их применение, как правило, дает быстрый и хороший клинический эффект. Тем не менее, такое лечение, вероятно, нельзя считать этиотропным, так как оно направлено на симптоматику, а не на причину заболевания. Так, применение гормональных препаратов при рассеянном склерозе, являющимся Th 1-опосредованным заболеванием, дает хороший клинический эффект, но не удлиняет продолжительности ремиссии – этого важного показателя эффективности терапии.
В основе этиопатогенеза многих аутоиммунных заболеваний, как при аллергических процессах, лежит дисбаланс Th 1/ Th 1-клеток. При рассеянном склерозе, ревматоидном артрите, аутоиммунных тиреоидитах и т.д. наблюдается повышенная активность Th 1-, при системной красной волчане, аутоиммунных васкулитах, некоторых видах анемий – Th 2-клеток. Учитывая эти данные, является очевидным, что иммуномодулирующая терапия при аутоиммунных заболевания должна включать препараты, понижающих активность Th 1- и повышающих активность Th 2-клеток. В настоящее время нет препаратов, разрешенных к медицинскому применению при аутоиммунных заболеваниях и обладающих способностью изменять баланс Th 1/ Th 2-клеток в указанном направлении. Поэтому основанием для применения иммуномодуляторов при аутоиммунных процессах, как и при аллергии, являются инфекционные процессы, осложняющие течение основного заболевания.
Иммунодефициты. Повышенная инфекционная заболеваемость является главным проявлением как первичных, так и вторичных иммунодефицитов. Возникает вопрос, целесообразно ли применение иммуномодулирующих препаратов при первичных иммунодефицитах, в основе которых лежит генетический дефект? Естественно, что с помощью этих препаратов исправить генетический дефект является невозможным. Но антиинфекционная защита является многокомпонентной и можно ожидать, что при некотором повышении с помощью иммуномодуляторов функциональной активности нормально работающего компонента иммунной системы будет скомпенсирована, хотя бы частично “плохая работа” дефектного компонента. Существенное улучшение клинического состояния и показателей иммунного статуса наблюдается у больных с пониженным уровнем всех классов иммуноглобулинов (общая вариабельная иммунологическая недостаточность) при лечении их иммуномодулирующими препаратами, активирующих фагоцитоз, в частности, полиоксидония. Поэтому хорошо продуманное применение иммуномодулирующей терапии у больных с первичными иммунодефицитами может дать хороший клинический результат.
Главной мишенью применения иммуномодулирующих препаратов являются вторичные иммунодефициты, которые проявляются в частых, рецидивирующих, трудно подающихся лечению инфекционно-воспалительных заболеваний всех локализаций и любой этиологии. В основе любого хронического инфекционно-воспалительного процесса лежат те или иные изменения в иммунной системе, которые и являются одной из причин существования этого процесса. Исследование параметров иммунной системы может не всегда выявить эти изменения. Поэтому при наличии в организме хронического инфекционно-воспалительного процесса можно назначать больному иммуномодулирующие препараты, даже в том случае, если иммунодиагностическое исследование не выявит существенных отклонений в иммунном статусе.
Как правило, при этих процессах в зависимости от вида возбудителя врач назначает антибиотики, противогрибковые, противовирусные средства или другие химиотерапевтические препараты. Мы считаем, что во всех случаях, когда врач назначает противомикробные средства при явлениях вторичной иммунологической недостаточности, следует назначать и иммуномодулирующую терапию. При лечении таких процессов иммуномодуляторы применяются в основном в комплексном лечении совместно с этиотропными химиотерапевтическими средствами.
Таким образом, основным критерием для назначения иммуномодулятора является клиническая картина заболевания, проявляющаяся в наличии хронического инфекционно-воспалительного процесса, трудно подающегося адекватному антиинфекционному лечению.
Отдельным является вопрос о применении иммуномодуляторов при острых бактериальных и вирусных инфекциях. Как правило, их назначение не рекомендуется при острых процессах, так как это может утяжелить их течение. Например, при вирусной инфекции активация Т-киллеров может вызвать фатальный исход за счет массивного разрушения тканей, инфицированных вирусом. Это, вероятно, нужно иметь в виду при назначении тимических препаратов, а также препаратов бактериального происхождения, являющихся мощными индукторами провоспалительных цитокинов. Применение иммуномодуляторов при острых инфекционных процессах, особенно бронхо-лёгочного аппарата, может быть оправдано у иммунологически компрометированных людей, например относящихся к группе часто и длительно болеющих. Иммуномодуляторы в этих случаях применяются с целью предупредить развитие постинфекционных осложнений. Наличие у полиоксидония детоксицирующих и антиоксидантных свойств делает возможным его применение при острых инфекционных заболеваниях. Клиническая практика показывает эффективность и безопасность его применения при острых инфекциях. Мы полагаем, что не только полиоксидоний, но и другие иммуномодуляторы с антиоксидантными и детоксицирующими свойствами могут применяться при острых инфекционных процессах у иммунологически компрометированных людей.
Нередко возникает вопрос, можно проводить иммуномодуляцию в виде монотерапии? Петровым Р.В. [6] было впервые сформулировано понятие иммунореабилитация, под которой понимается комплекс медикаментозных и немедикаментозных лечебных мероприятий, направленных на восстановление функциональной активности иммунной системы и здоровья человека. Мы полагаем, что при иммунореабилитационных мероприятиях иммуномодуляторы могут применяться виде монотерапии и в комплексе с различными общеукрепляющими средствами. Это оправдано у:
- людей с неполным выздоровлением (наличие бронхита, ларингита, трахеита и др.) после перенесенного острого инфекционного заболевания;
- часто и длительно болеющих людей, перед началом осенне-зимнего сезона, особенно в экологически неблагоприятных регионах;
- онкологических больных для улучшения качества жизни.
Наш опыт применения иммуномодуляторов в группе часто и длительно болеющих рабочих металлургического комбината г.Н.Тагил, являющегося одним из самых экологически неблагоприятных регионов России, позволил существенно снизить у этих рабочих частоту острых респираторных заболеваний [8]. Мы считаем, что разработка методов оздоровления населения с помощью иммуномодулирующей терапии является важной социальной задачей народного здравоохранения.
Другим направлением применения иммуномодуляторов в виде монотерапии является иммунореабилитация онкологических больных. O пыт применения иммуномодулятора полиоксидония показал, возможность существенного улучшения качества жизни таких больных за счет иммуностимулирующих, антиоксидантных и детоксицирующих свойств этого препарата. Мы считаем, что применение иммуномодуляторов в комплексном лечении онкологических больных является перспективным направлением клинической иммунологии и онкологии.
В заключение сегодня можно сформулировать некоторые общие принципы применения иммуномодуляторов у больных с недостаточностью антиинфекционной защиты:
1. Иммуномодуляторы назначают в комплексной терапии одновременно с антибиотиками, противогрибковыми, противопротозойными или противовирусными средствами.
2. Целесообразным является раннее назначение иммуномодуляторов, с первого дня применения химиотерапевтического этиотропного средства.
3. Иммуномодуляторы, действующие на фагоцитарное звено иммунитета, можно назначать больным как с выявленными, так и с невыявленными нарушениями иммунного статуса, т.е. основанием для назначения препарата является клиническая картина.
4. При наличии в данном лечебно-профилактическом учреждении соответствующей материально-технической базы применение иммуномодуляторов целесообразно проводить на фоне иммунологического мониторинга. Этот мониторинг следует проводить вне зависимости от выявленных или нет исходных изменений в иммунной системе.
5. Иммуномодуляторы можно применять в виде монотерапии при проведении иммунореабилитационных мероприятий, в частности при неполном выздоровлении после перенесенного острого инфекционного заболевания.
6. Наличие понижения какого-либо параметра иммунитета, выявленного при иммунодиагностическом исследовании у практически здорового человека, не обязательно является основанием для назначения ему иммуномодулирующей терапии.
В заключении хочется отметить, в настоящее время имеется теденция произвольно называть иммуномодуляторами различные биологически активные вещества типа пищевых добавок, витаминов, эубиотиков, ферментных препаратов и т.д. Ещё раз обращаем внимание на то, что иммуномодуляторы это лекарственные препараты, которые должны пройти доклинические и клинические испытания в соответствии с Методическими рекомендациями, утверждёёнными Фармакологическим государственным комитетом при Минздраве РФ [10,12], и получить разрешение на медицинское применение в качестве иммуномодуляторов.
Авторы приносят глубокую благодарность за критику и ценные замечания, сделанные при обсуждении данной статьи профессорам А.А.Ярилину, А.С.Симбирцеву, Л.П.Сизякиной, Т.И.Гришиной, Н.И.Ильиной, Т.В.Латышевой.
1.Ершов Ф.И. Антивирусные препараты. Справочник. М. Медицина. 1998
2.Лесков В.П. Иммуностимуляторы. Аллергия, астма и клиническая иммунология. 1999, N4, 12-25
3.Машковский М.Д. Препараты, корригирующие процессы иммунитета (иммуномодуляторы, иммунокорректоры). Лекарственные средства (Пособие для врачей). 1993. Часть II. 192-209
6.Петров Р.В. Иммунореабилитация и стратегия медицины. Int.J.Immunoreabil. 1994, 1 Suppl. 5-6
7.Петров Р.В., Хаитов Р.М., Некрасов А.В. и др. Полиоксидоний – иммуномодулятор последнего поколения: итоги трехлетнего клинического применения. Аллергия, астма и клиническая иммунология. 1999, N3, 3-6
8.Хаитов Р.М., Пинегин Б.В., Истамов Х.М. Экологическая иммунология. М. Изд.ВНИРО. 1995
9.Хаитов Р.М., Пинегин Б.В. Иммуномодуляторы и некоторые аспекты их клинического применения. Клиническая медицина. 1996, т.74, N8, 7-12
10.Хаитов P.М., Гущин И.С., Пинегин Б.В., Зебрев А.И. Экспериментальное изучение иммунотропной активности фармакологических препаратов. Ведомости фармакологического комитета. 1999, 1, 31-36
11.Хаитов РМ, Пинегин БВ. Современные иммуномодуляторы: основные принципы их применения. Иммунология. 2000. N5, 4-7
12.Хаитов Р.М., Пинегин Б.В., Латышева Т.В. Методические указания по испытанию новых иммуномодулирующих лекарственных средств. Ведомости научного центра экспертизы и государственного контроля лекарственных средств. 2002. №1. 11-21
13.Hadden JW. Immunostimulants. Immunol.Today. 1993, 14, 275-280
14.Werner GH, Jolles P. Immunostimulating agents: what next? A review of their present and potential medical applications. Eur.J.Immunol. 1996, 242, 1-19
Читайте также:


