Препараты для диагностики стафилококковых инфекций

Перетрухина А. Т., Блинова Е. И.,
Стафилококковая инфекция
Стафилококки относятся к 17 группе (Грамположительные кокки) по определителю Берджи.
Стафилококки входят в состав нормальной микрофлоры кожи и слизистых оболочек, сообщающихся с внешней средой. Поэтому стафилококковая инфекция может возникнуть как эндогенная (аутоинфекция) при снижении уровня иммунологической защиты или нарушении целостности кожно-слизистых барьеров. Также может развиваться и как экзогенная при инфицировании циркулирующими в окружающей среде штаммами, в том числе и больничными.
Клинические проявления стафилококковой инфекции определяются как биологическими особенностями штамма, так и локализацией процесса и уровнем специфических и неспецифических механизмов защиты.
Стафилококки имеют сложное антигенное строение (свыше 50 антигенов, отличающихся по строению и локализации).
Стафилококки - условно-патогенные микроорганизмы. Способность отдельных штаммов вызвать те или иные формы стафилококковой инфекции во многом определяется их способностью продуцировать тот или иной набор токсинов и ферментов агрессии и защиты.
Стафилококки продуцируют комплекс секретируемых экзотоксинов. Это мембраноповреждающие токсины - α-, β-, δ- и γ-гемотоксины. Повреждая мембраны, каждый из них разрушает эритроциты, лейкоциты, макрофаги и другие клетки. Кроме того, стафилококки могут образовывать энтеротоксины, эксфолиативный токсин, токсин, вызывающий развитие синдрома токсического шока.
К ферментам агрессии и защиты относится многочисленная группа секретируемых белков-ферментов: плазмокоагулаза, гиалуронидаза, фибринолизин, лецитиназа, протеаза, ДНК-азы и др. Они обеспечивают распространение стафилококков по тканям и органам и защищают их от действия антимикробных механизмов организма.
Противостафилококковый иммунитет складывается из антитоксического и антимикробного компонентов. Для создания искусственного иммунитета применяются стафилококковый анатоксин и вакцина.
Для лечебных целей изготавливается стафилококковый антифагин, а для диагностических - типовые бактериофаги.
Стафилококковый анатоксин
1. Нативный стафилококковый анатоксин
Готовый препарат прозрачен, желтоватого цвета. Применяется он подкожно для терапевтических целей при различных заболеваниях стафилококковой этиологии (стафилодермия, хронический и рецидивирующий фурункулез, карбункулы, остеомиелиты, септицемия и др.). В этих случаях проводится серия инъекций с интервалами в 3-5 дней, в дозах, начиная от 0, 1 до 2 мл. Разница между предыдущими и последующими дозами равна 0,2-0,3 мл в каждом случае при назначении дозы препарата необходимо руководствоваться интенсивностью местной и общей реакции, наблюдавшейся после предыдущей инъекции.
С профилактической целью анатоксин вводят подкожно трехкратно в дозах 0,5-1,0-1,0 мл с интервалами в 20 дней между первой и второй и 10 дней между второй и третьей инъекциями. Через 3 и 12 месяцев, а также в тех случаях, когда можно думать о возможности массивного загрязнения стафилококками, производится ревакцинация дозой в 1 мл.
Срок годности нативного стафилококкового анатоксина 1 год со времени окончания биологического контроля.
2. Очищенный концентрированный сорбированный стафилококковый анатоксин
Анатоксин хранится в темном, сухом месте при температуре 4-10 °С. Замораживание и оттаивание, даже однократное, приводит препарат в негодность.
Показания к применению очищенного концентрированного сорбированного стафилококкового анатоксина те же, что и для нативного анатоксина. Вводится препарат подкожно, дважды с интервалом 30-45 дней в дозах 0,5 мл. Ревакцинация той же дозой через 3 месяца и 1 год, а также по специальным показаниям.
Срок годности очищенного концентрированного анатоксина 2 года со дня контроля его биологических свойств. По истечении этого срока препарат может быть переконтролирован в институте, изготовившем его.
Стафилококковая вакцина
Препарат представляет собой взвесь убитых нагреванием стафилококков, антигенный комплекс которых является его действующим началом.
Для приготовления вакцины применяют штаммы золотистых и белых стафилококков, выделенные от больных с различными гнойничковыми поражениями кожи. Они должны обладать всеми признаками, характерными для безусловно-патогенных стафилококков.
Препарат предназначен для специфической иммунотерапии при различных процессах стафилококковой этиологии. Вводится вакцина подкожно и внутримышечно в дозах от 0,1 до 1,0 мл с интервалами в 3-4 дня (всего 10-12 инъекций). Необходимо учитывать степень общей, местной и очаговой реакции. Если предполагается высокая сенсибилизация организма, вакцина разводится 1:10 и даже 1:100.
Срок годности препарата - 1 год.
Стафилококковый антифагин
В основе действия антифагина лежит его способность вызывать образование агглютининов и опсонинов в организме иммунизированных им людей и животных, что повышает устойчивость их к инфекции. Систематический курс лечения антифагином приводит также к десенсибилизации организма больных.
Препарат представляет собой фильтрат двухсуточных культур стафилококков, прогретых при 100 °С в течение часа.
Срок годности его 2 года с момента определения активности: по истечении срока годности допускается продление его на год при условии сохранения специфической активности.
Стафилококковые диагностические типовые бактериофаги
Стафилококковые типовые бактериофаги представляют собой высушенные лиофильным методом стерильные фильтраты фаголизатов эталонных штаммов стафилококка (4 группы - 22 типа).
Предназначены типовые бактериофаги для идентификации и типирования патогенных, коагулазоположительных штаммов стафилококка.
Срок годности препарата - 1,5 года.
Стрептококковая инфекция
Стрептококки относятся к 17 группе (Грамположительные кокки) по определителю Берджи.
Стрептококки - условно-патогенные микроорганизмы. Обитают на слизистых оболочках верхних дыхательных путей, пищеварительного и мочеполового трактов. Поэтому вызываемые ими заболевания имеют как эндогенное, так и экзогенное происхождение. Стрептококки способны поражать любые органы и ткани, вызывая различные заболевания: от ангины до сепсиса. К специфическим проявлениям стрептококковой инфекции относятся скарлатина и рожистое воспаление.
Стрептококки имеют сложное антигенное строение. По локализации их антигены делят на экстрацеллюлярные (антигены токсинов и ферментов агрессии и защиты, капсульные) и целлюлярные (поверхностные и глубокие).
Факторы вирулентности стрептококков весьма разнообразны. Прежде всего это белки клеточной стенки в комплексе с тейхоевыми кислотами, обеспечивающие адгезию стрептококков на клетках тканей и органов.
М-белок стрептококков является протективным антигеном. Он нарушает процессы фагоцитоза, из-за сходства в строении с антигенами сердечной и почечной ткани становится причиной аутоиммунных процессов.
Fc-белок стрептококков неспецифически связывается с Fc-фрагментом иммуноглобулинов классов G и A, также вызывая аутоиммунные конфликты.
Токсины стрептококков - стрептолизин О и стрептолизин S. Первый обладает гемолитическим, лейко- и кардиотоксическим действием, второй - гемолитическим и цитотоксическим. Некоторые виды продуцируют эритрогенный токсин, вызывающий паралич капилляров.
К факторам вирулентности относится и капсулообразование, что особенно четко выражено у пневмококков.
Стрептококки продуцируют широкий набор ферментов агрессии и защиты: стрептокиназа (фибролизин), стрептодорназа (ДНК-аза), гиалуронидаза, протеазы, пептидазы, липаза и др.
В настоящее время с диагностическими целями для выявления аллергии и степени выраженности аллергического состояния у больных хронической, рецидивирующей стрептококковой инфекцией применяются комплексные микробные аллергены для кожных проб, аллерген гемолитического стрептококка (фиброаллерген).
Для определения напряженности иммунитета к скарлатине применяется кожная проба (реакция Дика) с очищенным токсином скарлатинозного стрептококка.
Аллерген гемолитического стрептококка (фиброаллерген)
Препарат представляет собой очищенный фильтрат бульонных культур гемолитического стрептококка. Дозируется он в кожных дозах и вводится внутрикожно в объеме 0,1 мл для выявления аллергии и степени выраженности аллергического состояния у больных хронической, рецидивирующей стрептококковой инфекцией.
Положительная реакция проявляется в гиперемии, инфильтрации и болезненности в месте введения препарата.
Учет реакции производится через 2, 24 и 48 часов, интенсивность ее оценивается по четырехплюсовой системе (диаметр гиперемии 30 мм и болезненность - ++++; 21-29 мм - +++; 15-20 мм - ++; 10-15 мм - + сомнительная реакция). Если на введение одной и двух кожных доз реакция отсутствует, можно ввести 4 кожных дозы в объеме 0,1 мл через 48 часов после первых инъекций.
Высокоочищенный эритрогенный (скарлатинозный) токсин
для реакции Дика
Для определения напряженности иммунитета к скарлатине применяется кожная проба (реакция Дика) с очищенным токсином скарлатинозного стрептококка. Сырьем для изготовления препарата служит токсин, продуцируемый на жидкой питательной среде гемолитическим стрептококком группы А, типа 10 (штамм Доше №5).
Приготовленный сухой очищенный токсин разводят таким образом, чтобы в 0,1 мл содержалось по 1, 4, 10 и 20 кожных доз (1 кожная доза - минимальное количество токсина, дающее эритему 15-20 мм при интенсивности ++). Разведенный токсин разливают по 2 мл.
Реакцию Дика ставят путем внутрикожного введения токсина в объеме 0,1 мл в среднюю часть внутренней поверхности предплечья. У неиммунных лиц наблюдается положительная реакция в виде гиперемии в области введения препарата.
Срок годности токсина 6 месяцев со дня разведения.
Комплексные микробные аллергены для кожных проб
Препараты представляют собой инактивированную суспензию микробных тел стафилококков золотистого и белого, кандида, кишечной палочки, бета-гемолитического и зеленящего стрептококков.
При внутрикожном введении 0,1 мл аллергена он вызывает в сенсибилизированном организме аллергическую реакцию трех типов: замедленную, немедленную, а также комбинированную. Учет реакции осуществляется так же, как и при введении аллергена гемолитического стрептококка.
Аллергены гемолитического стрептококка, энтерококка и гемолитического стафилококка
Препараты представляют собой термостабильные фракции, выделенные из фильтратов 5-6 дневных бульонных культур путем осаждения трихлоруксусной кислотой и спиртом. Для приготовления аллергенов используются термостабильные фракции культур 2-3 штаммов каждого вида микроорганизмов. Дозируются аллергены в кожных дозах. Диагностическими считаются положительные реакции на 1, 2, 4 кожных дозы аллергена гемолитического стрептококка и на 1, 2, 4, 10 доз гемолитического стафилококка и энтерококка.
Препараты вводятся внутрикожно в объеме 0,1 мл. Учет реакции производится так же, как и при введении аллергена гемолитического стрептококка.
Срок годности препаратов - 1 год.
Гонококковая инфекция
Возбудитель гонококковой инфекции гонококк Neisseria относится к группе 4 (Грамотрицательные, аэробные/микроаэрофильные палочки и кокки) по классификатору Берджи.
К основным факторам вирулентности гонококков относят способность к адгезии и колонизации эпителиальных клеток слизистой оболочки мочеполового тракта и продукции эндотоксина.
У гонококков имеются белковые антигены наружной мембраны и липополисахаридные антигены клеточной стенки.
В настоящее время гонококковую инфекцию относят к наиболее распространенным инфекционным заболеваниям. Она часто проявляется воспалением верхних и нижних отделов мочеполового тракта, может вызывать воспаления прочих органов и тканей (проктит, фарингит, бленнорея, тазовый перитонит и перигепатит, фарингеальная гонорея). Диссеминирование возбудителя может приводить к пельвиоперитониту, менингитам, артритам, эндокардитам и септицемиям. Перенесенное заболевание не оставляет стойкого иммунитета.
Попадание гонококков в организм не всегда приводит к развитию заболевания, важное значение имеют вирулентность возбудителя, инфекционная доза, место проникновения, функциональное состояние факторов неспецифической резистентности и скорость развития иммунных реакций.
Этиотропная терапия проводится антибиотиками. При хронических формах гонореи в качестве специфического лечебного средства применяется гонококковая вакцина.
Гонококковая вакцина
Гонококковая вакцина представляет собой поливалентный препарат, приготовленный из штаммов, свежевыделенных от больных с разными формами гонореи. Обычно используется не менее двенадцати штаммов, типичных по всем признакам.
Действующим началом препарата является антигенный комплекс убитых гонококков.
Вакцина назначается с лечебной целью при разных формах гонореи, а также для провокации процесса при затрудненной диагностике. Применяется внутримышечно или внутрикожно. Длительность иммунизации определяется лечащим врачом в зависимости от клинических показаний.
Относятся к семейству Micrococcoceae. Род Staphylococcus включает 19 видов, из которых патогенны для человека только некоторые: S.aureus, S.epidermidis и S.saprophyticus. Заболевания вызывают золотистые, реже – эпидермальные и еще реже – сапрофитные стафилококки.
Морфология, физиология. Отдельные клетки имеют форму правильного шара, при размножении образуют скопления в виде гроздьев винограда (slaphyle – виноградная гроздь). Размер от 0,5 до 1,5 мкм. В препаратах из патологического материала (из гноя) располагаются поодиночке, парами или небольшими скоплениями. Золотистые стафилококки имеют способность образовывать нежную капсулу.
Стафилококки – факультативные анаэробы, но лучше развиваются в аэробных условиях, Гр+. На поверхности плотных питательных сред образуют круглые, выпуклые, пигментированные (золотистые, палевые, лимонно-желтые, белые) колонии с ровными краями; в жидких – равномерное помутнение. В лабораториях используют способность стафилококков размножаться в средах с большим количеством (6-10 %) NaCl (ЖСА). Такую концентрацию соли другие бактерии не переносят Þ солевые среды являются элективными для стафилококков. Штаммы золотистых стафилококков, продуцирующие гемолизины, дают на кровяном агаре колонии, окруженные зоной гемолиза.
Стафилококки имеют ряд ферментов, расщепляющих многие углеводы, белки. Дифференциально-диагностическое значение имеет тест на сбраживание глюкозы в анаэробных условиях. Из ферментов, участвующих в патогенезе стафилококковых инфекций, только плазмокоагулаза и частично ДНКаза характерны для S.aureus. Другие ферменты (гиалуронидаза, протеиназа, фосфатаза, муромидаза) непостоянны (но чаще продуцируются S.aureus). Стафилококки ситезируют бактериоцины. Устойчивы к пенициллину (пенициллиназа).
Антигены. Вещества клеточной стенки: пептидогликан, тейхоевые кислоты, белок А, типоспецифические агглютиногены, а также капсула, имеющая полисахаридную природу. Пептидогликан имеет общие АГ с пептидогликанами микрококков и стрептококков. Антигенность тейхоевых кислот связана с аминосахарами. Белок А золотистого стафилококка способен к неспецифическому соединению с Fc-фрагментом IgG, в связи с чем он агглютинируется нормальной человеческой сывороткой. У стафилококков есть 30 белковых типоспецифических антигенов. Но внутривидовая дифференциация по Аг структуре в практике не используется.
Патогенность. Повреждающее действие на клетки и ткани организма человека оказывают токсины и ферменты. Также к факторам патогенности можно отнести капсулу, препятствующую фагоцитозу и связывающую комплемент, а также белок А, инактивирующий комплемент и тормозящий опсонизацию при взаимодействии с Fc-фрагментом IgG.
S.aureus способен выделять ряд токсинов, в частности лейкоцидин, который оказывает губительное действие на фагоцитирующие клетки, главным образом на макрофаги. Гемолизины (α, β, дельта, γ) оказывают лизирующее действие на эритроциты человека и животных (кролика, лошади, барана). Основным из них является α-токсин, продуцируемый S.aureus. Помимо гемолитического, этот яд обладает кардиотоксическим действием, вызывает спазм коронарных сосудов и остановку сердца в систоле, он поражает нервные клетки и нейроны, лизирует мембраны и лизосомы клеток, что приводит к освобождению лизосомальных ферментов.
Возникновение пищевых отравлений стафилококковой природы связано с действием энтеротоксинов, продуцируемых золотистыми стафилококками. Известно 6 антигенов различных энтеротоксинов (АВСDЕF).
Эксфолиативные токсины вызывают у новорожденных пузырчатку, локальное буллезное импетиго, генерализованную скарлатиноподобную сыпь. Заболевания сопровождаются внутриэпидермальной отслойкой эпителия кожи, образованием сливающихся пузырей, жидкость в которых стерильна. Фокус стафилококковой инфекции находится чаще всего при этом в пупочной ранке.
Экзоверменты: плазмокоагулаза осуществляет свертывание плазмы (белки как бы одеваются в фиброзный чехол, защищающий их от фагоцитоза). Большие концентрации коагулазы, в организме больного, приводят к уменьшению свертываемости периферической крови, нарушению гемодинамики, прогрессирующему кислородному голоданию тканей.
Гиалуронидаза способствует распространению стафилококков в тканях. Лецитиназа разрушает лецитин, входящий в состав оболочек клеток, вызывает лейкопению. Фибринолизин растворяет фибрин, отграничивающий местный воспалительный очаг, чем способствует генерализации патологического процесса. Патогенетические свойства других экзоферментов стафилококков (ДНКаза, мурамидаза, протеиназа, фосфатаза), часто сопровождающих коагулазную активность, еще не определены.
Экология и распространение. В первые дни жизни человека стафилококки поселяются на слизистых оболочках рта, носа, в кишечнике, а также на коже, входят в состав формирующейся нормальной микрофлоры тела человека.
Стафилококки постоянно поступают в окружающую среду от человека. Они присутствуют на предметах обихода, в воздухе, в воде, в почве, на растениях. Но их болезнетворная активность различна, особое внимание уделяется золотистым стафилококкам как потенциально патогенным для человека. При контакте с источником инфекции носителями S.aureus становятся не все люди. Формированию бактерионосительства способствуют низкое содержание SIgA в носовом секрете и другие проявления функциональной недостаточности иммунной системы. У таких лиц формируется резидентное носительство, т.е. постоянным местом обитания стафилококков становится слизистая оболочка носа, на которой микроорганизмы интенсивно размножаются и выделяются в окружающую среду массивными дозами. В лечебных учреждениях их источником являются больные с открытыми гнойно-воспалительными процессами (инфекция передается контактным путем). Этому способствует длительность выживания стафилококков на окружающих предметах.
Хорошо переносят высушивание, пигмент защищает их от губительного действия солнечного света (прямые солнечные лучи убивают их только через несколько часов). При комнатной температуре они остаются жизнеспособными на предметах ухода за больным в течение 35–50 дней, на предметах твердого инвентаря – десятки дней. При кипячении гибнут мгновенно, чувствительны к дезинфектантам, к бриллиантовой зелени, что позволяет широко применять её для лечения поверхностных воспалительных заболеваний кожи.
Патогенез заболеваний человека. Способны поражать любую ткань человеческого организма. Это местные гнойно-воспалительные процессы (фурункулы, карбункулы, нагноения ран, бронхиты, пневмонии, отит, ангина, конъюнктивит, менингит, эндокардит, энтероколит, пищевые отравления, остеомиелит). Генерадизация любой формы местного процесса завершается сепсисом или септикопиемией. У лиц с иммунодефицитными состояниями стафилококковые инфекции развиваются чаще.
Иммунитет. Взрослые устойчивы, т.к. имеют естественные защитные механизмы и специфические антитела, которые приобретаются в течение жизни при контакте с больными и носителями. В процессе стафилококковой инфекции возникает сенсибилизация организма.
В формировании иммунитета имеют значение как антимикробные, так антитоксические и антиферментные антитела. Степень защиты определяется их титром и местом действия. Большую роль играют секреторные IgA, обеспечивающие местный иммунитет слизистых оболочек. Антитела к тейхоевым кислотам определяются в сыворотках крови взрослых и детей с тяжелыми стафилококковыми инфекциями: эндокардитом, остеомиелитом, сепсисом.
Лабораторная диагностика. Материал (гной) подвергают бактериоскопии и высевают на питательные среды. Кровь, мокроту, фекалии исследуют бактериологическим методом. После выделения чистой культуры по ряду признаков определяют видовую принадлежность. В случае выделения S.aureus определяют плазмокоагулазу, гемолизин, А-протеин.
Серодиагностика: РП (альфа-токсин), РНГА, ИФА.
Для установления источника и путей распространения инфекции, выделенные культуры фаготипируют. Лабораторный анализ непременно включает определение чувствительности выделенной культуры или культур к антибиотикам.
Профилактика и лечение. Профилактика направлена на выявление носителей S.aureus, главным образом среди персонала медицинских учреждений, с целью их санации. Особое внимание уделяется профилактике стафилококковых инфекций у новорожденных.
Для лечения острых стафилококковых заболеваний назначаются антибиотики, выбор которых определяется чувствительностью выделенной культуры к набору препаратов. При септических процессах вводят противостафилококковый иммуноглобулин или антистафилококковую плазму. Для лечения хронических стафилококковых инфекций (хрониосепсис, фурункулез и др.) применяют стафилококковый анатоксин, аутовакцину, которые стимулируют синтез антитоксических и антимикробных антител.
Методы микробиологической диагностики стафилококковых заболеваний отражены в схеме 1. Выполняется следующий комплекс методов исследования.
Бактериоскопический метод – микроскопия мазков из материала от больного, окрашенных по Граму. Выявление в мазках кокков, располагающихся небольшими группами по 2-3 бактерии; типичное расположение в виде гроздьев винограда характерно для чистых культур стафилококка (рис. 1 – цветная вкладка).
Бактериологический метод. Исследуемый материал засевают на чашки с желточно-солевым (ЖСА) и кровяным МПА, инкубируют при 37 0 С сутки. На 2 день учитывают характер
роста колоний на обеих средах. На желточно-солевом агаре колонии стафилококка имеют ровные края, гладкую поверхность, вокруг колонии образуется радужный венчик в результате расщепления лецитина яичного желтка ферментом лецитовителлазой; цвет пигмента колоний варьирует от золотистого до белого. На кровяном МПА вокруг колоний образуются зоны
гемолиза. Из типичных для стафилококка колоний делают мазок, окрашивают его по Граму, микроскопируют. Оставшуюся часть колонии пересевают на скошенный МПА для получения чистой культуры. На 3 день проводят идентификацию выделенной культуры стафилококка с дифференциацией основных видов в соответствии с таблицей 2, определяют чувствительность к антибиотикам методом бумажных дисков и фаговар (набор для фаготипирования состоит из фагов 21 типа, разделенных на 4 группы; при внутрибольничных инфекциях наиболее часто встречаются фаговары 77 и 80).
Таблица 1. Этиология бактериальных раневых и гнойно-воспалительных инфекций
Enterococcus faecalis, Staphylococcus aureus, Staphylococcus hyicus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus haemolyticus, Staphylococcus hominis, Streptococcus pyogenes, Streptococcus agalactiae, Erysipelotrix rhusiopathiae
Неспорообразующие грамположительные бактерии
Неспорообразующие грамотрицательные бактерии
Peptostreptococcus spp, Propionibacterium spp
Cпорообразующие грамположительные бактерии
Clostridium perfringens, Clostridium novy, Clostridium oedematiens, Clostridium septicum, Clostridium sordelli, Clostridium histolyticum, Clostridium sporogenes, Clostridium ramosum
Схема 1. Микробиологическая диагностика стафилококковых инфекций
Материал: гной, раневое отделяемое, пунктаты из полостей и абсцессов, кровь, мокрота, моча, ликвор, рвотные массы, испражнения, остатки пищи.
Выявление грамположительных кокков (группами по 2-3 клетки) в мазках из материала от больного, окрашенных по Граму
РНГА или РН для определения α-антитоксина в сыворотке крови больных хроническими стафилококковыми инфекциями. ИФА для определения антител к стафилококку. Имеет вспомогательное значение
1 день. Посев материала на чашки с желточно-солевым (ЖСА), кровяным МПА, сахарным МПБ.
2 день - учет характера роста колоний. На ЖСА колонии стафилококка с ровными краями, гладкой поверхностью, радужным венчиком вокруг, цвет - от золотистого до белого.
На кровяном МПА - зоны гемолиза, в МПБ –равномерное помутнение. В мазке из колоний в окраске по Граму – кокки в виде гроздьев винограда. Пересев оставшейся части колонии на скошенный МПА для получения чистой культуры, а с сахарного МПБ на кровяной МПА и ЖСА для получения изолированных колоний.
3 день - идентификация выделенной культуры стафилококка, дифференциация видов по биохимическим свойствам, определение чувствительности к антибиотикам и фаговара. Выделение чистой культуры с ЖСА и кровяного МПА.
4 день. Заключение о виде стафилококка. Идентификация культуры, выделенной из сахарного МПБ
5 день. Заключение о виде стафилококка, выделенного из сахарного МПБ.
Таблица 2. Дифференциация основных видов стафилококка
Анаэробная ферментация глюкозы
Анаэробная ферментация маннита
Чувствительность к новобиоцину
Обозначения: (+) – наличие признака; (-) – отсутствие признака; S - чувствительный; R – резистентный.
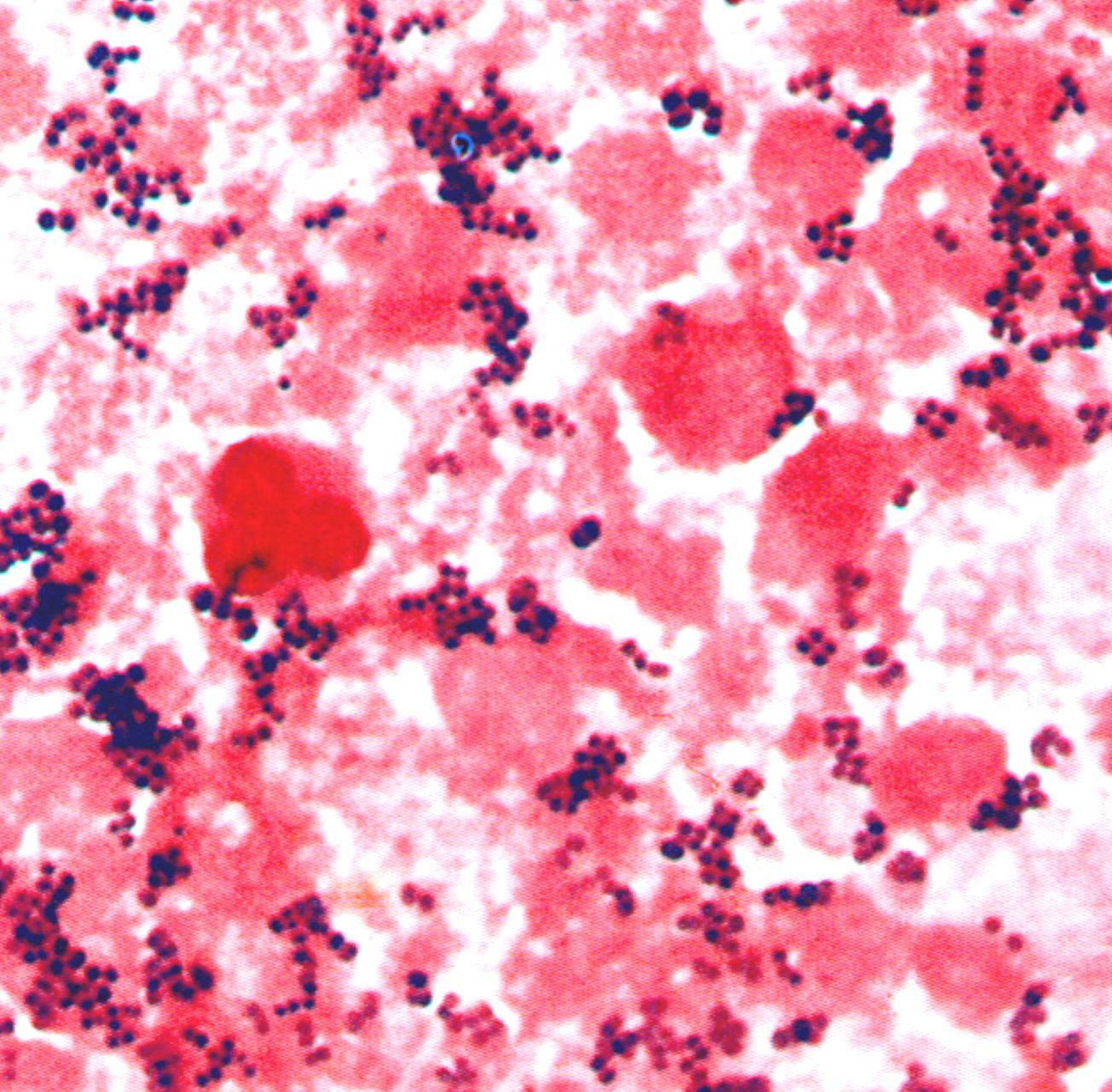
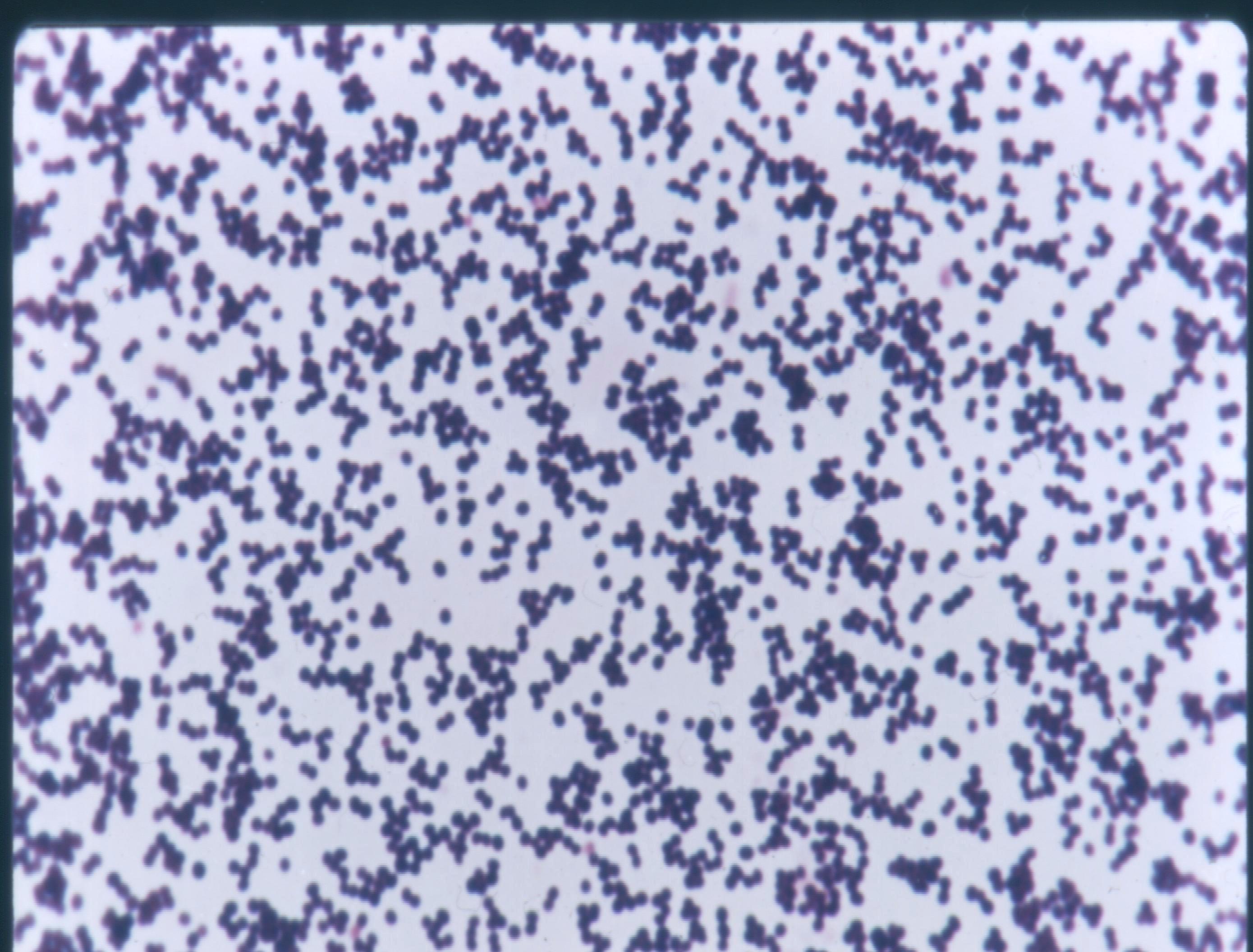
Рис. 1. Стафилококк - Staphylococcus aureus. а – мазок из исследуемого материала, б - мазок из чистой культуры. Окраска по Граму. Скопления кокков в виде гроздьев винограда. х900
Для выявления плазмокоагулазы цитратную плазму крови кролика разводят в 2 раза, разливают по 0,4 мл в пробирки, куда вносят петлей культуру стафилококков. Результаты регистрируют через 2, 4, 24 часа. При наличии плазмокоагулазы образуется сгусток.
В некоторых случаях у выделенных чистых культур стафилококка определяют наличие ДНК-азы, каталазы, лизоцимной активности, фибринолизина, гиалуронидазы.
Лизоцимную активность выявляют по зонам просветления вокруг колоний стафилококка при его посеве на МПА в чашках Петри с культурой Micrococcus luteus.
Определение ДНК-азы. Суточную агаровую культуру стафилококка засевают на МПА в чашке Петри, содержащий ДНК. После инкубации посевов при температуре 37 0 С в течение 18-24 часов поверхность МПА заливают 1 N раствором соляной кислоты. Наличие ДНК-азы характеризуется появлением зоны просветления вокруг колоний.
Каталазный тест. Чистую культуру стафилококка вносят в каплю 3%-10%-го раствора перекиси водорода на стекле и растирают круговыми движениями. При наличии каталазы перекись водорода разлагается с образованием пузырьков кислорода.
Cерологический метод в диагностике стафилококковых инфекций имеет вспомогательное значение, используясь, в основном, для диагностики хронических процессов (остеомиелит, септикопиемия и др.). Для определения антител к токсину стафилококка применяют РНГА с эритроцитарным диагностикумом, нагруженным α-токсином стафилококка или РН (реакция нейтрализации гемолитической активности стафилококкового токсина антитоксинами сыворотки крови больного в присутствии эритроцитов кролика). У здоровых лиц титр стафилококкового антитоксина составляет 0,5-4 АЕ. Разработан также ИФА.
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision September 2017 by Larry M. Bush, MD, FACP; Maria T. Perez, MD





Способность к тромбообразованию путем продуцирования коагулазы отличает вирулентный патоген, Staphylococcus aureus, от менее вирулентных коагулазонегативных штаммов стафилококка. Коагулазопозитивный S. aureus - один из самых распространенных и опасных для человека болезнетворных микроорганизмов из-за его высокой вирулентности и способности к формированию резистентности к антибиотикам.
Коагулазонегативные виды, такие как S. epidermidis все чаще ассоциируются с внутрибольничной инфекцией; S. saprophyticus является причиной инфекции мочевых путей. Коагулазонегативный S. lugdunensis может вызывать инвазивное заболевание с вирулентностью, аналогичной S. aureus. В отличие от большинства коагулазонегативных стафилококков, S. lugdunensis часто остается чувствительным к пенициллиназа-резистентным бета-лактамным антибиотикам (например, к метициллину).
Патогенные стафилококки распространены повсеместно. Около 30% здоровых взрослых, обычно временно, являются носителями стрептококков в носовых проходах и около 20% – на коже; отсюда стрептококки могут инфицировать самого носителя и других людей. Обсемененность пациентов стационаров и медперсонала значительно выше. Инфекция, вызванная S. aureus, чаще встречается среди бактерионосителей, чем среди лиц, которые таковыми не являются, и обычно вызвана колонизирующим штаммом.
Факторы риска
Людьми, предрасположенными к стафилококковой инфекции, являются:
Новорожденные младенцы и кормящие матери
Пациенты с гриппом, хроническими бронхолегочными заболеваниями (например, муковисцидоз, эмфизема), лейкемией, опухолями, хроническими кожными заболеваниями или сахарным диабетом
Пациенты с трансплантатами, имплантированными протезами, другими инородными телами или имплантированными внутрисосудистыми пластмассовыми катетерами
Пациенты, получающие глюкокортикоиды, иммуносупрессанты, лучевую терапию, или противоопухолевую химиотерапию
Пациенты с хронической болезнью почек и находятся на диализе
Пациенты с хирургическими разрезами, открытыми ранами или ожогами
Предрасположенным пациентам могут передаваться антибиотикорезистентные штаммы стафилококков от других пациентов, медперсонала или контактно-бытовым путем через предметы ухода за пациентами. Передача через руки персонала – наиболее распространенный способ заражения, воздушно-капельная передача также актуальна.
Болезни, вызываемые стафилококками
Стафилококки вызывают заболевание путем
Прямого проникновения в ткань
Иногда продукцией экзотоксина
Прямое проникновение в ткань является наиболее распространенным механизмом возникновения стафилококковых заболеваний, включая следующее:
Иногда стафилококками продуцируются множественные экзотоксины. Некоторые имеют локальные проявления; другие вызывают выработку цитокина из определенных Т-клеток, что ведет к серьезным системным поражениям (например, поражения кожи, шок, недостаточность органа, смерть). Лейкоцидин Пантона-Валентайна (PVL) является токсином, продуцируемым штаммами, инфицированными определенным бактериофагом. Лейкоцидин Пантон-Валентайна, как правило, присутствует в штаммах бытового метициллин резистентного стафилококка S. aureus (БМРЗС) и считается, что он опосредует способность к формированию некрозов; однако этот эффект не был доказан.
Токсин-опосредованные стафилококковые заболевания включают следующие:
Синдром токсического шока
Стафилококковый синдром ошпаренной кожи
Стафилококковое пищевое отравление
Упомянутые болезни обсуждаются далее в Р у к оводстве .
S. aureus вызываетбактериемию, которая часто приводит к появлению метастатических очагов инфекции, может возникнуть от инфекции S. aureus любой локализации, но особенно часто – от инфекции, связанной с присутствием внутрисосудистых катетеров или других инородных тел. Может также проявляться без какой-либо четко выявленной первичной локализации. S. epidermidis и другие коагулазонегативные стафилококки чаще вызывают внутрибольничную бактериемию, связанную с наличием внутрисосудистых катетеров и других инородных тел, так как они могут образовывать биопленки на этих материалах. Стафилококковая бактериемия является основной причиной заболеваемости (особенно удлинения периода госпитализации) и смертности среди ослабленных пациентов.
Инфекция кожи – наиболее распространенная форма стафилококкового заболевания. Поверхностные инфекции могут быть диффузными, с везикулярными пустулами, покрытыми коркой (импетиго), иногда в виде флегмоны или очаговыми с узловыми абсцессами (фурункулы и карбункулы). Более глубокие кожные абсцессы также широко распространены. Могут встречаться тяжелые некротизирующие инфекции кожи.




Стафилококки обычно являются причиной раневых и ожоговых инфекций, послеоперационных раневых инфекций и мастита или абсцесса груди у кормящих матерей.
Неонатальные инфекции обычно появляются у детей в течение 6 нед после рождения и включают:
Повреждения кожи с шелушением или без него
Пневмония, которая возникает в амбулаторных условиях, не является распространенной, однако может развиваться у пациентов
Пациенты, получающие кортикостероиды или иммуносупрессанты
Имеют хронические бронхолегочные или другие заболевания с высоким уровнем риска
Стафилококковая пневмония может быть первичной инфекцией, а также следствием гематогенного распространения инфекции S. aureus из других частей тела (например инфицирование внутривенного катетера, эндокардит, инфекция мягких тканей) или инъекционной наркомании. Однако S. aureus является частой причиной развития внутрибольничной пневмонии, включая вентиляторную пневмонию при ИВЛ
Стафилококковая пневмония иногда характеризуется формированием абсцессов легких, сопровождаемых быстрым развитием пневматоцеле и эмпиемы. Внебольничный MRSA часто является причиной развития тяжелой некротизирующей пневмонии.
Эндокардит может развиться у инъекционных наркоманов и пациентов с протезами клапанов сердца. Поскольку частота использования внутрисосудистых катетеров и имплантаций сердечных устройств увеличилась, S. aureus стал ведущей причиной бактериального эндокардита.
Эндокардит, вызванный S. aureus, является острым фебрильным заболеванием, которое часто сопровождается формированием висцеральных абсцессов, эмболий, перикардита, подногтевых петехий, кровоизлияний в конъюнктиву глаза, пурпуры, шумов в сердце и сердечной недостаточности, как следствие вторичного повреждения клапанов сердца.
Остеомиелит встречается наиболее часто у детей, вызывая озноб, лихорадку и боль поражённой кости. Впоследствии и мягкие ткани над зоной поражения становятся красными и отечными. Может наблюдаться суставная инфекция, что часто приводит к суставному выпоту, предполагая септический артрит, а не остеомиелит. Большинство инфекций позвонков и межпозвоночных дисков у взрослых связаны с S. aureus.
Стафилококковый синдром токсического шока может быть следствием применения вагинальных тампонов или осложнением любого типа инфекции S. aureus (например послеоперационная раневая инфекция, ожоговые инфекции, инфекции кожи). Хотя большинство случаев связано с метициллин-чувствительным S. aureus (MSSA), случаи, связанные с MRSA, становятся все более частыми.

Стафилококковый синдром ошпаренной кожи вызывается несколькими токсинами, так называемыми эксфолиатинами, и проявляется как детский эксфолиативный дерматит, характеризующийся крупными волдырями и шелушением верхнего слоя кожи. В конечном счёте происходит эксфолиация. Синдром "ошпаренной кожи" наиболее часто встречается у младенцев и детей
Стафилококковое пищевое отравление вызывается употреблением в пищу инфицированных стафилококками продуктов питания (устойчивый к высокой температуре стафилококковый энтеротоксин). Пища может быть заражена стафилококковыми носителями или людьми с выраженными заболеваниями кожи. В пище, недостаточно термически обработанной или оставленной при комнатной температуре, стафилококки активно размножаются и вырабатывают энтеротоксин. Многие продукты могут служить питательной средой, не изменяя при этом своих органолептических свойств (вкус и запах). Тяжелая тошнота и рвота начинаются спустя 2–8 ч после приема пищи, как правило, сопровождаемыми спазмами брюшной полости и диареей. Приступ непродолжительный, часто составляет 12 ч.
Диагностика
Цитобактерископия мазков, окрашенных по Граму, и посев на обогащенные питательные среды
Диагноз стафилококковой инфекции устанавливается после бактериоскопии мазков, окрашенных по Граму, и посевов инфицированного материала на питательные среды.
Необходимо провести тесты на восприимчивость, поскольку метициллин-резистентные микроорганизмы теперь повсеместно распространены и требуют альтернативной терапии.
Если подозревается стафилококковый синдром ошпаренной кожи, то следует провести посевы крови, мочи, носоглотки, отделяемого пупочного кольца, пораженной кожи или любого подозреваемого очага инфекции; интактные волдыри являются асептическими. Хотя диагноз обычно ставится клинически, биопсия зараженной кожи может помочь подтвердить диагноз.
Стафилококковое пищевое отравление обычно предполагают из-за регистрации однотипных случаев инфекции (например, в пределах семьи, среди посетителей массовых социальных учреждений или ресторанов). Подтверждение (как правило, отделом здравоохранения) подразумевает выделение стафилококков в подозрительной пище и иногда анализ на наличие энтеротоксинов.
При остеомиелите рентгенологические изменения могут не проявиться до 10–14 дней болезни, и размягчение кости, и периостальная реакция могут не выявляться и дольше. Отклонения по МРТ, КТ или сканирование радионуклида кости часто становятся очевидными раньше. Биопсия кости (открытая или перкутатная) должна быть проведена для идентификации патогена и анализа антибиотикорезистентности.
В некоторых учреждениях с высокой распространённостью метициллин - резистентных штаммов S. аureus обычно проверяют пациентов на стафилококковое носительство (активное наблюдение), используя лабораторные методы быстрой диагностики, чтобы оценить образцы мазков из носа. Некоторые учреждения проводят скрининг только у пациентов группы риска (например тех, кто поступает в отделение интенсивной терапии, у кого ранее была инфекция MRSA, кому планируются сосудистые, ортопедические оперативные вмешательства или операция на сердце).
Быстрая идентификация MRSA:
позволяет произвести изоляцию контактных носителей и, в случае необходимости предоперационной антибиотикопрофилактики против кожных микроорганизмов, назначить ванкомицин как часть их курса лечения
уменьшает распространение MRSA
может снизить частоту внутрибольничных инфекций MRSA
Однако лечение, направленное на деколонизацию (например, местное применение назального мупироцина), хотя иногда и проводится, но еще окончательно не доказало своей эффективности, так как выявлена резистентность к мупироцину. Ежедневное обмывание с хлоргексидином пациентов отделения интенсивной терапии снижает частоту инфекций, вызванных MRSA.
Лечение
Местные меры (например, санация раны, удаление катетеров)
Антибиотики выбираются с учетом тяжести заболевания и результатов антибиотикограммы
Контроль стафилококковых инфекций включает дренирование абсцесса, санацию некротической ткани, удаление инородных тел (включая внутрисосудистые катетеры) и назначение антибиотиков ( Лечение антибиотиками стафилококковых инфекций у взрослых).
Первоначальный выбор и дозировка антибиотиков зависят от
вероятности того, что задействованы резистентные штаммы
Таким образом, необходимо иметь данные о циркуляции антибиотикорезистентных штаммов в определенном регионе для стартовой терапии (и в конечном счете знать фактическую антибиотикочувствительность выделенного микроорганизма).
Лечение токсин-опосредованного стафилококкового заболевания (самым тяжелым из которых является синдром токсического шока) подразумевает деконтаминацию токсин-продуцирующих областей (ревизия хирургических ран, некрэктомия, промывание), интенсивную терапию (включая внутривенное введение жидкостей, вазопрессоры и респираторную поддержку), коррекцию водно-электролитного баланса и антибактериальные препараты. Доказательства in vitro свидетельствуют о предпочтительном назначении ингибиторов синтеза белка (например, клиндамицин по 900 мг внутривенно каждые 8 ч, линезолид 600 мг внутривенно каждые 12 ч) по сравнению с другими классами антибиотиков. В тяжелых случаях оправдано применение внутривенного иммуноглобулина.
Многие стафилококковые штаммы продуцируют пенициллиназу, фермент, который инактивирует некоторые бета-лактамные антибиотики; эти штаммы являются резистентными к пенициллину G, ампициллину и противопсевдомонадному пенициллину.
Внебольничные штаммы часто чувствительны к пенициллиназа-резистентным пенициллинам (например, метициллину, оксациллину, нафциллину, клоксациллину, диклоксациллину), цефалоспоринам, карбапенемам (например, имипенему, меропенему, эртапенему, дорипенему), тетрациклинам, макролидам, фторхинолонам, триметоприму/сульфаметоксазолу (TMP/SMX), гентамицину, ванкомицину и тейкопланину.
Изоляты MRSAстали повсеместно распространены, особенно в стационарах. Кроме того, внебольничный МRSA появился за последние несколько лет в большинстве географических регионов. Как правило, внебольничные MRSA обладают меньшей резистентностью ко многим антибиотикам, в отличие от внутрибольничных. Эти штаммы, хотя и резистентные к большинству бета-лактамов, обычно чувствительны к TMP/SMX, тетрациклинам (миноциклину, доксициклину) и часто чувствительны к клиндамицину, однако есть возможность развития резистентности к клиндамицину у штаммов с индуцируемой устойчивостью к эритромицину (эти штаммы могут быть выявлены с помощью D-теста). Ванкомицин эффективен против большинства MRSA, иногда в сочетании с рифампином и аминогликозидами при тяжелых инфекциях (таких как остеомиелит, инфекции протезированных суставов, эндокардит протезированного клапана). Назначение альтернативного препарата (даптомицин, линезолид, тедизолид, далбаванцин, оритаванцин, тигециклин, хинупристин/дальфопристин, TMP-SMX, возможно цефтаролин) следует рассматривать при лечении метициллин-резистентных штаммов S. аureus с МИК (минимальная ингибирующая концентрация) ванкомицина > 1,5 мкг/мл.
В США появились штаммы ванкомицин-резистентного S. aureus (VRSA; МИК > 16 мкг/мл) и штаммы S. aureus с умеренной чувствительностью к ванкомицину (VISA, МИК 4–8 мкг/мл). Для терапии инфекций, вызванных этими штаммами стафилококка, требуется назначение линезолида, тедизолида, хинупристина/дальфопристина, даптомицина, TMP/SMX или цефтаролина.
Поскольку распространённость метициллин - резистентных штаммов S. аureus увеличилась, стартовое лечение тяжелых стафилококковых инфекций (особенно тех, которые возникают в стенах учреждений здравоохранения) должно включать препарат с высокой активностью против метициллин-резистентного S. аureus. Таким образом, адекватными лекарственными средствами являются:
Для доказанных или подозреваемых инфекций кровотока– ванкомицин или даптомицин
Для пневмонии – ванкомицин, телаванцин или линезолид (т к даптомицин не проявляет должной активности в легких)
Читайте также:


