Правила отбор проб на орнитоз
федеральная служба по ветеринарному и фитосанитарному надзору
В данном разделе размещаются актуальные версии нормативно-правовых актов (законы, приказы, указы, решения Верховного суда РФ и др.), представляющие интерес для специалистов в области ветеринарии и фитосанитарии.
Дополнительную информацию Вы можете получить, задав вопрос в разделе "Электронная приемная".
"Об утверждении ветеринарных правил лабороторной диагностики гриппа А птиц"
- Приказ. Об утверждении ветеринарных правил лабороторной диагностики гриппа А птиц
- Приложение. Ветеринарные правила лабороторной диагностики гриппа А птиц
- Статья 1. Область применения
- Статья 2. Общие положения
- Статья 3. Обязательные требования по отбору проб для проведения диагностики гриппа птиц
- Статья 4. Методы и сроки проведения лабораторных исследований
В целях повышения эффективности борьбы с гриппом птиц и в соответствии с пунктом 5.2.11 Положения о Министерстве сельского хозяйства Российской Федерации, утвержденного Постановлением Правительства Российской Федерации от 24 марта 2006 г. N 164 (Собрание законодательства Российской Федерации, 2006, N 14, ст. 1543), приказываю:
утвердить Ветеринарные правила лабораторной диагностики гриппа A птиц согласно приложению.
| Министр А.В.ГОРДЕЕВ |
1.1. Настоящие Правила устанавливают обязательные требования к организации лабораторной диагностики гриппа A птиц (далее - грипп птиц).
1.2. Положения настоящих правил обязательны для выполнения на территории Российской Федерации органами государственной власти, предприятиями или иными хозяйствующими субъектами, учреждениями, организациями, общественными объединениями, независимо от их подчинения и форм собственности, должностными лицами и гражданами.
2.1. Диагностические лабораторные исследования и серологические тесты по определению напряженности поствакцинального иммунитета (далее - лабораторные тесты) проводят в специализированных ветеринарных учреждениях.
2.2. Лабораторная диагностика гриппа птиц направлена на выявление в исследуемых объектах ветеринарного надзора:
вируса гриппа птиц;
РНК вируса гриппа птиц;
антигенов вируса гриппа птиц;
антител к вирусу гриппа птиц.
2.3. При проведении лабораторных тестов могут быть использованы методы лабораторных исследований, применяющие:
тесты, утвержденные в установленном порядке;
тесты, которые реализуются с использованием тест-систем, зарегистрированных в установленном порядке в Российской Федерации.
3.1. Отбор проб крови и патологического материала проводит ветеринарный работник, имеющий специальную подготовку.
3.2. Пробы маркируются и опечатываются. К пробам прилагается сопроводительный документ, содержащий сведения о дате и месте отбора проб, юридическом или физическом лице - владельце птицы и месте его нахождения, виде, возрасте птицы и ее состоянии на момент отбора проб.
3.3. Для проведения исследований осуществляют отбор проб патологического материала (органы, ткани головного мозга, легких, трахеи, селезенки, участков кишечника, почек, сердца) от павшей или убитой с диагностической целью птицы.
3.4. От каждого стада птицы отбирают для исследований 5 - 10 трупов или патологический материал от 5 - 10 трупов, клоакальные и/или трахеальные смывы от 10 - 15 голов, 1 - 10 сборных проб помета от стада.
У мелких видов птиц для отбора проб используют свежий помет.
Пробу помета рекомендуется отбирать из расчета 1 грамм помета на 60 точек птичника (выгула или вольеры), выбранных по диагонали крест-накрест.
3.5. Пробы крови для определения антител к вирусу гриппа птиц рекомендуется отбирать у 25 - 30 птиц из стада (партии), из одного птичника (зала) или одного населенного пункта, местности (водоема).
Пробы крови отбирают из подкрыльцовой вены в пробирки, увлажненные физиологическим раствором. Кровь выдерживают до образования сгустка при комнатной температуре или в термостате при 37 град. C в течение 1 - 2 часов, затем обводят иглой или пастеровской пипеткой, отслаивая сгусток крови от стенок пробирки, и оставляют на 16 - 18 часов при температуре 2 - 4 град. C. Образовавшуюся прозрачную без признаков гемолиза сыворотку отбирают с помощью пипетки в отдельные, чистые пробирки.
Отбор крови допускается проводить с помощью иглы и шприца (или вакуумной пробирки).
Рекомендуется проводить центрифугирование проб крови для получения сыворотки в течение 10 - 15 минут при 1000 об./мин. для осаждения свободных эритроцитов.
Для серодиагностики используют парные пробы сывороток крови, полученные от больных или инфицированных птиц, в начале заболевания и через 4 - 10 дней.
3.6. Пробы транспортируются во влагонепроницаемой таре, в контейнере с хладоэлементами или в термосе со льдом. Допускается однократное замораживание сывороток.
При транспортировке проб соблюдают установленные ветеринарно-санитарные правила и меры безопасности, предъявляемые к транспортировке биологических материалов, содержащих инфекционные агенты 3-й группы патогенности.
3.7. Если немедленное исследование проб невозможно, допускается сохранять образцы на протяжении 4 дней при температуре 4 град. C.
При необходимости для увеличения срока хранения диагностические образцы и/или изолят помещают в морозильную камеру с температурой -80 град. C.
4.1. Для установления диагноза на грипп птиц допускается применение следующих методов:
-
а) для выявления вируса гриппа птиц - биопроба на СПФ (свободных от патогенной микрофлоры) - цыплятах с обязательным последующим подтверждением специфичности биологической реакции; б) для выделения вируса гриппа птиц - метод выделения вируса на СПФ - куриных эмбрионах или в культуре клеток; в) для обнаружения антигенов вируса гриппа птиц:
- иммуноферментный анализ (ИФА) для обнаружения одного или нескольких белков вируса;
- иммунопреципитация (двойная иммунодиффузия по Оухтерлони (далее - РДП) или иммуноэлектроосмофорез (далее - ИЭОФ);
- иммунохроматографические методы (далее - ИХА);
- радиоиммунный анализ (далее - РИА);
- непрямая гем- и латексагглютинация;
- реакция связывания комплемента (далее - РСК);
- реакция гемагглютинации (далее - РГА) с подтверждением специфичности в реакции торможения гемагглютинации (РТГА);
- ИФА на основе моноспецифических сывороток или моноклональных антител к вирусному гемагглютинину;
- полимеразная цепная реакция (далее - ПЦР);
- ПЦР с последующим секвенированием ее продуктов;
- Дот-блот и блот гибридизация нуклеиновых кислот;
- ИФА;
- РДП и ИЭОФ;
- ИХА;
- РИА;
- РТГА;
- РСК;
- РТГА;
- сиквенс к ДНК или ПЦР-продукта;
- ПЦР;
- Дот-блот и блот гибридизация нуклеиновых кислот;
- ИФА на основе моноспецифических сывороток или моноклональных антител к вирусному гемагглютинину; з) для субтипирования противовирусных антител по гемагглютинину:
- РТГА;
- ИФА на основе моноспецифических сывороток или моноклональных антител к вирусному гемагглютинину.
- При отборе образцов материала необходимо соблюдать меры, предупреждающие обсеменение объектов внешней среды.
- Материал от каждого животного отбирают отдельными инструментами.
- Образцы на исследование доставляют в опечатанном виде нарочным, в одноразовых пакетах и пробирках.
- Материал доставляют в лабораторию в день взятия или на следующий день, сохраняя при температуре от 2 до 8 0 С. Допускается хранение материала при температуре не выше минус 16 0 С в течение 30 дней.
- Инфекционные заболевания холера и столбняка
- Южная лихорадка есть в россии
- Ушная инфекция вода в ухе
- Приказ об эпидемиологическом надзоре за энтеровирусной инфекции
- Дискомфорт во влагалище инфекций нет
4.2. Применение иных тестов допускается для получения предварительных результатов.
4.3. Методы проведения лабораторных исследований реализуются на основе утверждаемых в установленном порядке методик проведения обязательных диагностических исследований.
4.4. Сроки проведения лабораторных исследований устанавливаются в зависимости от метода исследования и не могут превышать 1 месяца.
Бюджетное учреждение Удмуртской Республики
Проведено 150 исследований. Из них, с целью выявления возбудителей вирусных инфекций — 142 пробы, выявление возбудителей бактериальных инфекций — 8 проб. При проведении исследований положительных результатов не выявлено.
Диспансеризация представляет собой систему плановых диагностических и лечебно-профилактических мероприятий, направленных на своевременное выявление ранних субклинических и клинических признаков заболевания животных, профилактику болезней и лечение заболевших. Основное назначение диспансеризации — сохранение здоровья животных, повышение их продуктивности и создание здоровых высокопродуктивных стад, особенно в промышленном молочном животноводстве.
Специалистам государственной и производственной служб республики были озвучены виды диспансеризации, ее цели и задачи, сроки проведения и методика, особенности клинического осмотра животных при диспансеризации, а также анализ производственных показателей по животноводству, условий кормления и содержания. Особый акцент был сделан на важности лабораторных исследований и анализе полученных данных.

За 9 месяцев 2017 года методом ПЦР исследовано 5308 проб патматериала на такие заболевания, как бруцеллез, лептоспироз, туберкулез, вирусная диарея, грипп птиц, инфекционный ринотрахеит крупного рогатого скота, микоплазмоз, хламидиоз, орнитоз, африканская чума свиней, вирус Шмалленберг, сибирская язва. С целью выявления возбудителей вирусных инфекций проведены исследования 3662 пробы. С целью выделения бактериальных инфекций проведены исследования 1646 проб.
За 9 месяцев выявлено 24 положительных пробы на такие заболевания, как грипп птиц, микоплазмоз, орнитоз, хламидиоз, инфекционный ринотрахеит крупного рогатого скота.
Проведено 153 исследования. Из них, с целью выявления возбудителей вирусных инфекций- 143 пробы, выявление возбудителей бактериальных инфекций — 10 проб. При проведении исследований положительных результатов не выявлено.

За 9 месяцев 2017 года на ПГ-3 исследовано 25 проб патологического материала, из них положительный результат получен в 5 пробах (20%).
На вирусную диарею патологический материал поступил в количестве 67 проб, антиген выявлен в 34 пробах (51%). Патологический материал на коронавирусный энтерит поступил в количестве 58 проб, из них положительный результат получен в 13 пробах (22%). На ротавирусный энтерит исследовано 52 пробы патологического материала, антиген выявлен в 27 пробах (52%). По итогам работы за 9 месяцев 2017 года можно сделать вывод об увеличении процента выявляемости вирусной диареи и ротавирусного энтерита крупного рогатого скота, что, скорее всего, связано с нарушением схем вакцинации или их отсутствием, ухудшением условий кормления и содержания животных, несоблюдением условий карантинирования вновь ввозимых животных.
Выявлено 7 положительно реагирующих проб на лептоспироз в РМА, 6 положительно реагирующих проб на лейкоз в РИД.
Во всех случаях при выявлении положительно реагирующих животных даны рекомендации для постановки окончательного диагноза, согласно действующим нормативным документам.

В ходе учения отрабатывались планирование и организация выполнения мероприятий по ГО. Развертывание группировки сил и средств ГО, предназначенной для ликвидации крупномасштабных ЧС природного и техногенного характера, пожаров.
Администрация Индустриального района и Индустриальная территориальная избирательная комиссия г. Ижевска прислали письмо с выражением благодарности сотрудникам Удмуртского ветеринарно-диагностического центра за плодотворную работу и оказанную помощь в подготовке и проведении выборов.
Глава Администрации Л.Е. Зайцева и Председатель Индустриальной территориальной избирательной комиссии г. Ижевска Т.Н. Герасимова выразили уверенность в сохранении сложившихся дружественных отношений с надеждой на дальнейшее взаимное сотрудничество.
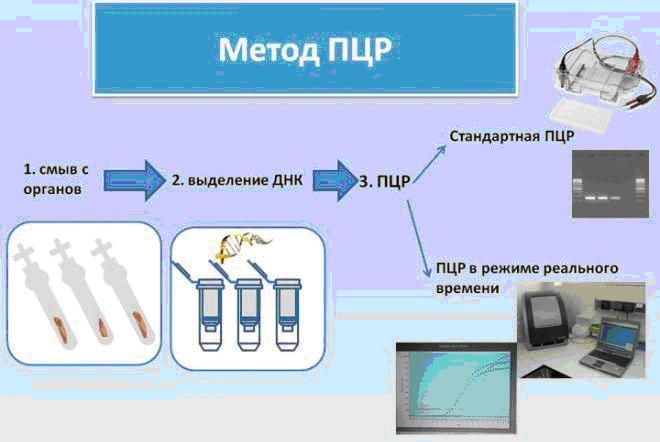
С 18.09. по 22.09.2017 в отдел ПЦР на исследование поступило 215 проб биоматериала на такие заболевания, как африканская чума свиней, сибирская язва, лептоспироз, вирус гриппа птиц, орнитоз, бруцеллез, хламидиоз.
Проведено 107 исследований, из них с целью выявления возбудителей бактериальных инфекций — 62 пробы, выявление возбудителей вирусных инфекций — 45 проб. При проведении исследований генетический материал вирусных и бактериальных инфекций не обнаружен.
Бюджетное учреждение Удмуртской Республики
Актуальная информация по отбору проб
(кроме крови и мочи). Кровь и мочу нужно доставлять в день взятия материала!!
-плацента и плодовые оболочки от абортировавших животных;
-содержимое бурс, гигром;
-кровь и молоко от абортировавших животных и /или животных, в сыворотке которых обнаружены агглютинины и/или комплементсвязывающие антитела.
— цельная кровь (5 мл,взятие крови проводится в пробирки с 6% раствором ЭДТА из расчета 1:20);
-вода (сточная, из водоемов, питьевая);
-смывы с воздушных фильтров;
-Порошкообразные вещества (корма для КРС, мука).
— моча (собирается в стерильную посуду);
-паренхиматозные органы (легкие, почки);
-культура бактерий.
-синовиальная жидкость суставов;
-желток, аллантоисная жидкость эмбрионов;
— цельная кровь, в пробирку с 6% раствором ЭДТА из расчета 1:20;
-сыворотки (лечебные), культуры клеток;
-сперма ( не менее 2 мл).
-ткани (отбирают в пределах видимых патологический изменений, не менее 1х1х1см)
-лимфоузлы (берут целиком);
-фарингеальные смывы (не менее 5-10мл);
-моча (не менее 5-10мл);
-молоко (не менее 5-10мл);
-биопсийный и аутопсийный материал
-паренхиматозные органы павших или вынужденно убитых животных (сердце, легкие, селезенка, печень, почки);
-кусочки плодовых оболочек;
-паренхиматозные органы абортплода;
-перевязанный с двух сторон сычуг абортплодов;
-сперма замороженная (или пробы эякулята);
-моча от производителей.
-помёт (4-5г) в стерильных контейнерах;
-мазки из клоаки, со слизистой глотки и трахеи берут сухими стерильными зондами с ватными тампонами.
-трахеальные смывы (получают с помощью физиологического раствора;
-внутренние органы (фрагменты трахеи и легких, селезенка, мозг, воздухоносные мешки, кишечник) в одноразовых стерильных контейнерах;
-яйцо для исследования отправляют целиком, в герметичном контейнере;
-эмбрионы кур целиком в яйце помещают в герметичный контейнер.
2. при исследовании свиней и лошадей:
-носовые смывы, получают с помощью стерильного физиологического раствора;
в одноразовых контейнерах;
-бронхиальный экссудат в одноразовых стерильных контейнерах;
-внутренние органы (фрагменты трахеи и легких) в одноразовых стерильных контейнерах;
3. мясо птиц и субпродукты в одноразовых стерильных контейнерах;
4.комбикорма для племенной птицы, сухие корма для непродуктивных животных, находящиеся в мешках или небольших насыпях на складе, отбирают по ГОСТ 13496.0
5.при исследовании свинины, продуктов ее переработки и субпродуктов:
—пробы мяса, продуктов переработки, субпродуктов в одноразовых стерильных контейнерах;
— цельная кровь (отбирают не менее 0,5-1 мл в стерильные пробирки с 3% раствором ЭДТА из расчета 10:1).Пробирка закрывается крышкой и переворачивается несколько раз (для перемешивания с антикоагулянтом);
— сыворотка крови : забор крови проводится в пробирку без антикоагулянта.
— Соскобы (мазки) со слизистой носоглотки и миндалин.
-ткани (отбирают в пределах видимых патологический изменений, не менее 1х1х1см), помещают в стерильный контейер.
-лимфоузлы (берут целиком);
-фекалии (5 г отбирают в стерильный пластиковый контейнер);
— цельная кровь (отбирают не менее 0,5-1 мл в стерильные пробирки с 3% раствором ЭДТА из расчета 10:1).Пробирка закрывается крышкой и переворачивается несколько раз (для перемешивания с антикоагулянтом);
— сыворотка крови : забор крови проводится в пробирку без антикоагулянта.
— Мазки (соскобы) со слизистой носоглотки и миндалин.
-ткани, продукты свиного происхождения (отбирают в пределах видимых патологический изменений, не менее 1х1х1см), помещают в стерильный контейер.
-лимфоузлы (берут целиком);
-сыворотка крови (забор крови в стерильные пробирки без антикоагулянта),
— патматериал (миндалины, легкие, печень, селезенка и др.);
-фекалии (5 г отбирают в стерильный пластиковый контейнер);
-мазки со слизистой носоглотки и миндалин (берут сухими стерильными зондами с ватными тампонами;
-лимфоузлы берут целиком;
-мазки со слизистой носовой полости (берут стерильным зондом, помещая собранный материал в пробирку, содержащую 500мкл стерильного физиологического раствора);
-мазки из влагалища (берут стерильным зондом с использованием стерильных гинекологических инструментов, помещая собранный материал в пробирку, содержащую 500мкл стерильного физиологического раствора;
-лифоузлы берут целиком;
-из тканей и органов (селезенки, легкие) вырезают кусочки размером 1х1х1 см и помещают в стерильный контейнер.
-помет птиц берут в стерильные контейнеры в количестве 1-3 г. В связи с непостоянным выделением возбудителя у инфицированной птицы, рекомендуется исследовать не менее трех образцов
патматериал (сердце, легкие, почки, печень, селезенка).
-пищевые продукты, содержащие компоненты растительного происхождения;
-пищевое сырье растительного происхождения;
-биодобавки, содержащие компоненты растительного происхождения.
Материалом для исследования НЕ могут служить:

В целях профилактики высоко патогенного гриппа и других инфекций птиц, животных и человека специалисты Нижневартовского отдела ветеринарного надзора обращают внимание вартовчан на меры предосторожности, которые помогут не допустить заболевания.
Острая форма гриппа, наиболее опасная для птиц, протекает быстро, почти без симптомов. Без своевременной профилактики, в случае заражения птиц вирусом, погибают 100 % кур.
Заражение домашней птицы и человека может произойти при тесном контакте с инфицированной живой и мертвой дикой или домашней птицей. В ряде случаев возможно заражение человека при употреблении в пищу мяса и яиц больных птиц без достаточной термической обработки. Кроме того, выделения зараженных птиц, попадая на землю, в воду, на растения могут стать причиной заражения человека и здоровой птицы при питье, купании и через грязные руки. Также заражение может произойти воздушно-капельным и воздушно-пылевым путями.
По информации специалистов ветеринарной службы ХМАО - Югры, для профилактики птичьего (куриного) гриппа применяют инактивированную вакцину. Владельцам личных подсобных хозяйств и птицеводческих ферм следует строго выполнять ветеринарные правила содержания птиц.
Профилактика гриппа птиц у домашней птицы:
Владельцы или лица, осуществляющие уход, содержание, разведение и реализацию птицы, согласно санитарно-гигиеническим и ветеринарно-санитарным нормам и правилам, обязаны:
- информировать государственную ветеринарную службу своего муниципального образования о наличии птицы в личных подсобных хозяйствах с целью проведения необходимых профилактических мероприятий у имеющегося поголовья;
- не допускать выгул (выход) домашней птицы за пределы дворовой территории, исключить контакт домашней птицы с дикими птицами, особенно водоплавающими;
- осуществлять куплю-продажу домашней и декоративной птицы в местах санкционированной торговли при наличии ветеринарных сопроводительных документов на нее;
- содержать территории и строения для содержания животных и птицы в чистоте; периодически (2-3 раза в неделю) проводить дезинфекцию всех помещений и территории;
- хранить корм для домашней и декоративной птицы в плотно закрытых водонепроницаемых емкостях, недоступных для контакта с дикой птицей;
- убой домашней птицы, предназначенной для реализации, должен осуществляться на специализированных предприятиях.
Профилактика орнитоза у птиц и человека:
- в частном секторе, в домашних городских условиях, птицу, найденную на улице, всю вновь завезенную или купленную в хозяйство, не имеющую документов, следует содержать изолированно на карантине;
- в промышленном птицеводстве и в домашнем хозяйстве птицам с профилактической целью назначают антибиотики;
- при возникновении болезни вся зараженная птица, согласно ветеринарным нормам, подлежит уничтожению, чтобы исключить перенос инфекции;
- птицу нужно содержать в хороших условиях и полноценно кормить. Ей может назначаться профилактическое лечение, но только по согласованию с ветеринарным врачом;
- возбудитель болезни погибает при температуре выше 70 градусов и при применении дезинфицирующих веществ (лизол, формалин, хлорамин, эфир). Если после приобретения птицы у владельца возникло респираторное заболевание, а у птицы появились клинические признаки, похожие на орнитоз, то владельцу нужно срочно посетить врача;
- при подозрении на орнитоз с птицей нужно работать в перчатках и в марлевой повязке;
- не следует покупать птиц без ветеринарных сопроводительных документов. Каждая купленная птица должна быть осмотрена специалистом на выявление внешних признаков болезни.
При появлении подозрений на птичий грипп необходимо незамедлительно обратиться в Нижневартовский отдел государственного ветеринарного надзора по ХМАО - Югре (улица Омская,8, телефон 67-03-69).
Управление по информационной политике администрации города Нижневартовска
Хламидиозы - разнообразные по патогенезу и клиническим проявлениям, распространенные заболевания человека и животных.
В последние десятилетия неуклонно возрастает роль в патологии человека, так называемых, антропонозных хламидиозов. Особенно большое значение приобретает урогенитальные хламидийные инфекции, которые относятся к числу наиболее распространенных заболеваний, передающихся половым путем. Они поражают мужчин и женщин, все чаще регистрируются у новорожденных, оказывают существенное влияние на репродуктивную функцию и часто являются причиной трубного бесплодия.
В связи с интенсификацией животноводства и птицеводства, созданием промышленных комплексов с высокой концентрацией животных, увеличивается потенциальная возможность возникновения крупных вспышек зоонозных хламидиозов, которые не только представляют серьезную угрозу для здоровья человека, но и наносят значительный экономический ущерб.
Следовательно, проблема хламидиозов приобретает все большее социально-экономическое и народнохозяйственное значение. Успешная организация борьбы с этими заболеваниями возможна лишь при условии их своевременного и полного выявления, а это, учитывая многообразие клинических форм, протекающих без патогномоничной симптоматики, представляет значительные трудности. В этой связи решающее значение в постановке диагноза приобретают методы лабораторной диагностики.
В настоящих Методических рекомендациях представлены основные методы лабораторной диагностики антропонозных и зоонозных хламидиозов с учетом возможности практической лабораторной службы.
Хламидии - грамотрицательные бактерии с облигатным внутриклеточным паразитизмом, характеризующиеся широким спектром естественных хозяев. Биологическое своеобразие хламидий, выражающееся в энергозависимом паразитизме и уникальном цикле развития, определяет самостоятельное положение этих микроорганизмов в системе прокариотов.
Хламидии выделены в отдельный порядок Chlamydiales, включающий одно семейство Chlamydiaceae содержащее один род Chlamydia, состоящий из 3 видов: C. trachomatis, C. psittaci, C. pneumoniae.
Вид C. trachomatis - объединяет микроорганизмы, вызывающие заболевания, главным образом, у человека (антропонозные хламидиозы). Они обусловливают разнообразную патологию урогенитального тракта, глаз и связанную с ней хламидийную инфекцию иной локализации у мужчин, женщин и детей.
Вид C. psittaci - включает микроорганизмы, первично поражающие животных. У человека они могут вызывать зоонозные хламидиозы (орнитоз, генерализованные инфекции, связанные с сельскохозяйственными и домашними животными).
Вид C. pneumoniae - включает микроорганизмы, вызывающие респираторную патологию и передающиеся от человека к человеку .
Идентифицирован в 1989 г., недостаточно изучен.
Основными морфологическими формами хламидий являются элементарные и ретикулярные тельца. Элементарные тельца - инфекционная форма, мелкие ригидные сферические клетки с плотным нуклеоидом, диаметр 0,25 - 0,35 мкм. Окрашиваются по Романовскому-Гимзе в фиолетово-красный цвет.
Ретикулярные тельца - вегетативная неинфекционная форма, пластичные сферические клетки с рыхлым нуклеоидом, диаметр 0,6 - 1,5 мкм. Окрашиваются по Романовскому-Гимзе в синий цвет.
Хламидии культивируют в желточных мешках развивающихся куриных эмбрионов, в первичных или перевиваемых культурах клеток; некоторые штаммы хламидий - в организме белых мышей, чаще при заражении в мозг. На искусственных питательных средах хламидии не размножаются. Их паразитизм обусловлен выраженной метаболитической зависимостью от клетки хозяина.
Цикл развития хламидий протекает в клетке-хозяине в "цитоплазматическом включении", представляющем собой микроколонию микроорганизма. В процессе цикла развития происходит преобразование элементарных телец в ретикулярные. Последние размножаются бинарным делением и преобразуются через переходные формы в элементарные тельца нового поколения микроорганизмов. Цитоплазматические включения и морфологические структуры хламидий выявляются при световой, люминесцентной и фазовоконтрастной микроскопии.
Хламидии имеют сложную антигенную структуру. Выделяют три основных антигенных комплекса. Родоспецифический термостабильный, липополисахаридный комплекс, характерный для всех представителей рода. Его детерминантной группой является кислый полисахарид. Родоспецифический антигенный комплекс локализуется в клеточной стенке хламидий. Видоспецифические и типоспецифические термолабильные белковые фракции. Видоспецифический антиген определяет принадлежность штаммов к соответствующему виду. Типоспецифические антигены позволяют дифференцировать различные серовары (серотипы) хламидий внутри вида.
Хламидии чувствительны к антибиотикам тетрациклинового ряда, макролидам, рифампицину (рифадину), являющимися основными средствами этиотерапии хламидиозов. Пенициллин и его производные вызывают образование Л-подобных форм микроорганизмов, способных реверсировать в инфекционные.
Хламидии быстро инактивируются под действием высокой температуры: при 60 °C - в течение 15 мин., при 80 °C - через 10 мин., при кипячении - через 3 мин. Материал, содержащий штаммы C. psittaci, может быть обеззаражен в течение 3 часов при комнатной температуре: фенолом (1% р-р), хлорамином (3% р-р), лизолом (3% р-р), марганцевокислым калием (1:500), формалином с содержанием 38 - 40% формальдегида.
"Урогенитальные штаммы" хламидий, C. trachomatis, высокочувствительны к 70° этанолу, растворам - 2% лизола, 0,05% серебра нитрата, 0,1% калия йодида, 0,5% калия перманганата, 25% перекиси водорода и инактивируются при комнатной температуре в течение 2 сут. Хлорамин в 3% концентрации инактивирует в течение 1 мин.
2.1. Методы лабораторной диагностики урогенитальных хламидиозов и связанных с ними заболеваний иной локализации.
Для диагностики этих инфекций используют бактериоскопический, бактериологический и серологические методы исследования. Техника лабораторных исследований приведена в Приложении I.
2.1.1. Бактериоскопический метод.
Бактериоскопическое исследование предполагает выявление хламидий, их морфологических структур и антигенов в пораженных клетках (клиническом материале).
Материалом для исследования служат соскобные препараты с доступных исследованию слизистых оболочек мочеполовых (уретра, шейка матки и т.п.) и других органов (конъюнктива, прямая кишка и пр.) при экстрагенитальных формах. Из исследуемого материала готовят мазки, которые окрашивают по Романовскому-Гимзе. Цитоплазматические включения хламидий (тельца Гальберштедтера-Провачека) содержат или крупные ретикулярные тельца, или мелкие элементарные тельца. Они по цвету и внутренней структуре отличаются от ядра клетки и цитоплазмы. Для постановки диагноза хламидийной инфекции достаточно обнаружить одно типичное цитоплазматическое включение. Метод характеризуется сравнительно низкой чувствительностью, позволяет диагностировать от 10 - 20% случаев урогенитальной инфекции. При хламидийной патологии глаз чувствительность способа составляет 90 - 100%.
Применение люминесцирующих поликлональных и моноклональных антител для выявления антигенов хламидий в цитоплазматических включениях в соскобных препаратах урогенитального тракта значительно увеличивает чувствительность и специфичность метода. С этой целью можно использовать как прямой, так и непрямой иммунофлуоресцентный метод. Первый предполагает обработку препарата непосредственно специфическими люминесцирующими моно- или поликлональными антителами, второй - иммунной и антивидовой флуоресцирующей сыворотками. При люминесцентной микроскопии антигены хламидий выявляют на красном или оранжевом фоне (при контрастировании синькой Эванса или родамином) цитоплазмы эпителиальных клеток в виде внутриклеточных включений ярко-зеленого цвета.
Метод отличается высокой информативностью и уступает по чувствительности только бактериологическому (выделение хламидий в клеточных культурах).
2.1.2. Бактериологический метод.
Бактериологический метод основан на выделении хламидий из исследуемого материала путем заражения куриных эмбрионов или клеточных культур с последующей идентификацией возбудителя. Исследуемый материал тот же, что и при бактериоскопическом методе. Для удаления сопутствующей бактериальной флоры клинический материал помещается в специальные транспортные среды, содержащие антибиотики, не влияющие на жизнеспособность хламидий. Способ может быть использован в течение всего периода заболевания. Особенно эффективен при острых формах, на ранних этапах инфекции до начала антибиотикотерапии.
2.1.2.1. Выделение хламидий на куриных эмбрионах.
Исследуемым материалом заражают 6 - 8-дневные куриные эмбрионы в полость желточного мешка. Наличие возбудителя определяют микроскопией мазков - отпечатков тканей оболочек желточного мешка, окрашенных по Маккиавелло, а также специфическими люминесцирующими поли- и моноклональными антителами.
2.1.2.2. Выделение хламидий в культурах клеток.
Выделение хламидий в культуре клеток проводят в 24-часовом монослое культуры клеток (L-929, McCoy, Hela), предварительно обработанном ДЕАЕ-декстраном (30 мкг/мл) в течение 30 мин. При инокуляции исследуемого материала на монослой применяют метод принудительной адсорбции - центрифугирование при 3000 об./мин. в течение часа. После центрифугирования неадсорбированный материал удаляют при промывании средой 199 без сыворотки и дальнейшее культивирование в течение 48 - 72 часов проводят при t = 36 °C в среде 199 с 5% фетальной сыворотки, 5% 0,5 М раствора глюкозы и 0,5 - 1,0 мкг/мл циклогексимида.
Оценку результатов проводят через 48 - 72 ч методами ПИФ (при использовании специфических люминесцирующих поли- и моноклональных антител), МГГ (при окраске Май-Грюнвальд-Гимза), Люголя (окраска раствором Люголя).
При исследовании препаратов инфицированных культур клеток хламидии выявляются в виде характерных цитоплазматических включений, окрашенных в соответствующий методу цвет. Выявление хотя бы одного цитоплазматического включения, имеющего специфическое окрашивание, форму и структуру достаточно для определения хламидийной инфекции в исследуемом объекте. По специфичности метод диагностического выделения хламидий в культуре клеток является эталонным.
2.1.3. Серологические методы диагностики.
Методы серологической диагностики основаны на выявлении специфических антител в сыворотке крови, а также в секретах больных и переболевших. Для серодиагностики обычно используют реакцию связывания комплемента (РСК), непрямой иммунофлуоресценции (РНИФ) и реакцию непрямой гемагглютинации (РНГА). Учитывая низкую иммуногенность "урогенитальных штаммов" хламидий при локализованных формах инфекции, возможность наличия антител, связанных с ранее перенесенной хламидийной инфекцией, необходимо исследовать несколько проб сыворотки в динамике заболевания с интервалом в 2 - 3 недели. Первую пробу забирают в момент обращения больного к врачу. Интерпретацию результатов серологического обследования следует проводить в совокупности с анализом клинико-эпидемиологических данных, а также с учетом особенностей использованного серологического теста. Оптимальным является параллельное применение нескольких серологических реакций. Эти серологические тесты могут быть также использованы для проведения эпиднадзора за хламидиозами.
РСК - выполняется с коммерческим диагностикумом, который выпускается Одесским предприятием по производству бактерийных препаратов Минмедпрома СССР. В РНГА и РНИФ - более эффективных серологических тестах, разработанных и успешно апробированных в последние годы, используются экспериментальные серии соответствующих препаратов, подготовленных к промышленному выпуску. Техника постановки этих реакций приведена в Приложении II.
2.1.3.1. Реакция связывания комплемента.
РСК проводят с родоспецифическим антигеном возбудителя орнитоза. Эту реакцию используют для диагностики так называемых "генерализованных" (осложненных) форы урогенитальных хламидиозов, венерической лимфогранулемы и ряда экстрагенитальных хламидийных поражений (болезнь Рейтера, пневмония новорожденных). При локализованных поражениях (уретрит, цервицит и т.п.) РСК недостаточно чувствительна.
2.2. Методы лабораторной диагностики орнитоза и других зоонозных хламидиозов у людей.
Поскольку методы диагностики орнитоза и других зоонозных хламидиозов аналогичны, то в последующем изложении материала использован только один термин - орнитоз.
Для диагностики орнитоза у людей и птиц используют бактериологический, серологический и кожно-аллергический методы исследования. Техника лабораторных исследований и постановки полной аллергической пробы приведены в Приложении I.
2.2.1. Бактериологическое исследование.
Возбудитель орнитоза по патогенности для человека относится к микроорганизмам II группы ("Положение о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов риккетсий, грибов, простейших, микоплазм, бактерийных токсинов, ядов биологического происхождения" утверждено МЗ СССР 18.05.1979), поэтому выделение возбудителей может проводиться только в лабораториях медицинского и ветеринарного профиля, имеющих разрешение режимной комиссии на работу с возбудителями второй группы патогенности со строгим соблюдением соответствующих режимных условий ("Инструкция о противоэпидемическом режиме работы с материалом, зараженным или подозрительным на зараженность возбудителями инфекционных заболеваний I - II группы патогенности" утверждена МЗ СССР 29.06.1978).
Для выделения возбудителя орнитоза от больных в качестве исследуемого материала используют кровь или мокроту. Изоляция возбудителя возможна из крови на протяжении первых 7 - 10 дней, из мокроты - 14 - 20 дней заболевания. Применение антибиотиков широкого спектра действия для лечения больных значительно снижает возможность выделения возбудителя орнитоза. При исследовании секционного материала чаще используют кусочки печени, легкого.
Патологический материал, полученный от людей, используют для заражения мышей чаще в мозг или внутрибрюшинно и развивающихся куриных эмбрионов - в желточный мешок. Наличие возбудителя контролируют микроскопией мазков-отпечатков мозговой ткани (или внутренних органов) зараженных мышей и оболочек желточных мешков зараженных куриных эмбрионов, окрашенных различными способами: по Романовскому-Гимзе, Маккиавелло, акридином оранжевым или специфическими люминесцирующими поли- или моноклональными антителами.
Тот же патологический материал можно использовать для выделения возбудителя орнитоза в монослойных культурах различных клеток (фибробласты куриных эмбрионов, клетки L-929, Hela-229, Hep-2 и другие).
В этом случае первичными критериями диагностического выделения хламидий является обнаружение типичных для этих микроорганизмов морфологических и тинкториальных характеристик, а также содержание родоспецифического хламидийного антигена, определяемого в реакции иммунофлуоресценции.
2.2.2. Серологические методы исследования.
Серологические методы являются основными средствами практической диагностики орнитоза. Они могут применяться без ограничений в различных лабораториях медицинского профиля.
Традиционно используют реакцию связывания комплемента (РСК), диагностические препараты для которой (антиген специфический, контрольный и диагностическую сыворотку) выпускает Одесское предприятие по производству бактерийных препаратов Минмедпрома СССР.
В последние годы разработаны, успешно апробированы и другие, более информативные тесты (реакция непрямой гемагглютинации - РНГА, реакция непрямой иммунофлуоресценции - РНИФ, иммунофлуоресцентная реакция микроагглютинации - ИФРМА, иммуноферментный метод - ИФА), в них используются экспериментальные серии препаратов. Техника постановки этих реакций приведена в Приложении II.
Для серологической диагностики орнитоза у людей наиболее широко применяют РСК, РНГА и РНИФ.
В целях дифференциации серологических показателей текущей орнитозной инфекции от анамнестических реакций и естественной иммунизации, серологическое обследование на орнитоз необходимо проводить неоднократно, с интервалом 10 - 14 дней. Наиболее информативным является использование комплекса серологических реакций. Бесспорным основанием для постановки диагноза орнитоза у больных является обнаружение сероконверсии - 4-кратное повышение титра хламидийных антител. Вместе с тем более низкие показатели титра антител во 2 или 3 пробе сыворотки могут быть следствием косвенного влияния интенсивной антибиотикотерапии. В этих случаях достоверное увеличение титра антител в 2 - 3 раза может оцениваться в качестве диагностического показателя.
Положительные результаты серологических реакций без сероконверсий оценивают с учетом особенностей каждого конкретного случая, во взаимосвязи с клиническими показателями и эпидемической ситуацией.
2.2.2.1. Реакция связывания комплемента (РСК).
РСК ставят с родоспецифическим антигеном возбудителя орнитоза (выпускается Одесским предприятием по производству бактерийных препаратов Минмедпрома СССР).
Комплементсвязывающие антитела определяют у больных людей к 10 - 15 дню болезни, обычно в невысоком титре (1:16). Нарастание титра антител наблюдают в течение 4 - 6 недель и их снижение - через 3 - 6 месяцев. Антитела нередко выявляют в крови переболевших 1 - 2 года, а иногда и более длительный срок.
При однократном обследовании или при отсутствии нарастания уровня антител в динамике показатель их титра 1:64 может оцениваться диагностическим при наличии соответствующих клинико-эпидемиологических данных. Определение в этих условиях меньших титров антител требует индивидуального анализа и может быть использовано для подтверждения клинико-эпидемиологического диагноза. При обследовании "профессионально угрожаемых" коллективов комплементсвязывающие антитела могут обнаруживаться и в сыворотках клинически здоровых людей. Их выявление на фоне благополучной эпидситуации, при отсутствии клинически выраженных случаев орнитоза, может быть связано с ранее перенесенным орнитозом, с естественной иммунизацией за счет постоянного контакта с микродозами возбудителя (прямая зависимость от стажа работы обследуемых на предприятии), а также с другими хламидийными инфекциями.
2.2.3. Кожно-аллергический метод.
Для диагностики орнитоза у людей может быть использована кожно-аллергическая проба с орнитозным аллергеном (выпускается Одесским предприятием по производству бактерийных препаратов Минмедпрома СССР). Внутрикожная проба с орнитозным аллергеном становится положительной с первых дней заболеваний у 87 - 95% больных, сохраняясь до года и более. Она является чувствительным индикатором эпидемиологического неблагополучия в коллективах, профессионально связанных с птицей. С увеличением стажа работы повышается вероятность обнаружения сенсибилизации к орнитозному аллергену и процент положительных находок по внутрикожной пробе возрастает. Положительные реакции могут определяться у здоровых лиц, профессионально связанных с птицами, что можно объяснить перенесенным в прошлом заболеванием, латентной формой инфекции, естественной иммунизацией.
Специфичность внутрикожной пробы на введение орнитозного аллергена на одной руке подтверждается отсутствием реакции на введение контрольного субстрата на другой.
Учитывая высокий уровень аллергизации населения и возможность развития неспецифических реакций, оценку результатов кожной пробы у людей проводят при комплексном учете данных других диагностических тестов и клинико-эпидемиологических показателей.
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

