Полирезистентные инфекции что это
Пенициллин стали широко применять для лечения инфекционных заболеваний и осложнений с 1942 г. В 1944 г. подавляющее большинство штаммов стафилококков были чувствительны к этому препарату. Однако уже в 1948 г. 65-85% штаммов стафилококков в больницах оказались резистентными к пенициллину.
Внедрение в практику в 1950-1960-х гг. пенициллинов, устойчивых к действию стафилококковой пенициллиназы (метициллин, оксациллин), привело к снижению частоты стафилококковых инфекций.
Одновременно отмечен рост числа заболеваний, вызванных грамотрицательными возбудителями. Кроме того, озабоченность врачей стали вызывать метициллин-резистентные стафилококки (MRSA).
С середины 1970-х гг. в арсенале врачей появились цефалоспорины 2-й, 3-й генераций, высокоактивные против грамотрицательных патогенов.
В начале 80- х гг. в разных странах мира зарегистрированы вспышки внутрибольничных инфекций, вызванных полирезистентными грамотрицательными микроорганизмами. Основным механизмом формирования устойчивости грамотрицательных бактерий к цефалоспоринам стала продукция бактериальных ферментов, разрушающих бета-лактамное кольцо антибиотиков (бета-лактамазы расширенного спектра — БЛРС).
Внедрение в практику в 1985 г. имипенема, первого антибиотика из класса карбапенемов, позволило почти два десятилетия держать под контролем инфекции, вызванные грамотрицательными возбудителями.
Первые устойчивые к ванкомицину клинические штаммы энтерококков — ванкомицин-резистентные энтерококки (VRE) были описаны в конце 80-х г. В настоящее время в Европейских странах выделяется от 1,1 до 11,5% ванкомицин-резистентных энтерококков, а в некоторых американских госпиталях доля таких штаммов достигает 75%.
С начала 1990-х гг. отмечается широкое распространение в стационарах всего мира MRSA (метициллин-резистентные стафилококки). Доля таких штаммов в некоторых учреждениях превышает 70%. Вместе с тем, в последние годы появились сообщения о снижении заболеваемости инвазивными MRSA инфекциями, что связывают с активным внедрением образовательных программ для медицинских работников и более строгим соблюдением принципов инфекционного контроля в стационарах.
С конца 1990-х гг. стали поступать сообщения о выделении штаммов стафилококков со сниженной чувствительностью к ванкомицину. Сначала такие штаммы выделяли в США и Японии, а затем и по всему миру. При заболеваниях, вызываемых такими стафилококками, терапия ванкомицином очень часто неэффективна.
Увеличение числа заболеваний, вызванных полирезистентными грамположительными возбудителями, способствовало поиску и внедрению в клиническую практику новых противомикробных препаратов.
Так, с конца 1990-х гг. разрешены к применению эффективные при жизнеугрожающих грамположительных инфекциях антибиотики новых классов: линезолид (класс оксазолидинов) и даптомицин (класс липопептидов).
Был открыт тигециклин — антибиотик из группы глицилциклинов, активный против MRSA, ванкомицин-резистентных энтерококков, пенициллин-резистентных пневмококков и энтеробактерий, продуцирующих БЛРС.
Разработаны и внедрены в практику цефалоспорины с анти -MRSA-активностью (цефтобипрол и цефтаролин). В настоящее время в клинике есть выбор препаратов, позволяющих эффективно лечить инфекционные заболевания, вызванные грамположительными возбудителями, в том числе и полирезистентными.
Единичные сообщения о выделении клинических штаммов грамотрицательных бактерий, устойчивых к карбапенемам, стали появляться с 1994 г. Карбапенемы по-прежнему рассматривались как препараты высокоэффективной терапии в случае инфекций, вызванных грамотрицательными возбудителями.
В этот период активно рекомендовалась политика деэскалационной терапии. Согласно такому подходу, пациенту с подозрением на грамотрицательную инфекцию предлагалось эмпирически назначать на несколько дней карбапенемы. Затем, согласно результатам микробиологического исследования, переходить на антибиотики с более узким спектром действия, например, цефалоспорины 3-й генерации.
Обосновывалась такая тактика тем, что раннее назначение антибиотика с максимально широким спектром активности позволит гарантировать высокую клиническую эффективность и обеспечит экономию средств за счет сокращения сроков госпитализации, уменьшения затрат на неэффективные препараты и коррекцию осложнений.
В результате пациенты с жизнеугрожающими заболеваниями, такими как медиастинит, перитонит, менингит, вентилятор- ассоциированная пневмония, сепсис, но вызванными антибиотико-чувствительными штаммами микроорганизмов, получали полный курс терапии карбапенемами.
Лечение отдельного пациента, конечно же, было успешным. Однако селективное давление карбапенемов постепенно способствовало изменению структуры возбудителей внутрибольничных инфекций (ВБИ) и значительному распространению полирезистентных штаммов микроорганизмов.
В ряде публикаций доказано, что увеличение использования карбапенемов в стационаре способствует быстрому распространению в данном учреждении устойчивых штаммов бактерий. По данным многочисленных работ, фактором риска развития инфекций, вызванных карбапенем- резистентными штаммами, является предшествующая терапия антибиотиками широкого спектра действия и, в частности, карбапенемами.
Микроорганизмы с приобретенной резистентностью к карбапенемам устойчивы ко всем бета-лактамным антибиотикам и часто — к препаратам других классов противомикробных средств.
В научной литературе встречается несколько терминов, характеризующих резистентность грамотрицательных патогенов к антибиотикам:
- возбудители с множественной лекарственной устойчивостью (MDR) — резистентные к трем классам антибиотиков и более;
- со значительной (extensively) лекарственной устойчивостью (XDR) — резистентные ко всем, кроме одного или двух классов антибиотиков;
- панрезистентные (PDR) — устойчивые ко всем известным классам препаратов.
Резистентность к карбапенемам грамотрицательных бактерий, за исключением видов с природной устойчивостью к этим препаратам, является маркером XDR или PDR.
Основной механизм формирования устойчивости грамотрицательных бактерий к карбапенемам такой же, как и к другим бета-лактамным антибиотикам — продукция бактериями ферментов, разрушающих бета-лактамное кольцо антибиотиков.
В настоящее время описано более 10 групп карбапенемаз, входящих в разные молекулярные классы бета-лактамаз. Продукция бета-лактамаз бактериями кодируется на генетическом уровне. Большинство генов, кодирующих продукцию карбапенемаз, входит в состав так называемых интегронов, распространяющихся с помощью плазмид между разными видами грамотрицательных бактерий.
В состав таких интегронов входят генные кассеты, несущие детерминанты устойчивости к антибиотикам разных классов. Поэтому происходит одномоментная передача фенотипа множественной лекарственной устойчивости. В последние годы во всех странах мира число штаммов карбапенем-устойчивых грамотрицательных бактерий возрастает в геометрической прогрессии.
S. maltophilia — неферментирующая грамотрицательная бактерия (НГОБ). В настоящее время все чаще выделяется как возбудитель внутрибольничных инфекций и представляет серьезную проблему в лечении пациентов в связи с множественной природной устойчивостью к противомикробным препаратам.
В. cepacia — условно-патогенный микроорганизм из группы НГОБ. Может вызывать вспышки ВБИ (раневые и катетер-ассоциированные инфекции, пневмонии). Особую опасность бактерии В. cepacia представляют для лиц с иммунодефицитами различного генеза.
В последнее время участились случаи госпитальных пневмоний и сепсиса, связанные с этим патогеном, у больных, находящихся длительно на искусственной вентиляции легких. При инфекциях, возбудителем которых является В. cepacia, смертность достигает 83%.
Заболевания, вызванные В. cepacia, с трудом поддаются лечению, так как этот микроорганизм обладает природной устойчивостью к большинству классов антибиотиков.
В настоящее время распространенность устойчивости к карбапенемам среди Р. аeruginosa, по данным различных исследований, составляет от 22 до 95,9%.
В последние годы в структуре возбудителей ВБИ, особенно у пациентов в критических состояниях, все чаще встречается Acinetobacter spp. В некоторых медицинских центрах Acinetobacter spp. является ведущим возбудителем ВБИ.
Препаратами выбора для лечения заболеваний, вызванных этим микроорганизмом, долгое время считались карбапенемы. Однако в настоящее время в разных странах мира устойчивость Acinetobacter spp. к карбапенемам стремительно нарастает.
По данным D.W. Wareham et al., за 8 лет доля устойчивых к карбапенемам штаммов Acinetobacter spp. увеличилась с 0 до 55%. В одном из китайских госпиталей за период с 2008 по 2011 гг. количество резистентных к имипенему штаммов Acinetobacter spp. возросло с 14,8 до 90,8%. По данным H.G. Lee et al., количество карбапенем-резистентных штаммов Acinetobacter spp. составляет 95,3%.
Первый клинический штамм Klebsiella pneumonia, устойчивый к карбапенемам, был описан в 1996 г. в Северной Каролине (США). В течение нескольких последующих лет единичные подобные возбудители выделялись в разных клиниках США.
Начиная с 2000- х гг. случаи ВБИ, вызванные карбапенем-резистентными штаммами Klebsiella pneumonia, стали фиксировать и в Европейских странах. После 2011 г. устойчивые к карбапенемам клебсиеллы были обнаружены во многих странах мира с заметными вспышками ВБИ в Израиле и США.
Наиболее часто эти возбудители вызывают заболевания у пациентов в критических состояниях, находящихся на лечении в отделении реанимации и интенсивной терапии (ОРИТ). В отдельных клиниках доля устойчивых к карбапенемам штаммов клебсиелл может достигать 40-50%. В случае развития заболеваний, вызванных такими штаммами, значительно увеличивается длительность пребывания больного в ОРИТ и потребность в искусственной вентиляции легких.
По данным многочисленных публикаций, ВБИ, вызванные устойчивыми штаммами бактерий, сопровождаются более высокой частотой смертельных исходов по сравнению с заболеваниями, вызванными чувствительными микроорганизмами. Эксперты придают особое значение проблеме карбапенем- резистентных возбудителей в связи с отсутствием на сегодняшний день альтернативных антибиотиков для лечения пациентов при таких инфекциях.
Американское общество инфекционных болезней (Infectious Diseases Society of America — IDSA) констатирует стагнацию в поисках новых антибиотиков против полирезистентных бактерий (Bad Bugs). Число новых антибиотиков, появляющихся на фармакологическом рынке, снижается: с 17 в 1980-1984 гг. до 2 в 2008-2011.
За период с 2010 г. по настоящее время только 7 новых препаратов, потенциально активных против MDR-патогенов, находятся на 2-3-й стадиях клинических испытаний. Причем все они принадлежат к уже длительно применяемым классам антибиотиков, к которым у бактерий выработались механизмы развития резистентности.
В условиях повсеместного распространения штаммов бактерий с множественной устойчивостью к противомикробным средствам ведется поиск эффективной альтернативы антибиотикам в профилактике и лечении инфекционно-воспалительных заболеваний.
В настоящее время активно проводятся исследования по изучению антибактериального действия ионов и наночастиц различных металлов и полупроводников. Их вводят в покрытия катетеров, хирургические повязки, антисептическую одежду, ортопедические устройства. Оцениваются перспективы более широкого использования наночастиц металлов в медицине.
В последние годы возобновился интерес к препаратам бактериофагов и лизатов бактерий. В качестве противомикробных средств их стали применять вскоре после открытия, начиная с 1920-х гг. Для фаготерапии того периода характерны нестабильные результаты лечения, что связано с недостаточным уровнем знаний о биологических свойствах фагов, способах применения, условиях их производства и хранения.
Появившиеся в клинической практике антибиотики быстро вытеснили фаги из арсенала противомикробной терапии. Изучение свойств бактериофагов и их клиническое применение продолжались в Грузии, России, Польше. Современные технологии позволили стандартизировать производство лечебных препаратов бактериофагов и расширить возможности их терапевтического применения.
В настоящее время лечебно-профилактические бактериофаги зарегистрированы для перорального, наружного, местного, ректального и интраназального использования.
По мнению экспертов, решить проблему полирезистентных возбудителей только путем разработки новых лекарств не получится. Признается тот факт, что возникновение устойчивости микроорганизмов является естественным биологическим ответом на использование антибиотиков, которые создают селективное давление, способствующее отбору, выживанию и размножению резистентных штаммов бактерий.
В связи с этим значительное место в организации борьбы с XDR- и PDR-бактериями отводят внедрению в стационарах систем инфекционного контроля и оптимизации политики применения антибиотиков.
Для стабилизации ситуации с распространением полирезистентных штаммов микроорганизмов необходимы комплексные, постоянно действующие мероприятия, включающие:
- микробиологический мониторинг структуры возбудителей и их устойчивости к антибиотикам для выявления зон наиболее высокого риска развития ВБИ;
- мониторинг использования антибиотиков (выбор препаратов, дозы, кратность введения, количество курсов);
- оптимизацию политики применения антибиотиков в стационаре;
- строгое соблюдение принципов инфекционного контроля.
Еще фото
Ключевые слова: инфекционные болезни животных, возбудители, резистентность к антибиотикам, госпитальные инфекции, лабораторная диагностика, энзибиотики, эпидемиологическое благополучие
Key words: animal infectious diseases, pathogens, antibiotic resistance, nosocomial infections, laboratory diagnosis, enzybiotics, public health
Вторая часть обзора посвящена проблемам антибиотикорезистентности, госпитальным инфекциям, лабораторной диагностике бактериальных и грибковых инфекций, а также новым перспективным средствам терапии. Освещены различные типы лекарственной резистентности микроорганизмов, в т.ч. мультирезистентность. Появление агрессивных, высококонтагиозных и резистентных штаммов привело к распространению в ветеринарии внутрибольничных инфекций. На этом фоне требуют пересмотра традиционные подходы к диагностике и терапии инфекционных заболеваний. Особую значимость приобретает лабораторная диагностика и корректное определение антибиотикочувствительности. Перспективным средством борьбы с инфекциями могут стать энзибиотики – новый тип противомикробных препаратов. Инфекционные болезни животных необходимо рассматривать в контексте эпидемиологического благополучия человека.
The second part of the survey is devoted to problems of antibiotic resistance, nosocomial infections, laboratory diagnosis of bacterial and fungal infections, as well as promising new therapies. Different types of antibiotic resistance (including multiresistance) are reviewed. The emergence of aggressive, highly contagious and resistant strains led to the spread of nosocomial infections in veterinary practice. Against this background, a revision of traditional approaches to diagnosis and treatment of infectious diseases is required. The laboratory diagnosis and the correct definition of antibiotic susceptibility are particularly significant. Promising tools to control infections are enzybiotics – a new type of antimicrobial agents. Infectious diseases of animals should be considered in the context of public health.
В настоящее время практикующие врачи все чаще сталкиваются с инфекционными заболеваниями, с трудом поддающимися традиционным средствам и схемам терапии. Это связано с распространением в этиологической структуре штаммов возбудителей, устойчивых к действию противобактериальных лекарственных средств.
Резистентность к антибиотикам обусловлена не только образованием биопленок (см. первую часть статьи), но и другими механизмами, имеющими генетическую природу. Одним из важнейших механизмов является образование микробных ферментов, способных непосредственно разрушать антибиотики. Наибольшую клиническую значимость сегодня представляют следующие типы лекарственной резистентности:
• у грамм-отрицательных бактерий – бета-лактамазы расширенного спектра (БЛРС) и карбапенемазы (KP);
• у стафилококков – метициллин-резистентность (MRS), которая является индикатором устойчивости ко всем бета-лактамным антибиотикам. Также начинают распространяться ванкомицин-резистентные штаммы стафилококков (VRS);
• у энтерококков также наблюдается резистентность к гликопептидному антибиотику ванкомицину (VRE).
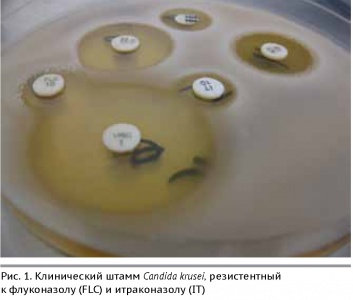
Патогенные грибы также проявляют резистентность к противогрибковым препаратам. На Рис. 1 представлен штамм дрожжевого гриба Candida krusei, резистентный к флуконазолу и итраконазолу – наиболее распространенным в практике противогрибковым препаратам.
Возникновению антибиотикорезистентности способствует неграмотное и зачастую неоправданное терапевтическое использование антибиотиков, профилактическое использование антибиотиков, а также использование антибиотиков в качестве стимуляторов роста (у продуктивных животных). Известно, что при неоправданном применении антибиотиков широкого спектра действия нарушается баланс в нормальной микробиоте животного – чувствительные микроорганизмы уничтожаются, а более устойчивые выживают и размножаются. В результате этого развивается резистентность не только у бактерий-возбудителей, но и у бактерий, составляющих эндогенную комменсальную микробиоту организма животных. Такие бактерии-комменсалы способны самостоятельно вызывать оппортунистические инфекции, а кроме того являются своеобразным резервуаром генов резистентности для болезнетворных бактерий (A. van den Bogaard et al., 1999).
Резистентные штаммы бактерий (таких как Escherichia coli, Salmonella spp., Campylobacter spp., Staphylococcus spp., Enterococcus spp. и др.) могут передаваться от животных к человеку как при непосредственном контакте, так и через пищевую цепочку. Более того, бактерии от животных могут передавать свои гены резистентности возбудителям болезней человека. Так, после внедрения в практику ветеринарного антибиотика апрамицина гены резистентности к нему были обнаружены не только у бактерий от животных, но также и у бактерий-представителей комменсальной микрофлоры человека, у зооантропонозных возбудителей (Salmonella spp.), а также у строго антропофильных патогенов, таких как Shigella spp. (A. van den Bogaard et al., 2000).
Изложенные выше особенности современных возбудителей во многом привели к распространению внутрибольничных инфекций (ВБИ), которые уже в течение многих лет являются острейшей проблемой гуманной медицины. Однако в последние годы наблюдается тревожная тенденция распространения ВБИ и в ветеринарной практике, что косвенно связанно с прогрессом ветеринарной медицины – массовым появлением стационаров, отделений реанимации и интенсивной терапии, проведением высокотехнологичных операций, внедрением современных инвазивных методов диагностики и терапии. Как и в гуманной медицине, возбудители внутрибольничных инфекций животных характеризуются широким спектром устойчивости к антибиотикам (Johnson J., 2002).
ВБИ (известные также как госпитальные, нозокомиальные инфекции) связаны с пребыванием животного в лечебном ветеринарном учреждении. Это может быть как длительное пребывание в стационаре, так и кратковременный визит. Соответственно, заражение животного происходит теми штаммами возбудителей, которые циркулируют в данной ветеринарной клинике. Источником заражения могут служить все объекты больничной среды, оборудование, инструменты, медикаменты, а также другие животные-пациенты. Однако наиболее значимым фактором заражения является ветеринарный персонал.
Инфекции могут быть локализованы в любом месте, но наиболее часто встречаются ВБИ мочевыделительной системы, кровеносной системы, пневмонии, бактериальные диареи, хирургические инфекции.
Внутрибольничные инфекции гораздо более устойчивы к антибиотикотерапии, т. к. вызываются мультирезистентными штаммами.
Терапия таких инфекций обходится существенно дороже, т.к. требует применения новейших дорогостоящих препаратов. Для ветеринарной медицины это играет особо важную роль, т.к. нередко владельцы животных ограничены в средствах и не могут оплатить длительное пребывание животного в стационаре и лечение дорогостоящими антибиотиками, в результате чего животных подвергают эвтаназии (A. Steele, 2009).
Наиболее часто возбудителями ВБИ являются такие микроорганизмы, как Enterococcus spp., E. coli, Staphylococcus spp., Enterobacter spp., Klebsiella spp., Acinetobacter spp., Pseudomonas spp. Из них Enterococcus spp., E. coli и Staphylococcus spp. способны легко приобретать детерминанты резистентности: резистентность к ванкомицину у энтерококков, мультирезистентность у E. coli, метициллин-резистентность у стафилококков. В течение многих лет эти микроорганизмы являются проблемой для гуманной медицины, а в настоящее время приобретают всё большее значение и в ветеринарии.
В гуманной медицине к настоящему времени накоплен большой опыт по профилактике и борьбе с внутрибольничными инфекциями, и ветеринарным специалистам необходимо взять этот опыт на вооружение. Тем более, что в большинстве случаев для профилактики ВБИ достаточно таких элементарных мер, как мытье рук между пациентами, дезинфекционная обработка инструментов, инвентаря и рабочих помещений. Как уже упоминалось, владельцы нередко прибегают к эвтаназии животных в случае заражения трудноизлечимой ВБИ. Т.к. в большинстве случаев эти инфекции можно было предупредить, ответственность за них ложится на плечи ветеринарного персонала, который должен знать и строго соблюдать профилактические меры.
Сложившаяся ситуация требует пересмотреть традиционные подходы к диагностике и терапии инфекционных заболеваний. Адекватная достоверная диагностика невозможна без проведения компетентного микробиологического исследования (Рис. 3). Оно позволяет судить обо всём микробном пейзаже в очаге поражения, выделить и идентифицировать всех членов микробной ассоциации, оценить численность популяции микроорганизмов. Количественная оценка позволяет с известной точностью отличить инфекцию от колонизации и контаминации.
Первостепенное значение приобретает точность выбора противомикробного средства (антибиотика), его эффективность против конкретного возбудителя. Имея дело с резистентными госпитальными штаммами, нельзя полностью полагаться на эмпирический подход в терапии.
При этом определение чувствительности возбудителя традиционным диско-диффузионным методом может оказаться недостаточным. Для препаратов с до-зозависимым эффектом возникает необходимость количественного определения МПК (минимальной подавляющей концентрации) (Рис. 4, 5). Это поможет определить эффективную дозу для конкретного возбудителя с учетом локализации инфекции. Для полирезистентных госпитальных штаммов это может быть единственным способом определения эффективной терапии. Также лаборатория должна быть способна к выявлению специфических типов лекарственной резистентности, которые не всегда обнаруживаются рутинными методами.
Также может быть эффективным сочетанное применение двух антибиотиков, обладающих синергидным эффектом. Однако для использования этого подхода необходимо лабораторное определение эффективности действия двух препаратов в отношении конкретного штамма возбудителя – препараты могут проявить как синергидный, так и конкурентный эффекты (M. Поляк, 2014).
Следует учитывать, что имеющиеся на сегодня классы антибиотиков в разной степени подвержены действию микробных литических ферментов. К некоторым из них, например, незащищенным беталак-тамам (пенициллины, цефалоспорины), резистентность встречается гораздо чаще, чем, например, к антибиотикам класса фторхинолонов. Также установлено, что определенные антибиотики могут быть эффективны даже в отношении биопленок. В частности, фторхинолоны третьего поколения эффективны против биопленок, образуемых Pseudomonas aeruginosa (T. Goto et al., 1999). Еще раз следует отметить, что при выборе средства терапии необходимо учитывать результаты лабораторного исследования, в т. ч. антибиотикограммы.
Однако в целом становится всё более очевидным, что имеющихся в арсенале лекарственных средств уже недостаточно для эффективной терапии инфекционных заболеваний, и победоносная эра антибиотиков клонится к своему закату. Количество новых препаратов, выходящих на рынок, в 2000-х годах резко сократилось, и в ветеринарии их нехватка ощущается особенно остро. Что касается открытия новых механизмов действия, то еще с 1987 г. ни одного принципиально нового класса антибиотиков предложено не было.
Каковы же дальнейшие перспективы борьбы с инфекционными заболеваниям? По мнению многих исследователей, прийти на смену антибиотикам могут т. н. энзибиотики – препараты, в корне отличающиеся от антибиотиков по механизму действия. По своей природе они являются ферментами, способными непосредственно лизировать те или иные структуры микробной клетки. Продуцентами этих ферментов являются бактериофаги, а также бактерии и другие микроорганизмы. Колоссальным преимуществом энзибиотиков является то, что они с успехом лизируют микроорганизмы любого типа резистентности, в т. ч. и госпитальные штаммы, и при этом не проявляют таких побочных эффектов на макроорганизм, как многие антибиотики.
К энзибиотикам во всем мире сейчас приковано самое пристальное внимание, и, безусловно, этот новый тип лекарственных средств открывает огромные перспективы в борьбе с инфекционными заболеваниями. Разработкой энзибиотиков сейчас активно занимаются многие научные лаборатории во всем мире, в том числе и в нашей стране. О том, насколько активно ведутся эти исследования, можно судить по онлайн-базе phiBIOTICS (http://www.phibiotics.org), где собрана информация по нескольким десяткам энзибиотиков, применяемым с терапевтической целью.
Отдельные препараты этой группы уже выпущены на рынок некоторых стран. Например, дисперсин – энзибиотик, действующий целенаправленно на биопленки. Он лизирует цементирующее вещество биопленочного матрикса поли-N-ацетил-глюкозамин. Данное вещество образуется в биопленках как грамположительных, так и грамотрицательных организмов, т.е. дисперсин обладает широким противомикробным потенциалом. В настоящее время коммерческий дисперсин для ветеринарного применения доступен в Канаде как средство против отитов и инфекций, ассоциированных с атопическим дерматитом.
1. Поляк М. Роль микробиологической службы в обеспечении эффективной антибиотикотерапии на современном этапе. Медицинский алфавит – Современная лаборатория, 2014, 15(231), стр. 51-55.
2. Anthony E. van den Bogaard, Stobberingh E. Antibiotic usage in animals: impact on bacterial resistance and public health. Drugs. 1999 Oct;58(4):589-607.
3. Anthony E. van den Bogaard, Stobberingh E. Epidemiology of resistance to antibiotics. Links between animals and humans. Int J Antimicrob Agents. 2000 May;14(4):327-35.
4. Goto T., Nakame Y., Nishida M., Ohi Y. In vitro bactericidal activities of beta-lactamases, amikacin and fluoroquinolones against Pseudomonas aeruginosa biofilm in artificial urine. Urology. 1999 May;53(5):1058-62.
5. Johnson J. Nosocomial infections. Vet Clin North Am Small Anim Pract. 2002 Sep; 32(5):1101-26.
6. Kumar J. Lysostaphin: an antistaphylococcal agent. Appl Microbiol Biotechnol. 2008 Sep; 80(4):555-61. doi: 10.1007/s00253-008-1579-y.
7. Mohammed M., Mohammed A., Mirza M., Ghori A. Nosocomial infections: An overview. Int. Res. J. Pharm., 2014, 5(1), pp 7-12; doi:10.7897/2230-8407.050102.
8. Nikaido H. Multidrug resistance in bacteria. Annu Rev Biochem. 2009;78:119-46. doi: 10.1146/annurev.biochem.78.082907.145923.
9. Roca I., Akova M., Baquero F., Carlet J. et al. The global threat of antimicrobial resistance: science for intervention. New Microbes New Infect. 2015 Apr 16;6:22-9. doi:10.1016/j.nmni.2015.02.007. eCollection 2015.
10. Steele A. Nosocomial infections: what's the big deal? AAHA Phoenix 2009 proceedings. American Animal Hospital Association, Phoenix, Arizona, March 26-29, 2009, PP 737-741.
ЖУРНАЛ "ПРАКТИКА ПЕДИАТРА"
Возникновение резистентности микробов - закономерное биологическое явление. Убежденность в том, что АБ могут все, привела к созданию и использованию десятков оригинальных препаратов и сотен дженериков, что создало интенсивное давление на микромир, находящийся как внутри нас, так и вовне, который вынужденно отреагировал созданием механизмов устойчивости, а также появлением в клинической практике таких супермикробов, как B. cepacia и Achromobacter, исходно полирезистентных.
Возникновение и распространение резистентности обусловлено не только способностью микроорганизмов развивать устойчивость и существовать в определенной экологической нише, но и возможностью независимого переноса механизмов резистентности между различными видами бактерий с помощью мобильных генетических элементов (плазмид). Так, например, резистентность энтерококков к гентамицину была приобретена от стафилококков [2].
Формирование резистентности, то есть образование некоторой критической массы бактерий, устойчивой к АБ [3], идет несколькими путями.
Пищевая безопасность. Продукция агропромышленного комплекса, где широко при-меняют АБ для лечения животных, а в малых дозах - для ускорения их роста, оказывает давление на микрофлору. Так, например, в США в 2010 году с этой целью было израсходовано 13 тыс. тонн АБ [4].
В значительной части случаев (40%) применение АБ - это самостоятельное (не всегда оправданное) решение родителей, ведь 80% семей в РФ имеют в домашних аптечках АБ, чаще всего это дженерики, качество которых нередко хромает. При этом 17% потребителей пополняют запас по совету знакомых и родственников [5].
Однако самый существенный вклад в возникновение проблемы резистентности вносит медицинское сообщество. Прежде всего это безрецептурная продажа (4-е место среди всех ЛС занимают АБ), при этом, по данным [5], большинство опрошенных (73%) положительно относятся к этому из-за удобства и экономии времени в связи с трудностями попадания к врачу в поликлинике. При покупке ЛС в аптеке треть опрошенных прислушиваются к совету фармацевта или приходят с готовым мнением, сформированным медицинскими изданиями, Интернетом, передачами о здоровье, рекламой.
При назначении АБ врачи нередко находятся в плену устойчивых заблуждений, что приводит к необоснованному и нерациональному их применению.
Вот наиболее распространенные заблуждения:
- АБ оказывают жаропонижающий эффект.
- АБ оказывают противовоспалительное действие.
- Повышение температуры есть, как правило, проявление инфекции, причем бактери альной. (В результате нередко АБ назначаются при любом повышении температуры.)
- АБ нужно назначать при ОРВИ для профилактики пневмонии. Но ведь такие проявления ОРВИ, как ринит, катаральный отит, бронхит, обладают высоким потенциалом спонтанного выздоровления [6]. В этом случае участковый педиатр может стать одной из ключевых фигур по сдерживанию формирования резистентности.
Варианты нерационального применения АБ [7]
Последствия нерационального применения АБ
- Неэффективность лечения с ухудшением прогноза.
- Рост летальности.
- Рост резистентности.
- Количество побочных эффектов (ПЭ) на АБ превышает их частоту на других ЛС.
- Избыточная лекарственная нагрузка: в привязке к АБ часто назначаются антигистаминные препараты, антимикотики, средства для коррекции дисбиоза, иммуномодуляторы [8, 9].
Состояние с резистентностью в России можно рассмотреть на примере внебольничной пневмонии (ВП) - наиболее частой формы острого инфекционного заболевания легких у детей.
Заболеваемость ВП в России у детей в возрасте от 1 мес. до 15 лет составляет 4-17:1000, а наиболее часто болеют дети в возрасте до 4 лет (40:1000) и у них она является основной причиной смерти [9, 11].
Основным респираторным патогеном ВП среди бактериальных возбудителей является S. pneumonia (70-85%), и если с начала 90-х годов пневмококк сохранил свои лидирующие позиции, то он не мог не измениться качественно за этот период 13.
При этом российские данные расходятся с зарубежными: так, в США резистентность пневмококка к пенициллину достигла 43%, а в РФ она не превышает 6-8% [6, 18]. Отчасти это объясняется тем, что пенициллин начал применяться в США с середины 40-х годов ХХ века, и тогда же А. Флеминг предупреждал, что необходимо воздержаться от его чрезмерного использования для сдерживания резистентности, поскольку уже в 1944 году были опубликованы данные о потере чувствительности стафилококка к пенициллину [4].
Очень тревожит и то, что резистентность пневмококка к пенициллину довольно часто сочеталась с резистентностью к макролидам (кларитромицину и азитромицину - до недавнего времени препараты II линии при лечении ВП): в азиатских странах - 80%, во Франции - 58%, в Испании - 36,6%. При этом резистентность пневмококка к макролидам растет опережающим образом, что вынудило врачей в этих странах отказаться от применения макролидов как препаратов резерва [1, 19].
Как снизить вероятность формирования резистентности к АБ [2, 21-25]
- Назначение АБ только по четким клиническим показаниям - наличие признаков бактериальной инфекции.
- Использование простейших АБ, например пенициллина при остром тонзиллофарингите, вызванном БГСА, что в свою очередь требует внедрения в практику стрептотеста.
- Использование только коротких курсов АБ, например для лечения неосложненной мочевой инфекции.
- Привлечение к сотрудничеству местной бактериологической лаборатории, в идеале оснащенной современной аппаратурой (например, MAIDY Biotyper), для быстрой (в течение нескольких часов) идентификации возбудителя и определения его чувствительности к АБ, что поможет рационализировать их применение.
- Строгий контроль над применением АБ в каждом учреждении.
- Выбор оптимального режима АБ-терапии следует осуществлять с учетом фармакодинамических и фармакокинетических характеристик АБ.
- При выборе антимикробного препарата необходимо знать региональную ситуацию с антибиотикорезистентностью наиболее актуальных возбудителей.
- Объяснять пациентам вред несоблюдения режима антибактериальной терапии и опасности самолечения АБ.
- Использовать в качестве руководства практические рекомендации экспертов, основанных на доказательной медицине.
- Антибиотикорезистентность как ключевой элемент образования и сертификации.
Однако эти предложения, обращенные к врачам клинической и амбулаторной практики, носят рекомендательный и, следовательно, необязательный характер. Поэтому хотя бы в ряде случаев нужны административные меры с неукоснительным их исполнением, как это было осуществлено в одном из хирургических стационаров Нижнего Новгорода [22]. Ограничительная политика администрации по уменьшению потребления АБ исходила из современных рекомендаций и данных локального бактериологического мониторинга с выделением группы АБ резерва, применение которых было возможно только по решению врачебной комиссии с участием клинического фармаколога. В результате жесткого контроля исполнения удалось добиться значительного снижения потребления АБ и уменьшения затрат на их покупку на 37,7% без снижения эффективности лечения.
По нашему мнению, эта инициатива требует расширенного применения.
Читайте также:


