Перипротезная инфекция что это такое

Тотальное эндопротезирование коленного сустава значительно уменьшает болевой синдром и улучшает функцию и качество жизни пациентов с гонартрозом. Одним из тяжелых осложнений после тотальной замены коленного сустава является перипротезная инфекция, которая составляет от 1,0 до 12,4 % [6]. При перипротезном инфицировании встречаются варианты латентно протекающей суставной инфекции, для выявления которой необходимы дополнительные методы исследования и коррекция алгоритма оперативного лечения [4].
Segawa H. в 1999 г. предложил классификацию перипротезной инфекции коленного сустава на основе клинических показателей тяжести симптоматики и временной зависимости между хирургическим вмешательством и возникновением инфекции [5].
1-й тип инфекции может быть выявлен у пациентов во время ревизионной артропластики по поводу предполагаемого асептического расшатывания компонентов эндопротеза при наличии позитивных результатов микробиологического исследования операционного материала и данных гистологического исследования параартикулярных тканей.
2-й тип – ранняя глубокая послеоперационная инфекция; возникает непосредственно в послеоперационном периоде (4–6 недель после операции). Как правило, отмечается у пациентов с проблемным заживлением раны, инфильтрацией вокруг раны и сопровождается болевым синдромом.
3-й тип инфекции возникает также, как и 2-й тип непосредственно в послеоперационном периоде, однако протекает с невыраженной симптоматикой вследствие слабо вирулентной инфекции. Основными симптомами являются суставная боль, отечность, появление экссудата, ригидность или ухудшение функции сустава.
4-й тип – гематогенная хроническая или поздняя вялотекущая инфекция при достаточно удовлетворительной функции сустава после имплантации чаще возникает на фоне хронических очагов инфекции мочевого тракта, полости рта, после перенесенной пневмонии, а также у иммунокомпрометированных пациентов.
Цель исследования: улучшение результатов хирургического лечения гнойных осложнений после тотального эндопротезирования коленного сустава.
Материал и методы. С 1995 по 2015 г. в МОНИКИ им. М.Ф. Владимирского наблюдался 31 пациент с перипротезной инфекцией коленного сустава. Женщин – 19, мужчин – 12, в возрасте от 48 до 83 лет.
Для диагностики воспаления в области эндопротеза коленного сустава применяли клинические, рентгенологические, микробиологические, лабораторные и морфологические методы исследования [3].
Клинический диагноз глубокой перипротезной инфекции области коленного сустава основывался при наличии одного из первостепенных и минимум трех второстепенных стандартизированных согласительной конференцией критериев [2].
Первостепенными или достоверными критериями считали наличие свищевого хода, сообщающегося с полостью сустава или два положительных результата посева с фенотипчески идентичными микроорганизмами. Малыми или второстепенными критериями перипротезной инфекции в нашей работе являлись:
- повышение уровня С-реактивного белка в плазме крови и скорости оседания эритроцитов ≥ 30 мм /час (СОЭ);
- повышенное процентное количество полиморфноядерных нейтрофилов;
- положительный результат гистологического исследования параартикулярных тканей;
- положительный тест на эстеразу лейкоцитов;
- единичный положительный посев бактерий.
Постоянным отделением из раны после тотального эндопротезирования коленного сустава считали выделения в области хирургического разреза, продолжающиеся более 72 часов (рис. 1) [2].
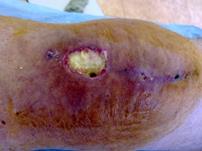
Рис. 1. Незаживающая рана у пациента Р., 1942 г.р. после тотального замещения коленного сустава
При выборе тактики хирургического лечения перипротезной инфекции коленного сустава проводилось изучение морфологических данных аспирата суставной жидкости [1].
Для лечения перипротезной инфекции коленного сустава на основе комплексного алгоритма диагностики использовали следующие основные методы хирургического лечения (табл. 1).
Методы хирургического лечения перипротезного инфицирования коленного сустава
Характер оперативного метода
Хирургическая санация с сохранением эндопротеза
Двухэтапный метод хирургического лечения
Одноэтапное ревизионное эндопротезирование
Удаление эндопротеза, резекционная артропластика, артродез коленного сустава
Хирургическая санация с сохранением эндопротеза коленного сустава проведена в 6 случаях острого воспаления, в одном из них выполнена замена полиэтиленового вкладыша. Во всех случаях выполнен поздний дебридмент (более 4 недель после появления признаков воспаления) с согласия пациентов и при отказе от проведения двухэтапной ревизии (рис. 2).
а) 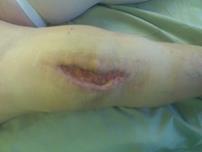
б) 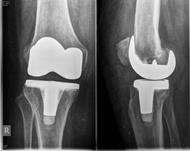
в) 
Рис. 2. Раннее перипротезное инфицирование правого коленного сустава, пациентка З., 1949 г .р.:
а) незаживающая рана коленного сустава; б) рентгенограмма при поступлении;
в) внешний вид коленного сустава через 2 месяца после хирургической санации
При наличии достоверных клинических проявлений перипротезной инфекции, положительном тесте синовиальной жидкости на эстеразу лейкоцитов, при наличии сегментоядерных нейтрофилов с пролиферацией синовиоцитов и фиброцитов в суставной жидкости и обнаружении более 5 нейтрофилов в поле зрения при гистологическом исследовании операционного материала выполнялась двухэтапная ревизия с использованием цементного спейсера и последующим реэндопротезированием (рис. 3).
а)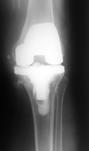
б)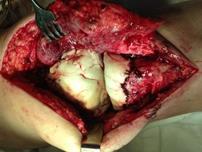
в)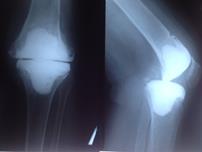
г) 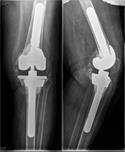
д)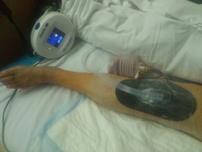
Рис. 3. Пациентка Ф., 1938 г.р. Глубокое перипротезное инфицирование коленного сустава. а) рентгенограмма коленного сустава до операции; б) во время хирургической санации после удаления компонентов эндопротеза и установки артикулирующего цементного спейсера;
в) рентгенограмма коленного сустава после первого этапа; г) рентгенограмма коленного сустава после второго этапа оперативного лечения; д) использование вакуумной терапии с целью профилактики послеоперационной гематомы
Во время первого этапа проводилось удаление бедренного итибиального компонентов эндопротеза, тщательный дебридмент с удалением резидуального цемента с последующей установкой спейсера, импрегнированного антибиотиком. Через 4–6 месяцев, при отсутствии клинических признаков рецидива воспаления, подтвержденных данными лабораторных исследований, выполнялся второй этап хирургического лечения – повторное эндопротезирование коленного сустава.
У пациентов с подозрением на латентно протекающую инфекцию, при наличии дестабилизации компонентов эндопротеза и слабоположительного теста на лейкоцитарную эстеразу, проводилось интраоперационное исследование нативных срезов свежезамороженных параартикулярных тканей. При определении менее 5 нейтрофилов в поле зрения выполнялось одноэтапное ревизионное эндопротезирование (рис. 4), в том числе и с использованием протезов несвязанного типа при отсутствии потери костной ткани.
а)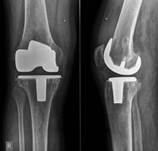
б)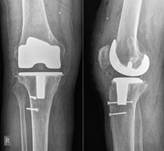
Рис. 4. Пациент Ч., 1956 г.р. Вялотекущий воспалительный процесс правого коленного сустава после тотального замещения без формирования фистулы а) рентгенограмма при поступлении; б) рентгенограмма правого коленного сустава после реэндопротезирования
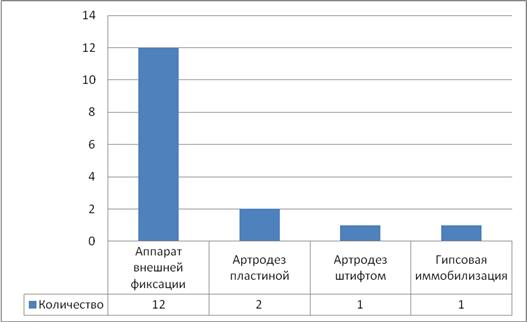
Показанием к удалению эндопротеза с последующим артродезом коленного сустава являлись случаи длительного вялотекущего воспалительного процесса с наличием контрактуры, рецидивы воспаления после предшествующих санирующих операций, выявление остеокластов при цитологическом исследовании аспирата суставной жидкости. Во время операции проводилась широкая ревизия с удалением всех компонентов эндопротеза, фиксирующих материалов и нежизнеспособных тканей. После адаптации суставных поверхностей в функционально выгодном положении (сгибание от 00–100, наружная ротация стопы 100–150, вальгусное отклонение под углом 50–70) проводится артродез коленного сустава с применением аппаратов внешней фиксации из четырехкольцевых опор или погружных металлических конструкций (интрамедуллярный штифт или чрезмыщелковая пластина).
Методы стабилизации коленного сустава после удаления эндопротеза представлены в табл. 2.
Методы стабилизации коленного сустава после удаления эндопротеза коленного сустава
Всем пациентам после оперативного лечения проводили ступенчатую антибактериальную терапию с учетом бактериологического исследования в течение 2-х недель внутривенно, затем в течение 4–6 недель продолжался пероральный прием антибиотиков.
Помимо антибактериальной терапии проводили коррекцию иммунного статуса пациентов с использованием иммуномодуляторов, на основании исследования фагоцитоза и субпопуляции лимфоцитов.
С целью профилактики послеоперационной гематомы у пациентов после хирургической санации с сохранением или возобновлением эндопротеза коленного сустава использовали метод локального отрицательного давления. Вакуумный аппарат устанавливали на постоянное отрицательное давление 125 мм рт. ст. Лечение продолжали в течение 5–7 дней.
Результаты и обсуждение. Результаты хирургического лечения перипротезной инфекции коленного сустава оценены по группам:
I группа: пациенты с сохранением или возобновлением эндопротеза (n=15);
II группа: после удаления эндопротеза с формированием анкилоза коленного сустава (n=16).
В первой группе у пациентов с сохранением или возобновлением эндопротеза коленного сустава положительные результаты и купирование воспалительного процесса отмечены в 86,7% случаев.
Во второй группе, после удаления эндопротеза и артродеза коленного сустава с последующим формированием костного анкилоза, купирование воспалительного процесса отмечено в 87,5 % случаев.
В46,7 % случаев в группе с сохранением или возобновлением эндопротеза больные передвигались без использования дополнительных средств опоры. В отличие от группы после удаления эндопротеза с формированием анкилоза коленного сустава только в 26,7 % случаев пациенты не использовали дополнительные средства опоры.
Дифференцированный подход к хирургическому лечению глубокой перипротезной инфекции коленного сустава позволил получить благоприятные результаты и стойкое купирование воспалительного процесса с частичным или полным восстановлением функции конечности в 87,1 % случаев.
Технологии оперативного лечения, позволяющие сохранить или возобновить эндопротез, демонстрируют лучшие функциональные результаты по сравнению с методами, предполагающими удаление имплантата.
Актуальным является вопрос о преимуществах одномоментного или двухэтапного методов лечения перипротезной инфекции коленного сустава в тех или иных клинических случаях.
Выполнение хирургической санации с заменой полиэтиленового вкладыша в течение 3–4 недель после появления признаков острой инфекции позволяет с большой вероятностью добиться купирования воспаления. В течение последующего времени шансы на успех сохранения эндопротеза уменьшаются.
Полный текст:
1. Atkins BL, Athanasou N, Deeks JJ, Crook DW, Simpson H, Peto TE et al. Prospective evaluation of criteria for microbiological diagnosis of prosthetic-joint infection at revision arthroplasty. The OSIRIS Collaborative Study Group. J Clin Microbiol. 1998; 36(10):2932-2939.
2. Berbari E, Mabry T, Tsaras G, Spangehl M, Erwin PJ, Murad MH, et al. Inflammatory blood laboratory levels as markers of prosthetic joint infection: a systematic review and metaanalysis. J Bone Joint Surg. Am. 2010; 92(11):2102-2109.
3. Bozic KJ, Ries MD. The impact of infection after total hip arthroplasty on hospital and surgeon resource utilization. J Bone Joint Surg. Am. 2005; 87(8):1746-1751.
4. Bozic KJ, Lau E, Kurtz S, Ong K, Rubash H, Vail TP, et al. Patient-related risk factors for periprosthetic joint infection and postoperative mortality following total hip arthroplasty in Medicare patients. J Bone Joint Surg. Am. 2012; 94(9):794-800.
5. Corona P, Gil E, Guerra E, Soldado F, Amat C, Flores X, et al. Percutaneous interface biopsy in dry-aspiration cases of chronic periprosthetic joint infections: a technique for preoperative isolation of the infecting organism. Int Orthop. 2012; 36(6):1281-1286.
6. Corvec S, Portillo ME, Pasticci BM, Borens O, Trampuz A. Epidemiology and new developments in the diagnosis of prosthetic joint infection. Int J Artif Organs. 2012; 35(10):923-934.
7. Fink B, Gebhard A, Fuerst M, Berger I, Schafer P. High diagnostic value of synovial biopsy in periprosthetic joint infection of the hip. Clin Orthop Relat Res. 2013; 471(3):956-964.
8. Frommelt L. [Aspiration of joint fluid for detection of the pathogen in periprosthetic infection]. Orthopade. 2008; 37(10):1027-1034; quiz 35-36.
9. Furustrand Tafin U, Corvec S, Betrisey B, Zimmerli W, Trampuz A. Role of rifampin against Propionibacterium acnes biofilm in vitro and in an experimental foreign-body infection model. Antimicrob Agents Chemother. 2012; 56(4):1885-1891.
10. Hsieh PH, Shih CH, Chang YH, Lee MS, Shih HN, Yang WE. Two-stage revision hip arthroplasty for infection: comparison between the interim use of antibiotic-loaded cement beads and a spacer prosthesis. J Bone Joint Surg. Am. 2004; 86-A(9):1989-1997.
11. Hwang JS, Beebe KS, Patterson FR, Benevenia J. Infected total femoral replacements: evaluation of limb loss risk factors. Orthopedics. 2011; 34(11):e736-740.
12. Ivancevic V, Perka C, Hasart O, Sandrock D, Munz DL. Imaging of low-grade bone infection with a technetium- 99m labelled monoclonal anti-NCA-90 Fab’ fragment in patients with previous joint surgery. Eur J Nuclr Med Molec Imag. 2002; 29(4):547-551.
13. Janz V, Wassilew GI, Hasart O, Matziolis G, Tohtz S, Perka C. Evaluation of sonicate fluid cultures in comparison to histological analysis of the periprosthetic membrane for the detection of periprosthetic joint infection. Int Orthop. 2013; 37(5):931-936.
14. Janz V, Bartek B, Wassilew GI, Stuhlert M, Perka CF, Winkler T. Validation of synovial aspiration in girdlestone hips for detection of infection persistence in patients undergoing 2-stage revision total hip arthroplasty. J Arthroplasty. 2016; 31(3):684-687.
15. Jung J, Schmid NV, Kelm J, Schmitt E, Anagnostakos K. Complications after spacer implantation in the treatment of hip joint infections. Int J Med Sci. 2009; 6(5):265-273.
16. Krenn V, Morawietz L, Kienapfel H, Ascherl R, Matziolis G, Hassenpflug J, et al. [Revised consensus classification: Histopathological classification of diseases associated with joint endoprostheses]. Z Rheumatol. 2013; 72(4):383-392.
17. Kurtz SM, Lau E, Watson H, Schmier JK, Parvizi J. Economic burden of periprosthetic joint infection in the United States. J Arthroplasty. 2012; 27(8 Suppl):61-65 e1.
18. Lange J, Troelsen A, Thomsen RW, Soballe K. Chronic infections in hip arthroplasties: comparing risk of reinfection following one-stage and two-stage revision: a systematic review and meta-analysis. Clin Epidemiol. 2012; 4:57-73.
19. Langlais F, Kerboull M, Sedel L, Ling RS. The ‘French paradox. J Bone Joint Surg. Br. 2003; 85(1):17-20.
20. Langlais F. Can we improve the results of revision arthroplasty for infected total hip replacement? J Bone Joint Surg. Br. 2003; 85(5):637-640.
21. Love C, Marwin SE, Palestro CJ. Nuclear medicine and the infected joint replacement. Sem Nucl Med. 2009; 39(1):66-78.
22. Maderazo EG, Judson S, Pasternak H. Late infections of total joint prostheses. A review and recommendations for prevention. Clin Orthop Rel Res. 1988; (229):131-42.
23. Miller TT. Imaging of hip arthroplasty. Eur J Radiol. 2012; 81(12):3802-3812.
24. Morawietz L, Classen RA, Schroder JH, Dynybil C, Perka C, Skwara A et al. Proposal for a histopathological consensus classification of the periprosthetic interface membrane. J Clin Pathol. 2006; 59(6):591-597.
25. Mulcahy H, Chew FS. Current concepts of hip arthroplasty for radiologists: part 2, revisions and complications. AJR Am J Roentgenol. 2012; 199(3):570-580.
26. Muller M, Morawietz L, Hasart O, Strube P, Perka C, Tohtz S. Diagnosis of periprosthetic infection following total hip arthroplasty--evaluation of the diagnostic values of preand intraoperative parameters and the associated strategy to preoperatively select patients with a high probability of joint infection. J Orthop Surg Res. 2008; 3:31.
27. Murdoch DR, Roberts SA, Fowler Jr VG, Jr., Shah MA, Taylor SL, Morris AJ, et al. Infection of orthopedic prostheses after Staphylococcus aureus bacteremia. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2001; 32(4):647-649.
28. Oliva A, Furustrand Tafin U, Maiolo EM, Jeddari S, Betrisey B, Trampuz A. Activities of fosfomycin and rifampin on planktonic and adherent Enterococcus faecalis strains in an experimental foreign-body infection model. Antimicrob Agents Chemother. 2014; 58(3):1284-1293.
29. Parvizi J, Adeli B, Zmistowski B, Restrepo C, Greenwald AS. Management of periprosthetic joint infection: the current knowledge: AAOS exhibit selection. J Bone Joint Surg. Am. 2012; 94(14):e104.
30. Perka C, Haas N. [Periprosthetic infection]. Der Chirurg; Zeitschrift fur alle Gebiete der operativen. Medizen. 2011; 82(3):218-226.
31. Portillo ME, Salvadó M, Alier A, Sorli L, Martínez S, Horcajada JP et al. Prosthesis failure within two years of implantation is highly predictive for infection. Clin Orthop Relat Res. 2013; 471(11):3672-3678.
32. Schinsky MF, Della Valle CJ, Sporer SM, Paprosky WG. Perioperative testing for joint infection in patients undergoing revision total hip arthroplasty. J Bone Joint Surg. Am. 2008; 90(9):1869-1875.
33. Sculco TP. The economic impact of infected total joint arthroplasty. Instr. course Lect. 1993; 42: 349-51.
34. Senthi S, Munro JT, Pitto RP. Infection in total hip replacement: meta-analysis. Int Orthop. 2011; 35(2):253-260.
35. Spangehl MJ, Masri BA, O’Connell JX, Duncan CP. Prospective analysis of preoperative and intraoperative investigations for the diagnosis of infection at the sites
36. of two hundred and two revision total hip arthroplasties. J Bone Joint Surg. Am. 1999; 81(5):672-683.
37. Strobel K, Stumpe KD. PET/CT in musculoskeletal infection. Semin Musculoskelet Radiol. 2007; 11(4): 353-364.
38. Tohtz SW, Muller M, Morawietz L, Winkler T, Perka C. Validity of frozen sections for analysis of periprosthetic loosening membranes. Clin Orthop Relat Res. 2010; 468(3):762-768.
39. Trampuz A, Piper KE, Jacobson MJ, Hanssen AD, Unni KK, Osmon DR, et al. Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med. 2007; 357(7):654-663.
40. Trampuz A, Zimmerli W. Diagnosis and treatment of implant-associated septic arthritis and osteomyelitis. Curr Infect Dise Rep. 2008; 10(5):394-403.
41. Trampuz A, Perka C, Borens O. [Prosthetic joint infection: new developments in diagnosis and treatment]. Dtsch Med Wochenschr. 2013; 138(31-32):1571-1573.
42. Winkler H. Bone grafting and one-stage revision of THR – biological reconstruction and effective antimicrobial treatment using antibiotic impregnated allograft bone. Hip Int. 2012; 22 Suppl 8:S62-68.
43. Zimmerli W, Trampuz A, Ochsner PE. Prosthetic-joint infections. N Engl J Med. 2004 ;351(16):1645-1654.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
По результатам 3641 операции эндопротезирования крупных суставов, проведенной у 3210 больных, изучены факторы риска развития гнойных осложнений после подобных операций. Эндопротезирование тазобедренного сустава проведено 2523 больным, коленного — 881, плечевого — 105 и локтевого — 132 пациентам. Операции ревизионного эндопротезирования тазобедренного и коленного сустава выполнены в 221 случае, по поводу диспластического коксартроза, врожденных и приобретенных деформаций, в условиях дефицита костной ткани и в других сложных случаях — в 492. В связи с острой травмой прооперирован 351 пациент. Перипротезная инфекция диагностирована в 58 случаях, что составило 1,59%. Установлено, что к критериям риска развития перипротезной инфекции относятся тяжелая сопутствующая патология (сахарный диабет, системные заболевания, степень их тяжести и продолжительность, ВИЧ-инфекция и др.), операции при диспластическом коксартрозе, ревизионное и сложное эндопротезирование тазобедренного сустава. В этих случаях риск осложнений возрастает в 1,5—3,5 раза. Гнойно-воспалительный процесс в области тазобедренного суста¬ва в анамнезе, а также каждая повторная операция на тазобедренном суставе увеличивают риск осложнений в послеоперационном периоде в разы. Различий в частоте осложнений в зависимости от вида фиксации и фирмы-производителя использованных имплантатов отмечено не было.
RISK FACTORS FOR PERIPROSTHETIC INFECTION AFTER LARGE JOINT ARTHROPLASTY
A.B. Slobodskoy, E.Yu. Osintsev, A.G. Lezhnev, I.V. Voronin, IS. Badak, A.G. Dunaev
Risk factors for the development of purulent complications after large joints arthroplasty were studied by the results of 3641 operations (3210 patients). Hip, knee, shoulder and elbow arthroplasty was performed in 2523, 881, 105 and 132 patients, respectively. Hip and knee revision replacements were performed in 221 cases and in 492 cases surgical interventions were performed for dysplastic coxarthrosis, congenital and acquired deformities, under conditions of bone tissue deficit and other complicated cases. Three hundred fifty one patients were operated on due to acute injury. Periprosthetic infection was diagnosed in 58 cases (1.59%). It was stated that risk factors for periprosthetic infection development included severe concomitant pathology (diabetes mellitus, operations somatic diseases, degree of their severity and duration, HIV infection and other conditions), surgical interventions for dysplastic coxarthrosis and complex total hip replacement. In those cases the risk of complications increased by 1.5-3.5 times. Proinflammatory process in the area of hip joint in history as well as every repeated surgery on the hip increased therisk of postoperative complications significantly. No differences in complication rate depending on the type of fixation and implant manufacturers were noted.
Рост числа операций эндопротезирования крупных суставов отмечается в большинстве стран мира, в том числе в России [1
4]. Несмотря на повышение качества применяемых имплантатов, совершенствование технологий эндопротезирования, а также накопление практического опыта у хирургов, процент осложнений и неудовлетворительных исходов остается достаточно высоким. Так, по данным ряда авторов, перипротезная инфекция (ППИ) как в раннем послеоперационном периоде, так и поздние сроки развивается в 1,5—6% случаев [5—8]. Доказано, что число этих же осложнений после предшествующих операций на суставе, после ревизионного эндопротезирования, а также целого ряда сопутствующих или перенесенных ранее заболеваний возрастает в разы [9
Изучить факторы риска развития гнойных осложнений после эндопротезирования крупных суставов, разработать возможные пути прогноза и профилактики.
На 3641 операцию диагностировано 58 случаев ППИ, что составило 1,59%. В 2 случаях это были ранние осложнения, в остальные — поздние (спустя 1 и более года после операции). С целью определения факторов, влияющих на риск развития ППИ, мы проанализировали следующие критерии: пол, возраст пациентов, индекс массы тела Кетле (ИМТ), наличие системных заболеваний, степень их активности и продолжительность, наличие сахарного диабета различного типа и тяжести, наличие сопутствующих специфических инфекций (ВИЧ, гепатит С и др.), наличие гнойных процессов в анамнезе, количество предшествующий операций на суставе, ревизий эндопротеза, продолжительность операции и объем интра- и пос, рационной кровопотери, вид использование темы для дренирования раны и реинфузии вид имплантата и способ фиксации, продолжительность температурной реакции в послеоперационном периоде, опыт хирурга (количество операций в год), сложность эндопротезирования (вмешательства при дисплазии, деформации, дефицитной ткани и др.), выполнялась ли операция воду острой травмы или в плановом порядк Статистическую обработку данных с использованием программ Microsoft Exce Statistica (StatSoft, Inc., 2007) методом вариной статистики для малых рядов наблюдена определения различий вычисляли доверите коэффициент t-критерий Стьюдента и определили величину р. Степень достоверности выной корреляционной связи при небольшой выборке (п
Герке против Баррака: снижает ли керамика риск перипротезной инфекции?
Герке: Мы говорим о перипротезных инфекциях суставов (PJI). Многие факторы риска, такие как продолжительность операции, возраст, пол и т.д. способствуют развитию перипротезной инфекции. И данный вопрос зависит от материала, из которого изготовлен имплантант.
В недавнем систематическом обзоре и мета-анализе о парах трения (Hexter, et al., BJJ, 2018) они не смогли найти каких-либо статистически значимых различий.
Если мы посмотрим на данные международного реестра — небольшой регистр из Словении в Европе показывает гораздо более низкий уровень заражения.
И если объединить много реестров, 10 реестров с более чем 1,1 миллионами пациентов, то сообщается о почти статистически значимой разнице между ними. В Новой Зеландии вы найдете то же самое.
Но в чем причина? Причиной может быть то, что материал не допускает образования биопленки на его поверхности (Peters, Dtsch Ärztebl, 1988).
Итак, что важно, если мы изучаем перипротезную инфекцию? Тип биоматериала может влиять на адгезию бактерий, например, шероховатость, pH, молекулярный состав, ионная сила. И мы также знаем из литературы, что были описаны определенные способы обработки поверхности, способствующие адгезии остеобластов или ингибирующие адгезию бактерий.
Доказано и опубликовано, что неблагоприятная реакция местной ткани создает среду для роста бактерий. Опубликованы данные, подтверждающие эту теорию, когда они культивировали S. epidermidis и S. aureus на разных поверхностях и пришли к выводу, что образование биопленки на керамических поверхностях намного ниже, чем на металлических поверхностях (Rimondini, ISTA, 2015).
Таким образом, реестры не очень значимо предполагают, что керамика связана с более низким риском инфекции при эндопротезировании тазобедренного сустава. Первые результаты in vitro и ex-vivo показывают более низкую бактериальную адгезию биопленки к керамическим несущим поверхностям.
Барак: Дело в том, что… мы действительно не согласны, потому что в заключительном слайде говорится, что керамика связана с более низким уровнем заболеваемости инфекцией. И они связаны с этим. Но, особенно с данными реестра, ассоциации легко показать; причинно-следственная связь не так проста.
Керамика не вызывает более низкого уровня заражения, она просто связана с более низким уровнем заражения. Я покажу вам опасность непонимания различий.
На Среднем Западе, на фермах каждое утро петухи и солнце встают, и поэтому они связаны. Но большинство из нас не думают, что петух контролирует восход солнца.
Таким образом, говорить, что они уменьшают PJI, неточно, потому что это подразумевает причинность. Там нет причинно-следственной связи, там просто связь.
Итак, что это за данные? Глядя на большие наборы реестра, легко найти ассоциации. Это похоже на цитирование Библии — вы можете найти любую ассоциацию, которую вы ищете, но ассоциации слабые. Когда у вас до 100 000 и ваш коэффициент опасности составляет всего 1,2-1,5, это действительно бессмысленно.
Фактически, эти небольшие различия легко объяснить различиями в популяции пациентов.
Шесть месяцев назад в AAHKS [Американская ассоциация хирургов тазобедренного и коленного сустава], используя данные из New Zealand Registry — того же реестра — Смит и соавторы сообщили, что специфические для пациента различия, такие как сопутствующие заболевания, были в 2-6 раз больше, чем коэффициент риска снижения инфекции при использовании керамики. Каждый известный фактор риска, скорее всего, будет присутствовать в популяции, где не использовалась керамика.
Еще одним серьезным недостатком данных является точность кодирования, особенно сложностей в реестрах. Большая обзорная статья из журнала AAOS показала, что кодирование осложнений отключено на 20% (Patel, et al., 2016). Десять лет назад на ежегодном собрании AAOS Фроимсон и др. показали, что кодирование инфекций было отключено примерно на 40% в клинике Кливленда по сравнению с тем, что хирург считал зараженным.
До недавнего времени большинство случаев трунионоза были закодированы как инфекции. Это может объяснить очевидную связь с более высоким уровнем заражения. Нет сомнений в том, что большинство из нас твердо убеждены в том, что с керамической головкой меньше конических повреждений. Так что это хорошая причина. Вот почему я использую керамические головки, как вы уже слышали. Но не для того, чтобы снизить уровень инфицирования, а только для того, чтобы снизить уровень трунионоза, который в большинстве случаев ошибочно диагностировался как инфекция (Kurtz et al., CORR, 2013).
Ассоциация регистров артропластики Северных стран также не показала различий в частоте ревизий, за исключением более высокой частоты ревизий переломов.
Другая большая проблема — смешанные переменные. Специальные процедуры, такие как керамика, как правило, предназначены для хирургов, которые имеют лучший подбор пациентов и имеют более низкий уровень инфекции. Неспособность контролировать эти смешанные переменные может привести к выводам, противоречащим литературе и даже здравому смыслу.
В заключение я считаю, что данные реестра неоценимы. Но это очень плохо, если он различает небольшие различия в хорошо работающих устройствах. Подавляющее большинство являются ассоциациями, и это ведет к злоупотреблениям.
Итак, Торстен, меня заинтересовали данные, которые вы представили, но для меня, возможно, пришло время сменить этот подгузник.
Берри: Торстен, ассоциации могут быть объяснены обоими факторами отбора, которые не контролируются должным образом, или неправильным диагнозом нескольких случаев конической коррозии для инфекций. Итак, возможно ли, что аргумент Роберта остается верным или вы собираетесь его оспаривать?
Герке: Вы абсолютно точны, а Роберт прав. У меня также есть своя критика относительно реестров, они иногда вводят в заблуждение. С другой стороны, какие объективные данные у нас есть, кроме реестров? Мы не можем действительно игнорировать реестры. Я знаю, есть много факторов. Мы
должны сделать многовариантный анализ и исключить все мешающие факторы, такие как ИМТ, сопутствующие заболевания и так далее. Нам нужны более надежные данные. И мы должны смотреть на свойства поверхности и формирование биопленки. Это было бы самым объективным.
Берри: Роберт, вы признаете, что существует риск возникновения конической коррозии, если вы не используете керамическую головку? Если вы используете кобальт-хромовую головку?
Барак: Абсолютно. Я годами использовал только керамику.
Берри: А если у вас имеется коническая коррозия, и если есть неблагоприятная реакция местной
ткани, то у этого пациента может быть повышенный риск заражения.
Барак: О, это было бы прекрасной темой для углубленного изучения. Я думаю, что в 90% случаев результаты будут ложноположительными.
Берри: Иногда вы видите, что есть ли культуры с наличием роста? Барак: Точно. Вы наблюдали подобное?
Берри: Да, у нас были такие случаи. Вопрос в том, случается ли это чаще, чем при любой другой ревизии?
Берри: Ваша точка зрения понятна. Способность приспосабливаться к смешанным переменным никогда не бывает хорошей. Торстен, данные выглядят так, как будто керамика, вероятно, немного более устойчива к образованию биопленки, чем металл. Но мы не можем сказать, что при замене тазобедренного сустава вы избавляетесь от металла. Там все еще есть металл, даже если вы используете керамическую головку и керамический вкладыш. Действительно ли избавление хотя бы от одной трети металла имеет значение?
Герке: Честно говоря, я не знаю. Но я думаю, что это может немного влиять на развитие PJI. Нам нужно больше исследований на этот счет.
Берри: Господа, спасибо вам большое за продуктивную дискуссию.
Читайте также:


