Папилломавирусная инфекция медицинские статьи
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
По официальной информации ВОЗ, ежегодно 357 млн человек в возрасте 15–49 лет заболевают 4 излечимыми инфекциями, передаваемыми половым путем (ИППП). Приоритетными и наиболее перспективными направлениями в снижении заболеваемости ИППП в мире до 2021 г. ВОЗ назвала борьбу с 3 инфекциями: Neisseria gonorrhoeae — для снижения и предупреждения растущего риска возникновения неизлечимых форм этого заболевания и риска коинфицирования другими ИППП; Treponema pallidum — для устранения врожденного сифилиса путем расширения скрининга и лечения всех беременных женщин и пациентов групп риска; ВПЧ — для предупреждения рак шейки матки и аногенитальных бородавок (АБ) с помощью вакцинации. Стратегия профилактики папилломавирусной инфекции (ПВИ) и АБ как одного из наиболее распространенных ее проявлений, включает в себя ряд мер, среди которых ключевой должна стать вакцинация против ВПЧ. Результаты программ вакцинации против ВПЧ во всем мире показали значимый вклад в снижение распространенности ПВИ. Это позволило медицинскому сообществу разных стран, в т. ч. России, рекомендовать вакцинацию против ВПЧ в качестве высокоэффективной меры по контролю за ПВИ и ее последствиями.
Ключевые слова: вирус папилломы человека, ВПЧ, аногенитальные бородавки, остроконечные кондиломы, профилактика ВПЧ, вакцинопрофилактика.
Для цитирования: Заславский Д.В., Баринова А.Н., Сыдиков А.А., Егорова Ю.С., Федорченко А.В., Оловянишников И.О. Стратегия профилактики папилломавирусной инфекции и ее проявлений в практике дерматовенеролога. РМЖ. Медицинское обозрение. 2019;12:20-24.
Treatment tactics for prevention of human papillomavirus infection and its manifestations in clinical practice of skin and STDs physician
D.V. Zaslavsky 1 , A.N. Barinova 2 , A.A. Sydikov 1,3 , Yu.S. Egorova 1,3 , A.V. Fedorchenko 3 , I.O. Olovyanishnikov 3
1 St. Petersburg State Pediatric Medical University
2 North-western State Medical University named after I.I. Mechnikov, Saint Petersburg
3 Leningrad Regional Center for Specialized Types of Medical Care, Saint Petersburg
According to official information by WHO, 357 million people aged 15–49 get 4 curable sexually transmitted disease (STDs) every year. Given the most promising areas for reducing the STDs incidence worldwide until 2021, WHO highlighted 3 infections: Neisseria gonorrhoeae — due to the developing risk of incurable disease forms and the risk of co-infection with other STDs; Treponema pallidum — elimination of congenital syphilis, which can become real due to the monitoring and treatment systems enhancement for all pregnant women and syphilis control in risk groups; human papillomavirus (HPV) — emphasizing vaccination to prevent cervical cancer (CC) and anogenital warts (AW). Treatment tactics for the prevention of human papillomavirus infection (PVI) and AW, as one of its most common symptoms, should include a series of actions, among which the vaccination a gainst HPV should be crucial. The results of HPV vaccination programs worldwide have shown a significant contribution to reducing the PVI prevalence. This allowed the medical international community, including the Russian, to recommend vaccination against HPV as a highly effective measure to control PVI and its consequences.
Keywords: human papillomavirus, HPV, anogenital warts, genital warts, HPV prevention, vaccination.
For citation: Zaslavsky D.V., Barinova A.N., Sydikov A.A. et al. Treatment tactics for prevention of human papillomavirus infection and its manifestations in clinical practice of skin and STDs physician. RMJ. Medical Review. 2019;12:20–24.
В статье рассматривается стратегия профилактики папилломавирусной инфекции, включающая в себя ряд мер, среди которых ключевую роль играет вакцинация против ВПЧ

Актуальность
Согласно официальной информации ВОЗ ежегодно 357 млн человек в возрасте 15–49 лет заболевают 4 излечимыми инфекциями, передаваемыми половым путем (ИППП): Chlamydia trachomatis (131 млн), Neisseria gonorrhoeae (78 млн), Treponema pallidum (6 млн) или Trichomonas vaginalis (142 млн). По оценкам ВОЗ, аналогичную высокую распространенность имеют ИППП вирусного происхождения: вирус простого герпеса 2 типа (ВПГ-2) (417 млн человек), вирус папилломы человека (ВПЧ) (291 млн женщин) [1]. Распространенность ИППП варьирует в зависимости от региона и пола. Эти эпидемии значимо влияют на здоровье и жизнь детей, подростков и взрослого населения во всех странах мира. ВПЧ служит причиной возникновения остроконечных кондилом, а некоторые подтипы ассоциируются с развитием рака шейки матки (РШМ) у женщин [2]. ВПЧ ежегодно приводит к 530 тыс. случаев цервикального рака и 264 тыс. случаев смерти, вызванных этим онкологическим заболеванием [1]. Заболеваемость россиян аногенитальными бородавками (АБ) в 2018 г. составила 18,8 случая на 100 тыс. населения. Однако данный показатель не отражает реального уровня заболеваемости из-за отсутствия всеобъемлющей регистрации новых случаев появления АБ [3, 4].
Приоритетными и наиболее перспективными направлениями для снижения заболеваемости ИППП во всем мире до 2021 г. ВОЗ назвала 3 инфекции:
N. gonorrhoeae — для снижения и предупреждения растущего риска возникновения неизлечимых форм этого заболевания, а также риска коинфицирования другими ИППП, включая C. trachomatis;
T. pallidum — для устранения врожденного сифилиса за счет расширения скрининга и лечения всех беременных женщин и борьбы с сифилисом в группах риска;
ВПЧ — для предупреждения РШМ и остроконечных кондилом, уделяя особое внимание вакцинации.
Максимальное внимание, по мнению экспертов ВОЗ, должно быть уделено особым группам населения, подверженным риску заражения ИППП. К этим группам ВОЗ относит людей с большим количеством сексуальных партнеров, таких как работники секс-индустрии и их клиенты, гомосексуалисты, больных ИППП или ВИЧ-инфекцей. Эти категории совпадают с ключевыми группами риска по ВИЧ-инфекции [5–8]. Кроме того, к особенно уязвимым к воздействию ИППП относятся следующие категории: молодые люди и подростки, женщины, мобильные группы населения, бездомные дети и молодые люди, заключенные, употребляющие наркотики, оказавшиеся в ситуации военных конфликтов и массовых беспорядков [9, 10].
Аногенитальные бородавки: определение и классификация
Аногенитальные венерические бородавки (А63.0) — заболевание, вызываемое ВПЧ и характеризующееся экзофитными и эндофитными разрастаниями на коже и слизистых оболочках наружных половых органов, уретры, влагалища, шейки матки, перианальной области. Как известно, ВПЧ относится к роду Papillomavirus семейства Papоvaviridae. ВПЧ является высокотканеспецифичным вирусом, поражающим клетки эпителия кожи и слизистых оболочек. В настоящее время обнаружено и описано более 190 типов ВПЧ. Наиболее важной представляется их классификация на группы высокого и низкого онкогенного риска — в зависимости от потенциала способствовать возникновению раковых заболеваний. Международное агентство по изучению рака (International Agency for Research on Cancer, IARC) выделяет 12 типов ВПЧ высокого онкогенного риска (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59), которые могут потенцировать развитие рака и предраковых поражений различной локализации: шейки матки, вульвы, влагалища, анального канала, пениса, шеи, гортани, ротовой полости. ВПЧ 34 типов из всех описанных на данный момент способны вызывать заболевания в аногенитальной области. АБ являются наиболее распространенным клиническим проявлением папилломавирусной инфекции (ПВИ). Обращает на себя внимание тот факт, что до 90% всех случаев АБ у мужчин и женщин ассоциировано с 6 и 11 типами ВПЧ. Среднее время между инфицированием ВПЧ и развитием АБ составляет 11–12 мес. у мужчин и 5–6 мес. у женщин.
Установлено, что наиболее подверженными ПВИ являются молодые люди, имеющие большое число половых партнеров. Инфицирование у взрослых лиц происходит при половых контактах, у детей отмечают следующие пути передачи: трансплацентарный (встречается редко), перинатальный, половой, контактно-бытовой (остается недостаточно изученным).
Клинические формы АБ:
бородавки в виде папул;
поражения в виде пятен;
бовеноидный папулез и болезнь Боуэна;
гигантская кондилома Бушке — Левенштейна.
Диагностика и лечение аногенитальных бородавок
В установлении диагноза АБ ведущую роль играют клинические проявления заболевания [11–16]. Дополнительно может быть выполнена проба с 5% раствором уксусной кислоты, который позволяет лучше визуализировать АБ за счет сохранения ими серовато-белой окраски и усиления сосудистого рисунка.
Остроконечные кондиломы выглядят как мелкие новообразования на неизмененном основании (тонкой нити или короткой ножке), телесного или красного цвета, при мацерации становящиеся снежно-белыми. АБ бывают плоскими или экзофитными, различного размера, реже встречаются бородавчатые, нитевидные или висячие формы (например, кондиломы в области полового члена).
АБ чаще всего образуются в местах, которые подвергаются травмированию при половых контактах: у мужчин — на уздечке, венечной борозде, головке и крайней плоти полового члена, реже — на стволе полового члена и мошонке, где нередко бывают множественными (рис. 1). Экзофитные кондиломы иногда поражают уретру (изолированно или в сочетании с экстрауретральными кондиломами). При поражении мочеиспускательного канала может возникать клиническая картина хронического уретрита, иногда сопровождающаяся кровоточивостью.

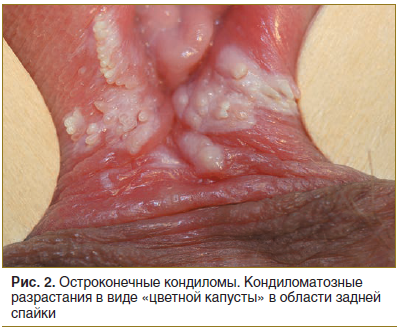
У женщин остроконечные кондиломы локализуются на наружных половых органах (рис. 2.), в мочеиспускательном канале, влагалище, на шейке матки, примерно в 20% случаев — вокруг анального отверстия и в области промежности. Нередко они локализуются только на губках уретры (внутренней ее стенке), что можно ошибочно принять за проявления хронического уретрита. В области сводов влагалищной части матки АБ возникают преимущественно у беременных женщин. Экзофитные кондиломы на шейке матки наблюдаются у 6% женщин с АБ, при этом они могут сочетаться с поражением вульвы [11, 12, 17].
Остроконечные кондиломы, находящиеся в области ануса и прямой кишки, вызваны преимущественно ВПЧ 6 типа и появляются при гениторектальных половых контактах. В 50% случаев у мужчин с остроконечными кондиломами в области ануса они также имеются на слизистой прямой кишки, особенно у гомосексуалистов.
При беременности, ВИЧ-инфекции, гемобластозах и приеме лекарств с иммуносупрессивным действием АБ могут достигать гигантских размеров. Это, в свою очередь, ведет к значительному разрушению подлежащих тканей. Они не малигнизируются, но могут затруднять роды, послужить причиной сепсиса и даже смерти пациентки.
Гигантские карциномоподобные кондиломы Бушке — Левенштейна представляют собой злокачественную опухоль и развиваются из длительно персистирующих остроконечных кондилом. Такие кондиломы преимущественно характерны для мужчин, типичная их локализация — на половом члене и около заднего прохода [3, 4, 11, 12, 18].
К признакам малигнизации остроконечных кондилом относятся: быстрое увеличение в размерах (периферический рост), уплотнение, появление кровянистых выделений и болезненности.
На основании множества клинических, цитологических и гистологических исследований доказано, что ВПЧ 16 и 18 типов могут вызывать дисплазии или интраэпидермальный РШМ. ВИЧ способствует реактивации и экспрессии ВПЧ, а при локализации АБ в области шейки матки или ануса — трансформации остроконечных кондилом в рак.
Верификация диагноза осуществляется с помощью лабораторных исследований: молекулярно-биологические методы — для идентификации генотипа ВПЧ, определения степени вирусной нагрузки и прогнозирования течения заболевания; цитологические и морфологические исследования — для исключения онкологической патологии.
В связи с применением в терапии АБ деструктивных методов дополнительно проводится серологическое исследование на сифилис, ВИЧ, гепатиты В и С. Женщинам, инфицированным ВИЧ, каждые 6–12 мес. необходимо проводить кольпоскопию, а мужчинам — ректоскопию для исключения видимых проявлений рака. Могут также использоваться тесты с применением гибридизации нуклеиновых кислот (дот-блот, Саузерн-блот, гибридизация in situ и полимеразная цепная реакция). Эти тесты специфичны для инфекции ВПЧ, они позволяют осуществить типирование ВПЧ и полезны при определении онкогенных типов вируса.
Дифференциальная диагностика АБ [3]:
Плоские или папулезные элементы сыпи:
гиперплазия сальных желез;
жемчужные папулы полового члена;
экстрамаммарная болезнь Педжета;
широкие кондиломы вторичного сифилиса.
Узловатые элементы сыпи:
Тактика лечения АБ направлена на деструкцию элементов и купирование клинических проявлений заболевания. Вне зависимости от применяемого метода деструкции АБ у 20–30% пациентов могут возникнуть новые поражения на коже и/или слизистых оболочках аногенитальной области [3, 4, 11].
Вакцинопрофилактика
Наиболее эффективной и безопасной мерой первичной профилактики АБ и рака аногенитальной области является вакцинация против ВПЧ. В России разрешены к применению 2 вакцины: двухвалентная, содержащая антигены ВПЧ 16 и 18 типов, и четырехвалентная, содержащая антигены ВПЧ 6, 11, 16 и 18 типов. Эти вакцины изготовлены с использованием рекомбинантной технологии и содержат очищенные капсидные белки L1, которые путем самосборки образуют ВПЧ-типоспецифические пустые оболочки или вирусоподобные частицы. Вакцинацию рекомендуется осуществлять до начала половой жизни. Двухвалентная вакцина используется для профилактики рака и предраковых поражений шейки матки, вульвы, влагалища у женщин в возрасте 9–45 лет. Четырехвалентная вакцина используется для профилактики рака и предраковых поражений шейки матки, вульвы, влагалища, рака анального канала и АБ у женщин, а также для профилактики рака анального канала и АБ у мужчин в возрасте 9–26 лет. Действие вакцины — исключительно профилактическое, без лечебного эффекта.
Рекомендуемый курс вакцинации состоит из 3 доз и проводится по схеме (0–2—6 мес.):
первая доза — в назначенный день;
вторая доза — через 2 мес. после первой;
третья доза — через 6 мес. после первой.
Допустима вакцинация по ускоренной схеме, при которой вторая доза вводится через 1 мес. после первой, а третья — через 3 мес. после второй. Курс вакцинации считается завершенным даже при нарушении интервала между введениями, если 3 прививки проведены в течение 1 года.
Альтернативная 2-дозовая схема вакцинации (0–6 мес.) допускается у лиц в возрасте 9–13 лет. При этом в случае введения второй дозы ранее, чем через 6 мес. после первой дозы, всегда необходимо вводить третью дозу.
Полный курс вакцинации приводит к образованию специфических антител к четырем типам ВПЧ — 6, 11, 16 и 18 — более чем у 98% вакцинируемых [19].
Исследования по эффективности четырехвалентной вакцины продемонстрировали, что среди лиц, не инфицированных ВПЧ, четырехвалентная вакцина обеспечивает почти 100% защиту от АБ, ассоциированных с ВПЧ 6 и 11 типов, и около 83% в отношении всех АБ [20].
С момента лицензирования в 2006 г. в Австралии, странах Северной Америки, Европы установлено снижение случаев АБ (до 90%), а также ВПЧ-инфекции, ассоциированной с 6, 11, 16, 18 типами (до 90%), цервикальных интраэпителиальных неоплазий легкой степени тяжести (до 45%) и гистологически подтвержденных цервикальных интраэпителиальных неоплазий высокой степени тяжести (до 85%) [16].
Распространенность ПВИ, ассоциированной с ВПЧ 16, 18 типов, в Австралии сократилась на 75–80% среди женщин младше 25 лет в вакцинальную эру в сравнении с довакцинальным периодом, что отмечается и в США среди когорты подростков (62–88%). Среди женщин 20–29 лет в США также отмечено выраженное снижение распространенности ПВИ, ассоциированной с ВПЧ 16 и 18 типов, на 26–56% [21].
В странах с охватом вакцинацией не менее 50% женской популяции показатель распространенности ВПЧ-инфекции, ассоциированной с 16 и 18 типами, в поствакцинальный период в сравнении с довакцинальным достоверно снизился на 68%, частота регистрации АБ достоверно уменьшилась на 61% в когорте девочек 13–19 лет. В указанной возрастной группе также было зарегистрировано достоверное снижение частоты выявления ВПЧ 31, 33 и 45 типов, что указывает на наличие перекрестной защиты. На наличие эффекта популяционного иммунитета указывает и достоверное снижение количества случаев АБ в когортах мальчиков моложе 20 лет и женщин 20–39 лет.
В странах с охватом вакцинацией менее 50% женской популяции достоверное снижение показателя ВПЧ-инфекции, ассоциированной с 16 и 18 типами, и АБ установлено в когорте девочек моложе 20 лет, при этом не отмечается формирование эффекта популяционного иммунитета или перекрестной защиты [22].
В России к 2017 г. было реализовано более 30 региональных программ вакцинации против ВПЧ. Пилотные программы были реализованы в Московской области, Санкт-Петербурге, Ханты-Мансийском автономном округе (ХМАО), Якутске, Новосибирске, Смоленской области и других регионах [23–25].
В Московской области по результатам региональной программы (2008–2015 гг.) зарегистрировано снижение заболеваемости АБ у девочек в 3 раза [26]. Региональная программа вакцинации девочек-подростков против ВПЧ в ХМАО (г. Сургут) стартовала в 2009 г. в виде двух вакцинальных кампаний: в 2008–2009 гг. и в 2014 г. (вакцинировано 4936 человек). Анализ заболеваемости ВПЧ-ассоциированными заболеваниями в ХМАО показал, что в 2013–2014 гг. снизилась частота выявляемости АБ у девочек-подростков как по результатам профилактических осмотров, так и по обращаемости в кабинеты детских гинекологов. Именно в этот период в 4-ю возрастную категорию 15–17 лет вступили девочки, привитые от ВПЧ в 2008–2009 гг. [26].
Заключение
Стратегия профилактики ПВИ и АБ как одного из наиболее распространенных ее проявлений включает в себя ряд мер, среди которых ключевой должна стать вакцинация против ВПЧ как возбудителя аногенитальных кондилом. Результаты программ вакцинации против ВПЧ во всем мире уже показали значимый вклад в снижение распространенности ПВИ и таких ее проявлений, как АБ и другие ВПЧ-ассоциированные заболевания у мужчин и женщин. Это позволило медицинскому сообществу разных стран, в т. ч. России, рекомендовать вакцинацию против ВПЧ в качестве высокоэффективной меры по контролю за ПВИ и ее последствиями.
Только для зарегистрированных пользователей
Статья посвящена проблемам заболеваемости папилломавирусной инфекцией человека среди сексуально активных девушек-студенток, ее своевременной ранней диагностики и профилактики. Определение экспрессии онкобелка E7 в комплексе с другими методами позволяет определять потенциальный риск возникновения неопластического процесса шейки матки, диагностировать на ранних этапах инфицированность вирусом папилломы человека и формировать группы диспансерного наблюдения.
Ключевые слова: папилломавирусная инфекция, девушки-подростки, диагностика, онкобелок, шейка матки
РШМ является первой злокачественной опухолью, в отношении которой установлена вирусная этиология. Имеется огромное количество эпидемиологических и молекулярно-биологических данных, свидетельствующих о том, что вирус папилломы человека (ВПЧ), передающийся половым путем, является основной причиной возникновения дисплазии и РШМ [2, С помощью метода гибридизации было показано наличие ДНК ВПЧ в злокачественных опухолей шейки матки [3, 6]. Вирусы имеют специфические гены — белки (Е6 и Е7), которые играют ключевую роль в трансформации нормальной клетки в злокачественную. Активность этих генов контролируется вирусными и клеточными факторами. Для возникновения моноклональной популяции и селекции клона с неконтролируемой пролиферацией необходима мутация клетки
Актуальность изучения репродуктивного здоровья девушек-студенток как будущих матерей связана, прежде всего, с неблагоприятной медико-демографической ситуацией как в России, так и в Новосибирской области.
Рост населения в области прекратился в 1992 году и, начиная с 1993 года, число жителей области стало сокращаться. При этом практически до конца годов шло чередование незначительного прироста или снижения численности населения области. В 1999 году область перешла в режим депопуляции на 12 тысяч человек ежегодно.
По данным Министерства здравоохранения Новосибирской области, в 2009 году показатель рождаемости составил 13 % на тысячу населения, показатель смертности — 14,1 %. Таким образом медико-демографическая ситуация в Новосибирской области характеризуется низкими показателями рождаемости, повышением общей смертности и начавшейся с 1992 года депопуляцией. Кроме того серьёзную тревогу вызывает репродуктивное здоровье современных девочек и девушек-подростков: ухудшились показатели физического и полового развития, повысилась распространённость гинекологических заболеваний, усложнилась их структура. Решить медицинскую проблему сохранения репродуктивного здоровья женского населения — значит осуществить принцип сохранения репродуктивного здоровья каждой девочки, начиная с рождения [2].
Таким образом, широкая распространенность урогенитальной папилломавирусной инфекции, ее этиологическая значимость в развитии неоплазии, проблема ранней своевременной диагностики, отсутствие эффективных организационных технологий по раннему выявлению и тактике ведения больных, немногочисленные сведения в России и за рубежом о ВПЧ поражениях шейки матки у сексуально активных девушек-студенток определили актуальность, цель и задачи нашего исследования.
Цель исследования. Научное обоснование и разработка критериев ранней диагностики урогенитальной папилломавирусной инфекции на основе эпидемиологических, клинических и лабораторных исследований для оптимизации профилактики и диспансерного наблюдения сексуально активных девушек-студенток с ВПЧ-поражениями шейки матки .
Согласно протоколу, критериями включения для всех групп явилялось: возраст студенток от 16 до 22 лет, добровольное осведомленное согласие студенток на участие, наличие клинических симптомов, подтвержденных результатами микроскопического и микробиологического исследований. Критерии исключения: беременность и лактация.
Клиническое исследование проводилось на базе врачебного здравпункта НГМУ во время профилактического осмотра студенток первых курсов всех факультетов в Всего было обследовано 1288 студенток, из них — 531 (41,2 %) студентка живет половой жизнью, 757 (58,8 %) — не живёт половой жизнью (VIRGO). Проведено комплексное обследование студенток, живущих половой жизнью, и выделены среди них 2 группы: группа 194 (26,5 %) здоровые — не имеющие визуальных изменений эпителия шейки матки и группа 337 (63,5 %) — с фоновыми заболеваниями шейки матки (эктопии, цервициты, кисты, полипы цервикального канала и шейки матки). Все девушки сопоставимы по возрасту (19 ± 2,5 года). Первичные данные были рандомизированы.
Статистическую обработку полученных результатов проводили с помощью пакета прикладных программ SPSS 11,5 с использованием методов описательной статистики.
Результаты и обсуждение. Начало половой жизни в лет отмечали 403 студентки (75,9 %), 128 (24,1 %) девушек указали возраст начала половой жизни Из методов контрацепции большая часть девушек предпочитает барьерный способ 447 (84,2 %), комбинированные оральные контрацептивы применяют 42 (7,9 %) девушки, не используют методы контрацепции или выбирают малоэффективные традиционные методы 45 (8,5 %). У 43 (8,1 %) девушек в анамнезе искусственное прерывание беременности.
Анализ структуры гинекологической заболеваемости показал: наиболее распространенной патологией у девушек являются заболевания шейки матки — эктопия шейки матки, которая обнаружена у 337 (63,5 %) обследованных, нарушения овариально-менструального цикла выявлены у 90 (16,9 %) девушек. Реже встречаются такие заболевания, как фиброзно-кистозная мастопатия 19 (3,6 %), мультифолликулярные яичники 12 (1,3 %), ретенционные образования яичников 14 (2,6 %).
Результаты обследования на носительство ВПЧ-инфекции в группе: ВПЧ 16 обнаружен у 39 (20,1 %) студенток, Е7 белок — у 1 (2,6%); ВПЧ 18 — у 11 (5,7) студенток, Е7 белок не обнаружен; одновременно ВПЧ 16 и 18 — у 3 (1,5 %), Е7 белок не обнаружен. Во группе: ВПЧ 16 обнаружен у 154 (45,7 %), Е7 белок — у 6 (3,9%) студенток; ВПЧ 18 — у 37 (11 %), Е7 белок не обнаружен; одновременно ВПЧ 16 и 18 — у 36 (10,6 %), Е7 — у 5 (13,9 %) студенток. Таким образом у 227 (67,4 %) девушек носительство ВПЧ-инфекции сочетается с фоновой патологией шейки матки, по сравнению с девушками, которые имеют здоровую шейку 53 (27,3 %), а также частота Е7 онкогенного белка превалирует при носительстве одновременно ВПЧ 16 и 18, что вызывает значительную онкологическую настороженность.
Среди триггерных факторов папилломавирусной инфекции: ранее начало половой жизни лет указали 96 (42,3 %) девушек, беспорядочная половая связь — 94 (41,4 %) студентки имели двух партнеров и 133 (58,6 %) больше двух.
Среди факторов, способствующих инфицированию ВПЧ и прогрессированию инфекционного процесса, ряд авторов выделяет курение [1]. Производные никотина и другие производные дыма (3—4-бензпирен, антрацен) были обнаружены в цервикальной слизи курильщиков. Под действием этих веществ в шейке матки уменьшается число клеток Лангерганса, являющихся важнейшей частью Т-лимфоцитарного звена клеточно-опосредованного иммунитета, противостоящего внедрению онкогенных факторов, в частности — ВПЧ. Из числа обследованных 211 (39,7 %) девушек указали на наличие вредных привычек, в частности курение.
Выводы. Полученные данные подтверждают высокий уровень ВПЧ у студенток с патологией шейки матки, что свидетельствует о необходимости проведения скрининговых исследований методом ПЦР на ВПЧ 16 и 18 типов, высокого канцерогенного риска на профилактических осмотрах и разработке алгоритма диспансерного ведения сексуально активных девушек-студенток с поражениями шейки матки. Генодиагностика папилломавирусной инфекции позволяет быстро, с высокой чувствительностью и специфичностью выявлять этиологический фактор возможной патологии, определять группы риска по онкозаболеваниям урогенитального тракта у сексуально-активных студенток. Определение экспрессии онкогена Е7 при ВПЧ 16 и 18 типов по уровню онкобелка Е7 является новым подходом в диагностике папилломавирусной инфекции, повышенная экспрессия онкогена Е7 при ВПЧ 16 и 18 могут использоваться в качестве прогностических онкомаркеров.
Список литературы
- Башмакова М. А. Папилломавирусная инфекция : пособие для врачей / М. А. Башмакова, А. М. Савичева. — М. : Медицина, 2003. — С.
- Евстигнеева Н. П. Папилломавирусная инфекция урогенитального тракта женщин: эпидемиология, факторы персистенции, оптимизация ранней диагностики и профилактики онкогенеза : автореф. дис. . д-ра мед. наук : шифр спец. 14.00.11 / Н. П. Евстигнеева ; РУДН. — М., 2007. — 42 с.
- Куевда Д. А. Высокая вирусная нагрузка и интеграция ВПЧ в геном человека как молекулярные маркеры диспластических изменений шейки матки / Д. А. Куевда [и др.] // Генодиагностика инфекционных болезней — 2007 : сб. трудов Всероссийской науч.-практич. конф. — М., 2007. — № 3. — С.
- Куевда Д. А. ВПЧ-тестирование: алгоритмы диагностики и требования к молекулярным тестам для выявления вирусов папилломы человека / Д. А. Куевда, О. Ю. Шипулина // Генодиагностика инфекционных болезней — 2007 : сб. трудов Всероссийской науч.-практич. конф. — М., 2007. — № 3. — С.
- Молчанов Д. А. Вирус папилломы человека и рак шейки матки : уникальная взаимосвязь и вызов современной медицине / Д. А. Молчанов // Здоровье Украины. — 2007. — № 1. — С. 3.
- Прилепская B. H. Профилактика рака шейки матки методы ранней диагностики и новые скрининговые технологии / В. Н. Прилепская // Гинекология. — 2007. — № 9 (1). — С.
- Роговская С. И. Вакцины против вируса папилломы человека : новые возможности профилактики цервикального рака (В помощь практикующему врачу) / С. И. Роговская // Гинекология. — 2007. — № 9 (1). — С.
- Munoz N. Epidemiologic classification of human papillomavirus types associated with cervical cancer / N. Munoz [et al.] // N. Engl. J. Med. — 2003. — Vol. 348. — Р.
- World Health Organization (WHO). Comprehensive cervical cancer control. A guide to essential practice. — Geneva WHO, 2006. — 120 s.
Государственная лицензия ФГБОУ ВО НГМУ Минздрава России
на образовательную деятельность:
серия ААА № 001052 (регистрационный № 1029) от 29 марта 2011 года,
выдана Федеральной службой по надзору в сфере образования и науки бессрочно
Свидетельство о государственной аккредитации ФГБОУ ВО НГМУ Минздрава России:
серия 90А01 № 0000997 (регистрационный № 935) от 31 марта 2014 года
выдано Федеральной службой по надзору в сфере образования и науки
на срок по 31 марта 2020 года
Адрес редакции: 630091, г. Новосибирск, Красный проспект, д. 52
тел./факс: (383) 229-10-82, адрес электронной почты: mos@ngmu.ru
Средство массовой информации зарегистрировано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) —
Свидетельство о регистрации СМИ: ПИ № ФС77-72398 от 28.02.2018.
 |
|
08.02.2016 11.01.2016 28.12.2015 Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|

