Ответ острой фазы при острой инфекции

ОТВЕТ ОСТРОЙ ФАЗЫ (ООФ).
Недомогание: депрессия, сонливость, безразличие, снижение интереса к окружающему, потеря аппетита, ↓ полового влечения, боли в мышцах, суставах, костях, головные боли, адинамия, мышечная слабость, похудание, снижение трудоспособности.
Защита организма: лейкоцитоз, лихорадочная реакция, отрицательный азотистый баланс (распад белка), снижение альбуминов, понижение А/Г коэффициентов крови, усиленный синтез глобулинов, ускорение СОЭ, появление белков ответа острой фазы, активация иммунной системы, стимуляция защитного стресса, стимуляция функций других органов и систем.
(Синтезируются в печени, макрофагах, тучных клетках, нейтрофилах и др.)
Выполняют три задачи :
1. Оказывают антимикробное действие: С – реактивный белок, факторы комплемента; гаптоглобин, лактоферин, трансферин.
2. Уменьшают повреждение тканей: церулоплазмин, гаптоглобин, лактоферин, ↓ трансферин.
3. Регулируют гомеостаз и антигомеостаз (факторы коагуляции и антикоагуляции)
ЭТИОЛОГИЯ - бактериальные, вирусные, грибковые заболевания, острые и хронические заболевания воспалительно-инфекционной и неинфекционной природы; при ожогах, травмах, ишемических повреждениях органов, тканей, при опухолевых заболеваниях и многих других.
1. Наличие местного повреждения,
2. Более или менее выраженные нарушения гомеостаза.
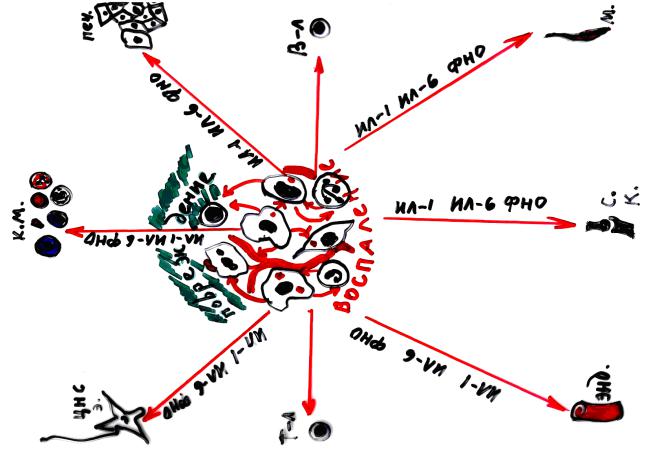
Ответ острой фазы - это развитие целого ряда системных реакций организма, возникающих в ответ на выделение цитокинов из клеток места повреждения, опосредующих свои эффекты через кровь и рецепторы клеток организма, посредниками которых внутри этих клеток чаще всего бывают производные арахидоновой кислоты.
1. Образуется в макрофагах, лейкоцитах, NK-клетках, дендритных клетках кожи, в клетках глии, нейронах, опухолевых клетках.
2. Продукция стимулируется инфекционными и неинфекционными факторами.
3. Как медиатор острого воспаления способствует выходу нейтрофилов в участок воспаления.
4. Как медиатор ответа острой фазы (ООФ) активирует Т - и В-клетки иммунитета → ↑ AT.
5. Как медиатор ответа острой фазы (ООФ) активирует стволовые клетки КМ: ↑НФ, ↑ тромбоциты.
6. Как медиатор ответа острой фазы (ООФ) активирует - гипоталамус-гипофиз-надпочечники: ↑ АКТТ + ↑ вазопрессин + ↑ кортикостероиды → распад белка; ↓ соматолиберин → ↓ СТГ, ↑ соматостатин (↓ избыточная активация образования АТ!); ↓ секреция гонадотропина → ↓ секреция половых стероидных гормонов, ↓ секреция пролактина.
7. Как медиатор ответа острой фазы (ООФ) влияет на ЦНС: сонливость, депрессия, снижение интереса к окружающему → ↓ аппетита, ↓ полового влечения, адинамия; лихорадка - ↑ t° тела.
8. Как медиатор ответа острой фазы (ООФ) влияет на другие органы (производные соединительной ткани): через О¯2 → ↑ ПОЛ → ↑ АЛФ → боль в мышцах (протеаз), боль в суставах (↑ коллагеназ), ↑ активность остеокластов, разрушающих кость, ↑ активность плазминогена → плазмин → распад белка → ↑ аминокислот (защ. акт + ресурсы).
ПРИ ИЗБЫТКЕ ИЛ-1:
1. Септический шок (↓ АД, лихорадка, лейкоцитоз).
2. Острый респираторный дистресс - синдром взрослых (массивная инфильтрация сосудов и лёгких нейтрофилами).
2. Главные стимуляторы образования ИЛ-6-инфекционногопроисхождения (вирусы, бактерии, липополисахариды, бактериальные пептиды, эндотоксины, грибки).
3. Как медиатор острого воспаления прекращает выход нейтрофилов (апоптоз), способствует выходу моноцитов в участок воспаления; способствует пролиферации через ФРФ моноцитов, лимфоцитов, макрофагов, тромбоцитов. Играет поэтому большую роль в, хроническом (пролиферативном)
4. Как медиатор ответа острой фазы (ООФ) активирует иммунитет: (Т - и В-клетки иммунитета, ↑ продукцию ИЛ-2 зрелыми Т-лимфоцитами).
5. Как медиатор ответа острой фазы (ООФ) - на КМ: ↑ НФ, позднее: ↑ МОН, ↑ тромбоциты, ↑ эритроциты.
6. Как медиатор ответа острой фазы (ООФ) влияет на эндокринную систему: активирует гитоталамо- гипофизарно-надпочечниковую ось стресса (КРГ, АКТГ, гормоны надпочечников → распад белка!).
7. Как медиатор ответа острой фазы (ООФ) влияет на ЦНС: → ↑ t тела, но менее пирогенен, чем ИЛ-1: слабая лихорадка.
8. Особые функции ИЛ-6-главный стимулятор синтеза белков ООФ печеночными клетками и макрофагами (комплемент).
ПРИ ИЗБЫТКЕ ИЛ-6:
1. Прогрессия аутоиммунного ответа;
2. Возможно обострение ревматоидного артрита;
3. Аутоиммунная активация остеокластов (остеопороз).
(фактор некроза опухолей - α)
2. Стимуляторами продукции являются инфекционный фактор (бактерии, вирусы, их токсины, грибки, паразиты), АГ + АТ, С3а, C5а, цитотоксины.
3. Как медиатор острого воспаления активирует все клетки в участке воспаления: эндотелий, лейкоциты, ↑ их адгезию, эмиграцию, фагоцитоз, ↑ О-2, усиливает выход хемоаттрактантов ИЛ-1, ИЛ-8, ИЛ-6, НФН γ, стимулирует пролиферацию фибробластов, ангиогенез. Особая роль в развитии первичного хронического воспаления!
4. Как медиатор ООФ активирует иммунитет, ↑ рост NK-клеток, их цитотоксичность (к опухолевым клеткам).
5. Как медиатор ООФ активирует оси стресса: катехоламиновую (катехоламины, глюкагон), гипоталамо- гипофизарно-надпочечниковую (АКТТ → кортизол).
6. Как медиатор ООФ действует на ЦНС: на гипоталамус (лихорадка, ↑ активность центра голода, ↓ активность центра сытости → снижение аппетита → похудание (кахексии).
7. Как медиатор ООФ - прямое действие на жировую ткань (ингибиция липогенных ферментов) → исчезновение жировой ткани не зависимо от аппетита (кахексии).
8. Как медиатор ООФ оказывает цитотоксическое действие на клетки органов и тканей: ↑ О¯2 → активация протеолиза, ↑ NO¯ в эндотелии сосудов, апоптоз клеток, выработка в АПУД-клетках сердца миокардиального депрессорного полипептида → ↓ УО, ↓ МО сердца; боли в мышцах, суставах, костях; токсичен в больших дозах для ЖКТ, почек, печени, эндотелия сосудов, нейронов.
9. Как медиатор ООФ обладает особым действием – тормозит экспрессию противошоковых агентов - эндогенных опиатов.
10. Как медиатор ООФ замедляет рост опухолей in vivo (геморрагический некроз), цитотоксичен для многих опухолей in vitro.
При избытке ФНО - α:
1. Септический шок (↓ АД, ↓ эндогенные опиаты, ↑ проницаемость капилляров, отек, гиповолемия).
2. ДВС - синдром (↓ снижение антикоагулянтных свойств эндотелия, ↑ свертываемость крови).
3. Острый респираторный дистресс – синдром взрослых.
4. Некроз эпителия ЖКТ, почечных канальцев, печени, (↑ О¯2, апоптоз).
5. Раковая кахексия, кахексия при раневом истощении, при хронических воспалительных процессах.
Ответ острой фазы, его проявления.
Ответ острой фазы – общая реакция организма на воспаление, сопровождающаяся увеличением его резистентности к инфекциям.
Проявления острой фазы
Лихорадка (антибактериальный эффект).
Активация фагоцитоза и иммунитета (выработка цитокинов).
Диспротеинемия: увеличение концентрации α1- и α2-глобулинов (при остром воспалении) и -глобулинов (при хроническом воспалении), гипоальбуминемия, отрицательный азотистый баланс, увеличение синтеза белков острой фазы, фибриногена, прокоагулянтов и плазминогена.
Увеличение синтеза АКТГ и кортизола (неспецифическая резистентность).
Нейтрофилия (с активацией фагоцитоза), лейкоцитоз со сдвигом влево.
Гиперлипидемия (за счет выброса адреналина и его действия на β-адренорецепторы жировой ткани с последующим липолизом).
Увеличение концентрации K + (повреждение клеток).
Белки острой фазы
С-реактивный белок (самый известный), является опсонином.
Сывороточный амилоид (маркер номер 1).
Транспортные белки (церуллоплазмин, гаптоглобин, орозомукоид).
Антиферменты (α1-антитрипсин и α1-антихимотрипсин, α2-макроглобулин).
Фибриноген и плазминоген.
Компоненты системы комплемента.
Противовоспалительный эффект оказывают: α1-антитрипсин, α1-антихимотрипсин, церулоплазмин, кортизол.
Основные медиаторы
Интерлейкин 1 (ИЛ1), интерлейкин 6 (ИЛ6), фактор некроза опухолей (ФНО) – эндогенные пирогены, стимулирующие синтез белков острой фазы. ФНО стимулирует синтез ИЛ1, ИЛ6, а ИЛ1 – ФНО и ИЛ6.
Значение температурного гомеостаза для организма. Основы физиологии терморегуляции (механизмы теплоотдачи, термогенеза, роль соматической и вегетативной нервной системы, гормонов).
Температура тела является побочным продуктом всех биохимических процессов метаболизма первичных субстратов и макроэргических соединений (АТФ). Все процессы распада биологических субстратов приводят к выделению тепла. От температуры зависит изменение проницаемости клеточных мембран, возбудимости нервных и мышечных тканей.
Постоянная температура тела может быть тогда, когда существует равенство между процессами теплопродукции и теплоотдачи.
Образование тепла (теплопродукция) при химических процессах называется химической терморегуляцией.
Метаболизм (энергетический обмен) в тканях.
Окислительные процессы (жирные кислоты) в бурой жировой ткани (скорость больше в 20 раз по сравнению с белой жировой тканью, активизируются при возбуждении -адренорецепторов бурой жировой ткани ).
Сократительный термогенез представляет собой термозависимое изменение тонуса и позы, а также мышечную дрожь.
Разобщение окислительного фосфорилирования (мощный разобщитель – тироксин).
Регуляция теплоотдачи - это физическая терморегуляция. Теплоотдача происходит главным образов за счет радиации (45-55% тепла при температуре комфорта), 15-30% тепла выводится конвекцией (нагреванием окружающего тело воздуха), испарение (пот с поверхности тела) и до 5% составляет кондукция или теплопроводность.
Процессы теплоотдачи во многом определяются действием сердечно-сосудистой системы, потому что она способна к перемещению потоков крови от глубоких тканей к поверхностным.
Рецепторы терморегуляции расположены в организме фактически везде, но они могут иметь перепад температуры до 30 градусов. Периферические рецепторы оценивают разнообразную информацию о температуре, причем холодовых, то есть активирующихся при понижении температуры рецепторов больше. Интерорецепторы также оценивают неодинаковые параметры в зависимости от функциональной активности органов. Центральные терморецепторы оценивают неодинаковую температуру, которая может меняться в пределах 1-2 градуса.
Информация о состоянии терморегуляции анализируется в гипоталамусе, где суммируются все термические сигналы. Передняя часть центра терморегуляции отвечает за теплоотдачу, задняя - за теплопродукцию, т.е. химическую терморегуляцию.
Белки острой фазы – это эволюционно консервативное семейство белков, продуцируемых, в основном, в печени в ответ на травму и инфекции.
Ответ острой фазы – это способность организма успешно реагировать на травму и инфекцию, это общие неспецифические реакции на повреждение.
Рост концентрации в плазме белков острой фазы имеет целью помочь иммунной защите, способствуя распознаванию вторгшихся микробов, мобилизации лейкоцитов из циркуляции и повышению скорости артериального кровотока в месте поражения ткани и ее инфицирования. Эти действия способствуют локальному накоплению эффекторных молекул и лейкоцитов в участке воспаления. В сущности, белки острой фазы усиливают местное воспаление и антимикробную защиту. Одновременно белки острой фазы предотвращают воспаление в окружающих тканях путем нейтрализации молекул воспаления, индуцировавших воспаление и поступающих в кровоток. Белки острой фазы предотвращают активацию клеток эндотелия и лейкоцитов в циркуляции. Особенно важную роль белки острой фазы играют в создании иммунной защиты. О важной роли белков острой фазы свидетельствует их короткий период полужизни и широкие функциональные возможности в воспалении, заживлении, адаптации к болевым раздражителям.
Белки острой фазы осуществляют различные функции, способствующие сохранению гемостаза:
- обеспечивают развитие воспаления;
- нейтрализуют свободные радикалы;
- разрушают потенциально опасные для тканей белки.
Комплекс функциональных особенностей белков острой фазы позволяют относить их к медиаторам и ингибиторам воспаления:
- классические компоненты комплемента (С3, С4), многие из которых являются белками острой фазы, играют центральную противовоспалительную роль в иммунитете;
- активация комплемента приводит к хемотаксису клеток воспаления в очаг локализации инфекции, опсонизации инфекционных агентов, изменению проницаемости сосудов и экссудации белков в место воспаления;
- другие белки острой фазы (фибриноген, плазминоген, тканевый активатор плазминогена, урокиназы и ингибитора активатора плазминогена-1) играют активную роль в восстановлении и ремоделировании ткани, проявляют противовоспалительное действие.
- белки острой фазы принимают непосредственное участие во врожденном иммунитете против патогенов;
- повышение уровня СРБ - прогностически неблагоприятный тест при ишемии – СРБ активирует систему комплемента. Повышенный уровень СРБ связан с увеличением риска атеросклероза у человека.
Изменение со временем концентрации белков острой фазы в плазме после повреждения(травмы, ожоги, хирургические вмешательства):
- СРБ повышается с первого дня, через 6-8 часов, пик – 3-й день, потом падает к норме к 6-7 дню. Принадлежит к числу главных белков врожденной иммунной системы, способных распознавать чужеродные антигены. Активирует комплемент, способствуя лизису бактерий и развитию воспаления. Усиливает цитотоксическое действие макрофагов на клетки опухоли и стимулирует высвобождение цитокинов.
- Гаптоглобин, фибриноген. Максимум повышения - к 4-му дню, постепенно падает, норма - к 14-му дню. Фибриноген – белок свертывающей системы крови, он создает матрикс для заживления ран, обладает противовоспалительной активностью, препятствует развитию отека. Гаптоглобин связывает гемоглобин, а образующийся при этом комплекс действует как пероксидаза (фермент, способствующий окислению различных органических веществ перекисями), ограничивает утилизацию кислорода патогенными бактериями.
- С3, С4, церулоплазмин повышается к 5-му дню, постепенно падает, норма - к 14-му дню. Церулоплазмин – протектор клеточных мембран, нейтрализующих активность супероксидного и других радикалов, образующихся при воспалении.
- Трансферрин, апоА-липопротеин падает максимально к 5-му дню, потом постепенное повышение, норма - к 14-му дню. Трансферрин – белок, обеспечивающий транспорт железа по крови. При ООФ его содержание снижается, что приводит к гипосидеремии. Антиферменты – сывороточные белки, которые ингибируют протеолитические ферменты, попадающие в кровь из мест воспаления. К ним принадлежат а-антитрипсин, который подавляет действие трипсина, коллагеназы, эластазы, урокиназы, хемотрипсина, плазмина, тромбина, ренина, лейкоцитарных протеаз. Недостаточность а-антитрипсина приводит к разрушению тканей ферментами лейкоцитов в очаге воспаления.
Уровень белков острой фазы определяется, прежде всего, синтезом и секрецией их печенью.
Синтез белков острой фазы регулируется воспалительными цитокинами (интерлейкин-6, интерлейкин-1 и фактор некроза опухоли).
- Интерлейкин-1 продуцирует моноциты, макрофаги, эндотелиоциты, нейтрофилы, В-лимфоциты, натуральные киллеры, фибробласты, дендритные клетки кожи, мезенгиальные клетки почек, клетки глии, нейроны.
Синтез м.б. вызван различными факторами:
- микроорганизмами и продуктами их жизнедеятельности;
- антигенами немикробного происхождения;
- органическими и неорганическими соединениями неантигенной природы (соли кремния, желчных кислот, мочевой кислоты, активные компоненты комплемента, нейрогормоны, ионизирующее излучение, перегревание и др.).
Интерлейкин-1 опосредует различные защитные процессы в организме, активируемые при его повреждении, стимулирует иммунную систему (активирует Т-клетки, обладает выраженным действием на центральную нервную систему).
- Интерлейкин-6 секретируется Т-клетками, вызывает конечную дифференцировку В-клеток в плазматические, продуцирующие антитела. Синтезируется макрофагами, фибробластами, моноцитами, Т-клетками, кератоцитами кожи, клетками эндокринных желез, глиальными элементами и нейронами отдельных областей мозга.
Главными стимуляторами являются вирусы, бактерии, эндотоксины, липополисахариды, грибы. Опухолевые клетки, в отличие от нормальных, продуцируют интерлейкин-6 постоянно в отсутствии внешней стимуляции.
- Фактор некроза опухолей обладает мощным противовоспалительным действием, активирует лейкоциты, экспрессирует молекулы адгезии на мембранах эндотелиоцитов, способствует миграции лейкоцитов в межклеточный матрикс, стимулирует продукцию активных метаболитов кислорода, секрецию противовоспалительных цитокинов клетками воспалительной ткани. Способен убивать опухолевые клетки и вызывать геморрагический некроз опухолевого трансплантанта. Ответственен за развитие кахексии при тяжелых хронических заболеваниях.
Врач лабораторной диагностики ЦДЛ
Новополоцкой городской больницы
Л.И.Быкова
Приемная главного врача
(+375 214) 50-62-70
(+375 214) 50-62-11 (факс)
Канцелярия
(+375 214) 50-15-39 (факс)
Цены на Белки "острой" фазы и маркеры воспаления
- Исследование уровня C-реактивного белка в сыворотке крови 450 руб.
- Определение прокальцитонина в крови (количественный метод) 1660 руб.
Белки острой фазы и маркеры воспаления необходимы для мониторинга течения заболеваний и контроля лечения. К ним относятся:
С-реактивный белок повышается сразу после возникновения заболевания (в первые 6-12 часов, максимум – на 2-е сутки); при наличии воспалительного процесса увеличивается в десятки и сотни раз, что делает тест очень чувствительным. Показатель этого белка позволяет определить вирусную и бактериальную инфекцию по степени концентрации. При эффективном лечении уровень белка быстро снижается уже на 2-е сутки, что позволяет контролировать течение болезни.
Антистрептолизин-О (АСЛО) - маркер острой стрептококковой инфекции. Антитела к АСЛО могут быть обнаружены через 1-3 недели после инфицирования и достигать максимальных значений на 3-6 неделе.
Прокальцитонин повышается в течение 6-12 часов при воспалительном процессе, вызванном бактериальными, грибковыми инфекциями и простейшими. Очень эффективен при дифференциальной диагностике бактериального и небактериального воспалительных процессов.
Повышение уровня С-реактивного белка наблюдается при:
- вирусных инфекциях;
- метастазировании опухолей;
- системных ревматических заболеваниях;
- бактериальных инфекциях;
- повреждении тканей (хирургические вмешательства, острый инфаркт миокарда);
- тяжелых генерализованных инфекциях, ожогах.
Измерение уровня СРБ широко применяется для мониторинга эффективности терапии бактериальных, вирусных инфекций, при обострении хронических воспалительных заболеваний.
Повышение уровня антистрептолизина-О отмечается при:
- ангине;
- скарлатине;
- хроническом тонзиллите;
- остром гломерулонефрите;
- стрептококковой пиодермии.
Прокальцитонин - параметр для мониторинга пациентов с сепсисом, синдромом полиорганной недостаточности, септическим шоком (при тяжелой бактериальной, паразитарной или грибковой инфекциях), инфицированным панкреонекрозом.
Специальной подготовки к исследованию не требуется.
Спасибо врачу за проведённую операцию, с легкостью легла к к нему на операционный стол и под его поддержку немножко юморной и я уснула, было не страшно , спасибо огромное за выполненную работу. Подробнее
Выражаю огромную благодарность замечательному доктору Титову Дмитрию Алексеевичу за проведенное лечение, за внимательное отношение и профессионализм! Спасибо за позитивный настрой на протяжении всего лечения. Подробнее
Проходила лечение в Отделении в IX/2019-II/2020, хочу выразить огромную благодарность всему коллективу Отделения противоопухолевой лекарственной терапии под руководством замечательного, чуткого доктора Шикиной Валентины Евгеньевны. Благодаря атмосфере, созданной в Отделении очень нелегкое лечение, перенесла морально легко! Спасибо за профессионализм, внимате. Подробнее
Я искренне благодарю очень хорошего врача Павла Юрьевича Орехова. Так сложилось, что мне по разным диагнозам довелось проходить лечение в отделении сосудистой хирургии, а Павел Юрьевич был моим лечащим врачем. Я уверен, что именно его профессиональные действия, назначения и рекомен. Подробнее
Потрясающий доктор. Спасибо ей огромное за всё, очень компентная, внимательная и что сейчас очень редко в нашей медицине, она нацелена на то, чтоб вылечить пациента и помочь ему, а не просто поговорить. Мы с мужем являемся её пациентами и очень рады, что нас судьба свела с таким чудесным доктором. Спасибо . Подробнее
Хочу выразить огромную благодарность Хлопушину Евгению Юрьевичу за профессионализм и необыкновенно чуткое отношение. Врач очень грамотно и комплексно подошел к моей ситуации: провел полную диагностику, в кратчайшие сроки организовал необходимое предоперационное лечение. Он блестяще провел сложную операцию, после которой уже практически через неделю я смогла . Подробнее
Выражаю огромнейшую благодарность хирургу-онкологу,д.м.н.Ищенко Роману Викторовичу за его добрейшее сердце, высочайший профессионализм и чуткое отношение к пациентам. Благодарю судьбу ,что мы узнали об этом замечательном враче по программе ЗдоровЯ. Роман Викторович помог нам справиться с нашей проблемой. Операция, которую он провел моему мужу на лёгком прошл. Подробнее
Огромная благодарность врачу-колопроктологу зиновскому Михаилу Вячеславовичу. Была у него на приёме 11 марта 2020 года. Острая боль, еле дошли с мужем, хотя всего и через дорогу. Сделал все, как мне кажется, возможное. Дал все необходимые рекомендации, и свой номер телефона. Сказал звонить, если будут какие либо вопросы. Звонила и консультировалась с ним у. Подробнее
В феврале 2020г попала в онкологическое отделение, где меня встретила зав отделением Косый Валентина Васильевна. Огромное ей спасибо за профессионализм и чуткое отношение. Здесь же мне была сделана сложнейшая операция Ищенко Романом Викторовичем и Астаховым Дмитрием Анатольевичем. Это мои три ангела-спасителя.
Сейчас я быстро восстанавливаюс. Подробнее
Выражаю огромную благодарность Артуру Робертовичу за его профессионализм и "золотые" руки. Оперировал маму дважды в июне 2019 и в феврале 2020 года и оба раза успешно. Очень внимательный, чуткий и отзывчивый Врач. Очень аккуратный в своей работе и что порадовало "эстет" по части швов))) Он в буквальном смысле спас жизнь моей м. Подробнее
Подайте заявку на госпитализацию или исследование.
Специалисты регистратуры свяжутся с вами и согласуют
удобное для вас время. Или перейдите к форме записи онлайн.
Аннотация научной статьи по клинической медицине, автор научной работы — Каротам П.А., Мазанкова Л.Н., Боровик Т.Э., Баканов М.И.
В статье изложены результаты исследований белков острой фазы воспаления при острых кишечных инфекциях у детей и приведены данные об их динамике в зависимости от тяжести заболевания, типа диареи, возраста больных и нарушений нутритивного статуса. Показано, что характер изменений белков острой фазы воспаления при тяжелой форме острой кишечной инфекции инвазивного типа коррелирует с выраженностью интоксикации и длительностью диареи. В остром периоде тяжелых форм кишечных инфекций у детей с преморбидной гипотрофией отмечаются глубокие изменения белков острой фазы воспаления , что указывает на нарастание степени белково-энергетической недостаточности в процессе заболевания и диктует необходимость проведения ранней коррекции питании
Похожие темы научных работ по клинической медицине , автор научной работы — Каротам П.А., Мазанкова Л.Н., Боровик Т.Э., Баканов М.И.
одинаковой частоте встречаемости антител к различным вирусам независимо от длительности аллергического процесса. Однако у детей младшего возраста (от 3 до 7 лет) уровень специфических антител к наиболее распространенным вирусам (грипп, парагрипп, аденовирусы) был несколько ниже, чем у детей старшей возрастной группы (7—11 лет). Возможно, это свидетельствует о том, что динамика образования специфических антител у детей с аллергической патологией подчинена основным онтогенетическим закономерностям реагирования иммунной системы.
Таким образом, высокая заболеваемость острыми респираторными инфекциями и связь обострений аллергических болезней с ОРВИ, массивная персистен-ция респираторных вирусов в носоглотке свидетельствуют о значительном влиянии вирусной инфекции на течение аллергической патологии у детей и подростков и оправдывают использование методов вакциноп-рофилактики и иммунофармакотерапии в целях предупреждения возникновения вирусных инфекций у часто болеющих детей с аллергической патологией.
1. Балаболкин И. И. Бронхиальная астма у детей. — М.: Медицина, 2003. — 320 с.
2. Намазова Л. С. Патогенетические основы дифференцированного лечения бронхиальной астмы у детей: Автореф. дисс. . д. м. н. — М., 2000. — 48 с.
3. Титов Л. П. Особенности иммунного статуса у часто и длительно болеющих детей с сопутствующей аллергической
патологией / Л. П. Титов, Е. Ю. Кирильчик // Иммунология. — 2000. — № 3. — С. 29—33.
4. Johnston S. L. Viruses and asthma // J. Allergy. — 1998. — V. 53. — P. 922—932.
5. Femandez-Benitez М. The role of infection in asthma // J. Allergologia et Immunopathologia. — 2001. — V. 29 (3). — P. 147—151.
6. Хаитов M. P. Острые респираторные вирусные инфекции и бронхиальная астма. Клеточные и молекулярные аспекты проблемы // Журн. микробиол. эпидемиол. и иммунобиол. — 2002. — № 4. — С. 84—93.
7. Johnston S. L. Mechanisms of asthma exacerbation // Clin. Ехр. Allergy. — 1998. — Suppl. 5. — P. 181—186.
8. Martinez F. D. Viruses and atopic sensitization in the first years oflife // Am. J. Respir. Crit. Care Med. — 2000. — V. 162. — P. 395—399.
9. Busse W. W. Viruses in asthma / W. W. Busse, J. Е. Gern // J. Allergy Clin. lmmunol. — 1997. — V. 100. — P. 147—150.
10. Смоленов И. В. Астма и свистящие хрипы, индуцированные вирусной инфекцией // Consilium medicum (прилож.). — 2001. — С. 9—13.
11. Балкарова О. А. Бронхиальная астма и вирусная инфекция / О. А. Балкарова, А. Г. Чучалин // РМЖ. — 2000. — № 1. — С. 1—12.
12. Sigurs N. Respiratory syncytial virus bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7 / N. Sigurs, R. Bjamason, F. Sigurbergsson // Am. J. Respir. Crit Care Med. — 2000. — V. 161. — P. 1501—1507.
13. Иммунология инфекционного процесса (руководство для врачей) / Под ред. В. И. Покровского, С. П. Гордиенко, В. И. Литвинова. — М.: РАМН, 1994. — 305 с.
14. Учайкин В. ф. Руководство по инфекционным болезням у детей. — М.: ГЭОТАР Медицина, 1999. — 810 с.
Значение белков острой фазы воспаления в патогенезе острых кишечных инфекций
П. А. Каротам, Л. Н. Мазанкова, Т. Э. Боровик, М. И. Баканов
Кафедра детских инфекций РМАПО, ГУ Научный центр здоровья детей РАМН, Москва
В статье изложены результаты исследований белков острой фазы воспаления при острых кишечных инфекциях у детей и приведены данные об их динамике в зависимости от тяжести заболевания, типа диареи, возраста больных и нарушений нутритивного статуса. Показано, что характер изменений белков острой фазы воспаления при тяжелой форме острой кишечной инфекции инвазивного типа коррелирует с выраженностью интоксикации и длительностью диареи. В остром периоде тяжелых форм кишечных инфекций у детей с преморбидной гипотрофией отмечаются глубокие изменения белков острой фазы воспаления, что указывает на нарастание степени белково-энергетической недостаточности в процессе заболевания и диктует необходимость проведения ранней коррекции питании. Ключевые слова: острые кишечные инфекции, белки острой фазы воспаления, дети раннего возраста
Уровень заболеваемости острыми кишечными инфекциями (ОКИ) в России остается высоким. По данным Госсанэпиднадзора, в 2004 г. зарегистрировано 1300 случаев ОКИ на 100 тыс. детского населения, среди которых треть составляют среднетяжелые и тяжелые формы.
Вопросам изучения этиологии, патогенеза, клиники и лечения ОКИ посвящено большое число исследований [1—5], однако отдельные аспекты патогенеза требуют углубленного изучения, в частности, особенности воспалительных реакций при различных типах диарей. В последние годы отмечается тенденция к утяжелению течения заболеваний, росту неблагоприятных исходов и последствий инфекционных диарей [2].
Одним из малоизученных аспектов патогенеза ОКИ является развитие постагрессивной реакции с метаболическими нарушениями, сопровождающимися глубокими изменениями белково-энергетического баланса, лежащего в основе формирования гипотрофии [2, 5].
Цель настоящего исследования — выявление особенностей изменений белков острой фазы воспаления у детей раннего возраста и установление их патогенетической роли в развитии нарушений нутритивного статуса в остром периоде и периоде реконвалесценции при острых кишечных инфекциях.
Для решения этой проблемы были поставлены следующие задачи8
■ Изучить характер изменения белков острой фазы воспаления при ОКИ разной этиологии в возрастном аспекте.
■ Провести корреляцию изменений белков острой фазы воспаления с тяжестью ОКИ, длительностью ди-арейного синдрома и нарушением нутритивного статуса.
■ Выявить клинико-биохимические параллели при нарушении нутритивного статуса у детей с ОКИ и определить патогенетическую роль белков острой фазы в развитии гипотрофии.
Материалы и методы исследования
По возрасту дети были распределены на две группы — до года было 14 (21,88%) пациентов и от 1 года до 3 лет 40 (78,12%) больных.
При поступлении в клинику для оценки нутритивно-го статуса всем детям проводились оценка массо-рос-товых показателей и калиперометрия [6].
При внешнем осмотре у 32 из 64 обследованных пациентов (50%) не выявлено внешних признаков расстройства питания и на момент обследования были установлены нормальные показатели физического развития, отнесенные к 25-му процентелю. При оценке нут-ритивного статуса при поступлении и в динамике у 32 (50,0%) больных была выявлена преморбидная гипотрофия, у 6 (18,75%) из них нарастала степень гипотрофии в динамике заболевания. У 25 (78,1%) детей с преморбидной гипотрофией результаты соматометриче-ских измерений установлены на границе 10-го и 25-го процентеля, что расценено как снижение показателей на 5—10% от нормы и соответствует I степени гипо-
трофии. У 5 (15,6%) пациентов масса тела, толщина кожно-жировой складки трицепса, окружности средней трети плеча отмечались в 5-м и 10-м процентеле, что соответствовало снижению результатов более чем на 10—20% и расценено как гипотрофия II степени. У 2 детей диагностирована наиболее тяжелая форма расстройства питания — кахексия, сопровождавшаяся клинически выраженными признаками интоксикации и дистрофии кожных покровов, слизистых, скелетной мускулатуры, а также нарушениями аппетита и задержкой физического и нервнопсихического развития. Соматомет-рические показатели не превышали 5-й процентель.
Контрольную группу составили 29 практически здоровых детей аналогичного возраста. Состояние большинства детей (97,6%) расценивалось на момент обследования как удовлетворительное. В эту группу вошли дети с энурезом, в основе которого имелись только психологические факторы (стрессы, переживания). физикальный осмотр и клинико-лабораторные результаты обследования детей данной группы не выходили за пределы возрастных норм (данные Ерпулевой Ю. В. [7]).
Помимо общеклинических, бактериологических и серологических исследований, которые проводились в профильных отделениях больницы, были использованы специальные биохимические методы: определение белков острой фазы воспаления (БОф): транстиретина (ТТР), трансферрина (Тф), альбумина (Алб), С-реак-тивного протеина (СРВ), орозомукоида (ОМ). Выбор белков острой фазы воспаления сделан на основании литературных данных о скорости реагирования, сохранении таких характеристик, как термостабильность и высокая чувствительность, а также практическая доступность исследования [8—12]. Белки, концентрации которых превышают норму более чем на 25%, были названы позитивными (С-реактивный белок, Ц-кислый гликопротеин — орозомукоид), белки, концентрации которых снижаются, были названы негативными реак-тантами острой фазы (тироксинсвязывающий протеин или транстиретин, трансферрин, альбумин) [13]. Комплекс биохимических исследований ОМ, ТТР и Тф выполнен в лаборатории клинической биохимии ГУ НЦЗД РАМН, а определение СРВ и альбумина в лаборатории клинической биохимии ТДГБ г. Москвы (табл. 1).
Анализ вида распределения количественных признаков проводился с помощью критерия Шапиро-Уилка W.
Таблица 1. Характеристика белков острой фазы воспаления
Белки плазмы Период полужизни Концентрация в сыворотке крови (мг/дл)
1. Транстиретин 2—3 суток 15—36
2. Трансферрин 8 суток 200—360
3. Альбумин 15—20 суток 3,6—4,5
4. С-реактивный белок 6—8 часов 0—10
5. Орозомукоид 24 часа 50—120
□ Инвазивный тип □ Секреторный тип □ Осмотический тип □ Норма Рисунок 1. Изменения БОф в зависимости от типа диареи
Читайте также:


