Осложнения на почки после кишечной инфекции у детей
ГЕМОЛИТИКО-УРЕМИЧЕСКИЙ СИНДРОМ (ГУС) является одной из частых причин острой почечной недостаточности (ОПН) у детей.
ТРИАДА СИМПТОМОВ:
- Гемолитическая анемия (снижение уровня гемоглобина и эритроцитов в крови, с наличием фрагментированных эритроцитов – шизоцитов)
- Тромбоцитопения – снижение уровня тромбоцитов в крови
- Острая почечная недостаточность
У большинства (90-95%) детей отмечается так называемый типичный или постдиарейный ГУС (Д+ГУС).
Другая форма ГУС, называемая атипичный (аГУС), встречается гораздо реже (5-10 % всех случаев) и является результатом аномалии (чаще генетической) белков, регулирующих процесс активации комплементов.
Д+ГУС ИЛИ ПОСТДИАРЕЙНЫЙ ГУС
Д+ГУС развивается вследствие кишечной инфекции вызванная Е coli (кишечная палочка) которая продуцируют токсин – шигатоксин (STEC).
тмечается в основном в возрасте до 3 лет и редко до 6 месяцев.
Симптомы
- диарея (разжиженный стул, понос) в течение нескольких дней (у 90-95%). Иногда бывает кровь в стуле. ЕСЛИ ВЫ ЗАМЕТИЛИ КРОВЬ В СТУЛЕ, НЕЗАМЕДЛИТЕЛЬНО ОБРАТИТЕСЬ К ВРАЧУ.
- рвота (у 30-60%) и боли в животе
Манифестация ГУС начинается в среднем через 6 (в среднем 2-14) дней. Бледность, общее недомогание, слабость, изменение поведения, небольшая желтушность, уменьшение количества мочи после (кровавой) диареи должны насторожить врача в отношении ГУС.
ЕСЛИ У ВАШЕГО РЕБЕНКА КИШЕЧНАЯ ИНФЕКЦИЯ И ЧЕРЕЗ НЕСКОЛЬКО ДНЕЙ ВЫ ЗАМЕТИЛИ ТЕМНУЮ МОЧУ (КРАСНУЮ) С УМЕНЬШЕНИЕМ ЕЕ КОЛИЧЕСТВА, ИЛИ ЗАМЕТИЛИ ПАСТОЗНЫЕ ВЕКИ ИЛИ ОТЕК ЛИЦА, БЛЕДНОСТЬ С ЖЕЛТУШНОСТЬЮ НЕ ЗАМЕДЛЕТЕЛЬНО ОБРАТИТЕСЬ К ВРАЧУ!
РАЗВЕРНУТАЯ КАРТИНА ГУС
- гемолитическая анемия (снижение гемоглобина, шизоциты)
- тромбоцитопения
- лейкоцитоз
ОПН с повышением уровня сывороточного креатинина и азота мочевины. Приблизительно половина пациентов имеют тяжелую олигурию (снижение количества мочи) или анурию (полное отсутствие мочи), 50-60% нуждаются в остром диализе. При наличии хоть какого-нибудь количества мочи постоянно определяются микро- или макрогематурия (кровь в моче) и протеинурия (белок в моче).
ВНЕПОЧЕЧНЫЕ ОСЛОЖНЕНИЯ
- поражение центральной нервной системы
- поражение желудочно-кишечного тракта (воспаление толстого кишечника – колит и др.)
- отек поджелудочной железы
- поражение печени
- сердечные осложнения
Для уточнения диагноза срочно должны быть проведены соответствующие лабораторные исследования и незамедлительно начать лечение.
ПРОГНОЗ
В большинстве случаев в течение менее чем 1-2х недель исчезают гемолитическая анемия и тромбоцитопения, нормализуется диурез. 10% детей в среднем в течение 4-х месяцев достигают терминальной ХПН. Смертность в основном в результате поражения ЦНС (центральной нервной системы).
СОВЕТЫ РОДИТЕЛЯМ
ПРЕДОТВРАЩЕНИЯ ИНФИЦИРОВАНИЯ STEC (кишечная палочка содержащий шигатоксин) и развития ГУС
- рубленая говядина должна быть хорошо прожарена до приобретения на разрезе серого цвета
- дети до 3 лет не должны употреблять непастеризованные продукты (молоко, сыр, фруктовые соки)
- до приготовления пищи, особенно после манипуляций с рубленой говядиной, необходимо мыть руки
- дети, которые прикасались к крупному рогатому скоту и другим животным, должны после этого умыться, а также перед едой.
- для предотвращения контаминации мяса кишечным содержимым необходим контроль убоя скота. Важен надлежащий надзор и уход за водоснабжения
- антибиотики? Многочисленные исследования показали, что антибиотикотерапия в период диареи увеличивает риск развития ГУС, возможно в связи с освобождением шигатоксина в результате лизиса бактерий. Тем не менее, этот риск пока не доказан.
Для получения больше информации звоните врачам отделения: + 7(499) 134-07-43
С летним расстройством пищеварения хотя бы раз сталкивался каждый

Фото с сайта livingsu.syr.edu
В жару чаще портятся продукты и готовые блюда, активнее размножаются болезнетворные микробы, больше соблазнов – скушать ягодку с кустика или пирожок с сомнительного лотка. Иногда ОКИ (острая кишечная инфекция) безопасна, иногда грозит тяжелейшими осложнениями. Как уберечься?
Понос и рвота – в чем причина?
Основные симптомы кишечных заболеваний известны каждому. Человек чувствует тошноту, боли и напряжение в животе, его начинает рвать, появляется диарея. Почему так происходит?
Перед микробами, стремящимися проникнуть в человеческий организм, стоит много барьеров. Первый – рот. Человек ощущает вкус и запах пищи, а врожденный инстинкт вызывает у него отвращение к смраду тухлятины, кислятине и гнилой горечи. В слюне содержится бактерицидное вещество лизоцим. Но этого не всегда достаточно.
При легком отравлении достаточно избавиться от съеденного, чтобы спустя 6-8 часов пойти на поправку. Если неприятные симптомы длятся дольше, а рвота и понос не приносят облегчения, значит микробы серьезно атаковали организм. Бактерии размножаются в кишечнике, повреждая слизистую оболочку (кровавый понос), истощение нарушает функционирование желчного пузыря, перегруженные почки не справляются со своей работой. При сильной диарее и рвоте возникает обезвоживание. В тяжелых случаях страдает и мозг – безобидная на первый взгляд кишечная палочка вызывает в том числе и менингит. Без лечения ОКИ может привести к смерти, особенно у детей до 3-х лет (это ведущая причина детской смертности в Африке), стариков, беременных и людей с ослабленным здоровьем.
Ставим диагноз
В любом медицинском справочнике можно найти длинный список из нескольких десятков пищевых и кишечных инфекций. Здесь и брюшной тиф, и холера, и дизентерия (бактериальная и амебная), и коварный ротавирус, и мучительный сальмонеллез. Расстройство желудка вызывается и риккетсиями, и шигеллами, и клебсиллами, и иерсиниями, и другими микроорганизмами. Вызвать понос могут незрелые фрукты, избыток зелени, овощей, домашнее молоко, непривычный состав воды. Под кишечную инфекцию охотно маскируются аппендицит и гепатит, всевозможные отравления – ботулотоксинами, ядовитыми растениями или грибами, продуктами горения. От своевременной и правильной постановки диагноза зависит здоровье, а иногда и жизнь человека. Что нужно выяснить и передать врачам?
1. Что человек ел в ближайшие 72 часа (копчености, грибы, рыбу, неизвестные растения, немытые фрукты или овощи, еду в общепите и т.д.).
2. Когда началось ухудшение состояния и продолжается ли оно, есть ли облегчение от дефекации или рвоты, постоянное или временное.
5. Болит ли живот, и если да, то насколько сильно.
6. Температура повышена, понижена или в норме.
7. Есть ли признаки обезвоживания (сухая, дряблая кожа, сухие потрескавшиеся губы и рот, слабое, затрудненное мочеиспускание, темная, зловонная моча).
8. Имеются ли признаки поражения печени (желтые белки глаз, светлый кал, тёмная моча), почек (кровь в моче, затрудненное мочеиспускание), мозга (спутанное сознание, бред).
9. Есть ли сыпь, кровоподтеки?
10. Есть ли другие симптомы, нарушения зрения, слуха, координации и т.д.?
11. Хочет ли больной есть и пить?
12. Заболел недугом со схожими симптомами ли кто-то из близких или людей, обедавших с больным в ближайшие дни?
Если у больного относительно мягкий живот, рвота и понос случились 2-3 раза за сутки, нет температуры, обезвоживания и других симптомов, скорее всего это пищевое отравление или легкая форма ОКИ.
Если у больного мягкий живот, сильная тошнота, частая рвота и слабость – скорее всего, это ротавирус.
Жар, бред и быстрое ухудшение состояния характерны для брюшного тифа.
Твердый, болезненный живот в сочетании с мучительной рвотой, свидетельствует о воспалении в брюшной полости – возможно это аппендицит, перитонит или заворот кишок. Но окончательный диагноз может поставить только врач.
Сам себе Айболит
Самостоятельное лечение ОКИ возможно, но довольно рискованно. Если вы уверены, что дело во вчерашней колбасе или немытых сливах, сталкивались с аналогичными расстройствами раньше и чувствуете себя относительно неплохо – без жара, мучительной рвоты или слабости, сыпи, сильных болей и других необычных симптомов – попытайтесь лечиться сами. Однако у детей младше 3-х лет, у взрослых старше 60 лет, у лиц, страдающих нарушениями иммунитета, болезнями сердца, ЖКТ, печени и почек, гипертонией и т.д., при одновременном заболевании нескольких членов семьи, резком ухудшении состояния, отсутствии улучшения в течение 3-х дней, появлении симптомов недуга после турпоездки в страны Африки или Азии, южные республики бывшего СССР или после контакта с людьми оттуда, консультация врача обязательна!
Основное домашнее средство против ОКИ – диета. На 12-24 часа лучше полностью отказаться от пищи. Затем можно съесть немного рисового отвара, овсяной каши без масла, сахара и молока, черничного киселя, некрепкого куриного бульона с белыми сухариками. В течение 3-7 дней стоит питаться кашами без молока (кроме перловой), котлетками и тефтелями на пару, вареными овощами (кроме капусты и свеклы), печеными яблоками, компотами (без чернослива), подсушенным белым хлебом, нежирным кефиром. Затем постепенно возвращайтесь к привычной пище.
Пить во время ОКИ нужно очень часто – обезвоживание опасно. Поите больного каждый час, понемножку, чтобы не стошнило. Давайте черный некрепкий чай, ромашковый чай и отвар черники с сахаром. При сильной рвоте необходим солевой раствор: чайную ложку соли, 4 ложки сахара, 1,5 ложки питьевой соды растворить в литре воды, прокипятить 2-3 минуты и давать по 2-3 столовые ложки каждые полчаса. Полезно обтирать больного, уложить его в теплую ванну.
Чтобы избежать раздражения и вторичных инфекций, следует полоскать рот с содой или лекарственными травами, смазывать задний проход облепиховым маслом, если кожа начинает сохнуть – пользоваться кремом.
У больного должна быть отдельная посуда, его белье и одежду следует стирать отдельно, после ухода за ним необходимо помыть руки. Рвотные и каловые массы рекомендуется заливать хлоркой.
При пищевом отравлении и неосложненной ОКИ больному должно стать легче через день-два после появления первых симптомов, полное выздоровление наступит через 7-10 дней. При ухудшении состояния, появлении новых симптомов, крови, судорог и т.д. обязательно обратитесь к врачу.
Гемолитико-уремический синдром (ГУС) хорошо известен многим педиатрам и в типичном случае проявляется остро развившейся диареей (гемоколит наблюдается у 75% больных), на фоне которой остро возникает состояние, сопровождающееся.
Гемолитико-уремический синдром (ГУС) хорошо известен многим педиатрам и в типичном случае проявляется остро развившейся диареей (гемоколит наблюдается у 75% больных), на фоне которой остро возникает состояние, сопровождающееся:
- микроангиопатической (неиммунной) гемолитической анемией (тест Кумбса отрицательный);
- тромбоцитопенией;
- острой почечной недостаточностью (ОПН).
Восстановление почечной функции в периоде выздоровления отмечается лишь у 70% больных, и связано это, прежде всего, с глубиной повреждения почечной ткани вследствие разнообразия причинно-значимых, провоцирующих факторов. Так, плохой прогноз имеют атипичные семейные (наследственные) и спорадические случаи ГУС, не ассоциированные с диареей, 25% этих больных погибают в острой фазе заболевания, у 50% прогрессирует отек-набухание головного мозга.
Этиология
Типичный ГУС вызывается шигаподобным токсином Stx1 Shigella disenteria и шигаподобным токсином Stx2 Escherichia coli O157:Н7. Цитопатический эффект шигаподобного токсина обнаружен на вероклетках почек африканских зеленых мартышек. У серотипа E. coli O157 имеются уникальные биохимические свойства — отсутствие ферментации сорбитола. Однако некоторые другие серотипы эшерихий способны вызывать диарею, ассоциированную с ГУС, у детей — О26, О145, О121, О103, О111, О113 и др. Они продуцируют другие токсины, отличные от шигаподобных токсинов своими субъединицами, аминокислотными последовательностями и молекулярным весом.
Классификация тромботических микроангиопатий (представлена Европейской педиатрической группой, 2006 г.).
С учетом этиологии:
- с включением инфекции — шигаподобный токсин S. disenteria и вероцитотоксин Е. coli.
Нарушения обмена веществ:
- генетические нарушения комплементарного обмена.
- образование аутоантител, включая аFH-АТ;
- нарушения метаболизма кобаламина.
Не полностью установленная этиология:
- ВИЧ;
- опухоли;
- лекарства;
- беременность;
- системная красная волчанка и антифосфолипидный синдром.
Установлено, что в основе не ассоциированного с диареей ГУС (non-Stx-HUS) имеет место генетическое нарушение — низкий уровень третьего компонента комплемента в сыворотке и нарушение его регуляции. Выявлены генетические маркеры, которые приводят к атипичному ГУС у больных с наследственной предрасположенностью. В настоящее время обнаружено более 50 мутаций в гене фактора НF1, кодирующих систему активации комплемента. В развитых странах такие больные проходят генетическое тестирование, а также определение уровня аутоантител. Так как атипичный ГУС протекает неблагоприятно с формированием в 50% случаев хронической почечной недостаточности (ХПН) или необратимого повреждения головного мозга, генетическое тестирование важно для решения вопроса о возможности успешной трансплантации почек таким пациентам [2].
Заболеваемость и факторы передачи
В Африке, Азии при бактериологическом исследовании кала от больных ГУС чаще высеваются серотипы шигелл, выделяющие Stx1, после его воздействия у 38–60% детей развивается гемоколит. В США ежегодно регистрируется до 70 тыс. заболевших эшерихиозом и примерно 60 летальных исходов. В Аргентине, Уругвае эшерихиоз эндемичен. Заболеваемость диареей, ассоциированной с ГУС, составляет 10 на 100 тыс. детей в год. Частое возникновение эшерихиоза связывают с традиционным употреблением мясных продуктов из телятины: до 40% молодых животных длительно выделяют в стуле Stx2 E. coli O157:Н7.
В России не ведется анализ заболеваемости диареей, ассоциированной с ГУС, у детей. Публикации скудны, осуществляются в основном реаниматологами. Диарея, ассоциированная с ГУС, этиологически редко расшифровывается. Врачи не диагностируют признаков тяжелого бактериального токсикоза в начальном периоде заболевания. Происходит недооценка степени тяжести состояния больных, соответственно, запоздалая адекватная терапия и неблагоприятные исходы.
Патогенез
- Stx1 S. disenteria и Stx2 E. coli O157 образуются в эпителиальных клетках слизистой кишечника.
- Токсинемия. Stx найден in vitro в эритроцитах, тромбоцитах, моноцитах, но в большей мере в нейтрофилах, которые имеют к нему специфический рецептор globotriaosylceramide Gb3.
- Проникновение Stx в эндотелий клубочков, рецепторы которых имеют в 100 раз более высокую аффинность, чем рецепторы нейтрофилов, в этой связи в кровеносном русле нет такого повреждения эндотелия, как в почках.
- Эндотелий мелких сосудов более чувствителен к Stx, чем эндотелий крупных сосудов (его рецепторы экспрессируются в 50 раз сильнее к Gb).
- Stx блокирует синтез протеинов в клетках, разрушая эндотелиальные клетки, индуцирует эндотелиальный апоптоз и лейкоцитоззависимое воспаление.
- В ренальных микрососудах моноцитами вырабатывается много туморнекротизирующего фактора, все это создает биохимическую базу для преимущественной локализации микроангиопатических повреждений в почках.
Таким образом, в детском возрасте у большинства детей встречается типичный или постдиарейный ГУС, который вторичен по отношению к острым кишечным инфекциям (ОКИ), а центральную роль в патогенезе почечных поражений, гемолиза и тромбоцитопении играет повреждение эндотелиальных клеток. В основе повреждения почек при ГУС лежит гломерулярная тромботическая микроангиопатия — утолщение стенки сосудов с отеком эндотелия и накоплением белков и клеточного детрита в субэндотелиальном слое в результате воздействия одного или нескольких повреждающих факторов. Кроме этого гистопатологические варианты ГУС включают в себя ишемию клубочков, которая в сочетании с тромбозом в последующем может приводить к многоочаговому или диффузному некрозу клубочков (коркового вещества), окклюзии клубочков фибриновыми тромбами.
Нормальный эндотелий обеспечивает эукоагуляционную ситуацию. Это поддерживается продукцией антитромбина III, простациклина, оксида азота, эндотелийзависимого релаксирующего фактора и т. д. При повреждении эндотелия его поверхность приобретает прокоагулянтные свойства, что в свою очередь способствует локальной активации свертывающей системы крови с внутрисосудистой коагуляцией, отложению фибрина в стенках и просвете капилляров. Это приводит к сужению или облитерации просвета капилляров клубочков, снижению скорости клубочковой фильтрации и уменьшению перфузии почечных канальцев с их вторичной дисфункцией или некрозом [5]. При ОКИ, осложненных ГУС, наиболее часто страдают внутриклубочковые сосуды, поражение которых возникает на ранних стадиях заболевания.
Генез тромбоцитопении при ГУС связан с усилением внутрипочечной агрегации тромбоцитов, при этом повышается уровень 3-тромбоглобулина и тромбофактора-4 — специфических тромбоцитарных белков, количество которых в плазме нарастает при активации тромбоцитов и снижении гломерулярной фильтрации [6]. Тромбоцитопении также способствует повышенное их потребление в тромбы. Кроме того, экспериментально показано, что после проведенной двусторонней нефрэктомии уровень тромбоцитов достаточно быстро восстанавливается. Это подтверждает причастность почек к данному лабораторному симптому.
Другим удивительным фактом является значимое снижение продукции эндотелиальными клетками простациклина (PGJ2) у некоторых больных с ГУС и членов их семей. Это предполагает наличие генетического дефекта, который может привести к развитию семейных случаев ГУС, при условии воздействия этиологического фактора на эндотелий сосудов.
Таким образом, при ГУС, обусловленным шигаподобным токсином, изменения наблюдаются непосредственно в клубочках и канальцах почек. Однако нефробиопсия, проведенная через несколько месяцев после заболевания, показывает, что большая часть клубочков сохраняет нормальное строение и только 15–20% склерозированы. Поэтому исходы ОКИ, осложненных ГУС, как правило, благоприятны, если своевременно купируется ОПН.
Основные клинические признаки (ОКИ + ГУС):
- острое начало, симптомы гастроэнтерита или тяжело протекающий колит, часто гемоколит (75% случаев);
- резкая бледность кожного покрова;
- кожный геморрагический синдром (петехии или пурпура);
- дизурия в виде олиго- либо анурии как основное проявление ОПН. При этом восстановление почечной функции возникает у большинства детей (70% случаев), а у 30% больных наступает либо смерть в результате развития синдрома полиорганной недостаточности, либо формирование ХПН.
Дополнительные симптомы ОКИ + ГУС:
- анорексия;
- раздражительность;
- гипертензия;
- спленомегалия;
- желтуха, темный цвет мочи (гемоглобинурия);
- признаки застоя в системе кровообращения (отек легких, кардио-, гепатомегалия, расширение вен, тахикардия).
Лечение больных с ГУС проводится исключительно симптоматическое, поддерживающее, поскольку патогенетической терапии с доказанной эффективностью в настоящее время не существует.
Ниже представлены рекомендации по ведению пациентов с ГУС, опубликованные Европейской педиатрической исследовательской группой [3] и в Консенсусе исследовательской группы по печеночно-почечной трансплантации при ГУС.
Лечение:
- высококачественная диета;
- при выраженной анемии переливание эритроцитарной массы;
- инфузии плазмы, включая плазмообмен;
- перитонеальный диализ;
- гемодиализ при стойкой тяжелой ОПН;
- в терминальной стадии хронический диализ с перспективой трансплантации почки.
Нами проводилось изучение клинического профиля, спектра функциональных нарушений, прогностических факторов и исходов у 25 детей с ОКИ, осложненными гемолитико-уремическим синдромом, которые находились на лечении в МУЗ ДГКБ № 3 Новосибирска в период с 1991 по 2010 гг.
Наибольшее количество случаев (16 из 25 больных) ГУС наблюдалось у детей в возрасте до трех лет, что согласуется с данными литературы [1, 3]. В 1,3 раза чаще заболевание развивалось у девочек, такое соотношение встречается не везде, например, в Непале мальчики болеют в 3 раза чаще, чем девочки [4].
В первые трое суток от начала ОКИ ГУС развился у 13 больных, что составило 52% больных, до 5 дней — у 7 (28%) больных, и от 6 до 8 дней — у 5 (20%) детей. Таким образом, острое начало ГУС отмечалось только у половины, а у остальных больных проходило некоторое время от начала диареи, болезнь манифестировала клиникой гастроэнтероколита, поэтому терапия продолжалась на участке и была неадекватной степени тяжести. При этом длительно использовались сорбенты, не назначались антибактериальные препараты, либо использовался фуразолидон без эффекта, и терапия не менялась до появления клинических симптомов ГУС.
Результаты бактериологических исследований кала были положительны лишь у 8 больных. Так, в периоде диареи у двух пациентов в копрокультуре отмечался высев шигелл Флекснера; у одного — Salmonella typhy murium; у двух — E. coli O26; у трех — E. coli O157. Сложность верификации E. coli O157, выделяющей Stx2, обусловлена уникальным свойством ферментации бактерий данного серотипа на средах, содержащих сорбитол.
Развернутая клиническая картина в начале заболевания включала лихорадку, рвоту, абдоминальные боли, одышку, при этом колит отмечался у всех 100% заболевших, а гемоколит — только у пяти больных. Мочевой синдром в виде макрогематурии в острой фазе болезни имел место у двух детей.
Поражение центральной нервной системы (ЦНС) диагностировано у 14 детей (оглушение, сопор, судороги, кома), что было расценено нами как проявление токсикоза, гипергидратации, метаболических изменений (ацидоза), электролитных нарушений — гиперкальциемии, гипокалиемии (гиперкалиемия выявлялась редко), гипонатриемии, нарушение осмолярности плазмы. Гипонатриемия была связана как с потерей этого электролита с кишечником, так и почками. На фоне олигурии экскреция натрия усиливается за счет торможения реабсорбции в канальцах. Начальные признаки поражения ЦНС — повышенная возбудимость, беспокойство, затем прогрессирующая вялость, затем больные впадали в кому. Нарушение сознания проявлялось в основном у детей первых лет жизни.
Основные показатели системы гемостаза, за исключением тромбоцитопении, изменялись незначительно. Это свидетельствовало о том, что в патогенезе ГУС отсутствует системное тромбообразование (ДВС-синдром (диссеминированное внутрисосудистое свертывание)), а тромбоз сосудов осуществляется преимущественно на уровне почек. Возможно, у детей и есть период диссеминированного свертывания крови, но факторы, потребляемые в этот период заболевания, быстро восстанавливаются до нормы. Рекомендуется поддерживать нормальный уровень фибриногена, факторов свертывания введением свежезамороженной плазмы, где они содержатся в большом количестве. Так, у наших больных время свертывания, АЧТВ (активированное частичное тромбопластиновое время), уровень фибриногена, количество РФМК (растворимых фибрин-мономерных комплексов), как правило, соответствовало контрольным значениям.
Однако кровотечения отмечались у двух больных. В 1997 г. мы наблюдали случай ГУС у ребенка Р. 3 лет с шигеллезом Флекснера и язвенно-некротическим поражением толстого кишечника. В данном случае отмечался тяжелый гемоколит с периодическими кишечными кровотечениями в течение 12 дней. Предпринимались попытки коррекции гемостаза путем введения большого количества свежезамороженной плазмы, но у больного развился парез кишечника, который определил наступление летального исхода. В 2003 г. у больной К. 6 лет наблюдалось массивное кровотечение из толстого кишечника, использование препарата NovoSeven — рекомбинантного фактора свертывания крови VIIa позволило остановить кровотечение, в последующем наступило выздоровление. Тромбомасса вводилась некоторым больным с критическими цифрами, но только при кровотечениях, поскольку срок жизни тромбоцитов ограничен.
Значения сывороточного уровня мочевины и креатинина в остром периоде болезни значительно превышали контрольные возрастные показатели (в среднем в 1,5–2 раза и более). Тяжесть ГУС обусловливает глубина поражения почек, соответственно, состояние больного и исход зависят от снижения почечных функций. Как известно, длительность анурии предопределяет прогноз — чем дольше она продолжается, тем вероятность восстановления почечной функции меньше и чаще наблюдается переход в ХПН [3]. При сохранении водовыделительной функции почек (так называемая неолигурическая ОПН), даже при высоких цифрах мочевины, прогноз, как правило, благоприятен. Для олигоанурической стадии ГУС не характерны отеки в связи с потерями жидкости со стулом и перспирацией. Протеинурия встречалась у 38% и микрогематурия — у 70% больных.
Варианты заместительной почечной терапии
Плазмообмен — первый уровень терапии, он выполнялся всем 25 больным в объеме 1,5–2 объема циркулирующей плазмы. Это коррекция плазменных факторов, осуществлялась в остром периоде ежедневно, в дальнейшем по необходимости. Острый период ГУС у всех детей протекал по-разному — обычно в течение 2–5 дней наблюдались токсикоз, тромбоцитопенические сыпи, тромбозы катетеров. Если за это время не восстанавливался диурез, больному устанавливали перитонеальный катетер и проводили перитонеальный диализ от 2 до 6 недель.
Перитонеальный диализ выполнялся шести больным (четырем в сочетании с гемодиализом и двум — с гемодиафильтрацией). Есть больные без тяжелого токсикоза и выраженных электролитных нарушений, которым можно проводить только перитонеальный диализ, и они поправляются. Перитонеальный диализ — щадящая заместительная терапия, при которой медленно происходит обмен жидкости через брюшину, он может использоваться длительно, до восстановления функции почек.
С 1991 по 2003 г. плазмообмен в сочетании с гемодиализом был выполнен 14 (56%) больным. С 2008 г. для стабилизации гомеостаза в стационаре осуществляется гемодиафильтрация в сочетании с перитонеальным диализом (использовалась в лечении трем больным). Принцип гемодиафильтрации — замена интерстициальной жидкости на специальные растворы, которые полностью, кроме белков, соответствуют составу плазмы. При гемодиафильтрации плазмообмен осуществляется аппаратным способом, это многочасовая процедура, иногда она длится сутки, при этом диализирующая жидкость вводится со скоростью 70 мл/мин. Этот метод терапии более эффективен при SIRS-синдроме. Гемодиализ показан больным с нарушением азото- и водовыделительных функций почек без симптомов воспаления, снижает уровень азотемии, нормализует гомеостаз за 3–4 часа, поток диализирующего раствора по фильтру составляет 500 мл/мин.
В нашем наблюдении олиго/анурия у трех больных отсутствовала, а в остром периоде болезни доминировали симптомы гемолиза, у трех пациентов олиго/анурия сохранялась до трех суток, у 8 детей — до 8 суток, у шести человек до 15 суток и у двух — до 20 и более. Так, у пациента с длительностью олигурической стадии ОПН 28 дней, которому проводилась почечная заместительная терапия, полностью восстановились функции почек. У другой больной, после 42 дней заместительной почечной терапии, развилась ХПН.
Таким образом, при современном и адекватном лечении ГУС у детей, который возник после перенесенной ОКИ, исходом в 18 (72%) случаях стало выздоровление, в одном случае (4%) переход в ХПН, в 6 (24%) — смерть больных. К прогностически неблагоприятным признакам можно отнести:
- длительную анурию;
- нарушения со стороны ЦНС;
- остро развивающийся массивный гемолиз эритроцитов;
- гиперлейкоцитоз;
- гиперкалиемию;
- гемоколит, неразрешающийся парез кишечника.
Литература
- Байко С. В. Гемолитико-уремический синдром: эпидемиология, классификация, клиника, диагностика, лечение (Обзор литературы. Часть 1) // Нефрология и диализ. 2007, т. 9, № 4, с. 370–377.
- Байко С. В. Гемолитико-уремический синдром: эпидемиология, классификация, клиника, диагностика, лечение (Обзор литературы. Часть 2) // Нефрология и диализ. 2007, т. 9, № 4, с. 377–386.
- Ariceta G., Besbas N., Johnson S., Karpman D. et al. Guideline for the investigation and initial therapy of diarrhea-negative haemolytic uremic syndrome // Pediatr. Nephrol. 2009, 24, s. 687–696.
- Cerda J., Bagga A., Kher V., Chakravarthi R. M. The contrasting characteristics of acute kidney injury in developed and developing countries // Nature Clinical Practice Nephrology. 2008, 4, s.138–153.
- Petruzziello T. N., Mawji I. A., Khan M., Marsden Ph. Verotoxin biology: molecular events in vascular endothelial injury // Kidney International. 2009, 75, s. 17–19.
- Tarr Ph. Shiga toxin-associated hemolytic uremic syndrome and thrombotic thrombocytopenic purpura: distinct mechanisms of pathogenesis //Kidney International. 2009, 75, s. 29–32.
Е. И. Краснова, доктор медицинских наук, профессор
С. А. Лоскутова, доктор медицинских наук, доцент
О. В. Гайнц
НГМУ, МУЗ ДГКБ № 3, Новосибирск

Краснодарский край
ст. Павловская,
ул. Первомайская, 14
8 (86191) 5-33-52
Телефон регистратур:
8(86191)5-19-91, 8(86191)5-44-88
- Новости
- Горячая линия
- Информационные материалы
- Медицинское страхование
- Пациентам информация ТФОМС
- информация прессы
- Запись на прием через интернет
- Паллиативная помощь
- Часы приёма специалистов
- Политика обработки персональных данных
- Доступная среда
- Телефоны доверия
- Рекомендации гражданам пожилого возраста
- Антикоррупционная деятельность
- Сведения о проведенных контрольных мероприятиях
- Информационные материалы МЗ РФ
- Информация о закупках
- Подразделения ЦРБ
- Акушерское-физиологическое отделение
- Гинекологическое отделение
- Инфекционное отделение
- Травматологическое отделение
- Терапевтическое отделение
- Кардиологическое отделение
- Хирургическое отделение
- Педиатрическое отделение
- Отделение анестезиологии и реанимации
- Отделение скорой медицинской помощи
- Медицинская профилактика
- Независимая оценка качества оказания услуг медицинскими организациями
- Бухгалтерская отчетность
- Форум
- Задать вопрос
- Конференции
- Новости зарубежной медицины
- Высокотехнологичная медицинская помощь
- Высокотехнологичная медицинская помощь
- Приказ Минздрава России №796н от 02.12.2014г
- Приказ Минздрава России № 930н от 29.12.2014
- Мемориальный комплекс
- Карта сайта
- Сведения о ЦРБ
- Лицензии
- Руководство
- Структура
- Государственное (муниципальное) задание
- Информация для пациентов
- Территориальная программа государственных гарантий
- Диспансеризация
- Платные услуги
- Реабилитация
- Меры социальной поддержки
- Донорство
- Информация для специалистов
- Медицинские работники
- Вакансии
- Лекарственное обеспечение
- Вышестоящие и контролирующие органы
- Документы
- Отзывы пациентов
- Контактная информация
Новости
Кишечные инфекции
Кишечная инфекция – заболевание, вызываемое болезнетворными микроорганизмами (вирусами, бактериями), проникающими в человеческий организм через пищеварительный тракт. Как правило, пищевые инфекции вызывают только временные неприятности, не урожая жизни взрослого или ребенка, но некоторые из них несут серьезную опасность – холера, ботулизм и др. В настоящее время врачи выделяют около 30 заболеваний, которые относятся к этой группе.
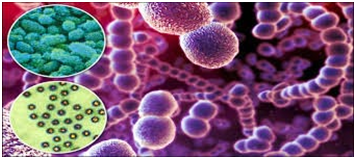
Возбудитель стафило-стрептококковой инфекции.
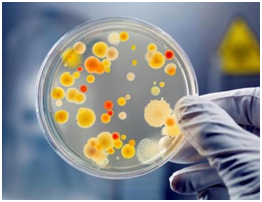
Результаты бак посева биоматериала на чашку Петри.
Пищевые инфекции возникают после поступления в организм болезнетворных микроорганизмов с зараженной пищей, грязной водой, через немытые руки, на которых они могут задерживаться в течение многих часов и даже суток. Симптомы заболевания проявляются после токсического и болезнетворного воздействия на ЖКТ бактерий и вирусов.
При генерализации процесса поражаются уже не только органы ЖКТ, но и весь организм в целом. Кишечная инфекция может проявляться в различных формах и разной степени тяжести. Если стафилококковая инфекция не представляет серьезной опасности и победить ее относительно легко, то такие пищевые инфекции, как холера очень опасны и в случае если больному не будет оказано своевременное полноценное лечение, то возможен даже летальный исход.
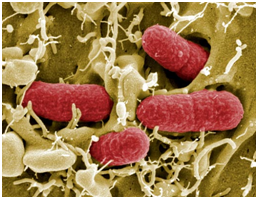
Центрально-африканская кишечная палочка.
Наиболее опасен летний сезон. Поскольку в это время люди склонны пить некипяченую воду, употреблять недостаточно качественно вымытые фрукты и овощи. Кроме того многие продукты быстро портятся из-за жары, а сразу заметить это не всегда удается. Переносчиками болезнетворных микробов могут быть насекомые. Относительным фактором риска является повышенная потребность человека в жидкости. Вода растворяет желудочный сок и он теряет свои бактерицидные свойства. В жаркую погоду, особенно при резкой смене климатического пояса может существенно снизиться иммунная защита организма.
От больного или бактерионосителя возбудитель попадает во внешнюю среду через испражнения, рвоту. Кишечная инфекция очень устойчива к внешним воздействиям. Она может в течение долгого времени сохранять жизнеспособность в пище, загрязненной воде, на руках больного, на предметах, которыми он пользовался – ложки, тарелки, кружки, мебель, дверные ручки и пр. Несмотря на то, что возбудители хорошо переносят низкую температуру, но наиболее опасны они именно в теплой среде и при повышенной влажности.
Самое быстрое размножение микроорганизмов происходит в молочных продуктах, в киселе, в мясном фарше. Кратковременное нарушение стула — дизентерию можно получить просто выпив парного некипяченого молока. Стафилококк хорошо сохраняется в тортах и пирожных с кремами. Сальмонелла распространяется через любые пищевые продукты: яйца и куриное мясо, вареная колбаса, овощи, фрукты и ягоды.
Возбудитель дизентерии Флекснера.
Инкубационный период кишечной инфекции составляет от нескольких часов до 2-х суток в зависимости от типа возбудителя. Симптомы заражения могут появиться внезапно, но при некоторых видах инфекций в течение некоторого времени они могут развиваться постепенно, исподволь. На начальном этапе — жалобы на слабость, потерю аппетита, повышение температуры, головную боль. В этот момент многие эти симптомы схожи с проявлениями ОРЗ и больные начинают обычное лечение простуды. Но спустя некоторое время появляются новые признаки пищевого отравления – тошнота и рвота, боли в животе, слизисто-гнойный понос с кровью. Некоторые заболевания характеризуются ознобом и сильной жаждой.
Наиболее часто кишечная инфекция проявляется следующими симптомами:
- Гипертермия (повышение температуры до фебрильных или субфебрильных значений).
- Тошнота, рвота.
- Метеоризм (вздутие живота и активное кишечное газообразование).
- Диарея (понос) иногда с гнойно-слизистыми и кровянистыми примесями.
- Избыточная потливость.
Наиболее опасными осложнениями кишечного инфекционного заражения ребенка является обезвоживания вследствие избыточной потери жидкости с поносом и рвотой. Иногда только что выпитая жидкость просто не успевает всасываться в желудке или кишечнике – она сразу же выделяется с рвотой. Обезвоживание ведет к потере натрия и калия, что очень опасно и может привести к нарушению работы сердца, почек и других органов. Как результат – у ребенка или пожилого человека эти изменения могут приобретать настолько тяжелые формы, что больной может умереть, у взрослых летальные исходы (кроме особо опасных инфекций) встречаются нечасто.
Возбудитель ротавирусной инекции.
Возбудитель энтеровирусной инфекции.
Диагностика кишечной инфекции
Зачастую острая кишечная инфекция походит на другие заболевания: неинфекционное пищевое отравление (алкоголем, наркотиками, химическими веществами, лекарствами и пр.), острый аппендицит, почечная колика, беременность, остеохондроз нижних отделов позвоночника, воспаления легких, инфаркт и пр.
При возникновении у ребенка или у взрослых симптомов, похожих на острую кишечную инфекцию, нужно обратится за помощью к врачу-инфекционисту или терапевту, которые могут назначить правильное лечение.
Основанием для установки диагноза служат типичные симптомы, результаты бактериологического исследования материала, полученного из испражнений или рвоты. Серологические методы могут также выявить наличие антител к конкретному инфекционному возбудителю.
При кишечном отравлении ребенка необходимо проводить комплексное лечение. В первую очередь необходимо предпринять все меры по уничтожению вредоносных бактерий или вирусов, но только этим ограничиваться нельзя. Многие признаки свидетельствуют об отравлении организма бактериальными или вирусными токсинами и нарушениями водно-электролитного баланса. Через рвоту и понос из ЖКТ выводятся токсины, поэтому не нужно искусственно их заглушать. Напротив, показано лечение путем промывания кишечника с применением клизмы. Для нейтрализации токсинов могут применяться специальные сорбирующие лекарства (сорбенты) – например, Смекта.
Показана голодная или со скудным рационом диета, потому что обычная пища может продолжать провоцировать прогрессирование заболевания. Овсяная и рисовая пресные каши обеспечат достаточное питание для организма ребенка и окажут благотворное успокаивающее действие на кишечник. Для восстановления электролитов — лечение Бегидроном или Регидроном. Эти растворы пьют по 2-3 глотка 2-3 раза за час. Показано обильное питье – несладкие компоты, травяные чаи.
При появлении признаков кишечной инфекции не стоит принимать антибиотики без указания врача.
Такое лечение может оказаться неэффективным до выяснения какой конкретно микроорганизм является причиной отравления, а вот нарушить микрофлору и вызвать нарушения со стороны ЖКТ способны любые антибиотики. Назначить определенные антибиотики или противовирусные препараты для ребенка может только врач. Для восстановления микрофлоры применяются лекарства Линекс, Лактобактерин.
Самая эффективная профилактика кишечной инфекции заключается в соблюдении элементарных гигиенических норм, эти правила закреплены у взрослых и у ребенка в памяти с самого раннего детства:
- Тщательное мытье рук перед едой.
- В жару не употреблять пирожные с кремом.
- Рыбу и мясо хранить только в холодильнике.
- Тщательно мыть фрукты и овощи перед употреблением.
- Кипятить воду для питья.
Профилактика кишечных инфекций — мытье овощей.

Профилактика кишечных инфекций — мытье рук.
Профилактика кишечной инфекции не так уж и сложна, но все равно в инфекционные отделения регулярно поступают новые пациенты с кишечными отравлениями.
Диспансеризация проводится в будние дни с 08:00 до 20:00
и субботу с 08:00 до 15:42
подробнее.
Читайте также:
- Что такое инфекционные заболевания и профилактика человека
- Какие инфекции могут быть в кишечнике и желудке
- Меры защиты растений от инфекций
- Памятка о иммунопрофилактике инфекционных болезней
- Образец справки от клещевого энцефалита
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

