Новое об инфекции кровотока
В больницах, где пациенты ищут помощи и облегчения их страданий, их иногда поджидает новый невидимый враг: внутрибольничные инфекции. По статистике, в России вероятность заразиться в больнице – 0,1%. Это означает, что из тысячи обратившихся за помощью один получит новое заболевание, которое с огромным трудом подается лечению, так как внутрибольничные инфекции обычно имеют высокий уровень резистентности к антибиотикам.
Как часто у нас заражаются ВБИ
В июле 2015 года Роспотребнадзор отчитался о снижении количества случаев внутрибольничных инфекций в России. При этом по другим данным распространенность ВБИ в тот же самый период времени выросла на треть. Согласно данным официальной статистики, в год в России регистрируется 20-30 тысяч случаев заражения инфекционными заболеваниями при поступлении в больницы. По другим данным их число может достигать 2,5 миллионов. Экономический ущерб, причиняемый внутрибольничными инфекциями, может достигать 15 млрд. рублей в год.
По словам Василия Акимкина, доктора медицинских наук, замдиректора НИИ дезинфектологии Роспотребнадзора РФ, чаще всего внутрибольничные инфекции (ВБИ) регистрируются в отделениях реанимации, хирургии, онкологии, родовспоможения, трансплантологии. Из-за присоединяющихся инфекций пребывание пациентов в стационарах увеличивают в среднем на 6-8 дней. Они усложняют лечение, а в тяжелых случаях могут приводить и к летальным исходам.
Как ни странно, наличие бахил у посетителей стационаров и запрет на посещение пациентов большого значения в профилактике инфекций не играют. Провоцируют же развитие ВБИ нарушения режима стерилизации медицинских инструментов и правил дезинфекции, заражения при контакте с больными, а также носительство внутрибольничных штаммов среди пациентов и персонала. Такую точку зрения высказал Владимир Кулабухов, кандидат медицинских наук, заведующий отделением анестезиологии и реанимации Ожогового центра Института хирургии им. Вишневского.
Что такое внутрибольничные инфекции
Классификация ВБИ в зависимости от способа передачи:
По словам Владимира Витальевича Кулабухова, к. м. н., доцента, заведующего отделением анестезиологии и реанимации Ожогового центра ФГБУ Института хирургии имени А. В. Вишневского, от внутрибольничных инфекций умирает большая часть пациентов стационаров во всем мире. Около четверти всех инфекций составляют инфекции кровотока, что связано с широким внедрением методов катетеризации кровеносных сосудов. Важнейшую роль в профилактике такого рода инфекций играет использование современных материалов — катетеров, отграничивающих адгезивных повязок с антисептическими свойствами. Например, использование вместо марли специальных гелевых накладок, пропитанных хлоргексидином, для фиксации катетера, сокращает риск возникновения инфекции на 60%. Необходимо разумное ограничение применения антибиотиков. Как отметил Кулабухов, борьба с ВБИ в России требует, прежде всего, осознания всей серьезности проблемы, финансирования не только оборудования, но и расходных материалов, а также внедрения жесткого регламента всех процессов и медицинского ухода в стационарах.
А как дела на Западе?
Безусловно, до сих пор наиболее эффективным методов борьбы с внутрибольничными инфекциями считается их предотвращение.
Так, в исследовании SENIC было показано, что тщательная организация профилактических мероприятий и постоянный эпидемиологический мониторинг позволили сократить частоту случаев заражения ВБИ на 32% в течение пяти лет. Ключевое значение имеет проведение профилактических мероприятий на всех уровнях с использованием надежного оснащения. Кроме того, в США госпитальная инфекция считается настолько серьезной проблемой, что там, в частности, из-за этого стараются максимально сократить сроки пребывания пациентов в больнице, выписывать сразу после операций и т.д.
А на днях группа ученых Медицинской школы Университета Мичигана и Управления по контролю за продуктами и лекарствами США (University of Michigan Medical School and the U.S. Food and Drug Administration) опубликовала результаты своего исследования в онлайн-журнале PLoS Pathogens. Их исследование приоткрыло завесу тайны над тем, почему некоторые больничные пациенты и жители домов престарелых имеют гораздо более высокий риск заражения внутрибольничными инфекциями, чем другие. Оказалось, что пациенты, принимающие препараты с кальцием, имеющие низкий уровень содержания в крови витамина D, либо страдающие от заболеваний, не позволяющих усваивать кальций, гораздо чаще страдают от внутрибольничных инфекций, в частности от кишечной инфекции, вызываемой Clostridium difficile. Неусвоенный кальций, содержащийся в кишечнике, в комбинации с желчными солями таурхлоратами (taurochlorate), стимулирует выработку фермента, ускоряющего активацию и прорастание спор бактерий Clostridium difficile.
Автор исследования Трэвис Кочан (Travis Kochan) провел эксперимент, удалив излишки кальция из питательной среды для прорастания Clostridium difficile. В среде, освобожденной от кальция, споры бактерий не прорастали. Дальнейшие эксперименты были проведены на мышах, и подтвердили, что дефицит витамина D, как и излишки кальция, провоцируют развитие кишечной инфекции, которая уносит ежегодно до 30 000 жизней только в США.
Это открытие позволит скорректировать лечение уже полученных в больнице тяжелых заболеваний, таких как Clostridium difficile. Возможно, со временем удастся понять механизм возникновения и других внутрибольничных инфекций, что поможет не только предотвращать их возникновение, но и эффективно лечить тех, кто окажется им подвержен, несмотря на профилактику заболеваемости ВБИ.
Есть и сверхантибиотики
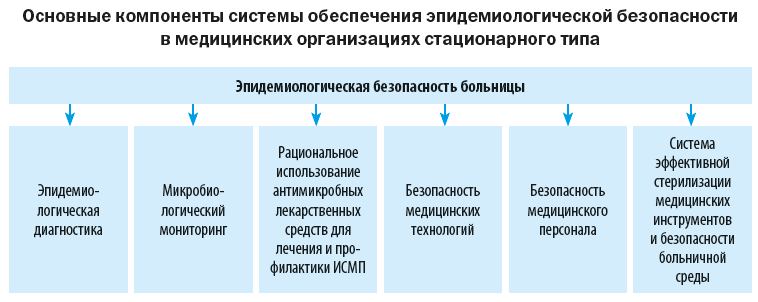
Высококвалифицированная и безопасная медицинская помощь — приоритетная задача современного здравоохранения. Одним из критериев качества медицинских услуг является эпидемиологическая безопасность пациентов и профилактика инфекций, связанных с оказанием медицинской помощи (ИСМП). Данный раздел работы должен контролироваться главными врачами или их заместителями, а также главными медицинскими сестрами в ходе реализации программы внутреннего контроля и аудита.
Эпидемиологическая безопасность медицинской помощи – это условия, при которых отсутствует недопустимый риск возникновения у пациентов и медицинского персонала инфекций, связанных с оказанием медицинской помощи.
Ключевая роль в реализации требований по эпидбезопасности принадлежит госпитальному эпидемиологу, а также администрации медицинской организации.
Рассмотрим их подробно.
1. Эпидемиологическая диагностика
Включает в себя совокупность приемов и способов, направленных на выявление причин и факторов риска возникновения ИСМП.
И чтобы эпидемиологическая диагностика была эффективной, в стационаре должна функционировать система активного выявления, учета, регистрации и анализа ИСМП.
Методы выявления инфекций делятся на пассивные и активные.
Пассивные методы предполагают, что врачи и медицинские сестры сами сообщают госпитальному эпидемиологу о случаях ИСМП. Однако такой подход малоэффективен и позволяет выявить не более 35 % всех инфекций.
Поэтому более предпочтительны активные методы, которые подразумевают постоянное наблюдение за пациентами, цель которого — выявить случаи ИСМП.
Активное эпидемиологическое наблюдение может быть тотальным или целенаправленным. В первом случае наблюдение организуют за всеми пациентами стационара и исходами их заболеваний. Во втором случае наблюдение может проводиться в отношении:
- конкретных видов ИСМП (например, инфекции в области хирургического вмешательства, внутрибольничные пневмонии, катетер-ассоциированные инфекции кровотока, внутрибольничные инфекции мочевыводящих путей);
- определенных групп пациентов (хирургические пациенты, пациенты, находящиеся на искусственной вентиляции легких, пациенты с центральными сосудистыми катетерами);
- отделений повышенного риска (отделения реанимации, ожоговые отделения, хирургические отделения).
С целью выявления случаев ИСМП в медицинской организации разрабатывают перечень стандартных определений случаев ИСМП, т. е. набор критериев, позволяющих определить, есть или нет у пациента инфекционного заболевания или состояния, связанного с лечебно-диагностическим процессом. Данные критерии используют лечащие врачи и врачи-эпидемиологи для постановки клинического или эпидемиологического диагноза.
Если у пациента выявлены признаки ИСМП, заполняется карта эпидемиологического наблюдения. В ней указываются:
- общие данные о пациенте;
- сведения о факторах риска возникновения ИСМП;
- критерии, на основании которых был поставлен диагноз ИСМП.
К сведению
В стационаре должны быть разработаны карты эпидемиологического наблюдения для различных видов ИСМП, актуальных для данной медицинской организации.
Выявленные ИСМП регистрируются в установленном порядке. На каждый случай заполняется экстренное извещение об инфекционном заболевании по форме 058/у, которое направляется в органы, уполномоченные осуществлять государственный санитарно-эпидемиологический надзор, информация вносится в журнал учета инфекционной заболеваемости (форма 060/у).
Ретроспективный анализ заболеваемости ИСМП у пациентов позволяет выявить фоновый уровень заболеваемости, основные источники инфекции, ведущие факторы передачи. На его основе разрабатываются профилактические и противоэпидемические мероприятия, адекватные конкретной эпидемиологической обстановке как в медицинской организации в целом, так и в конкретных отделениях.
Ретроспективный анализ заболеваемости медицинского персонала позволяет выявить источники инфекции и провести мероприятия, ограничивающие их роль в распространении ИСМП.
Сведения об ИСМП вносятся в электронные таблицы. Это позволяет накапливать, систематизировать и анализировать информацию.
К сведению
Используя базы данных, врач-эпидемиолог может рассчитать относительные частотные показатели заболеваемости, чтобы сравнивать и сопоставлять заболеваемость ИСМП в различные временные промежутки, а также в разных группах пациентов, выявлять факторы, влияющие на эпидпроцесс.
Чтобы рассчитать относительные частотные показатели заболеваемости, необходима информация об основных действующих факторах риска, таких как:
- количество дней искусственной вентиляции легких;
- количество дней катетеризации сосудов;
- количество дней катетеризации мочевого пузыря и т. д.
Данные собираются обо всех пациентах, подвергающихся фактору риска, вне зависимости от того, развивается у них ИСМП или нет.
Собирать данные должен персонал, который непосредственно осуществляет уход за пациентами, например медицинские сестры.
2. Микробиологический мониторинг
Программа микробиологического мониторинга разрабатывается для анализа микроорганизмов, циркулирующих в медицинской организации, выделенных от пациентов, персонала и с объектов внешней среды, а также для раннего выявления формирования госпитальных штаммов и вспышек ИСМП.
Мониторинг должен включать:
- бактериологические исследования биологического материала пациентов отделений стационара при наличии клинических или эпидемиологических показаний;
- санитарно-бактериологические исследования объектов больничной среды в плановом порядке и при наличии эпидемиологических показаний;
- анализ чувствительности/резистентности выделенных микроорганизмов с целью раннего выявления госпитальных штаммов и вспышек ИСМП;
- внесение данных, полученных в ходе проведения бактериологических исследований, в электронную базу данных аналитической компьютерной программы;
- анализ микробиологического пейзажа отделений стационара;
- разработку и корректировку протоколов определения чувствительности микроорганизмов к антимикробным препаратам, дезсредствам, бактериофагам;
- оценку и корректировку проводимой антимикробной терапии, коррекция лекарственного формуляра;
- оценку и корректировку дезинфекционных мероприятий в стационаре.
Карбапенемы — бета-лактамные противомикробные препараты широкого спектра действия, обычно применяемые в качестве последней линии терапии инфекций, вызванных продуцирующими бета-лактамазы расширенного спектра (ESBL) энтеробактериями и неферментирующими грамотрицательными микроорганизмами со множественной лекарственной устойчивостью (MDR). Появление и распространение резистентных к карбапенему энтеробактерий и неферментирующих грамотрицательных бактерий вроде Pseudomonas aeruginosa и Acinetobacter baumannii становится важнейшей проблемой общественного здравоохранения во всём мире.
Иные противомикробные препараты для терапии инфекций, вызванных устойчивыми к карбапенему грамотрицательными микроорганизмами, такие как амикацин (amikacin), колистин (colistin) и тигециклин (tigecycline), сопровождаются токсичностью, ростом резистентности, а в случае двух последних — первичной резистентностью или сниженной активностью против некоторых видов энтеробактерий, включая Morganella morganii, Proteus spp., Providencia spp., Serratia spp. Кроме того, тигециклин обладает первичной резистентностью к Pseudomonas aeruginosa. Вот почему столь высока медицинская потребность в новых антибиотиках против грамотрицательных бактерий — с уникальным механизмом действия и низкой предрасположенностью к развитию резистентности.
Цефидерокол (cefiderocol), относящийся к цефалоспоринам, располагает совершенно новым механизмом проникновения через наружную мембрану грамотрицательных патогенов, в том числе мультилекарственно резистентных штаммов. Цефидерокол способен обходить все три основных механизма резистентности к бета-лактамным антибиотикам: мутации пориновых каналов, сверхэкспрессию эффлюксных насосов, ферментативную инактивацию бета-лактамазами.
Молекула цефидерокола включает цефалоспориновый антибиотик и катехиновый фрагмент. Благодаря последнему цефидерокол работает как сидерофор: связываясь с трехвалентным железом из внеклеточной среды, он активно транспортируется в клетки микроорганизмов посредством бактериальных переносчиков железа, жизненно необходимого для них. Другими словами, цефидерокол, проникая в бактерии словно троянский конь, может не обращаться к пассивной диффузии через пориновые каналы.
Цефидерокол является плохим субстратом для эффлюксных насосов, и потому сохраняет свою активность против грамотрицательных патогенов, экспрессирующих в большом количестве эффлюксные насосы, которые откачивают антибиотики из периплазматического пространства.
В периплазматическом пространстве цефидерокол работает, как обычный бета-лактамный антибиотик, уничтожающий бактерию за счет связывания с пенициллинсвязывающими белками (PBP) и ингибирования пептидогликанового синтеза ее клеточной стенки. Боковые цепи цефидерокола наделяют его как стерическими, так и ионными свойствами, позволяющими противостоять всем известным классам бета-лактамаз, в том числе ESBL, AmpC и карбапенемазам, — бактериальным ферментам, разрушающим бета-лактамное кольцо антибиотиков. Клинически это отражается низкой минимальной ингибирующей концентрацией (MIC) для почти всех грамотрицательных патогенов: менее чем 1% клинических изолятов не чувствительны к цефидероколу ввиду множества факторов, включая некоторые специфические бета-лактамазы. Против грамположительных или анаэробных бактерий цефидерокол не работает.
…резко ускорит создание вакцины против нового коронавируса SARS-CoV-2.
Тяжелые последствия запоров, вызванных клозапином, могут привести к смертельному исходу.
…поможет избавиться от этой проблемной пищевой аллергии.
Клинические исследования APEKS-cUTI (NCT02321800) фазы II (рандомизированные, двойные слепые, с группой активного препарата сравнения, многоцентровые, международные) охватили взрослых пациентов (n=452), госпитализированных с осложненной инфекцией мочевыводящих путей (с пиелонефритом или без) или острым неосложненным пиелонефритом (AUP). Среди критериев исключения: более двух уропатогенов, грибковая инфекция мочевыводящих путей, резистентные к карбапенемам патогены. Участникам назначали внутривенно каждые восемь часов на протяжении 7–14 дней: либо цефидерокол, либо сочетание имипенема (imipenem) с циластатином (cilastatin). Композитная первичная конечная точка была заявлена пропорцией испытуемых, показавших одновременно клиническое излечение (устранение или улучшение симптомов заболевания) и микробиологическую эрадикацию (титр патогена в посеве мочи ниже 1×10 4 КОЕ/мл) по прошествии 7 дней после завершения терапии.
К заявленной конечной точке вышли 72,6% (n=183/252) пациентов в группе цефидерокола против 54,6% (n=65/119) в контрольной группе. Скорректированная разница эффективности лечения составила 18,58% (95% ДИ: 8,23–28,92; p=0,0004) в пользу цефидерокола. Для удовлетворения критерию, что экспериментальная терапия не хуже стандартной, цефидероколу было необходимо уложиться в разницу 15% и 20% — соответственно для клинического ответа и микробиологического ответа. По этим двум показателям цефидерокол показал превосходство над имипинемом с циластатином: первая разница составила 17,25%, вторая — 2,39%.
Клинические исследования CREDIBLE-CR (NCT02714595) фазы III (рандомизированные, открытые, с группой активного препарата сравнения, многоцентровые, международные) оценили, насколько безопасно и эффективно цефидерокол справляется с грамотрицательными бактериальными инфекциями, резистентными к карбапенемам. Проверка была осуществлена при инфекциях трех типов, как то: внутрибольничная пневмония (HAP), вентилятор-ассоциированная пневмония (VAP) или пневмония, связанная с оказанием медицинской помощи (HCAP); инфекции кровотока (BSI) и/или сепсис; осложненные инфекции мочевыводящих путей (cUTI). Взрослым пациентам (n=150) назначали либо цефидерокол (с опциональным дополнительным антибиотиком), либо наилучшую доступную терапию (один, два или три антибиотика).
Языком статистики: Нозокомиальные или внутрибольничные инфекции являются четвертой по частоте причиной летальности в США. По данным специалистов Центров по контролю и профилактике заболеваний, у 2 млн пациентов, госпитализированных в стационары США в 1998 г., развились нозокомиальные инфекции. По данным официальной статистики в России, в 1997 г. было зарегистрировано 56 тыс. случаев нозокомиальной инфекции, хотя их предполагаемое число составляет 2,5 млн.
— Наталья Владимировна, наверное, на сегодня не существует медицинского работника, который бы ни понимал, насколько опасны внутрибольничные инфекции. Ведь можно сделать уникальную операцию, но потерять пациента именно по этой причине.
— Да. При хирургических вмешательствах это особенно обидно. Операция может занять 10–12 часов, потребовать больших трудо и финансовых затрат, а потом больной умирает от внутрибольничной инфекции.
— Когда вы читает лекции врачам, что вы до них хотите донести? Они же в курсе проблемы.
— Знать о проблеме не достаточно, надо понимать, что с ней делать. Если проблема понята, но при этом ничего не делается, то грош цена этим знаниям.
Обычно я подробно останавливаюсь на соблюдении правил асептики и антисептики. Во всем мире с пациентами чаще всего общается средний медперсонал, и оказывается, что многие просто не моют руки, когда подходят к больным, перед перевязками. Да и перевязочный материал часто не меняется вовремя.
— Отследить это невозможно.
— Крайне сложно, это на совести самого медработника. И если руки не обрабатывать, внутрибольничная, резистентная инфекция переносится от пациента к пациенту, одновременно загрязняются предметы внутрибольничной среды — стерильные столы, поверхности фонендоскопов, мобильный и общественный телефоны. Все, за что берется сотрудник. Как выяснилось, санитарно-гигиеническими навыками обычное население той или иной страны обладает в очень небольшой степени. Многие почему-то не моют руки даже после туалета.
— И что же делать?
— В идеале, в каждой палате должны быть современные дезинфектанты, и переходя от больного к больному, сотрудник постоянно обрабатывает ими руки. Если говорить об устройствах, которые используются для исследовательских целей, то, например, для каждого больного должен быть отдельный, взятый после стерилизации, эндоскоп.
Положено иметь большую дезкамеру, куда ставится кровать после, например, гнойных больных. Ведь если больной уже инфицирован резистентным микроорганизмом, он соответственно колонизирует все вокруг себя. И если в этом случае меняется только постельное белье.
В больнице не должно быть стандартных бытовых кранов, которые открываются руками. Потому что человек открыл воду грязными руками, помыл их, а потом опять берется за кран, и все возвращается назад.
Уходя домой, сотрудникам обязательно нужно протереть телефон, поверхность фонендоскопа и т.д.
— О чем еще вы рассказывали в лекции?
— О том, что в современной клинике должна быть современная бактериологическая лаборатория. Дело того стоит. Современное оборудование помогает очень быстро получить результат микробиологического исследования, а это значит сориентироваться и подобрать правильную антибиотиковую терапию (по результатам антибиотикограммы) при которой частота ошибок будет минимальной.
Если стартовая терапия назначена неправильно, то летальность будет выше. Если она правильная, но отсроченная, все равно летальность выше, чем при адекватной стартовой. Чтобы определить, что правильно и что неправильно, надо знать какие микроорганизмы обитают в среде. Все внутрибольничные инфекции представлены в основном четырьмя локализациями — легкие, мочевыводящие пути, раны и инфекции кровотока. Биологический материал из этих очагов инфекции приносится в баклабораторию. Дальше лаборатория должна очень быстро выдать ответ: идентифицировать микроорганизм и определить его чувствительность к антибиотикам. Все оснащение лаборатории направлено на то, чтобы он был выдан максимально быстро.
Как правило, в отделении присутствуют одни и те же штаммы. В зависимости от этого надо понять к чему они чувствительны и на этом основании строить свои рекомендации. Это будет и финансово выгодно для клиники, и приостановит развитие резистентности в конкретном стационаре.
— Появилось ли что-нибудь новое в профилактике внутрибольничных инфекций?
— Ничего принципиально нового не изобретено за последние годы. Когда речь идет, например, о плановой хирургии, используются четыре основных антибиотика. Одна доза вводится до операции, другая после и все.
Антибиотики должны использоваться только в течение одних суток, а не 7-10 дней до периода снятия швов.
Опубликован список из 12 бактерий, устойчивых к действию большинства антибиотиков
Критически высокий уровень приоритетности
- Acinetobacter baumannii
- Pseudomonas aeruginosa
- Enterobacteriaceae
Рейтинг бактерий, устойчивых к антибиотикам, заслуженно возглавляют грамотрицательные микроорганизмы — возбудители большинства нозокомиальных (внутрибольничных) инфекций в отделениях реанимации и интенсивной терапии, гнойной хирургии и онкологии. Вызывают инфекции кожи и мягких тканей, ЖКТ, мочевыводящих путей, раневые, эндокардит, менингит, остеомиелит. У ослабленных пациентов особое значение имеют инфекции кровотока и ИВЛ-ассоциированная пневмония. Для бактерий этой группы практически не осталось антибиотиков резерва.
В терапии карбапенем-резистентной A. baumannii относительно эффективны комбинации антибиотиков: полимиксин Е + рифампицин/карбапенемы/хинолоны/цефепим/ампициллин-сульбактам/пиперациллин-тазобактам.
Синегнойная палочка распространена повсеместно, встречается в почве и воде, на/в растениях, животных, людях. Вызывает до 20 % нозокомиальных инфекций. Чувствительность к антибактериальной терапии очень сильно варьирует. В тяжелых случаях отмечается развитие резистентности к ранее высокоэффективным цефалоспоринам, фторхинолонам, карбапенемам, аминогликозидам, азтреонаму, пиперациллину-тазобактаму. Сохраняется чувствительность к полимиксину Е, а также комбинациям антибиотиков.
Смертность при развитии инфекций, вызванных мультирезистентной P. aeruginosa, варьирует от 5 до 50 %, в зависимости от состояния пациента и локализации процесса.
Из большого семейства энтеробактерий основные проблемы в стационарах доставляют Klebsiella, Escherichia coli, Citrobacter, Salmonella, Enterobacter, Serratia, Proteus. Вызывает опасения растущее повсеместное снижение чувствительности семейства к карбапенемам. Описаны единичные случаи резистентности E. coli ко всем существующим антибиотикам, включая полимиксин Е.
Высокий уровень приоритетности
- Enterococcus faecium
- Staphylococcus aureus
- Helicobacter pylori
- Campylobacter spp.
- Salmonellae
- Neisseria gonorrhoeae
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит. Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E. faecium чувствительны к линезолиду, тигециклину, даптомицину.
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S. aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России. Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении. Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора. По данным микробилогических исследований, в России также еще вполне актуальны фторхинолоны. В запасе для особо тяжелых случаев с осложнениями — гентамицин и карбапенемы.
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу. Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения. Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией. При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона. В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Средний уровень приоритетности
- Streptococcus pneumoniae
- Haemophilus influenzae
- Shigella spp.
Пневмококки — одни из основных возбудителей инфекций ЛОР-органов, внебольничной пневмонии, менингита. Резистентны к тетрациклину и ко-тримоксазолу. В мире постепенно снижается чувствительность S. pneumoniae к бета-лактамам и макролидам, однако, как и в других случаях, доля резистентных штаммов сильно варьирует от страны к стране. В России большинство штаммов пневмококков, к счастью, всё еще чувствительны к пенициллинам и макролидам, также эффективны хлорамфеникол, рифампицин, левофлоксацин, ванкомицин.
Гемофильная инфекция у детей младшего возраста протекает в виде бактериемии, гнойного менингита, пневмонии, целлюлита и эпиглоттита, у взрослых — в основном в виде пневмонии. Тревогу ВОЗ вызывает развитие полной резистентности гемофильной палочки к ранее эффективному ампициллину, в результате чего от него пришлось повсеместно отказаться. В России эффективны амоксициллин, цефалоспорины и макролиды, однако рекомендуется проводить бактериологический анализ с оценкой резистентности.
Возбудители дизентерии практически не чувствительны к ампициллину. Как и прочие энтеробактерии, они также постепенно вырабатывают устойчивость к фторхинолонам, которые тем не менее всё еще остаются препаратами выбора. В качестве альтернативы — цефалоспорины III поколения, ко-тримоксазол.
Итого
Появление устойчивых к антибиотикам бактерий и публикация этого списка в очередной раз привлекают внимание человечества к необходимости создания — в идеале — принципиально новых средств борьбы с микроорганизмами, иначе, по пессимистичным прогнозам, из-за появления бактерий, устойчивых к антибиотикам, через несколько десятилетий одна только послеоперационная летальность может скатиться до уровня начала прошлого века. Разработка таких препаратов — занятие неблагодарное, поэтому фармацевтические компании не стремятся развивать данное направление, и ВОЗ выносит проблему на межгосударственный уровень.
Сводная таблица: чувствительность возбудителей к антибактериальной терапии
Читайте также: