Моча при кокковой инфекции
- КЛЮЧЕВЫЕ СЛОВА: урология, нефрология, хронический цистит, биоптаты мочевого пузыря, микст-инфекция, неклостридиальные анаэробные бактерии
Среди инфекций мочевых путей хронический цистит занимает ведущее место. Число хронических заболеваний мочеполовой сферы инфекционно-воспалительного характера с каждым годом увеличивается, кроме того, для хронического цистита свойственно рецидивирующее течение. 20% девушек в возрасте 18–20 лет отмечают хотя бы один эпизод цистита, в 50% случаев происходит рецидив заболевания [1–3].
Несмотря на существование большого количества мощных антибактериальных препаратов, лечение хронического цистита вызывает некоторые сложности [4], что связано с ростом в последние годы штаммов возбудителей, обладающих множественной лекарственной устойчивостью. Как известно, в этиологической структуре хронического цистита доминируют представители семейства Enterobacteriaceae с ведущей ролью Escherichia coli (70–95%), реже из мочи выделяют Klebsiella spp., Proteus spp. и другие грамотрицательные бактерии [5]. До настоящего времени дискутируется этиологическая роль коагулазоотрицательных стафилококков, в частности Staphylococcus saprophyticus [6, 7]. В формировании хронического цистита также могут участвовать дрожжеподобные грибы рода Candida, неферментирующие грамотрицательные бактерии, микоплазмы, уреаплазмы, хламидии и вирусы [8–11]. К сожалению, в литературе практически не освещен вопрос о причастности неклостридиальных анаэробов к развитию хронического цистита у женщин, что отчасти связано с техническими трудностями культивирования данной группы микроорганизмов.
С целью полнообъемного изучения микрофлоры мочи (включая неклостридиальные анаэробы, бактерии и вирусы) при хроническом цистите у женщин нами было проведено клиническое исследование.
Материалы и методы
Обследованы 28 женщин (20–30 лет) с хроническим рецидивирующим циститом в период очередной манифестации заболевания до назначения антибактериальной терапии. Проведено бактериологическое исследование средней порции утренней мочи с соблюдением правил забора материала. По показаниям проведена цистоскопия и щипковая биопсия стенки мочевого пузыря с последующим бактериологическим исследованием биоптатов. Транспортировка мочи и биоптатов в лабораторию происходила в течение 1 часа.
При бактериологическом исследовании мочи 28 пациенток с хроническим циститом в 14,3% случаев были выделены только неклостридиальные анаэробы, в 85,7% обнаружена аэробно-анаэробная микст-инфекция, в том числе неклостридиальные анаэробные бактерии. Из вирусов в моче был обнаружен только ВПГ I типа (7,1%).
В микробной структуре мочи при хроническом цистите доминировали неклостридиальные анаэробы (табл. 1). Паттерн неклостридиальных анаэробов, выделенных из мочи больных хроническим циститом, был представлен: Propionibacterium spp. (50,0 ± 4,3) со средним уровнем бактериурии lg4,3, Peptostreptococcus spp. (35,7 ± 5,4) – lg4,0, Eubacterium spp. (28,6 ± 4,1) – lg4,8, Peptococcus niger (28,6 ± 4,7) – lg4,5, Bacteroides spp. (14,3 ± 4,4) – lg4,4. Во всех случаях неклостридиальные анаэробы выделяли из мочи в количествах, превышающих формально допустимые для нормы показатели бактериурии (> 10³ КОЕ/мл), с максимальным уровнем для Eubacterium spp. – lg4,8.
Из мочи выделяли также представителей семейства Enterobacteriaceae. Среди представителей семейства Enterobacteriaceae доминировали E. coli (21,4%), реже выделяли Citrobacter freundii (14,3%), Proteus vulgaris и Klebsiella pneumoniae (по 7,1%). Обращает на себя внимание низкий уровень выделения данных видов бактерий из мочи за исключением штаммов Proteus vulgaris (lg10,0).
Коагулазоотрицательные стафилококки и Corynebacterium spp. регистрировали с одинаковой частотой – по 42,8%. В группе коагулазоотрицательных стафилококков в моче были обнаружены Staphylococcus haemolyticus (lg2,5) и Staphylococcus epidermidis (lg1,5) – по 28,6%. Staphylococcus aureus, Enterococcus faecalis, Candida albicans были определены в 21,4% случаев. В единичных случаях (7,1%) регистрировали стрептококки. Mycoplasma hominis и Ureaplasma urealyticum обнаружены в моче у 35,7% пациенток, Chlamidia spp. – у 7,1%. Среди представителей грампозитивной флоры только Staphylococcus aureus выделяли из мочи со средним уровнем бактериурии lg4,0, формально превышающим нормативные показатели.
При бактериологическом исследовании 28 биоптатов мочевого пузыря только неклостридиальные анаэробы выделены в 85,7% случаев, только аэробные – в 7,1%, аэробно-анаэробные ассоциации – в 7,1%. Из аэробных бактерий в биоптатах регистрировали Corynebacterium spp., Mycoplasma spp. и Chlamidia spp. (по 7,1%).
В биоптатах, так же как и в моче, доминировали Propionibacterium spp. (42,8 ± 3,8) (табл. 2). Eubacterium spp. и Bacteroides spp. выделяли с такой же частотой, как и из мочи, – 28,6% и 14,3% соответственно. В биоптатах чаще обнаруживали Peptococcus spp. (35,7%) и реже Peptostreptococcus spp. (14,3%). Veillonella spp. регистрировали только в биоптатах (7,1%).
В 64,3% случаев обнаружено полное или частичное совпадение бактерий, выделенных из средней порции утренней мочи и биоптатов мочевого пузыря. В этих случаях обнаруживали высокую тесноту ранговой коррелятивной связи (r = 0,39, p
Щелчкова К.М. – ветеринарный врач терапевтического отделения ИВЦ МВА.
Инфекции мочевыводящих путей (ИМП) – это воспалительные заболевания мочевыделительной системы, вызываемые бактериальной или грибковой микрофлорой , острого или подострого характера с возможным развитием осложнений.
Часто инфекции мочевыводящих путей являются следствием миграции бактерий через половые пути и уретру в мочевой пузырь, возможно обсеменение с воспалительных участков кожи, находящихся рядом с мочеиспускательным отверстием. Осложнением может быть распространение бактерий на мочеточники и почки (восходящий путь инфицирования).
Проксимальная часть уретры и также мочеточники, мочевой пузырь стерильны, благодаря тому, что организм обладает природными защитными механизмами против инфекции.
Уретра в дистальной части и наружные половые органы имеют нормальную микрофлору, которая включает в себя кишечные микроорганизмы.При исследовании мазков из влагалища или препуция, обычно обнаруживается широкий спектр бактерий, большинство из них являются уропатогенными.
Группы риска по инфекциям мочевыделительной системы
1. Немаловажным фактором является возраст животного.
У собак и кошек инфекции мочевыделительной системы диагностируются в основном у животных старше 10 лет. У животных до 1 года риск инфекции минимальный.

2. Самки более предрасположены к инфекциям мочевыделительной системы из-за анатомического строения половых органов и уретры. Уропатогенные микроорганизмы поступают с фекальной флорой, колонизируя область промежности наружных половых органов.
3. Бактериальная микрофлора может вызвать как инфекции мочевыделительной системы, так и инфекционные заболевания репродуктивного тракта, такие как эндометрит, пиометра и другие.

4. Врожденные аномалии могут привести к увеличению восприимчивости к инфекции.
5. Восходящая инфекция с пиелонефритом часто возникает при эктопии мочеточников. Вульвовагинальные стриктуры также могут предрасполагать к инфекциям мочевыделительной системы.
6. Собаки и кошки с проведенной уретростомией и цистотомией.
7. Мочекаменная болезнь.
Инфекции мочевыделительной системы являются как причиной, так и следствием образования уролитов. Инфекции, вызываемые бактериями, продуцирующими уреазу, приводят к образованию струвитных камней у собак.
Инфицирование уреазо-продуцирующими бактериями приводит к отложению магния-аммония фосфата на поверхности уролитов других типов, осложняя диагностику и лечение.

8. Установка уретрального катетера и фиксация его на срок от 4 дней по статистическим данным ведет к 100 % инфицированию мочевого пузыря и уретры.
9. Некастрированные кобели в возрасте старше трех лет.
Это связано с развитием гиперплазии предстательной железы и другими заболеваниями простаты.

10. Собаки и кошки с дископатиями, травмами позвоночника, нейрогенными нарушениями мочеиспускания.
Эти заболевания могут влиять на частоту и объем мочеиспускания. Суточная моча может оставаться в мочевом пузыре, и своевременно не эвакуироваться, это предрасполагает к развитию инфекции.

11. Животные, получающие высокие дозы иммуносупрессивных препаратов (кортикостероиды, противоопухолевая терапия). Важно исключить инфекцию мочевыделительной системы у таких пациентов до начала введения препаратов и контролировать их состояние во время лечения.
Защитные свойства самого организма от инфицирования
- Нормальный поток мочи.
- Полное опорожнение мочевого пузыря.
- Уретральная зона высокого давления.
- Перистальтика уретры.
- Простатический секрет и его антибактериальные фракции.
- Длина мочеиспускательного канала.
- Пузырно-мочеточниковые клапаны, перистальтика самого мочеточника.
- Моча содержит значительное количество IgG и секреторного иммуноглобулина, который важен в профилактике инфекций мочевыделительной системы.
- Природные антимикробные свойства слизистой, поверхностный слой глюкозаминогликана, своевременное отмирание нежизнеспособных клеток.
- Антибактериальные свойства самой мочи: рН мочи, гиперосмолярность, концентрация мочевины.
Диагностика
1. Сбор анамнеза
Необходимо определить активность инфекционного процесса. Присутствует ли поллакиурия, затруднение и задержка мочеиспускания, гематурия, ослабление силы струи, непроизвольное мочеиспускание, патологический запах мочи.
У большинства животных с хроническими инфекциями мочевыделительной системы присутствуют минимальные клинические признаки.
Анализы крови необходимы для исключения системных заболеваний, скрининга скрытых заболеваний.
2. Клинический осмотр животного
При пальпации может наблюдаться болезненность в области мочевого пузыря, почек, предстательной железы. Может повыситься температура тела, наблюдаться общее угнетение состояния.
3. Общий клинический анализ мочи
В общем анализе можно увидеть активный осадок мочи: бактерии, лейкоциты, эритроциты, цилиндры, увеличение количества эпителиальных клеток. Если в воспалительный процесс вовлечены почки, можно увидеть лейкоцитарные цилиндры, зернистые цилиндры и почечный эпителий.
4. Ультразвуковая диагностика
Позволяет оценить внутреннюю архитектуру почек, простаты, мочевого пузыря и уретры. С помощью УЗИ можно предположить наличие инфекции мочевыделительной системы, но для подтверждения необходимы дополнительные методы диагностики.
5. Бактериологический посев мочи
Для выявления патогенных микроорганизмов обязательно проводить бактериологический посев с определением чувствительности к определенным антибиотикам и антимикотикам.
Необходимо провести забор мочи цистоцентезом (золотой стандарт культурального исследования при инфекциях мочевыделительной системы).
При подозрении на наличие инфекционного процесса в предстательной железе для культурального исследования можно собрать мочу путем взятия срединной порции мочи (в этом случае следует учитывать возможное обсеменение патогенной микрофлоры из дистальной части уретры).
Проба мочи должна быть стерильна. При катетеризации катетер идет по дистальной части уретры и собирает бактерии, таким образом контаминируя пробу, и может вызывать ятрогенную инфекцию.
Моча, которая получена естественным путем, стекает по дистальной части уретры, поэтому проба также может контаминироваться бактериальной флорой.
Возбудители инфекции
В таблице представлены самые распространённые возбудители заболеваний с процентом от общего числа выделенных бактерий у собак. (Lingetal., 2001).
Выделенная бактерия
% от общего числа выделенных бактерий (№=8,354)
Бактериурия
Основной метод диагностики инфекционных заболеваний мочевыводящих путей — это выявление бактерий в моче (бактериурия).
У здорового человека моча в почках и мочевом пузыре стерильна. Но появление бактерий необязательно говорит об инфекционном заболевании. Например, при мочеиспускании в мочу попадают непатогенные микробы из нестерильного нижнего отдела уретры, но их количество не больше 10 4 в 1 мл мочи (10 000). Другие причины появления бактерий без наличия инфекции мочевыводящих путей: длительное стояние мочи до проведения анализа (размножение бактерий) и несоблюдение гигиенических условий сбора мочи (поступление бактерий с наружных половых органов).
Для выявления бактерий в моче существуют:
- ориентировочные методы: микроскопия, химические тесты (нитритный тест)
- бактериологические тесты (посев мочи на стерильность)
Бактериурия отмечается, если в поле зрения микроскопа при увеличении х400 обнаруживается 1 и более бактерий, что предполагает рост колоний в культуре, превышающий 10 5 в 1 мл мочи (100 000 бактерий). Чувствительность теста составляет 61-88%, специфичность — 65-94%.
Тест основан на превращении нитратов в нитриты под действием в основном грамотрицательных микроорганизмов, присутствующих в моче. Чем больше бактерий, тем больше изменяется окраска нитритной полоски в моче.
Положительный нитритный тест подтверждает инфекцию мочевых путей. Отрицательный результат при использовании нитритных полосок не позволяет исключить бактериурию, т. к. при инфицировании грамположительной кокковой флорой (стафилококк, энтерококк) нитритный тест всегда отрицательный.
Чувствительность данного метода по данным разных авторов составляет от 40 до 70%. Причиной ложно-отрицательных результатов могут стать:
- низкий удельный вес за счёт повышенного диуреза (рекомендуется перед исследованием ограничить приём воды),
- кислая реакция мочи (рекомендуется в день накануне исследования увеличить в рационе количество овощей),
- высокая концентрация аскорбиновой кислоты,
- предшествующий приём антибактериальных препаратов.
Посев мочи — это золотой стандарт диагностики инфекций мочевыводящей системы, который проводят с целью идентификации возбудителя и определения его чувствительности к антибиотикам.
При бактериурии обычно превалирует какой-либо один вид бактерий, наличие двух и более видов бактерий скорее всего свидетельствует о загрязнении мочи при взятии пробы.
Для исследования в стерильную банку, не касаясь её внутренних поверхностей, собирается средняя порция мочи. Чтобы избежать бактериального загрязнения мочи, перед её сбором:
- женщины вводят во влагалище тампон и моют наружные половые органы, затем половые губы разводят пальцами, чтобы струя мочи их не касалась;
- мужчины отодвигают крайнюю плоть и моют головку полового члена.
Бактериологическое исследование при неосложнённой инфекции мочевыводящих путей не требуется, если общее состояние удовлетворительное и получен хороший ответ на курс антимикробной терапии.
Посев мочи обязательно проводят в следующих случаях:
- При отрицательных результатах экспресс-диагностики (нитритный тест) у пациентов с подозрением на острый пиелонефрит.
- При отсутствии положительной динамики у амбулаторных больных острым пиелонефритом через 5-7 дней от начала эмпирической антимикробной терапии.
- При рецидиве инфекции мочевыводящих путей.
- У госпитализированных больных по поводу инфекции мочевыводящих путей (при поступлении).
- У пациентов с высоким риском осложнённой инфекции мочевыводящих путей (пациенты с аномалиями развития мочевых путей и иммунодефицитными состояниями, мужчины с простатитом или доброкачественной гиперплазией предстательной железы и пр.)
Бактериурия оценивается в зависимости от количества колониеобразующих единиц (КОЕ) микробов в единице объёма, способа получения материала для исследования, конкретного заболевания и пола пациента.
- Более 100 000 микробных тел в 1 мл (10 5 на 1 мл) — достоверная, истинная бактериурия.
- От 10 000 до 100 000 — недостоверная, сомнительная бактериурия. Диагноз инфекции ставят, учитывая пол и возраст пациента, анамнез и другие факторы.
- Менее 10 000 — загрязнение материала, ложная бактериурия.
- 1000 микробных единиц в 1 мл мочи, полученной при помощи надлобковой пункции мочевого пузыря — вероятность наличия инфекции мочевыводящих путей 99%. Недостатки метода: инвазивная процедура, риск осложнений.
- 10 000 микробных единиц в 1 мл мочи, полученной при помощи катетеризации мочевого пузыря — вероятность наличия инфекции мочевыводящих путей 95%. Недостатки метода: риск развития восходящей инфекции.
- 100 000 и более колоний в 1 мл свежевыпущенной мочи — вероятность наличия инфекции мочевыводящих путей 95% при трёхкратном подтверждении, 90% при двукратном, 80% при однократном. Недостатки метода: временные затраты на получение результатов троекратного посева.
- Согласно рекомендациям Европейской ассоциации урологов, при остром неосложённом цистите у женщин диагностически значимым является получение роста 10 3 и более КОЕ уропатогенов в 1 мл средней порции свежевыпущенной мочи.
- При остром неосложнённом пиелонефрите у женщин — 10 4 и более в 1 мл средней порции свежевыпущенной мочи.
- При осложнённой инфекции мочевыводящих путей — 10 5 и более у женщин в 1 мл средней порции свежевыпущенной мочи; 10 4 и более КОЕ уропатогенов в 1 мл средней порции свежевыпущенной мочи у мужчин или мочи, собранной с помощью катетера, у женщин.
• Выявление уропатогенов: методы и диагностические критерии.
 |
подраздел
Урология
содержание файла
Инфекция мочевыводящих путей
Цель исследования — изучить динамику микробного пейзажа мочи на основе данных о структуре и антимикробной резистентности возбудителей заболеваний мочевыделительной системы у пациентов многопрофильных детских стационаров.
Материалы и методы. Исследовались штаммы бактерий, выделенные из мочи пациентов в возрасте от 1 мес до 18 лет с заболеваниями мочевыделительной системы, находящихся на лечении в педиатрических отделениях клиник Н. Новгорода с 2005-го по 2017 г. Определялись степень бактериурии и чувствительность к антибиотикам и антимикробным препаратам.
Результаты. Установлено, что, по данным исследования микробной флоры мочи пациентов педиатрических отделений Детской городской клинической больницы №1 (Н. Новгород), за период 2000–2016 гг. выявлена смена спектра возбудителей. Если ранее преобладала смешанная флора, то в последние годы (2014–2016 гг.) главную роль играла монокультура бактерий. Доминировали грамотрицательные бактерии (E. coli, Klebsiella, Proteus), грамположительная флора была представлена бактериями рода Streptococcus, Enterococcus и Staphylococcus. С 2014 г. возросла частота обнаружения бактерий рода Klebsiella — до 14,7%.
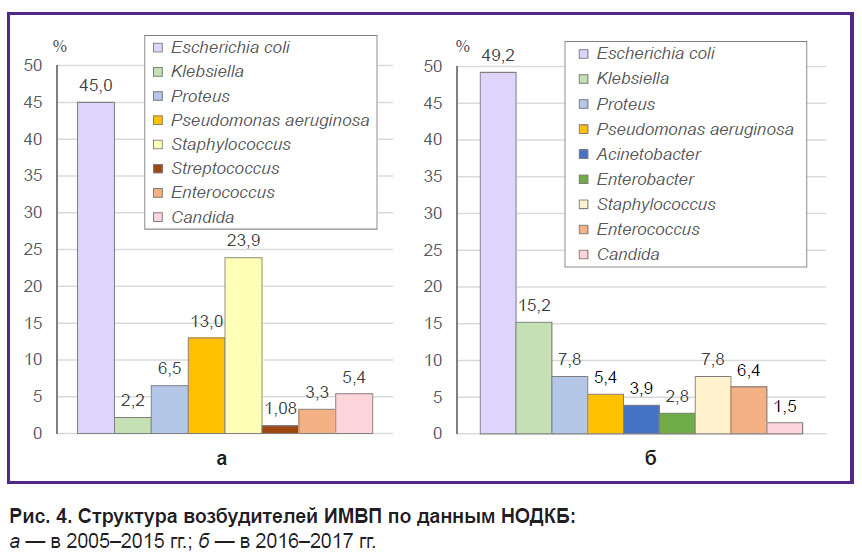
В хирургическом отделении Нижегородской областной детской клинической больницы в монокультуре бактерий за весь период исследований (2005–2017 гг.) ведущее место также принадлежало грамотрицательной флоре. Среди представителей грамположительной флоры ведущую роль играли бактерии рода Staphylococcus. В последние годы также возросла частота обнаружения бактерий рода Klebsiella, хотя это произошло позже, чем в первом случае.
Заключение. За последние 16 лет отмечена смена спектра возбудителей инфекций мочевыводящих путей как в педиатрических, так и в хирургическом отделениях многопрофильных детских стационаров. Постоянный мониторинг спектра микрофлоры и ее чувствительности к антибиотикам и антимикробным препаратам позволит повысить эффективность антимикробной терапии при инфекции мочевыводящих путей у детей.
Введение
Проблеме резистентности микроорганизмов к антимикробной терапии отводится значительная роль при лечении инфекции мочевыводящих путей (ИМВП). Данный термин обозначает рост бактерий в мочевом тракте, который сопровождает такие заболевания, как острый и хронический пиелонефрит, острый и хронический цистит, пузырно-мочеточниковый рефлюкс, связанный с обструктивным и необструктивным пиелонефритом, и некоторые другие.
Среди факторов, способствующих развитию ИМВП, приоритетное значение имеют биологические свойства микроорганизмов, колонизирующих почечную ткань, а также нарушение уродинамики.
Согласно клиническим рекомендациям по диагностике и лечению ИМВП у детей, распространенность их в детском возрасте составляет 18 случаев на 1000 детского населения [1, 2]. Среди детей грудного и раннего возраста это наиболее частая и тяжелая бактериальная инфекция. ИМВП с одинаковой частотой встречаются у мальчиков и девочек первого года жизни (по 1% соответственно), но в более старшем возрасте (от 10 до 15 лет) заболеваемость девочек в 9 раз выше, чем мальчиков, что обусловлено анатомо-физиологическими особенностями организма, эндокринными перестройками в связи с менархе [3].
Ключевым элементом терапии ИМВП является назначение антибактериальных и антимикробных препаратов. Основная рекомендация при этом — ориентироваться на чувствительность бактерий. Однако быстрый рост устойчивости микроорганизмов и появление полирезистентных возбудителей становятся актуальной проблемой современной антимикробной терапии. Меняющаяся картина антибиотикочувствительности уропатогенных штаммов делает адекватный выбор антибактериальной терапии достаточно сложным. При этом число новых антибиотиков, одобренных Управлением по контролю за пищевыми продуктами и лекарственными препаратами США (FDA), неуклонно снижается [4, 5].
Цель исследования — изучить динамику микробного пейзажа мочи на основе данных о структуре и антимикробной резистентности возбудителей заболеваний мочевыделительной системы у пациентов многопрофильных детских стационаров.
Материалы и методы
Собранный материал доставляли в лабораторию в течение 2 ч в изотермических условиях. Посевы осуществляли на среду HiCrome UTI Agar (HiMedia Laboratories Pvt. Ltd, Индия). Морфологическое исследование микроорганизмов проводили по Граму. Антибиотикочувствительность оценивали методом стандартных дисков. Диагностически значимой бактериурию считали по присутствию в 1 мл мочи, полученной из средней струи, более 10 5 колониеобразующих единиц (КОЕ) бактерий и наличию в моче, полученной катетером, микроорганизмов одного вида в количестве 10 4 КОЕ/мл и более [7, 8]. Уровень резистентности возбудителей определяли по минимальной подавляющей концентрации (МПК), т.е. по наименьшей концентрации антибиотика, способной подавить видимый рост микроорганизма in vitro. Высоким уровень резистентности возбудителя считали при отсутствии клинического эффекта от терапии даже при использовании максимальных терапевтических доз антибиотика; умеренным — когда хорошая клиническая эффективность наблюдается только при использовании высоких терапевтических доз препарата или при локализации инфекции в месте, где антибиотик накапливается в высоких концентрациях; низким — если при лечении стандартными дозами антибиотика инфекций, вызванных данным возбудителем, отмечается хорошая терапевтическая эффективность [9].
В ДГКБ №1 было исследовано 865 посевов за 2016 г., 853 — за 2014 г., 570 — за 2003 г. и 522 — за 2000 г. Дети, находящиеся на госпитализации в 2014 и 2016 гг., были распределены на две группы (табл. 1). В 1-ю группу вошли дети в возрасте от 1 мес до 3 лет включительно, во 2-ю — дети от 4 до 18 лет.
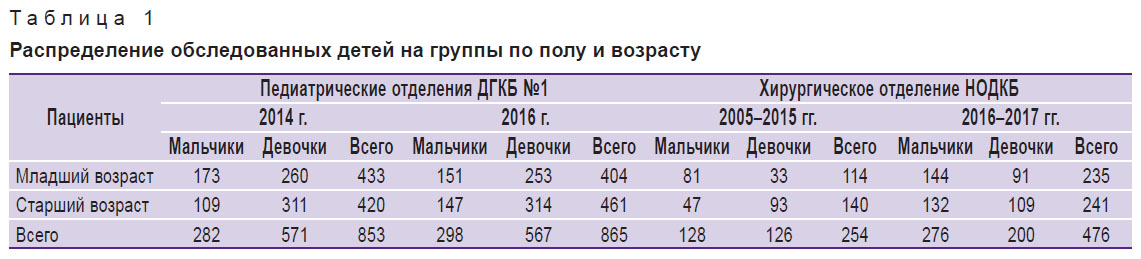 | Таблица 1. Распределение обследованных детей на группы по полу и возрасту |
На базе хирургического отделения НОДКБ было исследовано 254 посева за 2005–2015 гг. и 476 посевов за 2016–2017 гг. Пациенты были распределены на такие же группы (см. табл. 1).
Статистическую обработку данных проводили с помощью программ Microsoft Excel 2000, BioStat (Primer of Biostatistics 4.03). Оценивали критерий χ 2 . Различия считались достоверными при p
Результаты и обсуждение
По данным педиатрических отделений ДГКБ №1 в 2014 г. бактериальная флора из мочи выделена у 392 из 853 больных (45,9%) обеих возрастных групп. В 55,4% случаев (217/392) выделена монокультура, в 44,6% (175/392) — смешанная флора. Анализ видового состава микрофлоры показал, что преобладает грамотрицательная флора (89,4%; 194/217) в обеих возрастных группах. Она представлена в основном E. coli (67,3%; 146/217), Klebsiella (14,7%; 32/217) и Acinetobacter (3,2%; 7/217) (рис. 1, а). Pseudomonas aeruginosa выделена только в старшей возрастной группе. Ее удельный вес составил 1,3% от всей бактериальной флоры мочи детей данной группы (1/84). Род Proteus был обнаружен только у детей младшего возраста (2%; 5/133). Грамположительная флора была представлена родом Streptococcus (0,4%; 2/133 — в младшей группе; 1,3%; 2/84 — в старшей группе), а также родом Enterococcus (3,8%; 9/133 — в младшей группе; 6,6%; 10/84 — в старшей группе).
В 2016 г. бактериальная флора была выделена из мочи 361 больного из 865 (41,7%) обеих возрастных групп. В 62,9% случаев выделена монокультура (227/361), у 37,1% детей (134/361) — смешанная флора. В составе микрофлоры также доминировали грамотрицательные бактерии (87,6%; 199/227): E. coli (71,9%; 163/227), Klebsiella (7%; 16/227), Proteus (6%; 14/227) (рис. 1, б). Pseudomonasaeruginosa была выделена только в младшей возрастной группе (р=0,067), в отличие от результатов исследования в 2014 г. На ее долю пришлось 3,1% (6/195) от всей флоры мочи данной группы детей. Бактериями, представляющими грамположительную флору в посевах 2016 г., были род Staphylococcus, встречающийся только среди детей старшего возраста (3%; 5/166; р=0,051), и род Enterococcus (8,4%; 14/166 — в старшей возрастной группе; 4,1%; 8/195 — в младшей возрастной группе).
Рис. 1. Структура возбудителей ИМВП по данным педиатрических отделений:
а — в 2014 г.; б — в 2016 г.
Среди пациентов ДГКБ №1 доминировали больные с микробно-воспалительными заболеваниями органов мочевыделительной системы (табл. 2). Наиболее часто встречающимся заболеванием среди госпитализированных детей обеих возрастных групп стал пиелонефрит: острый пиелонефрит составил 43%, хронический пиелонефрит — 13%. Значительно чаще это заболевание отмечалось у детей младшей возрастной группы — 71,7% (290/404), у детей старшего возраста — 29,4% (136/461); р=0,002.
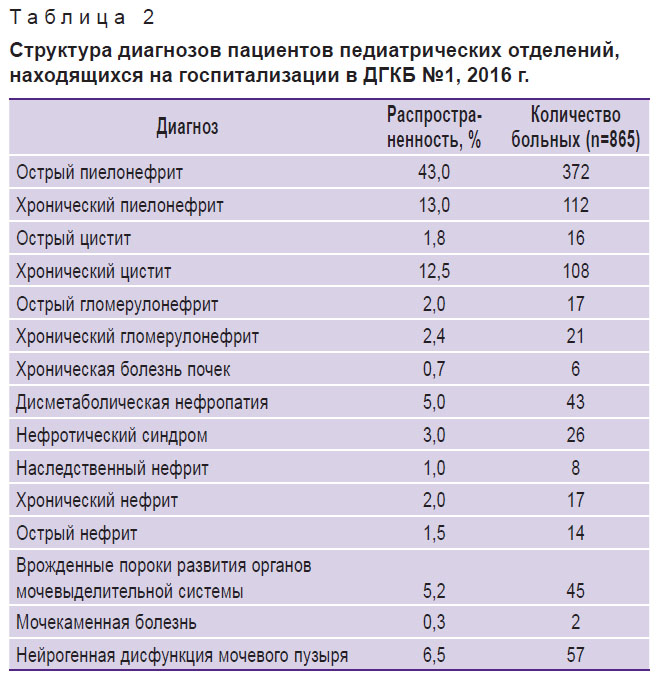 | Таблица 2. Структура диагнозов пациентов педиатрических отделений, находящихся на госпитализации в ДГКБ №1, 2016 г. |
Врожденные пороки развития органов мочевыделительной системы встречались значительно реже, чем у пациентов хирургического отделения НОДКБ, — менее 6% (45/865); р=0,018.
При сравнении структуры возбудителей инфекционных заболеваний органов мочевыделительной системы среди пациентов ДГКБ №1 в 2016 г. с предыдущими годами наблюдается смена спектра возбудителей. Например, в 2014 г. возросла частота обнаружения бактерий рода Klebsiella — 14,7% (32/217) по сравнению с 2000 г. (1,5%; 4/289) и 2013 г. (4,6%; 11/245), однако в 2016 г. их доля в бактериальной флоре мочи снизилась до 7% (16/227) по сравнению с 2014 г. (рис. 2, а).
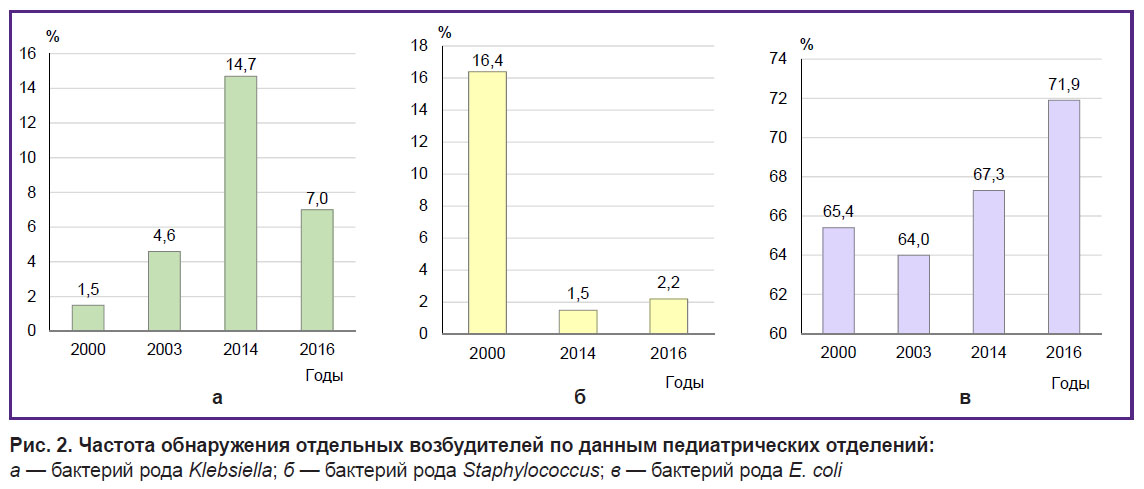 | Рис. 2. Частота обнаружения отдельных возбудителей по данным педиатрических отделений:
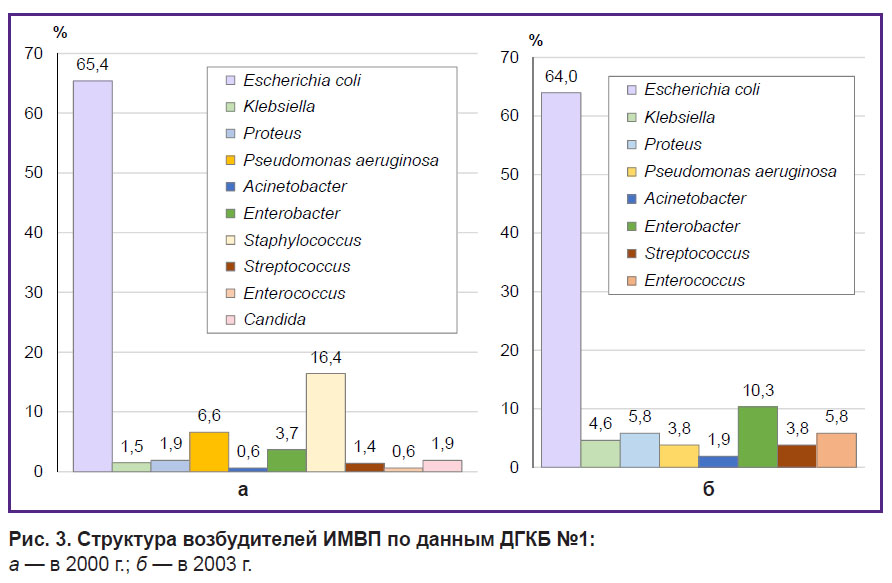
а — бактерий рода Klebsiella; б — бактерий рода Staphylococcus; в — бактерий рода E. coli При сравнении с данными проведенных ранее исследований по изучению возбудителей ИМВП у детей, получавших лечение в ДГКБ №1 в период с 2000 по 2003 г., отмечено изменение частоты выделения бактерий рода Staphylococcus: в 2000 г. — 16,4% (47/289), в 2014 г. — 1,5% (3/217), в 2016 г. — 2,2% (5/227) (рис. 2, б). В бактериальной флоре мочи неизменно преобладает E. coli: в 2000 г. — 65,4% (189/289), в 2003 г. — 64,0% (157/245), в 2014 г. — 67,3% (146/217), в 2016 г. — 71,9% (163/227), при этом отмечается тенденция к увеличению ее доли в структуре возбудителей (рис. 2, в). Структура возбудителей ИМВП (по данным ДГКБ №1) в 2000 и 2003 г. представлена на рис. 3.
|