Микст инфекция у беременных

Среди причин, приводящих к нарушениям родовой деятельности, особое внимание привлекает инфекционная патология беременных, и давно доказано, что инфекционно-воспалительные процессы оказывают негативное влияние на плаценту. Об этом свидетельствуют высокая частота угрозы прерывания беременности, самопроизвольных выкидышей и преждевременных родов у женщин с инфекционными заболеваниями полового аппарата и инфекциями другой локализации[5].
Инфекционная патология женских половых органов часто обуславливает воспалительные заболевания гениталий, хронические тазовые боли, осложненное течение беременности, а также привычное невынашивание, преждевременные роды, плацентарную недостаточность, задержку развития плода, внутриутробное инфицирование плода и новорожденного. Причём, известно, что при беременности организм женщины предрасположен к инвазии патогенных микроорганизмов и последующему их развитию, поэтому, инфекционные заболевания, встречающиеся во время гестационного процесса, подразделяют на: инфекции, передаваемые половым путем, воспалительные заболевания органов малого таза, инфекционные осложнения послеродового периода, а также экстрагенитальные и нозокомиальные инфекции[11].
Современные стремительное распространение оппортунистических инфекций и изменение особенностей микробиологического спектра оказывают негативное влияние на уровень здоровья населения, причём наиболее неблагоприятно это отражается на репродуктивной системе.[7]
И в этой связи в течение последних десятилетий одними из основных проблем акушерства являются инфекции у беременных, особое внимание уделяется изучению влияния инфекционно-воспалительных процессов на течение самого значимого события гестации - непосредственно родового акта, в частности на родовую деятельность; частота аномалий родовой деятельности у женщин, у которых есть урогенитальная хроническая инфекция, существенно превышает средние показатели по отношению ко всем родам, достигая 50%[10].
У детей ранний неонатальный период, при воздействии негативного характера, связанного с нарушением гестационного процесса, в том числе обусловленного внутриутробным инфицированием, характеризуется проявлением критических значений физиологических показателей, которые вызваны не только гемостазиологическими нарушениями в системе мать-плацента-плод, но и выявлением значительного дефицита ряда факторов свертывания крови, физиологических антикоагулянтов и компонентов фибринолиза; также обнаруживается прекращение плацентарного и включение легочного кровообращения, послеродовой гемолиз, которые происходят под воздействием "бактериального стресса" и ряда других сдвигов, создающих предпосылки для крайне негативных и опасных срывов в системе саморегуляции именно в этот периоде жизни[9].
Инфекции, передаваемые половым путём, занимают одно из ведущих мест в развитии невынашивания, причем исследования последних лет показали, что у женщин с синдромом потери плода вирусно-бактериальная колонизация плаценты встречается значительно чаще, чем у женщин с нормальным акушерским анамнезом. Соответственно, данная патология, учитывая ее распространенность, вносит значимый вклад в младенческую и перинатальную смертность[3].
Хроническая плацентарная недостаточность (ХПН), будучи одной из самых распространенных осложнений при беременности, часто сопровождается задержкой внутриутробного роста и развития плода, гипоксией, нарушением функций и структуры его жизненноважных органов, вот почему на данный момент и считается самой главной причиной перинатальной заболеваемости и смертности[17].
Этиологическая основа плацентарной недостаточности весьма разнообразна и зависит от множества факторов, которые принято делить на эндогенные и экзогенные. Эндогенными факторами можно считать морфологические нарушения плаценты, возникающие у будущей матери при генетических, эндокринных, инфекционных, иммунологических заболеваниях, а также под влиянием курения, и других различных вредных факторов окружающей среды, а также заболевания женщины, другого генеза, особенно на ранних сроках беременности; при этом достоверно установлено, что наиболее часто развитие плацентарной недостаточности есть результат инфекционного поражения плаценты беременной женщины.[13]
Особое место среди этиологических факторов занимают нарушения эндокринной системы, в частности заболевания щитовидной железы, диагностика которых в современном мире не представляет труда и является более доступной населению по сравнению с генетическими или иммунологическими исследованиями.[8]
К одной из наиболее часто диагностируемых инфекций мочеполового тракта относится хламидиоз - сексуально-трансмиссивная инфекция, ведущая к развитию воспалительных заболеваний урогенитальной системы и органов малого таза и оказывающая значительное влияние на репродуктивную функцию[17].
По оценкам Всемирной Организации Здравоохранения, хламидиоз занимает второе место после урогенитального трихомониаза среди инфекций, передаваемых половым путем; хламидии выявляются у каждой второй женщины с хроническими воспалительными процессами мочеполовой системы, у 70-80% - с привычным невынашиванием, у 40-50% - с трубным бесплодием. [12].
Урогенитальные микоплазмы относят к числу возбудителей внутриутробной инфекции, вызывающей в плацентах воспалительные, дистрофические и гемодинамические нарушения, которые могут приводить не только к выраженным морфологическим изменениям последа и его оболочек, но и к внутриутробной гибели плода[16].
Снижение функциональной активности эритроцитов в системе мать-плацента при обострении HVS-1,2 является одним из значимых факторов в патогенезе развития ХПН, высокий риск формирования которой имеется у 10% беременных с ранней плацентарной недостаточностью.
Таким образом, наличие недифференцированной формы дисплазии соединительной ткани у беременных с персистирующей инфекцией семейства вирусов герпес является клиническим предиктором риска реализации инфекционного процесса в плаценте с развитием субкомпенсированной фетоплацентарной недостаточности[4].
В случае заражения трихомонадной инфекцией или при активации хронического процесса, до формирования хориоамниотических оболочек, беременность может прерываться в результате самопроизвольного выкидыша. Если же заражение произошло на более поздних сроках, восходящая инфекция развивается редко. При этом, известно, что одно из наиболее частых проявлений урогенитальных инфекций у беременных женщин - фетоплацентарная недостаточность, которая характеризуется соответствующими эхографическими признаками, расстройством маточно-плацентарной и фетоплацентарной гемодинамики, нарушением реактивности сердечно-сосудистой системы плода[14].
Заключение
Отмеченные факты дают основание считать, что при наличии у беременных таких фоновых состояний, как острые и хронические инфекционные заболевания, самопроизвольное и искусственное прерывание предыдущих беременностей, экстрагенитальной патологии, их следует относить к группе риска по развитию плацентарной недостаточности[2].
У беременных с острой или обострением хронической инфекции крайне важно проведение мероприятий, направленных на борьбу с инфекцией и улучшение защитных резервов в системе мать - плацента - плод.
Можно выделить несколько основных направлений лечения беременных при плацентарной недостаточности:
- нормирование гемодинамики в плацентарной системе;
- усиление интенсивности газообмена;
- постоянное наблюдение и своевременный контроль реологических свойств крови;
- постоянная профилактика гиповолемии;
- поддержание онкотического давления крови.
- стабилизация сосудистого тонуса
- нормализация сократительной активности матки
- усиление работы антиоксидантной системы;
- уравновешивание метаболических и обменных процессов между плодом и плацентой [14].
При плацентарной недостаточности инфекционного генеза, наряду с улучшением показателей гемодинамики и метаболизма в системе мать - плацента - плод, большое значение имеют профилактика и лечение острой инфекции или обострения хронической[1].
Таким образом, адекватное и своевременное лечение хронической ПН с использованием современных препаратов способствует повышению вероятности благоприятного исхода беременности и позволяет избежать прогрессирования нарушений в системе мать -плацента - плод[6].
Рецензенты:
Артифексова А.А., д.м.н., профессор, зав. кафедрой патологической анатомии, ГБОУ ВПО НижГМА Минздрава России, г. Нижний Новгород;
Потемина Т.Е., д.м.н., профессор, зав. кафедрой патологической физиологии, ГБОУ ВПО НижГМА Минздрава России, г. Нижний Новгород.

Статья просмотрена: 3763 раза
Сохранение репродуктивной функции у женщин и мужчин является одной из приоритетных задач современной медицины. Одной из главных причин нарушения репродуктивного здоровья является поражение инфекциями, передающимися половым путем (ИППП).
Целью нашей работы является выявление характера влияния ИППП на репродуктивную функцию женщин, проживающих в г. Астрахань и Астраханской области.
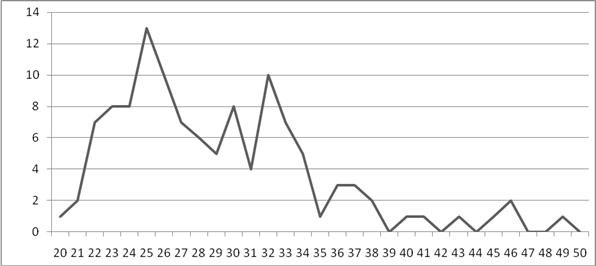
Большинство случаев ИППП пришлись на возраст от 22 до 34 лет. (Рисунок 1).
Рисунок 1. Возраст, исследуемых больных
Из сопутствующих заболеваний наиболее часто встречались хронический гастрит, вегето-сосудистая дистония, хронический пиелонефрит. Из вирусных заболеваний у 1 женщины обнаружен вирус краснухи в период беременности. В 2 случаях женщины были больны токсоплазмозом.
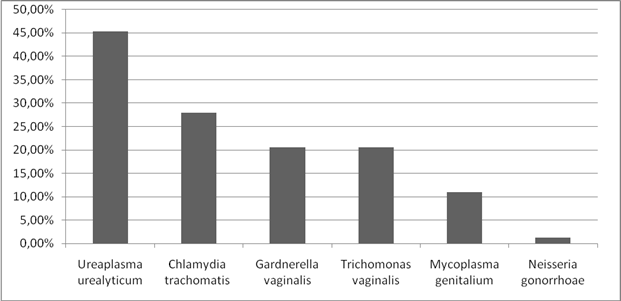
При анализе структуры заболеваемости ИППП у женщин, выявлено, что на I месте стоит заболеваемость уреаплазмозом, что составляет 45,3%. На II месте - заболеваемость хламидиозом 28%. III место разделили трихомониаз и гарднереллез, частота составила по 20,5%. Частота микоплазмоза составила 11 %. А так же был выявлен 1 случай гонореи. (Рисунок 2).
Рисунок 2. Анализ структуры заболеваемости ИППП.
Вирусные инфекции выявлялись реже - ЦМВ был обнаружен у 12 женщин, при чем в 5 случаях сочетался с вирусом простого герпеса 1 и 2 типа, вирусом папилломы человека были заражены 2,6% больных.
Нами было отмечено, что в 48% случаев наблюдалась микст-инфекция. Наиболее часто встречались такие сочетания как трихомониаз и хламидиоз, сочетание микоплазмоза и уреаплазмоза. В 12,8% уреаплазмоз протекал на фоне бактериального вагиноза.
ВПЧ встречался только в сочетании с другими ИППП, с наибольшей частотой у больных с микоплазмозом и уреаплазмозом, а так же у больных с гарднереллезом.
Вирус герпеса 1 и 2 типа в 65% случаев сочетался с ЦМВ.
Анализируя жалобы, предъявляемые больными, при обращении в клинику мы обнаружили следующую закономерность. При гарднереллезе и уреаплазмозе, в большинстве случаев, женщины предъявляли жалобы на обильные бели с неприятным запахом, зуд – 28,2% случаев. Либо инфекции были обнаружены при плановом обследовании у женщин при отсутствии каких-либо проявлений заболевания- 17% случаев.
Женщин, страдающих хламидиозом, трихомониазом и микоплазмозом, чаще беспокоили нарушения менструального цикла (альгодисменорея, гиперполименорея, метроррагия, пройоменорея) – 28,2%, бесплодие- 17%.
Последствия ИППП мы разделили на ранние и отдаленные. К ранним последствиям мы отнесли острые воспалительные заболевания женских половых органов, фоновые заболевания шейки матки, нарушения менструального цикла. К группе отдаленных последствий мы отнесли хронические воспалительные заболевания придатков матки, бесплодие, как первичное, так и вторичное.
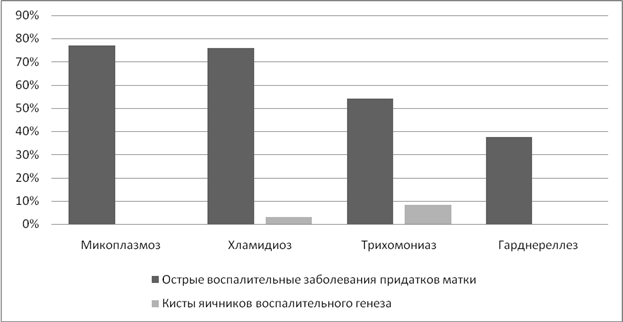
Итак, изучая показатели ранних последствий, получили следующие результаты. Воспалительные заболевания придатков матки наиболее часто выявлялись при микоплазмозе (77%) и хламидиозе (75,8%). При трихомониазе показатель составил 54,2%. (Рисунок 3).
Острые воспалительные заболевания придатков матки стали этиологическим фактором для образования кист яичников у 15,4% женщин при трихомониазе, а при хламидиозе у 4%.
Рисунок 3. Частота острых воспалительных заболеваний придатков матки на фоне ИППП
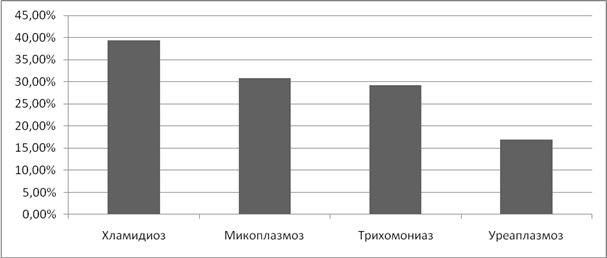
Хроническое течение воспалительных процессов на фоне ИППП чаще отмечалось при хламидиозе, в 39,4% случаев, в 30,8% случаев при микоплазмозе, и в 29,2% случаев после перенесенного трихомониаза. При уреаплазмозе хронизация воспалительного процесса придатков матки наблюдалась реже, в 17% случаев. (Рисунок 4)
Рисунок 4. Частота хронических воспалительных заболеваний придатков матки на фоне ИППП
У 31,6% женщин по результатам гинекологических мазков были выявлены дрожжевые клетки.
Частота возникновения дрожжевого кольпита на фоне микоплазмоза составила 46,2%, при трихомониазе 25%. При уреаплазмозе этот показатель составил 15% и при хламидиозе 12%. В 37,5% кандидоз сочетался с гарднереллезом. (Рисунок 5).
Рисунок 5. Частота дрожжевого кольпита на фоне ИППП
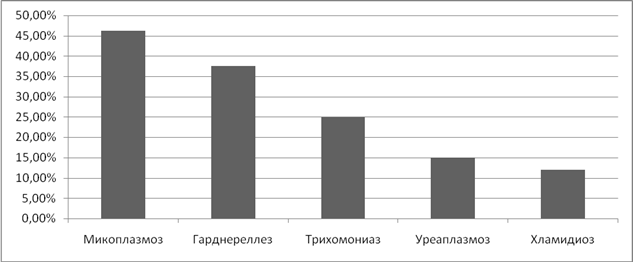
Изучая частоту возникновения фоновых заболеваний шейки матки у женщин, страдающих ИППП мы выявили, что эрозия и эктопия шейки матки встречались с частотой – от 21% при хламидиозе до 15,4% при микоплазмозе. (Рисунок 6)
Рисунок 6. Частота фоновых заболеваний шейки матки при ИППП
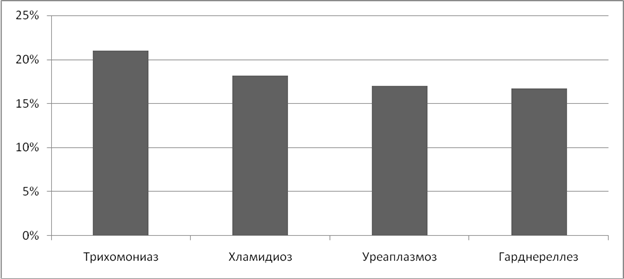
У 28,2% женщин, страдающих ИППП мы выявили нарушения менструального цикла. Чаще всего нарушения встречались при микоплазмозе - 30,8% и гарднереллезе- 25%.(Рисунок 7) С наибольшей частотой предъявлялись жалобы на альгодисменорею - 20,5%, метроррагию - 4,3%, гиперполименоррею - 17%, пройоменоррею - 3,4% случаев.
Рисунок 7. Частота нарушений менструального цикла при ИППП
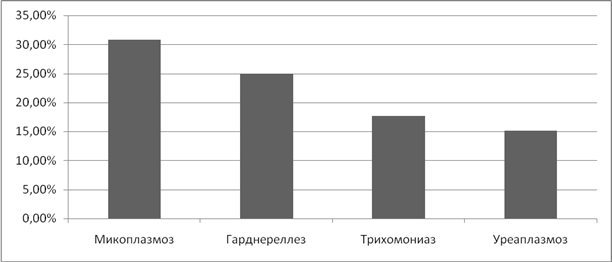
Анализируя частоту возникновения бесплодия, как первичного, так и вторичного, у женщин, которые перенесли ИППП, мы выявили, что самый большой процент пришелся на микоплазмоз- 46,2%, трихоманиаз-41,6% и хламидиоз-33,3%. В 20,7% бесплодие возникло после перенесенного уреаплазмоза. (Рисунок 8).
Рисунок 8. Частота бесплодия при ИППП
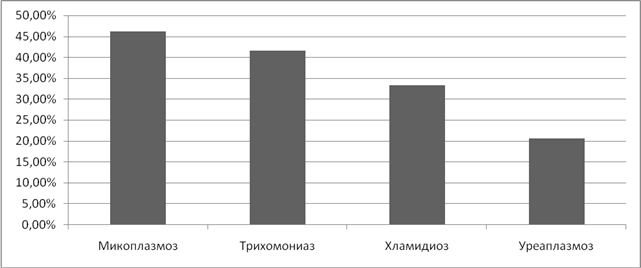
Изучая влияние ИППП на течение беременности, мы отметили, что наиболее часто встречаются угроза прерывания беременности, привычное невынашивание и в послеродовом периоде- послеродовый эндометрит.
При уреаплазмозе угроза прерывания наблюдалась в 17% случаев, при трихомониазе в 12,5%, при микоплазмозе в 7,7%. Самые низкие показатели угрозы прерывания были установлены при хламидиозе и гарднереллезе – 6% и 4,4% соответственно. (Рисунок 9).
Рисунок 9. Частота угрозы прерывания беременности при ИППП
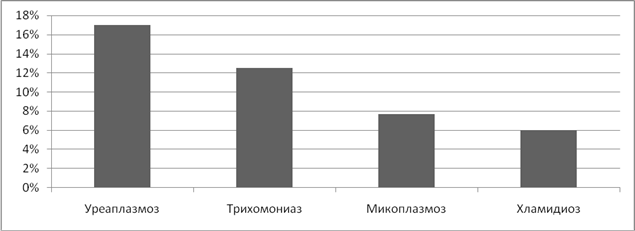
Анализируя частоту возникновения неразвивающейся беременности, было выявлено, что наиболее неблагоприятное влияние оказывает наличие вирусных инфекций, причем, чаще остановка развития беременности наблюдалась в первом триместре беременности. Вирус простого герпеса 1 и 2 типа стал причиной неразвивающейся беременности в 40% случаев. (Рисунок 10).
У одной из беременных женщины, при наличии хламидиоза, уреаплазмоза, микоплазмоза в сочетании с ЦМВ инфекцией мы наблюдали внутриутробное инфицирование плода, приведшее к антенатальной гибели.
Рисунок 10. Частота неразвивающейся беременности при ИППП
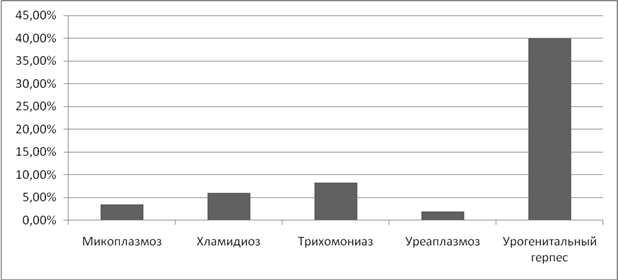
Привычное невынашивание так же оказалось прерогативой вирусных инфекций. Так, при ЦМВ невынашивание составило 33%, а при герпесной инфекции 20%. (Рисунок 11).
Рисунок 11. Частота привычного невынашивания беременности при ИППП
Осложнение в послеродовом периоде- послеродовый эндометрит наблюдался при уреаплазмозе в 1,9% случаев и при микоплазмозе в 7,7 % случаев.
Подводя итог, проведенной нами работы, можно сделать вывод, что, острые воспалительные заболевания придатков матки с достаточно высокой частотой вызывают все ИППП. Хронизация воспалительных процессов придатков матки чаще наблюдалась при микоплазмозе, трихомониазе и хламидиозе. Фоновые заболевания шейки матки встречались при всех ИППП. Нарушения менструального цикла наиболее часто встречались при инфицировании микоплазмозом и гарднереллезом.
Причиной бесплодия чаще становятся такие ИППП, как микоплазмоз, трихомониаз и хламидиоз. Причем, сочетание нескольких инфекций, резко повышает риск развития бесплодия.
Причиной угрозы прерывания чаще становились уреаплазмоз, трихомониаз и микоплазмоз. Неразвивающаяся беременность и привычное невынашивание являлись прерогативой вирусных инфекций.
На сегодняшний день тактика лечения больных с ИППП, остается весьма актуальной проблемой. В схему лечения обязательно входят иммуномодулирующие препараты (Лавомакс, Арбидол, Ликопид); антибактериальные средства (препаратами выбора являются макролиды – Доксициклин, Сумамед, Азитромицин, Юнидокс, Вельпрофен). В качестве препаратов для санации влагалища назначаются Бетадин, Гексикон, Йодоксид; Тержинан эффективен при гарднереллезе. Всем больным должна проводиться витаминотерапия, используются витамины группы Е и В - В1, В6. Немаловажным этапом лечения является назначение НПВС в/м или ректально, используются такие препараты как Диклофенак, Мовалис, Найс, свечи с индометацином. Для улучшения результатов лечения, учитывая частое сочетание ИППП с Г – флорой, назначается Метронидозол и/или Метрогил. При наличии кандидоза местно назначаются Клотримазол, Ливарон; для системного воздействия назначаются Микомакс, Микосист, Дифлюкан, Ирунин. Для повышения эффективности проводимой терапии назначается Генферон, Виферон вагинально. Так же рекомендовано назначение ферментных препаратов- Вобэнзим, Флогэнзим. По показаниям женщинам проводят физиотерапевтическое лечение – электрофорез с сернокислой медью, сернокислым цинком, с салицилатом натрия, переменное магнитное поле, УЗ. Контрольный бак посев на выявленные инфекции проводят через 30 дней. В случае получения отрицательного контрольного результата применяют грязелечение.
Нами было отмечено, что те женщины, которые прошли полноценное лечение с обязательным контрольным гинекологическим мазком, в большинстве случаев избежали отдаленных последствий и сохранили репродуктивную функцию. У женщин, которые по каким-либо причинам, отказались от лечения, в отдаленном периоде чаще наблюдались воспалительные изменения придатков матки, и самым грозным осложнением для них стало бесплодие.
В заключение несколько слов о профилактике. К методам профилактики относится отказ от случайных половых связей, наличие одного полового партнера, использование средств индивидуальной защиты, повышение информативности населения. Каждая женщина, в обязательном порядке должна проходить плановые осмотры гинеколога 1 раз в год. Если обнаружилось наличие ИППП, обязательным является полное обследование полового партнера с совместным лечением. Только при выполнении всех этих условий и своевременное лечение обоих партнеров позволит избежать всех грозных осложнений ИППП, а значит сохранить репродуктивную функцию.
1. Краснопольский В.И., Буянова С.Н., Щукина Н.А. Гнойная гинекология – М.: МЕДпресс, 2001 г.
2. Руководство CDC по лечению инфекций, передающихся половым путем, Издательство Медиа Сфера, Москва, 2007.
3. Охапкин М.Б., Хитров М.В., Ильяшенко И.Н. Инфекции передающиеся половым путем – Ярославская государственная медицинская академия, 2000г.
В настоящее время в ряде стран отмечается высокий темп роста вагинальных инфекций, занимающих в структуре акушерско-гинекологической заболеваемости ведущее место. Результаты зарубежных и отечественных исследований свидетельствуют о высокой частоте преждевременного прерывания беременности, плацентарной недостаточности, задержки развития плода, хориоамнионита, послеродовых гнойно-воспалительных осложнений и патологии при вагинальной инфекции и нарушении микробиоценоза влагалища. Своевременная диагностика, прогнозирование, профилактика и обоснованная терапия вагинальной инфекции и дисбиоза влагалища позволяют снизить частоту осложнений беременности, родов, послеродового периода, перинатальной заболеваемости.
В настоящее время в ряде стран отмечается высокий темп роста вагинальных инфекций, занимающих в структуре акушерско-гинекологической заболеваемости ведущее место. Результаты зарубежных и отечественных исследований свидетельствуют о высокой частоте преждевременного прерывания беременности, плацентарной недостаточности, задержки развития плода, хориоамнионита, послеродовых гнойно-воспалительных осложнений и патологии при вагинальной инфекции и нарушении микробиоценоза влагалища. Своевременная диагностика, прогнозирование, профилактика и обоснованная терапия вагинальной инфекции и дисбиоза влагалища позволяют снизить частоту осложнений беременности, родов, послеродового периода, перинатальной заболеваемости.
Актуальность проблемы вагинальной инфекции (ВИ) обусловлена ее высокой распространенностью среди всех генитальных воспалительных заболеваний и неблагоприятным влиянием на течение и исходы беременности. Несмотря на развитие и внедрение в клиническую практику методов профилактики, диагностики и лечения вагинальной инфекции, ее частота не снижается и варьируется в пределах 35–67% [1, 2].
Нарушение количественного соотношения бактериального сообщества микроценоза влагалища приводит к развитию клинических проявлений ВИ. Исходя из этого были выделены самостоятельные нозологические формы заболеваний влагалища: бактериальный вагиноз (БВ), кандидозный вагинит (КВ), аэробный вагинит (АВ) [3–6].
Около 40–65% беременных сталкиваются с проблемой ВИ, при этом 5–10% из них страдают рецидивирующим БВ или КВ [1, 6].
У 55% беременных группы высокого перинатального риска развиваются ВИ и дисбиоз влагалища с преобладанием БВ, КВ, АВ, а также микст-инфекции [7].
Вагинальные инфекции, вызванные сочетанным воздействием не менее двух патогенных факторов, например БВ и КВ, выявляются достаточно часто – 10–30% всех случаев. Наличие смешанных форм инфекции затрудняет диагностику и лечение. Неадекватное лечение при нераспознанной сочетанной ВИ нередко приводит к увеличению частоты рецидивов и реинфицирования [5–7].
Необходимо помнить, что инфекционные заболевания нижних отделов половых путей у беременных являются важным фактором повышения материнской и перинатальной заболеваемости, связанной с восходящим инфицированием [1, 2].
Данные литературы свидетельствуют, что при ВИ и дисбиозе имеет место высокая частота (свыше 40%) задержки роста и развития плода, возникновения хориоамнионита и инфекции околоплодных вод, внутриутробной инфекции, послеродовых гнойно-воспалительных осложнений (в 3,5–5,8 раза чаще) и др. [7–11].
При БВ во время беременности возможно инфицирование плодных оболочек, околоплодных вод и плаценты. Однако механизм миграции микроорганизмов во время беременности до конца не изучен. БВ также сопровождается повышенным риском преждевременных родов. Причем, чем раньше диагностируется БВ, тем выше вероятность рождения недоношенных детей [3].
На микроэкологию влагалищной среды влияют физиологические изменения в организме беременной, сопровождающиеся временной иммуносупрессией и гормональной перестройкой.
Как известно, с развитием беременности снижается количество транзиторных микроорганизмов. Активный рост лактобацилл приводит к увеличению кислотности влагалища, что, однако, является благоприятным условием для размножения генитальных микоплазм и дрожжеподобных грибов рода Candida. Частота выделения последних иногда достигает 25–30% [12, 13]. К моменту родов доминирование лактобактерий становится абсолютным, и в родовых путях создается оптимальная бактериальная среда.
По данным отечественных авторов [14], нарушение микроценоза влагалища у беременных в 40–60% случаев приводит к заболеваниям шейки матки с последующим воспалением плодных оболочек и развитием инфекции околоплодных вод. Контаминация микробной флорой родовых путей способствует достоверному увеличению воспалительных заболеваний после родов. У большинства родильниц с гнойно-воспалительными заболеваниями после операции кесарева сечения спектр микроорганизмов в полости матки соответствует нарушенному микробиоценозу влагалища.
К факторам, инициирующим нарушение вагинального микроценоза, относится широкое использование противоинфекционных препаратов. Это сродни дисбиозу кишечника, часто наблюдаемому после длительной антибактериальной терапии и свидетельствующему о единстве дисбиотических процессов. Поскольку микрофлора влагалища обладает эстрогензависимой способностью, нарушение менструального цикла по типу олигоменореи или неполноценной лютеиновой фазы также может быть фактором риска ВИ [15]. Ситуация усугубляется на фоне значительного увеличения числа беременных с экстрагенитальной патологией, индуцированной беременностью, использования гормонального лечения, случаев абдоминального родоразрешения, широкого внедрения инвазивных лечебно-диагностических методик [2, 16].
В настоящее время имеются данные, подтверждающие этиологическую роль полимикробных ассоциаций в развитии ВИ как воспалительного, так и невоспалительного генеза. Как известно, одни и те же условно патогенные микроорганизмы в разных условиях могут быть возбудителями ВИ либо входить в состав нормальной микрофлоры влагалища [6, 17]. Таким образом, объективное представление о соответствии критериям нормального микробиоценоза или состоянию дисбаланса можно получить только на основании количественной оценки всех компонентов микрофлоры влагалища. Клинические проявления оппортунистических ВИ как вне беременности, так и в период беременности также зависят от количественного и видового состава микроорганизмов [7, 9].
При наличии вагинальной инфекции у беременных и родильниц преобладают условно патогенные бактерии семейства энтеробактерий в ассоциации с облигатно-анаэробными бактериями группы бактероидов-превотелл и анаэробных кокков (Enterobacteriaceae, Bacteroides, Prevotella spp., Staphylococcus, Streptococcus, Corynebacterium, Candida и др.). При этом нередко ониц сочетаются с вирусами, уреаплазмами и микоплазмами [5–7, 18]. Кроме того, возрастает роль оппортунистических инфекций во внутриутробном инфицировании плода [7, 14, 19].
Как уже отмечалось, у беременных с ВИ часто имеет место бактериальный вагиноз. По данным эпидемиологических исследований, частота БВ зависит от контингента обследованных женщин. Так, в амбулаторной поликлинической практике данный показатель составляет 15–25%, у женщин с инфекциями, передаваемыми половым путем, – до 40%, в структуре воспалительных заболеваний половых органов женщин репродуктивного возраста – 40–60%, у беременных – 20–46%. По мнению специалистов, это обусловлено объективным различием этнических популяций, медико-социальными условиями и проч. [1, 4, 20].
Первичными возбудителями БВ считаются анаэробные бактерии, в частности Gardnerella vaginalis, Atopobium vaginae, Prevotella spp., Mobiluncus spp., Mycoplasma hominis, концентрация которых нередко достигает 10 10 КОЕ/мл. Дисбиоз влагалища связан с нарушением физиологического взаимодействия микроорганизмов во влагалищном биотопе. При БВ концентрация аэробных и анаэробных микроорганизмов увеличивается в несколько раз. На этом фоне уменьшается концентрация факультативных лактобацилл, что приводит к снижению содержания молочной кислоты, кислотности влагалищного содержимого и росту анаэробов [6, 8, 15].
Кандидозный вагинит при беременности регистрируется в 30–40% случаев. Перед родами этот показатель может достигать 45–50%. Это объясняется изменением гормонального баланса: из-за повышения уровня эстрогенов и прогестерона увеличиваются адгезивные свойства эпителиоцитов влагалища. Помимо этого гиперэстрогенемия способствует повышенной пролиферации клеток влагалищного эпителия и увеличению содержания в них гликогена – питательной среды для грибов.
В зависимости от состояния вагинального микробиоценоза выделяют две формы кандидозной инфекции влагалища:
истинный кандидоз – грибы выступают в виде моновозбудителя (высокая концентрация грибов сочетается с высокой концентрацией лактобактерий);
сочетание КВ и БВ – грибы участвуют в микробных ассоциациях (грибы вегетируют при доминировании облигатных анаэробов) [13, 16, 18].
В 85–90% случаев возбудителем КВ является Candida albicans, частота выделения C. glabrata – 15–30%. Кроме того, C. glabrata значительно чаще выделяется у пациенток на фоне сахарного диабета и ВИЧ-инфекции. Кандидозный вагинит, вызванный C. glabrata, нередко протекает в хронической рецидивирующей форме. При этом в 7% случаев возбудители устойчивы к имидазольным антимикотикам [3, 4, 21].
К возбудителям аэробного вагинита относятся преимущественно факультативно-анаэробные бактерии: стрептококки группы В (62,2%), энтерококки (48,7%) и эшерихии (40,5%). При сочетании АВ у беременных с БВ или КВ этиотропное лечение неэффективно [6].
Поскольку симптомы различных форм ВИ неспецифичны, правильная тактика ведения невозможна без лабораторного подтверждения. Из-за этиологической роли условно патогенных микроорганизмов и их ассоциаций диагностика ВИ несколько затруднительна. Выделение из отделяемого влагалища микроорганизма, входящего в состав нормальной вагинальной микрофлоры, еще не говорит об этиологической роли в развитии инфекции. Только определение количественного соотношения видов микроорганизмов позволяет охарактеризовать степень нарушения микробиоты и подтвердить участие этих микроорганизмов в этиологии заболевания [1, 12, 17].
Согласно современным рекомендациям, лабораторная диагностика ВИ включает микроскопический и культуральный методы.
Для клинического диагноза БВ в отечественных и зарубежных руководствах рекомендуется использовать критерии Amsel, включающие четыре признака:
Наличие трех из четырех признаков достаточно для постановки диагноза [22].
В зарубежных работах при количественной оценке микрофлоры влагалища используются критерии Nugent. Количество морфотипов оценивается по десятибалльной шкале:
Читайте также:


