Микроорганизмы вызывающие инфекции лор органов
У большинства пневмококков есть полисахаридная капсула, которая является важным фактором вирулентности. Известно более 90 серотипов S. pneumoniae, чатота выявления того или иного серотипа в популяции зависит от географического положения, возраста, социально-экономического статуса исследуемой группы, практики вакцинации в стране.
S. pneumoniae является возбудителем широкого круга инвазивных и неинвазивных инфекций человека, включая менингит, бактериемию, пневмонию, инфекции ЛОР-органов (средний отит, риносинусит), обострение хронической обструктивной болезни лёгких.
Распространённость инвазивных пневмококковых инфекций составляет 15-24 на 100000 населения; наиболее высокая их частота регистрируется у детей младше 2 лет, взрослых старше 65 лет, а также отдельных категорий лиц с факторами риска (функциональная и органическая аспления, ВИЧ-инфекция и др.).
Пневмококк является самым частым бактериальным возбудителям внебольничной пневмонии; пневмококковые пневмонии могут развиваться у пациентов любого возраста как в амбулаторной практике, так и в стационаре, однако чаще регистрируется среди пациентов с сопутствующими заболеваниями — хроническая обструктивная болезнь лёгких, сахарный диабет, алкоголизм; у лиц с аспленией, иммунодефицитом; нередко протекают с бактериемией (до 25-30%).
На долю S. pneumoniae приходится 40-50% случаев острых средних отитов бактериальной этиологии и 40% острых риносинуситов. Пневмококковые отиты сопровождаются самой высокой частотой развития гнойных осложнений (мастоидит и др.), тромбоза латерального синуса, тимпаносклероза и нарушений слуха у детей.
Следует отметить, что S. pneumoniae не является облигатным патогеном, он может выявляться у детей и взрослых в верхних дыхательных путях без каких-либо клинических проявлений. Бессимптомное носительство широко распространено у детей (до 30-70% случаев) и менее характерно для взрослых.
Для профилактики инвазивных пневмококковых инфекций разработаны различные типы вакцин — 23-валентная полисахаридная вакцина и конъюгированные 7-, 10- и 13-валентные вакцины, каждая из которых направлена на определённый спектр серотипов S. pneumoniae.
Некоторые штаммы H. influenzae имеют полисахаридную капсулу и могут быть подразделены на сероварианты в зависимости от антигенных свойств капсулы. Наличие капсулы имеет большое клиническое значение, так как она является основным фактором вирулентности. Большинство инвазивных инфекций вызывается штаммами H. influenzae типа b (Hib). Бескапсульные штаммы обозначаются как нетипируемые.
H. influenzae является патогеном исключительно человека. Инфицирование происходит воздушно-капельным путём или при контакте с контаминированным материалом. Инфекции, обусловленные гемофильной палочкой, можно подразделить на инвазивные (менингит, эпиглотит, септический артрит, и др.) и неинвазивные; к последним относятся такие распространённые респираторные инфекции, как средний отит, риносинусит, обострение хронической обструктивной болезни лёгких.
Первоначальным этапом патогенеза инфекционного заболевания является колонизация H. influenzae слизистой носоглотки, которая в последующем, при наличии предрасполагающих факторов (предшествующая вирусная инфекция, микроаспирация и др.), может обусловить попадание возбудителя в стерильные в норме локусы (полость среднего уха, альвеолы лёгкого и др.) с развитием инфекционного процесса.
Следует отметить, что гемофильные палочки, преимущественно нетипируемые штаммы, часто входят в состав нормальной микрофлоры верхних дыхательных путей у здоровых взрослых и детей, поэтому их выделение из нестерильных локусов, например мокроты, не всегда является достаточным для подтверждением этиологического диагноза респираторной инфекции.
Для детей первых лет жизни наиболее тяжёлыми клиническими формами гемофильной инфекции являются менингит и эпиглоттит (воспаление надгортанника). Эпиглоттит начинается остро, характеризуется быстрым подъёмом температуры тела, выраженной общей интоксикацией и картиной быстро прогрессирующей обструкции дыхательных путей.
Для специфической профилактики инвазивных инфекций, вызванных Hib, широко используется вакцинация детей первого года жизни.
В патогенезе инфекций, вызываемых S. pyogenes, имеют значение капсула, элементы клеточной стенки и секретируемые факторы (стрептолизин О, гиалуронидаза и др.). Кожа и слизистые оболочки человека служат естественным резервуаром данного микроорганизма, передача происходит воздушно-капельным путём или при непосредственном контакте. В организованных коллективах возможны вспышки заболевания.
БГСА — один из наиболее распространённых бактериальных возбудителей инфекций верхних дыхательных путей, в первую очередь тонзиллофарингита, скарлатины; может вызывать острый средний отит и риносинусит, инфекции кожи и мягких тканей. К иммунологически опосредованным осложнениям стрептококковой инфекции относятся такие серьёзные заболевания, как острая ревматическая лихорадка и постстрептококковый гломерулонефрит.
Частота выявления БГСА у взрослых с острым тонзиллофарингитом обычно составляет не более 5-15%, у детей — 32-43%. Среди детей нередко встречается бессимптомное носительство S. pyogenes в ротоглотке (15–20%).
Общность инфекций, вызванных данной группой бактерий, обусловлена устойчивостью к пенициллинам и другим β-лактамным антибиотикам в связи с отсутствием у бактерий клеточной стенки или их внутриклеточной локализацией, а также сходными методическими подходами к диагностике и лечению.
M. pneumoniae относится к классу Mollicutes, порядок Mycoplasmatales, включающий семейства Mycoplasmataceae и род Mycoplasma. Микоплазмы являются самыми мелкими по размерам среди внеклеточно культивируемых патогенных микроорганизмов. К основным биологическим особенностям M. pneumoniae, определяющим её место среди других прокариотов, а также эпидемиологическое значение и подходы к диагностике и лечению, относятся: отсутствие ригидной клеточной стенки, что обусловливает полиморфизм клеток; резистентность к различным агентам, подавляющим синтез клеточной стенки, прежде всего β-лактамным антибиоиткам, малый размер генома, определяющий ограниченность биосинтетических возможностей и высокие требования к условиям культивирования; способность паразитировать на мембране эукариотической клетки и длительно персистировать в организме человека.
Инфицирование при микоплазменной инфекции происходит воздушно-капельным путём. В патогенезе микоплазменных инфекций, особенно внелёгочной локализации, помимо инвазии и непосредственного повреждения эпителиальных клеток определённое значение имеют иммунологически-опосредованные механизмы повреждения.
M. pneumoniae является одним из наиболее частых возбудителей внебольничной пневмонии у взрослых (чаще у лиц молодого возраста и при нетяжёлом течении заболевания). У детей данный микроорганизм наиболее часто выявляется в возрасте 5-15 лет.
M. pneumoniae также может вызывать острый бронхит и инфекции верхних дыхательных путей, при этом для микоплазменной инфекции характерно постепенное прогрессирование и длительная персистенция симптомов заболевания. Типичными клиническими проявлениями являются боль в горле, осиплость голоса, лихорадка, в дальнейшем может появляться малопродуктивный кашель. Для детей младшего возраста характерен бронхообструктивный синдром.
M. pneumoniae может вызывать вспышки инфекции в организованных коллективах (военные части, школы, дома-интернаты, лечебные учреждения); подъёмы заболеваемости в странах Европы и США регистрируются с периодичностью в 4-7 лет.
C. pneumoniae — облигатный внутриклеточный бактериальный патоген из семейства Chlamydiacea, род Chlamydophila. Обладает тропностью к эпителию дыхательных путей и макрофагам, характеризуется двухфазным циклом развития, который представляет собой чередование двух функционально и морфологически различных форм: элементарных и ретикулярных телец. Элементарные тельца являются инфекционной формой, метаболически малоктивной и адаптированной к внеклеточному существованию. Ретикулярные тельца — это внутриклеточная, метаболически активная форма, обеспечивающая репродукцию микроорганизма. Благодаря своим морфологическим и функциональным особенностям C. pneumoniae способна к длительной персистенции в клетках хозяина и индукции слабого иммунного ответа. С наличием специфического белка теплового шока (C. pneumoniae heat shock protein 60) ассоциируется способность данного микроорганизма индуцировать гиперреактивность бронха и активировать функцию макрофагов.
C. pneumoniae — актуальный возбудитель различных респираторных инфекций, из которых наиболее частыми являются внебольничная пневмония и острый бронхит. Клиническое течение пневмонии хламидийной этиологии может варьировать от лёгких случаев с тенденцией к спонтанному разрешению до тяжёлых; последнее более характерно для пациентов пожилого возраста с сопутствующими бронхолёгочными заболеваниями и иммунодефицитом.
C. pneumoniae может являться этиологическим агентом тонзиллофарингита, риносинусита, острого среднего отита, вызывать обострение хронической обстуктивной болезни лёгких. Для большинства инфекций, ассоциирующихся с C. pneumoniae, характерно малосимптомное течение с постепенным прогрессированием симптомов или их волнообразным изменением и длительной персистенцией.
C. pneumoniae может вызывать вспышки в организованных коллективах и выявляться в ассоциации с другими возбудителями.
L. pneumophila относится к роду Legionellа, который является единственным в семействе Legionellaceae. Легионеллы являются факультативными внутриклеточными паразитами, которые широко распространены в окружающей среде. Они паразитирует в простейших, обитающих в пресных водоемах, активно колонизируют синтетические и резиновые поверхности водопроводного, промышленного, медицинского оборудования, где их накопление в высоких концентрациях может быть эпидемиологически опасныим и являться причиной вспышек легионеллёза. В организме человека размножаются преимущественно в альвеолярных макрофагах, полиморфно-ядерных лейкоцитах и моноцитах крови.
В настоящее время известно больше 50 видов легионелл. Однако, бо́льшая часть случаев легионеллёза внебольничного происхождения (до 90%) ассоциированы с одним видом — L. pneumophila.
Лихорадка Понтиак — это ОРВИ-подобное заболевание, для которого характерен короткий инкубационный период (обычно 36–48 ч), 1–2-дневное повышение температуры тела, сухой кашель, катаральные явления в носоглотке, головные и мышечные боли. Заболевание протекает, как правило, в нетяжёлой форме и разрешается самостоятельно в короткие сроки (2–7 дней).
При болезни легионеров инкубационный период составляет 2-10 дней. Клинические проявления легионеллёзной внебольничной пневмонии могут варьировать по тяжести от лёгких до очень тяжёлых. Несмотря на то, что в целом уровень заболеваемости болезнью легионеров невелик, спорадические случаи и эпидемические вспышки с летальными исходами регистрируются в разных странах ежегодно.
Ринит редко бывает самостоятельным заболеванием. Чаще всего насморк является симптомом какой–ли бо другой нозологической формы. Насморк наблюдается при различных ОРВИ или ОРЗ (грипп, парагрипп, аденовирусная инфекция, корь и др). Острые респираторные заболевания являются наиболее распространенными в структуре инфекционных заболеваний. В России ежегодно регистрируется около 50 млн. случаев инфекционных заболеваний, из них до 90% случаев приходится на острые респираторные вирусные инфекции. При патологии ЛОР–органов в первую очередь страдает слизистая оболочка с ее железистыми клетками. Основными этиологическими факторами в развитии воспаления слизистой оболочки ЛОР–органов является вирусная и бактериальная инфекция. Слизистая дыхательного тракта представляет собой весьма благоприятную среду для развития самых различных микроорганизмов: бактерий, вирусов и грибов. Поэтому инфекционные заболевания являются наиболее частыми заболеваниями в области патологии ЛОР–органов. В тот момент, когда защитные силы организма ослабевают, вследствие переохлаждения, воздействия холода и влаги, сквозняков, а также благодаря наличию факторов патогенности, вирулентные микроорганизмы, проникая в слизистую оболочку, вызывают отек, а также повышение продукции секрета слизистых желез и десквамацию эпителия. Наиболее часто ринит наблюдается в периоды резких температурных колебаний, что связано с изменением вирулентности (степени патогенности) микроорганизмов, а также с фактором переохлаждения. Особенно выраженная реакция слизистой оболочки полости носа наблюдается при охлаждении стоп. Это объясняется наличием рефлексогенных связей между стопами и слизистой носа.
В результате происходит блокирование естественных соустий околоносовых пазух отечной слизистой оболочкой и патологическим секретом. При этом возникающий блок соустьев затрудняет транспорт секрета из синусов. Аналогичная ситуация развивается при поражении слизистой оболочки носоглотки, приводящей к блокированию глоточных отверстий слуховой трубы. Застой секрета, нарушение вентиляции и связанные с этим явления гипоксии являются пусковым моментом к активизации сапрофитной флоры. Таким образом, первоначальная вирусная инфекция сменяется бактериальной, а первичная бактериальная патология может осложниться присоединением ассоциативной флоры, что приведет к утяжелению течения заболевания.
Столь частые заболевания респираторного тракта объясняются многообразием этиологических факторов (вирусы гриппа, парагриппа, аденовирусы, риновирусы, реовирусы, респираторно–синцитиальный вирус), а также легкостью передачи возбудителя от одного человека к другому. Помимо вирусов, поражение верхних дыхательных путей может быть вызвано бактериальными агентами, а также внутриклеточными патогенами – микоплазмами, хламидиями и легионеллами. Несмотря на прогресс в лечении самых разных заболеваний, этиотропная терапия вирусной патологии остается недостаточно разработанной. В связи с этим решающее значение в лечении ОРВИ по–прежнему принадлежит своевременному использованию симптоматических и патогенетических средств, направленных на подавление механизмов развития клинических проявлений и облегчение симптомов болезни. Возбудители ОРВИ обладают тропностью к слизистой оболочке верхних дыхательных путей. При проникновении их в клетки эпителия развивается локальная воспалительная реакция. Всасывание в системный кровоток продуктов клеточного распада приводит к системным токсическим проявлениям. Результатом является типичный для ОРВИ симптомокомплекс: сочетание местных (насморк, кашель, заложенность носа, боль или першение в горле, изменение тембра голоса) и общетоксических (головная боль, слабость, вялость, повышение температуры, боли в мышцах) реакций.
Инфекционный ринит является самым распространенным симптомом различных инфекций (инфекционных болезней), которые протекают с поражением верхних дыхательных путей. При этом, кроме самого насморка, больной жалуется и на другие симптомы, характерные для той или иной болезни. Часто одновременно с насморком появляется головная боль, повышается температура тела, появляется чувство усталости и разбитости. Развитие инфекционного ринита определяется прямым агрессивным действием патогенных микробов (бактерий или вирусов) на слизистую оболочку носа. Как уже упоминалось выше, слизистая оболочка носа является первым барьером защиты дыхательных путей, поэтому на слизистой носа ежесекундно осаждаются сотни или даже тысячи микробов. Большинство из этих микроорганизмов являются представителями сапрофитной микрофлоры и не причиняют человеку никакого вреда, тогда как другие способны спровоцировать развитие инфекционного заболевания (патогенные, болезнетворные микробы). При инфекционном рините размножение микробов на слизистой носа приводит к ее повреждению и отслаиванию верхней части эпителия. Этот процесс и объясняет все проявления насморка: чувство жжения в носу, истечение слизи (эксудата), заложенность носа, изменения голоса (гнусавость) и др. Нужно заметить, что истечение слизи из полости носа при насморке вызывается реакцией кровеносных сосудов и эпителия слизистой носа на воспаление. Истечение мокроты из носа – это основной защитный механизм при насморке: с мокротой из организма выводятся болезнетворные микробы.
При этом четко сменяются основные фазы воспалительного процесса. Так, попадая с вдыхаемым воздухом на слизистую оболочку носа, вирусы проникают в поверхностные клетки, имеющие реснички, и там развиваются в течение 1–3 дней. В норме реснички совершают колебательные движения, благодаря чему и происходит механическое очищение носа от чужеродных агентов, которое предохраняет организм от возможной адгезии и инвазии микроорганизмов. Вирусы, попадая на слизистую оболочку верхних дыхательных путей и репродуцируясь в ее клетках, вызывая альтерацию, резко нарушают её целостность. Размножение вирусов сопровождается цитопатическим эффектом, степень выраженности которого обусловлена особенностями возбудителя. В слизистой оболочке респираторного тракта при этом развивается воспаление, сопровождающееся резкой вазодилатацией с увеличением проницаемости сосудистой стенки и усиленной экссудацией. Нарастают явления ацидоза, создаются условия для присоединения вторичной бактериальной инфекции, являющейся причиной осложнений острого ринита. При этом, помимо слизистой оболочки носа, может поражаться и слизистая оболочка околоносовых пазух, а также среднего уха.
Первая стадия (сухого раздражения) развивается быстро, длится от нескольких часов до 2 суток. Слизистая оболочка резко бледнеет за счет сужения сосудов, отмечается сухость, жжение в полости носа, многократное чихание. Следом за этим наступает вторая стадия – серозных выделений, которая характеризуется выходом транссудативной жидкости, богатой медиаторами воспалительных реакций, которая в среднем продолжается от 2 до 3 дней. При остром воспалении преобладают экссудативные процессы. Первона чально, на ранних стадиях воспаления, экссудат серозный, затем слизисто–серозный. При этом повышается проницаемость капилляров и развивается отек слизистой оболочки; происходит резкое расширение сосудов, покраснение слизистой и отек носовых раковин. Отмечается затрудненное носовое дыхание, при вирусном инфицировании обильные прозрачные водянистые выделения из носа, снижение обоняния, слезотечение, заложенность ушей и гнусавый оттенок голоса. Слизистая оболочка носа имеет ярко–красный цвет. Начало третьей стадии обусловлено выходом форменных элементов крови в очаг воспаления и соответствует стадии пролиферации воспалительной реакции. Чаще всего третья стадия характеризуется присоединением бактериальных патогенов, которые в обычных условиях вегетируют на слизистой оболочке верхних дыхательных путей, составляя так называемую транзиторную микрофлору. С присоединением бактериальной инфекции отделяемое из носа становится гнойным, содержащим большое количество лейкоцитов и детрита. Общее состояние пациентов, как правило, при этом улучшается, постепенно восстанавливаются носовое дыхание и обоняние, но выделения из носа приобретают желтый или зеленый цвет и более густую консистенцию. Цвет слизистой оболочки носа постепенно приближается к нормальному, и просвет носовых ходов постепенно расширяется.
Весь цикл болезни завершается за 7–10 дней. Отдельные стадии могут быть более или менее выраженными либо полностью отсутствовать, если не наступает вирусного или бактериального инфицирования. В ряде случаев при хорошем иммунитете и быстро начатом лечении выздоровление возможно в течение 2–3 дней; при ослабленном состоянии защитных сил организма и недостаточном лечении ринит может затянуться до 3–4 недель, перейти в хроническую форму или привести к развитию осложнений.
Помимо инфекционных заболеваний, в индустриально развитых странах в настоящее время от 10 до 20% населения страдают острыми аллергическими заболеваниями. Поскольку весь организм представляет собой единое целое, то в случае поражения слизистой оболочки одного органа процесс может легко распространяться на другие органы и ткани. Наблюдая проявление патологии в отдельном органе или системе, необходимо постоянно помнить о возможности распространения процесса и развития различных местных и общих осложнений. Кроме того, в патогенезе воспалительных заболеваний верхних дыхательных путей наряду с местным и общим воздействием возбудителя играют роль сенсибилизация организма и иммунологические сдвиги непосредственно в слизистой оболочке носа и околоносовых пазух.
Слизистая носа является той зоной, которая подвергается воздействию самых разнообразных инородных частиц. Молекулы аллергенов чрезвычайно быстро вызывают аллергическую реакцию, вследствие чего уже через минуту после проникновения аллергенов возникают чиханье, зуд в полости носа, ринорея. При аллергическом рините развивающиеся реакции относятся к реакциям немедленного типа. Их механизм состоит в последовательности сменяющих друг друга этапов. Реакция запускается взаимодействием аллергена с аллергическими антителами, относящимися к IgE. Взаимодействие аллергена с IgE происходит на тучных клетках соединительной ткани и базофилах. Затем следует высвобождение биохимических медиаторов из тучных клеток и базофилов. Гистамин является наиболее важным веществом, которое высвобождается из медиаторных клеток при аллергической патологии носа. Он оказывает разнообразное действие. Во–первых, прямое действие на клеточные гистаминовые рецепторы, что является основной причиной отека и заложенности носа. Во–вторых, гистамин оказывает непрямое рефлек торное действие, что приводит к чиханию. В–третьих, гистамин вызывает усиление проницаемости эпителия и гиперсекрецию. Все эти факторы в совокупности приводят к выраженному отеку слизистой оболочки и блокированию соустий пазух носа и слуховой трубы. Возникают необходимые предпосылки для развития уже инфекционного патологического процесса в ЛОР–органах.
В качестве других этиологических факторов поражения слизистой оболочки могут выступать также выхлопные газы, химические и пылевые раздражители, табакокурение, неблагоприятные метеорологические условия. Нежная эпителиальная ткань наиболее подвержена неблагоприятному влиянию экологических факторов. В городе, непосредственно у поверхности земли, обнаруживается наибольшая концентрация всех видов ксенобиотиков – свободно–радикальные соединения, канцерогены, соли тяжелых металлов, все виды аллергенов, ну и, конечно, патогенные микроорганизмы. Слизистая оболочка носа, полости рта и глотки находится в постоянном контакте с вдыхаемым воздухом и таким образом подвергается воздействию вредных факторов внешней среды, что приводит к ее отеку. В любом случае возникают условия, при которых слизистая носа легко инфицируется, реагируя появлением значительного отека.
В терапии острого ринита главная роль отводится назальным деконгестантам. Назальными деконгестантами (от congestion – застой) называют группу препаратов, вызывающих вазоконстрикцию сосудов слизистой оболочки полости носа. Являясь альфа–адрено миме тиками, назальные деконгестанты вызывают стимуляцию адренергических рецепторов гладкой мускулатуры сосудистой стенки с развитием обратимого спазма. Регуляция носового сопротивления обеспечивается собственной вегетативной иннервацией анатомических структур полости носа. В зависимости от параметров вдыхаемого воздуха (температуры, влажности) вегетативные механизмы регулируют кровенаполнение сосудов слизистой оболочки полости носа и кавернозных тел носовых раковин, а также количество и физико–химические свойства секретируемой слизи. Так, известно, что парасимпатическая стимуляция вызывает вазодилатацию и увеличение кровенаполнения слизистой оболочки, с увеличением количества и уменьшением вязкости слизи. И, наоборот, при симпатической стимуляции развивается вазоконстрикция и уменьшение кровенаполнения слизистой оболочки.
Несмотря на разницу патогенетических механизмов упомянутых явлений, общим для них является симптоматическая терапия назальными деконгестантами. Назальные деконгестанты быстро и эффективно ликвидируют симптомы заложенности носа и ринореи, чем обусловлена их высокая популярность у населения. Большинство деконгестантов продаются в отделах безрецептурного отпуска, и многие больные применяют их самостоятельно, без предварительной консультации с врачом. Именно с этим связано большое количество осложнений и предубеждение специалистов к этой группе препаратов. Важно помнить, что большинство вазоконстрикторов не рекомендуется применять длительными курсами, более 7 дней подряд. Не следует превышать указанные в аннотации дозы, особенно это касается препаратов в форме носовых капель, трудно поддающихся дозировке.
В настоящее время на отечественном рынке лекарств данная группа препаратов представлена очень широко, и зачастую пациентам очень не легко сделать выбор между ними. Одним из таких препаратов является достаточно известный и хорошо зарекомендовавший себя топический вазоконстриктор Отривин, который отличается по своим свойствам от других .–адрено миметиков. Отривин представляет собой лекарственную форму ксилометазолина с увлажняющими компонентами.
Отривин содержит сорбитол, который используется в фармацевтике и косметике и обладает свойствами увлажнителя, нормализуя уровень жидкости в слизистой, не допуская при этом пересыхания и раздражения и оказывая смягчающее действие на слизистую оболочку, а также метилгидроксипропилцеллюлозу, усиливающую увлажняющий эффект за счет усиления вязкости раствора.
Преимуществами препарата Отривин является высокая эффективность, которая позволяет активно снимать заложенность носа за счет сужения кровеносных сосудов слизистой, не раздражая ее и не нарушая функцию реснитчатого эпителия носоглотки. У него продолжительное (до 12 часов) действие, и его можно применять до 2–х недель при хроническом или затянувшемся насморке. Таким образом, препарат оказывает уникальное пролонгированное вазоконстрикторное воздействие.
Совсем недавно на аптечных прилавках появился принципиально новый препарат – Отривин Море, основным преимуществом которого является сам его состав. Средство представляет собой изотонический раствор, состоящий из океанической воды из Бретани, добываемую в экологически чистом районе Атлантического океана, обогащенной натуральными микроэлементами и минералами, что обеспечивает максимально бережный и физиологичный уход за полостью носа. Благодаря такому составу препарат Отривин Море идеально подходит для защиты слизистой оболочки носа от неблагоприятных условий города, а также для облегчения носового дыхания во время болезни. Отривин Море обеспечивает быструю элиминацию возбудителей и аллергенов, то есть многократно снижает их концентрацию и способствует механическому очищению поверхности слизистой оболочки носа. Помимо этого Отривин Море стимулирует клетки мерцательного эпителия, способствует нормализации выработки слизи и ее разжижению, а также повышает местный иммунитет. Важным преимуществом препарата является отсутствие какого–либо системного действия на организм пациента, что крайне важно людям, страдающих различными соматическими заболеваниями и опасающихся приема традиционных топических вазоконстрикторов из-за риска развития побочных эффектов. Кроме того у пациента появляется возможность снизить дозировку других лекарственных средств, применяемых для комплексного лечения, и ускорить выздоровление.
Отривин Море можно использовать как в профилактических и лечебных целях, так и для ежедневной гигиены полости носа. Новинка не содержит консервантов и дополнительных химических ингредиентов. Основ ными показаниями для назначения препарата являются острый ринит (включая аллергический) и заложенность носа. При насморке и аллергии Отривин Море облегчает дыхание, деликатно механически очищая носовые ходы, а также оказывает определенное антибактериальное воздействие. Кроме того, средство можно использовать для гигиены полости носа перед применением других лекарственных препаратов. В целях профилактики возможно использование препарата Отривин Море в период эпидемий различных вирусных заболеваний, препятствуя развитию различных форм инфекционного процесса на слизистой носа. Препарат также может применяться с целью гигиены полости носа, эффективно очищая слизистую носа и бережно увлажняя ее.
Не секрет, что многие назальные препараты вызывают дискомфортные ощущения при их приеме, что связано с раздражением слизистой оболочки полости носа. Отривин Море лишен данного побочного эффекта. Промывая полость носа, препарат удаляет пыль, бактерии и секрет и предотвращает ее пересыхание, тем самым, оберегая от раздражающего воздействия внешних факторов, что особенно важно людям, работающим в условиях чрезмерно сухого воздуха, например в помещениях с кондиционером или около нагревательных приборов, которым не понаслышке знакомо неприятное ощущение в полости носа.
Большое значение имеет форма выпуска препарата. При использовании носовых капель большая часть введенного раствора стекает по дну полости носа в глотку. В этом случае не достигается необходимый лечебный эффект. В этом плане намного более выгодным выглядит назначение дозированных аэрозолей. Уникальной особенностью препарата Отривин Море является выпуск в форме назального спрея, оснащенного уникальным анатомическим наконечником. Изогнутая форма насадки позволяет равномерно и аккуратно орошать слизистую носа и достигать даже ее самых труднодоступных участков. Благодаря такой конструкции средство увлажняет полость носа и тщательно очищает ее, обеспечивая комфортное дыхание в течение всего дня. К преимуществам спрея относят также: равномерное орошение слизистой носа, возможность достигать самых верхних участков носовой полости, экономичность.
Все вышесказанное позволяет утверждать, что препарат Отривин Море является надежным средством, очищающим слизистую оболочку носа у взрослых и детей, восстанавливая ее физиологическую функцию не вызывая при этом ее сухости и обладая стойким длительным эффектом, предотвращая тем самым развитие грозных осложнений и одновременно бережно воздействуя на ее структурные компоненты.
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
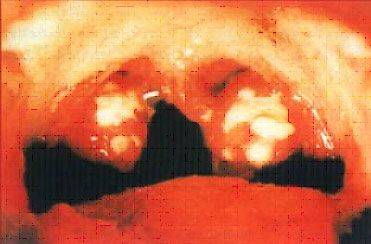
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
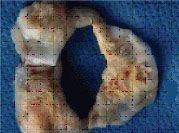
Аортальный клапан
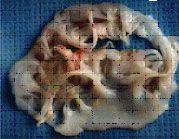
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
Читайте также:


