Микробиологические методы диагностики менингококковых инфекций
Глава 1
ПОКАЗАНИЯ К ЛАБОРАТОРНОМУ ИССЛЕДОВАНИЮ
Лабораторная диагностика менингококковой инфекции и гнойных менингитов (ГМ) осуществляется бактериологическим методом путем выделения и идентификации возбудителя, серологическим - путем выявления специфических антигенов в жидкостях организма (ликвор, кровь, синусоидальная жидкость и др.) или антител в сыворотке крови. Лабораторное обследование проводят с диагностической целью и по эпидемиологическим показаниям. С диагностической целью обследуют больных с клинически выраженной формой заболевания, локализованной формой (назофарингит) и с подозрением на менингококковую инфекцию и менингиты иной этиологии.
По эпидемиологическим показаниям обследуют лиц, бывших в контакте с больными менингококковой инфекцией.
Глава 2
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА МЕНИНГОКОККОВОЙ ИНФЕКЦИИ
И ДРУГИХ ГНОЙНЫХ БАКТЕРИАЛЬНЫХ МЕНИНГИТОВ
В связи с тем, что наряду с менингококками, наиболее частыми этиологическими факторами гнойных менингитов могут быть пневмококки, а у детей младшего возраста - H.influenzae и др. возбудители, представляется целесообразным изложение основных дифференциально-диагностических признаков и методов выделения этих микроорганизмов. По классификационной систематике бактерий Bergey (I том, 1994 г., 9-е издание), менингококки принадлежат к семейству Neisseriaceae роду Neisseria, к группе 4 - грамотрицательные аэробные / микрофильные палочки и кокки и к подгруппе 4 А - Аэробы. Род нейссерий включает два вида патогенных микроорганизмов: N.meningitidis и N.gonorrhoeae, остальные представители этого рода являются резидентной флорой слизистых оболочек. К последним относятся пигментообразующие, объединенные в один вид N.subflava, а также N.sicca, N.mucosa, N.flavescens, N.lactamica. Катаральный диплококк выделен в род Moraxella и обозначен как Moraxella (Branhamella) catarrhalis.
Менингококки требовательны к условиям культивирования. При росте требуют повышенной влажности и 5 - 10% содержания CO2 в воздухе, чувствительны к малейшим отклонениям температуры. В качестве источника нативного белка рекомендуется применять сыворотку крупного рогатого скота, лошадиную или кровь различного происхождения.
Основой для приготовления сред могут служить бульоны на основе гидролизата мяса по Хоттингеру, "эритрит-агар", агар АГВ, сухой питательный агар специального назначения и аминопептид для микробиологических питательных сред (жидкий). Сухие питательные агары, а также сыворотки крови должны быть обязательно проверены на пригодность для культивирования менингококка. Проверку необходимо проводить со свежевыделенной культурой или эталонным штаммом менингококка, хранившимся в высушенном состоянии.
Идентификация вида N.meningitidis основана на комплексе морфологических, тинкториальных, культуральных и биохимических признаков (таблица 1). При первом выделении менингококкам свойственен полиморфизм, который проявляется в различной величине и разной интенсивности окрашивания микробных клеток. Колонии менингококков на сывороточном агаре бесцветные, круглые с ровным краем, опалесцирующие, выпуклые, имеют маслянистую консистенцию, легко снимаются петлей со среды, что отличает их от колоний непатогенных нейссерий, имеющих крошащуюся или тянущуюся консистенцию. Некоторые штаммы, выделенные из спинномозговой жидкости (СМЖ), могут обладать слабой ферментативной активностью в отношении глюкозы или мальтозы или обоих углеводов. Большинство непатогенных видов нейссерий, в отличие от патогенных, способны при выращивании на сывороточном агаре с 5% сахарозы образовывать крахмалоподобное вещество (полисахарид), выявляемое с помощью водного раствора Люголя, в виде появления бурого окрашивания культуры.
Менингококки делятся на следующие серогруппы: A, B, C, X, Y, Z, 29Е, Д, 135W, К, Н. Проведение серологического группирования менингококков является обязательным для практических лабораторий как одна из мер эпидемиологического надзора за менингококковой инфекцией.
Наличие ферментов оксидазы и каталазы присуще всем нейссериям и М.catarrhalis в отличии от гемофилов и пневмококков, что может служить дифференцирующим признаком при идентификации в сочетании с другими (таблица 2).
Пневмококки и гемофилы, как и менингококки, являются высокотребовательными к культивированию микроорганизмами. В качестве фактора, способствующего их росту используют кровь различного происхождения. Поэтому универсальной средой для всех возбудителей может служить "шоколадный" агар. Заболевания, где этиологическим агентом являются гемофилы, характеризуются воздушно-капельным механизмом передачи, что способствует их широкому распространению. Среди видов гемофильных бактерий, наибольшей патогенностью обладает Н.
Этот возбудитель имеет несколько специфических сероваров: a, b, c, из которых ведущую роль в этиологии генерализованных гнойно-септических инфекций играет инкапсулированная форма серовара "b" (Hib), относящейся к биотипу 1.
Для проведения достоверной бактериологической диагностики гнойных бактериальных менингитов необходимо обеспечить забор материала от больных в полном объеме с соблюдением сроков забора, доставки патологического материала и условий транспортировки.
Материал для бактериологических и серологических исследований доставляются в бактериологическую лабораторию немедленно после забора в специально оборудованных контейнерах при температуре 37 град. C.
При невозможности немедленной доставки допускается хранение патологического материала в условиях термостата при температуре 37 град. C в течение 18 часов.
В бактериологическую лабораторию материал доставляется в следующем объеме:
1. Ликвор для первичного посева, бактериоскопии и серологических исследований в количестве не менее 2,0 мл.
2. Ликвор в 0,1% полужидком агаре (среда обогащения) для бактериологического накопления культуры; 0,5 мл ликвора засевают в 5,0 мл полужидкого агара немедленно у постели больного.
3. "Толстая капля" крови для бактериоскопии.
4. Кровь в жидкой питательной среде - 5,0 мл крови засевают в 0,1% полужидкий агар (среда обогащения).
5. Кровь в количестве не менее 2,0 мл для серологических исследований (РПГА, ВИЭФ, ЛА и др.).
Объектом исследования является спинномозговая жидкость (для установления диагноза менингита). Исследованию подвергается также слизь из носоглотки больных и здоровых лиц при обследовании на бактерионосительство, кровь при подозрении на сепсис, а также органы людей, умерших от менингококковой инфекции. При исследовании любого материала необходимо помнить о крайней лабильности менингококка и предусмотреть все условия для сохранения: производить исследование как можно быстрее, при доставке защищать материал от холода, в лаборатории хранить его в термостате до исследования.
Спинномозговую жидкость получают при соблюдении асептических условий путем люмбальной пункции. Жидкость при менингите мутная, так как содержит гнойные клетки и выходит струей под большим давлением (в норме жидкость прозрачная и вытекает по каплям, медленно).
Схема №7. Микробиологическое исследование при менингококковой
Инфекции и бактерионосительстве (по Борисову л.Б., 2001 г.)
Ликвор, слизь из зева и носа, кровь, гной,



Ликвор
Бактериоскопическое Бактериологическое Серодиагностика
исследование исследование
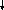

1 этап Мазок, окраска Посев на сыво- В реакции РПГА
по Граму роточный пита- встречного
сыворотками тельный агар иммуноэлектрофореза
Люминесцентная преципитирующими

микроскопия мазков, антименингококковыми
флюоресцирующей
2 этап Характер Посев на сывороточный
колоний питательный агар
(чистая культура)
3 этап Мазок, 


Определение окраска по Посев на Серотипи-
к антибиотикам ряд культуры
Спинномозговую жидкость берут в количестве 2-5 мл и делят на две части: одну центрифугируют и исследуют осадок, к другой добавляют полужидкую питательную среду и выдерживают при 37 о С для накопления бактерий.
Из исследуемого материала готовят мазки и производят посевы.
Бактериоскопическое исследование. Мазки из осадка спинномозговой жидкости окрашивают по Граму и микроскопируют. При наличии гноя в большинстве случаев обнаруживаются типичные, грамотрицательные диплококки, имеющие характерное расположение – внутри лейкоцитов, что позволяет сделать окончательное заключение о менингококковой инфекции. При микроскопии мазков из носоглотки бактерионосителей наряду с менингококком обнаруживаются грамположительные стафилококки и стрептококки, а также непатогенные нейсcерии - Branchamella и др. Дифференцировать их по морфологической картине мазка не представляется возможным.
Для экспресс - диагностики и выявления менингококков в исследуемом материале используется также метод флюоресцирующих антител.
Бактериологическое исследование. Исследуемый материал засевают петлей на чашки с питательным агаром, содержащим кровь, сыворотку крови или асцитическую жидкость. Кроме того, используют данную среду с добавлением антибиотика ристомицина (150 ЕД/мл.), который задерживает размножение грамположительных кокков, содержащихся в исследуемом материале, и тем самым способствует выделению чистой культуры менингококка. Образование колоний менингококка на этих средах наблюдается через 48 часов после инкубации посевов при 37 0 C. В отличие от других кокков, колонии менингококка величиной с булавочную головку, прозрачны имеют голубоватый оттенок и ровные края. Такие колонии пересевают в пробирку со скошенным агаром для получения чистой культуры.
Идентификацию чистой культуры, дифференциацию от сапрофитных нейссерий, обитающих в носоглотке, проводят по ряду признаков. Так, менингококки растут только в присутствии нативного белка, в то время как другие нейссерии размножаются на простых средах и образуют пигмент, на средах Гисса с добавлением сыворотки крови менингококк ферментируют глюкозу и мальтозу до кислоты.
Фаготипирование менингококка проводят для эпидемиологического анализа. Определение серовара производят в реакции агглютинации в пробирках.
Серологическое исследование. Для экспресс – диагностики с целью обнаружения в спинномозговой жидкости специфического полисахаридного менингококкового антигена используется метод встречного иммуноэлектрофореза.
В агаровых пластинках на стекле размером 9×12 см вырезают два параллельных ряда около 3 мм . В лунки одного ряда вносят исследуемую жидкость, в лунки другого ряда – преципитирующие менингококковые сыворотки разных серогрупп.
Для реакции используется веронал – мединаловый буфер. Пластинки помещают в аппарат для иммуноэлектрофореза на 40- 45 минут при комнатной температуре и силе тока около 30 А. При положительном результате между лунками со спинномозговой жидкостью и соответствующей антисывороткой образуются 1-2 полосы преципитации.
Для подтверждения диагноза и при серологическом обследовании больных используют также РПГА с парными сыворотками.
Гонококк - морфологически сходный с менингококком диплококк бобовидной формы, в культуре принимающий вид разрозненных полиморфных кокков. Неподвижен, не имеет спор, не образует капсул, по Граму красится отрицательно. В гнойном отделяемом типичное расположение гонококка внутри лейкоцитов (незавершенный фагоцитоз).
Для гонококка характерна крайняя нестойкость при воздействии физических и химических агентов: он погибает уже при температуре 40-41˚; даже в гное гонококк гибнет уже через несколько часов. Губительно действуют на гонококк и нитрат серебра в концентрации 1 : 1000, 1% раствор фенола, 0,05 % раствор биглюконата хлоргексидина. Чувствительны микроорганизмы и к антибиотикам - пенициллину, тетрациклину, эритромицину. Однако высокая заболеваемость гонореей в последние годы и самолечение больных привели к широкому распространению гонококков, устойчивых к сульфаниламидам и антибиотикам.
Гонококк чрезвычайно требователен к питательной среде; при выделении из организма растет только на средах с добавлением человеческого белка (асцитической жидкости, сыворотки, или крови). Растут лучше при содержании в атмосфере 3-10% СО2. На асцит агаре гонококки образуют прозрачные колонии с ровными краями и блестящей поверхностью. Биохимические свойства слабо выражены – из углеводов гонококки расщепляют только глюкозу, образуют каталазу и оксидазу. Протеолитической активностью не обладают.
3 2011, Т. 1, 1 Диагностика менигококковой инфекции и менингитов Циркуляция среди населения различных групп менингококков и непатогенных нейссерий создает у людей целую гамму устойчивости к различным агентам и определяет ряд особенностей развития эпидемического процесса. Результаты изучения антигенной структуры менингококков позволили разработать проспективную номенклатуру, которая имеет следующий вид: серогруппа : серотип по белку : субтип по белку : серотип по ЛПС. Например, В : 2а : Р 1,2 : L 3,7, что означает: штамм менингококка серогруппы В, серотипа 2а, субтипа 1,2, серотипа по ЛПС 3,7. Соответствующие современные классификации менингококков по различным антигенным системам позволяют определять их популяционные особенности и отбирать наиболее иммуногенные компоненты для конструирования вакцинных препаратов нового поколения. Основной фактор патогенности менингококка бактериальная капсула, защищающая менингококки от различных воздействий, в первую очередь от поглощения фагоцитами. АТ, образующиеся к полисахаридам капсулы, проявляют бактерицидные свойства. Токсические проявления менингококковой инфекции обусловлены липополисахаридами, сходными по химическим и биологическим свойствам с эндотоксинами энтеробактерий. Им принадлежит ведущая роль в патогенезе поражений сосудов и кровоизлияний во внутренние органы. Наиболее постоянный и диагностически значимый признак менингококцемии экзантема в виде характерной геморрагической сыпи (петехии, пурпура, экхимозы). В процессе метаболизма менингококк гибнет, освобождая эндотоксин, который является мощным нейротропным и сосудистым ядом, который, как и сам возбудитель, усиливает продукцию спинномозговой жидкости, чем и обусловлено развитие гипертензионного синдрома, который усугубляется изменением качественного состава ликвора. Пили являются фактором адгезии к слизистой оболочке носоглотки и тканям мозговой оболочки. Менингококки выделяют IgА-протеазы, расщепляющие молекулы IgА в шарнирной области, что защищает бактерии от действия Ig. Менингококковая инфекция строгий антропоноз. Различают три категории источников менингококковой инфекции: больные генерализованными формами; больные назофарингитом; носители. Входные ворота при менингококковой инфекции преимущественно носоглотка. В большинстве случаев заболевание протекает субклинически (менингококконосительство). Воспалительный процесс в месте внедрения (острый назофарингит) сопровождается яркой гиперемией и отечностью задней стенки глотки на фоне почти неизмененных небных дужек, миндалин и мягкого неба. Основной путь распространения в организме гематогенный. Менингококковую бактериемию сопровождает массовая гибель возбудителей и выделение эндотоксина (менингококкцемия). Генерализация наиболее часто связана с предшествующими респираторными инфекциями (особенно вирусными), нарушениями иммунного статуса, а также резкой сменой климатических условий. Патогенез заболевания включает поражения токсического и септического характера в сочетании с аллергическими реакциями. Преобладание того или иного компонента проявляется в различных клинических формах, подробно описанных в соответствующей литературе [2, 4, 11, 12]. Менингококк малоустойчив к воздействию факторов внешней среды, требователен к условиям культивирования. Температурный оптимум для него 36,5 37 С в атмосфере с повышенным содержанием СО 2 (5 10%) и влажности, чрезвычайно чувствителен к воздействию внешней среды. Менингококки нуждаются в высокопитательных средах, содержащих нативные белки или кровь животного происхождения. При росте на плотных питательных средах образуют небольшие, слегка выпуклые, полупрозрачные колонии с идеально ровными краями. При выдерживании посевов в термостате в течение 2 5 дней колонии увеличиваются в размере, становятся менее прозрачными и края их приобретают неровный вид. Биохимическая активность менингококков невелика и из числа многих углеводов они ферментируют только глюкозу и мальтозу с образованием кислоты без газа, не разжижают желатин, оксидазо- и каталазоположительны. Бактериальные менингиты Бактериальные гнойные менингиты группа инфекционных заболеваний нервной системы, характеризующихся развитием общеинфекционного, общемозгового, менингеального синдромов и воспалительными изменениями в цереброспинальной жидкости гнойного характера [2, 12]. По данным Всемирной Организации Здравоохранения (ВОЗ) ежегодно в мире регистрируется 1 млн случаев гнойных бактериальных менингитов, из которых 200 тыс. заканчиваются летально. Гнойные бактериальные менингиты могут вызывать следующие микроорганизмы: N. meningitidis, H. influenza, S. pneumonia, Acinetobacter, Actinobacillus, Aeromonas, B. dermatitidis, B. zoohelcum, Bacillus, Balneatrix, Borrelia, C. burnetii, Campylobacter, Capnocytophaga, CDC group IIe, Citrobacter, Coccidioides, Commamonas, E. coli, E. me- 53
Менингококковая инфекция и гнойные бактериальные менингиты относятся к категории социально значимых инфекций с высокими показателями летальности (10-25%), инвалидизации (до 50%) и вовлечением в эпидемический процесс детей младших возрастных групп (более 50%).
Эпидемиологическая ситуация по менингококковой инфекции в Российской Федерации за последние годы имеет медленную тенденцию к снижению, при этом сохраняется спорадическая заболеваемость.
Развитие бактериального менингита начинается с момента, когда вирулентные микроорганизмы преодолевают защитные барьеры центральной нервной системы, при этом в первую очередь в процесс вовлекается субарахноидальное пространство.
По данным отечественных авторов, основным этиологическим фактором бактериального менингита в Росси является Neisseria meningitides серотипы А и С (примерно 65%), Streptococcus pneumoniae (20%), Haemophilus influenzae тип b (10%), 5% прочие это: Enterobacteriaceae , Listeria monocytogenes и другие.
Структурной особенностью возбудителей являются поверхностные образования – пили, которые снабжены рецепторами, обепечивающие тропную адгезию бактериальной клетки к слизистой оболочке. Кроме того они снабжены наружной оболочкой из полисахаридов, которая определяет такие факторы вирулентности, как невозможность фагоцитоза и препятствует лизису бактерий. Именно по составу полисахарида менингококки классифицируют на 12 серологических групп, из которых только три серогруппы (А,В,С) отвечают за более чем 90% случаев клинически выраженной генерализованной менингококковой инфекции.
Основным биологическим материалом для исследования при бактериальных менингитах служит спинномозговая жидкость и кровь. Для бактериологического подтверждения менингококкового назофарингита и выявления назофарингиального менингококкового носительства исследуют носоглоточную слизь.
В диагностическую цепочку кроме культурального метода исследования включены экспресс методы.
Наиболее простым методом, не требующим сложного оборудования и дорогостоящих реактивов, является метод латекс-агглютинации с применением тест-систем, позволяющий в течение 15 минут дать заключение об отсутствии или наличии в исследуемом материале (СМЖ, ликвор) больного специфических антигенов.
Встречный иммуноэлектрофорез позволяет с помощью специфических антисывороток выявлять полисахаридный антиген возбудителя в СМЖ и сыворотке крови больного уже в первый день исследования материала.
Вспомогательным методом диагностики менингококковой инфекции является реакция непрямой гемагглютинации с "парными" сыворотками крови, постановка которой выявляет динамику нарастания титров специфических антител к менингококку и позволяет определить принадлежность возбудителя к наиболее распространенным серогруппам менингококков (А и С).
Более высокой чувствительностью и специфичностью является ПЦР, которая дает возможность установить этиологический фактор в первые сутки болезни. Кроме этого ПЦР играет важную роль в расшифровке менингитов вирусной этиологии.
По результатам проведенных серологических исследований в 2017-2018 годах отмечаются иммунологические сдвиги в сыворотках крови при обследовании к менингококкам серогруппы А, тогда как положительных сдвигов к менингококкам серогруппы С отмечено не было. Данные серологические исследования указывают на возможное отсутствие циркуляции менингококка серогруппы С и циркуляцию менингококка серогруппы А среди учащихся Республики Марий Эл разных возрастных групп.
Актуальность изучения менингитов определяется с одной стороны высокими показателями заболеваемости, распространенностью носительства, широким спектром этиопатогенов, ростом резистентности возбудителей к наиболее распространенным антибиотикам, а с другой - трудностью диагностики, связанной со сложностью культивирования возбудителей традиционными методами. Поэтому рационально организованная, комплексная, лабораторная диагностика бактериальных менингитов любой этиологии, включающая в диагностическую цепочку все методы исследования: от культивирования до ПЦР метода позволяет достоверно контролировать состояние проблемы этой инфекционной патологии.
исследований микробиологической лаборатории
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
1. Таксономия боррелий, лептоспир и трепонем, и названия заболеваний, вызываемых ими.
2. Микроскопическая диагностика сифилиса.
3. Реакции, используемые в серодиагностике сифилиса. Общая характеристика каждой из них.
4. Серодиагностика сифилиса с использованием РПГА.
5. Серодиагностика сифилиса с использованием ИФА.
6. Серодиагностика сифилиса с использованием РСК.
7. Методы микробиологической диагностики лептоспироза.
8. Методы микробиологической диагностики боррелиозов
9. Ультрамикроскопическое строение спирохет в виде схемы. Указать название структур этих микроорганизмов.
10. Ультраозвученный трепонемный антиген.
11. Кардиолипиновый антиген.
12. Инактивированная лептоспирозная вакцина.
13. Эритроцитарный трепонемный диагностикум.
14. Гемолитическая кроличья сыворотка к эритроцитам барана.
15. Единый бруцеллезный диагностикум.
16. Бруцеллезные вакцины.
17. Группы риска по бруцеллезу. Определение восприимчивых и невосприимчивых лиц
18. Проба Бюрне, компоненты, постановка, учет результатов.
19. Серодиагностика бруцеллеза.
20. Методы микробиологической диагностики туляремии. Характеристика перечисленных методов.
21. Реакция Асколи. Компоненты, постановка, учет результатов.
22. Характеристика возбудителя чумы
24. Сибиреязвенный иммуноглобулин.
25. Характеристика возбудителей сибирской язвы.
27. Характеристика возбудителя сифилиса.
28. Характеристика возбудителя возвратного тифа.
29. Характеристика возбудителя лептоспироза.
30. Виды трепонем, вызывающих невенерические трепонематозы, название этих болезней.
31. Характеристика возбудителя столбняка.
32. Характеристика возбудителя ботулизма.
33. Характеристика возбудителя дифтерии.
34. Характеристика возбудителей газовой анаэробной инфекции.
35. Бактериологический метод исследования при дифтерии.
36. Бактериологический метод исследования при газовой анаэробной инфекции.
37. Бактериологический метод исследования при ботулизме.
38. Определение токсигенности методом Оухтерлони.
39. Реакция нейтрализации токсина антитоксином. Компоненты, постановка, учет результатов.
40. Иммунотерапия столбняка.
41. Иммунотерапия ботулизма.
42. Иммунотерапия дифтерии.
43. Иммунотерапия газовой анаэробной инфекции
44. Специфическая профилактика столбняка.
45. Специфическая профилактика ботулизма.
46. Специфическая профилактика дифтерии.
47. Специфическая профилактика газовой анаэробной инфекции.
48. Возможные осложнения при иммунотерапии л антитоксическими сыворотками. Метод Безредка.
49. Характеристика стафилококков.
51. Методы микробиологической диагностики стафилококковой инфекции.
52. Специфическая иммунопрофилактика стафилококковой инфекции.
53. Определение критериев патогенности стафилококков.
54. Бактериологический метод исследования при стафилококковом сепсисе.
55. Характеристика стрептококков.
56. Факторы патогенности стрептококков. Перечислить болезни, вызываемые стрептококками
57. Методы микробиологической диагностики стрептококковой инфекции.
58. Характеристика менингококков. Заболевания, вызываемые ими. Факторы патогенности.
59. Принцип патогенеза эпидемического цереброспинального менингита.
60. Методы микробиологической диагностики эпидемического цереброспинального менингита.
61. Специфическая профилактика менингококковой инфекции.
62. Характеристика гонококков.
63. Бактериологический метод исследования гонореи.
64. Экспресс-метод в диагностике гонореи (РИФ).
65. Микроскопическая диагностика гонореи
66. Гонококковая вакцина.
67. Факторы патогенности менингококков.
68. Методы микробиологической диагностики менингококкового сепсиса.
69. Вакцины менингококковые.
70.Характеристика возбудителей туберкулеза.
71. Характеристика туберкулезной инфекции у человека.
72. Методы диагностики туберкулеза. Общая характеристика каждого из них.
73. Микроскопический метод диагностики туберкулеза.
74. Бактериологическая диагностика туберкулеза.
75. Аллергодиагностика туберкулеза.
76. Серологическая диагностика туберкулеза.
79. Эритроцитарный туберкулезный диагностикум.

Латексная агглютинация
Наборы для идентификации и дифференциации микроорганизмов из клинического материала или из чистой культуры методом латексной агглютинации.
Выпускаются в двух форматах:
1) Жидкие
Латексный реагент представлен в жидкой форме, хранение при + 2-8° С 1 год
Латексный реагент нанесен на реакционную карточку и лиофилизирован, хранение при + 2-25° С до 2 лет
Артикул
Название (русское/английское)
Фасовка
Описание
Бактериальный менингит
Набор Wellcogen на менингококковые инфекции/Wellcogen Bacterial Antigen Kit
Быстрый тест для прямого определения антигенов в жидкостях тела методом латексной агглютинации (цереброспинальной жидкости, сыворотке, моче, крови, культуре с питательной среды):
- Streptococcus гр. B
- H. influenzae тип b
- N. meningitidis групп A, C, Y, W135
- N. meningitides гр. B/E.coli K1.
- Время реакции – 3 минуты
- Чувствительность – 97% *
- Специфичность – более 98%
- В состав набора входят все необходимые компоненты
*для Н. influenzae тип b
Набор Wellcogen для определения H. influenzae b/Wellcogen Haemophilus influenzae b Test Kit
Прямое определение антигенов в жидкостях тела (цереброспинальной жидкости, сыворотке, моче, крови, культуре с питательной среды)
Набор Wellcogen для определения N. meningitidis A, C, Y, W 135/Wellcogen Neisseria meningitidis A, C, Y, W135 Test Kit
Прямое определение антигенов в жидкостях тела (цереброспинальной жидкости, сыворотке, моче, крови, культуре с питательной среды)
Набор Wellcogen для определения N. meningitidis B/E. coli K1/Wellcogen Neisseria meningitidis B/E. coli K1
Прямое определение антигенов в жидкостях тела (цереброспинальной жидкости, сыворотке, моче, крови, культуре с питательной среды)
Набор Wellcogen для определения стрептококков группы B/Wellcogen Strep B Rapid Latex Agglutination Test
Прямое определение антигенов в жидкостях тела (цереброспинальной жидкости, сыворотке, моче, крови, культуре с питательной среды)
Набор Wellcogen для определения Streptococcus pneumoniaе/Wellcogen Streptococcus pneumoniae Test Kit
Прямое определение антигенов в жидкостях тела (цереброспинальной жидкости, сыворотке, моче, крови, культуре с питательной среды)
Streptococcus
Набор для диагностики стрептококков групп A, B, C, D, F и G /PathoDxtra Strep Grouping Kit

Быстрый тест для дифференциации групп стрептококков A, B, C, D, F и G по Лансфильду с первичных чашек с культурой.
- Мгновенная экстракция без инкубации для восстановления
- Работа напрямую с колониями, без разведения в пробирках
- Сокращение времени проявления результатов
- Не требует дополнительных реагентов
- Идентификация всех клинически значимых стрептококков, включая группу D
- Возможность дополнить набор наиболее расходуемыми реагентами
Набор для диагностики стрептококков групп A/PathoDxtra Strep Group A Latex
Предназначен только для использования с набором DR0700M
Набор для диагностики стрептококков групп B/PathoDxtra Strep Group B Latex
Предназначен только для использования с набором DR0700M

Набор для диагностики стрептококков групп C/PathoDxtra Strep Group C Latex
Предназначен только для использования с набором DR0700M
Набор для диагностики стрептококков групп D/PathoDxtra Strep Group D Latex
Предназначен только для использования с набором DR0700M
Набор для диагностики стрептококков групп F/PathoDxtra Strep Group F Latex
Предназначен только для использования с набором DR0700M
Набор для диагностики стрептококков групп G/PathoDxtra Strep Group G Latex
Предназначен только для использования с набором DR0700M
Набор Streptex для диагностики групп стрептококков A, B, C, D, F и G (ферментная экстракция)/Streptex

Набор для идентификации стрептококков групп A, B, C, D, F, G по Лансфильду с использованием ферментной экстракции
Набор для диагностики стрептококков групп A, B, C, F и G (кислотная экстракция)/Streptex Rapid
Набор для идентификации стрептококков групп A, B, C, F, G по Лансфильду с использованием кислотной экстракции
Набор для быстрой диагностики стрептококков групп A, B, C, F и G (кислотная экстракция)/Streptex Acid Extraction Kit
Набор для быстрой кислотной экстракции для использования с Streptex Rapid Latex Agglutination Test для идентификации стрептококков групп A, B, C, F, G по Лансфильду
Набор DrySpot для диагностики Streptococcus pneumonia/Pneumo
Сухой латексный тест для подтверждения Streptococcus pneumoniae в культурах на чашках или положительных культурах крови.

Staphylococcus и MRSA (метициллин-резистентный стафилококк)
Набор DrySpot для идентификации Staphylococcus aureus (MRSA)/Dryspot Staphytect Plus
Сухой латексный тест для идентификации S. aureus после первичного посева
Плазма кроличья для выявления коагулазы (лиофилизированная)/Coagulase Plasma (lyphohilized)
Реагент для выявления фермента коагулазы у стафилококков
Читайте также:
- Системные васкулиты при системной красной волчанке
- Инфекция у женщин таблица
- Какие инфекции могут вызвать боли внизу живота
- Повышенное слюноотделение при инфекции
- Какие инфекции вызывают прыщи на попе
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

