Методы определения источника инфекции
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.

- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
Для идентификации вида возбудителя гнойно-воспалительных заболеваний и определения чувствительности к антибактериальным препаратам бактериологические лаборатории используют комплекс методов. Они включают:
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза и т.д.). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видом микроорганизмов в биологическом материале, а также дает предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.

Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Чашки Петри с посевами инкубируют в термостате при определенных температурных, а для ряда микроорганизмов газовых (например, для выращивания анаэробов создают условия с низким содержанием кислорода) режимах в течение 18-24 ч. Затем чашки Петри просматривают. Количественную обсемененность доставленного биоматериала микрофлорой определяют по числу колониеобразующих единиц (КОЕ) в 1 мл или 1 мг исследуемого образца. При просмотре чашек Петри выявляют некоторые особенности изменения цвета среды, ее просветления в процессе роста культуры. Многие группы бактерий образуют характерные формы колоний, выделяют пигменты, которые окрашивают колонии или среду вокруг них. Из каждой колонии делают мазки, окрашивают по Граму и микроскопируют. Оценивают однородность бактерий, форму и размер, наличие спор или других включений, капсулы, расположение бактерий, отношение к окраске по Граму. Вся эта информация служит важнейшей составляющей для выбора сред и получения в дальнейшем чистой культуры каждого микроорганизма.
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
С внедрением в практику лабораторий метода иммуноферментного анализа (ИФА) стало возможным определять в крови больных антитела, относящиеся к различным классам иммуноглобулинов (IgM и IgG), что существенным образом повысило информативность серологических методов диагностики. При первичном иммунном ответе, когда иммунная система человека взаимодействует с инфекционным агентов в первый раз, синтезируются преимущественно антитела, относящиеся к иммуноглобулинам класса М. Лишь позднее, на 8-12 день после попадания антигена в организм, в крови начинают накапливаться антитела иммуноглобулинов класса G. При иммунном ответе на инфекционные агенты вырабатываются также и антитела класса А (IgA), которые играют важную роль в защите от инфекционных агентов кожи и слизистых оболочек.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100 % чувствительностью и специфич-ностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген. Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях. Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР) являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать. Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы. Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Преимущество ПЦР в диагностике инфекционных заболеваний перед другими методами исследований заключается в следующем:
- возбудитель инфекции может быть обнаружен в любой биологической среде организма, в т.ч. и материале, получаемом при биопсии;
- возможна диагностика инфекционных болезней на самых ранних стадиях заболевания;
- возможность количественной оценки результатов исследований (сколько вирусов или бактерий содержится в исследуемом материале);
- высокая чувствительность метода; например чувствительность ПЦР для выявления ДНК вируса гепатита В в крови составляет 0,001 пг/мл (приблизительно 4,0 . 10 2 копий/мл), в то время как метода гибридизации ДНК с использованием разветвленных зондов - 2,1 пг/мл (приблизительно 7,0 . 10 5 копий/мл).
Инфекционные заболевания создают особые проблемы в медицинских учреждениях, где люди подвержены большему риску из-за основного заболевания и повышенной восприимчивости. Инфекции, связанные с оказанием медицинской помощи (ИСМП), являются распространенными причинами заболеваемости и смертности и создают высокую финансовую нагрузку на системы здравоохранения.
По оценкам ВОЗ:
- Европа: 37 000 смертей ежегодно напрямую связаны с ИСМП; косвенная причина более чем 110 000 смертей
- США: 99 000 смертей ежегодно
- Страны с небольшим объемом ресурсов: количество предотвратимых смертей от ИСМП в ОИТ может составлять ¼ и более
- Ежегодное экономическое бремя: €7 миллиардов в Европе; $6,5 миллиарда в США
Определение
Инфекции, связанные с оказанием медицинской помощи (ИСМП), вызывают бактерии, вирусы и грибы. Заражение большинством этих заболеваний может происходить в любом месте, однако в медицинских учреждениях они становятся более серьезной проблемой. Большинство ИСМП вызывают бактерии, уже присутствующие в организме пациента до инфекции и могут быть причиной перекрестной передача между пациентами или между пациентами и медицинскими работниками. Среда медицинского учреждения также может быть источником инфекции с распространением микроорганизмов через воздух, воду или поверхности. Пациенты в медицинских учреждениях более восприимчивы, чем население в целом, из-за основного заболевания, уязвимости (например, недоношенные дети, пожилые пациенты и пациенты с ослабленным иммунитетом) и воздействия инвазивных медицинских процедур.
Во многих странах с высоким уровнем доходов национальные и региональные органы здравоохранения наряду с отдельными медицинскими учреждениями осуществляют меры по профилактике, контролю, наблюдению и отчетности. Несмотря на значительное снижение в последние годы заболеваемость ИСМП остается высокой, особенно в группах риска. Так, приблизительно у 25-30% пациентов ОИТ в странах с высоким уровнем доходов развивается не менее одного эпизода ИСМП 1,2 . В странах с низким и среднем уровнем доходов проблемы осложняются из-за слабо развитой инфраструктуры и недостаточного уровня гигиены и санитарии. По оценке ВОЗ, инфекции, приобретенные в ОИТ, встречаются как минимум в 2-3 раза чаще, чем в странах с высоким уровнем доходов, а инфекции, связанные с устройствами, могут встречаться до 13 раз чаще, чем в США 1 .
ИСМП включают все типы инфекций, в том числе инфекции мочевыводящих путей (чаще в странах с высоким уровнем доходов 1,2 ), инфекции в месте проведения операции (чаще в странах с низким уровнем доходов 1 ), инфекции дыхательных путей, желудочно-кишечного тракта и кровотока. Появление микроорганизмов, устойчивых к антимикробным препаратам, способствует распространению и увеличению тяжести ИСМП. Медицинское учреждение, в котором возникает вспышка ИСМП, сталкивается с серьезными проблемами лечения пациента, бременем расходов и возможным отрицательным влиянием на имидж и репутацию.
Какие инфекции относят к ИСМП?
Инфекция называется инфекцией, связанной с оказанием медицинской помощи (ИСМП), если она отсутствует у пациента при поступлении и возникает в течение 48 часов или более после поступления в медицинское учреждение. У хирургических пациентов инфекция считается ИСМП в течение трех месяцев после хирургического вмешательства или одного года в случае операции на костях или суставах 3 .
Диагностика
Решающее значение имеет регулярное тщательное наблюдение за всеми пациентами в медицинском учреждении на предмет инфекционных заболеваний, особенно в ОИТ и группах особого риска по другим причинам. Для точного определения инфекционного агента, чувствительности к антимикробным препаратам и выбора соответствующей антимикробной терапии для борьбы с этим заболеванием используется диагностика in vitro. Кроме того, важно выявлять и ограничивать возможные эпидемические заболевания, наблюдая за пациентами из групп риска и быстрого определяя источник инфекций.
Микроорганизмы — частые возбудители ИСМП 1,2,4
- Золотистый стафилококк
- Метициллин-резистентный золотистый стафилококк (МРЗС)
- Энтерококки
- Escherichia coli
- Klebsiella pneumoniae
- Карбопенем-резистентные энтеробактерии (КРЭ)
- Clostridium difficile
- Энтеробактерии, продуцирующие бета-лактамазы расширенного спектра действия (БЛРС)
- Pseudomonas aeruginosa
- Acinetobacter baumannii
- Ванкомицин-резистентные энтерококки
- Стрептококки
- Candida albicans
Профилактика и ведение / лечение
Меры профилактики ИСМП следует принимать как на уровне пациента, так и на уровне всего медицинского учреждения.
Руководства
Артикулы
1. World Health Organization 2011: Report on the Burden of Endemic Health Care-Associated Infection Worldwide
2. CDC, Public Health Reports 2007: Estimating Health Care-Associated Infections and Deaths in U.S. Hospitals, 2002
4. CDC: Antibiotic Resistance in the United States 2013
Этот сайт не является источником медицинских рекомендаций.
Медицинские сведения на этом сайте представлены кратко, имеют общий характер и приведены исключительно в информационных целях. Они не предназначены и не рекомендованы быть заменой профессиональной медицинской консультации. Вы не должны использовать медицинские сведения на этом сайте для диагностики проблем со здоровьем, физическим состоянием или заболеваний. Всегда обращайтесь к своему врачу или другому квалифицированному медицинскому работнику по поводу любого медицинского состояния или лечения. Никакие сведения на данном сайте не предназначены для медицинской диагностики или лечения. Они не должны использоваться врачами в качестве единственного источника информации при принятии решений о назначении лечения. Никогда не пренебрегайте медицинской консультацией и не откладывайте обращение за помощью из-за того, что Вы прочли на этом сайте.
Практическое руководство по предотвращению вспышек ИСМП
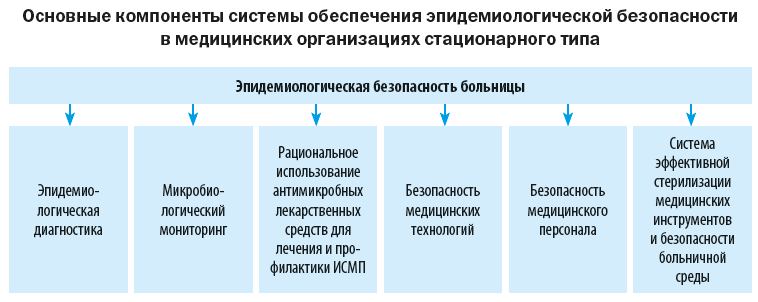
Высококвалифицированная и безопасная медицинская помощь — приоритетная задача современного здравоохранения. Одним из критериев качества медицинских услуг является эпидемиологическая безопасность пациентов и профилактика инфекций, связанных с оказанием медицинской помощи (ИСМП). Данный раздел работы должен контролироваться главными врачами или их заместителями, а также главными медицинскими сестрами в ходе реализации программы внутреннего контроля и аудита.
Эпидемиологическая безопасность медицинской помощи – это условия, при которых отсутствует недопустимый риск возникновения у пациентов и медицинского персонала инфекций, связанных с оказанием медицинской помощи.
Ключевая роль в реализации требований по эпидбезопасности принадлежит госпитальному эпидемиологу, а также администрации медицинской организации.
Рассмотрим их подробно.
1. Эпидемиологическая диагностика
Включает в себя совокупность приемов и способов, направленных на выявление причин и факторов риска возникновения ИСМП.
И чтобы эпидемиологическая диагностика была эффективной, в стационаре должна функционировать система активного выявления, учета, регистрации и анализа ИСМП.
Методы выявления инфекций делятся на пассивные и активные.
Пассивные методы предполагают, что врачи и медицинские сестры сами сообщают госпитальному эпидемиологу о случаях ИСМП. Однако такой подход малоэффективен и позволяет выявить не более 35 % всех инфекций.
Поэтому более предпочтительны активные методы, которые подразумевают постоянное наблюдение за пациентами, цель которого — выявить случаи ИСМП.
Активное эпидемиологическое наблюдение может быть тотальным или целенаправленным. В первом случае наблюдение организуют за всеми пациентами стационара и исходами их заболеваний. Во втором случае наблюдение может проводиться в отношении:
- конкретных видов ИСМП (например, инфекции в области хирургического вмешательства, внутрибольничные пневмонии, катетер-ассоциированные инфекции кровотока, внутрибольничные инфекции мочевыводящих путей);
- определенных групп пациентов (хирургические пациенты, пациенты, находящиеся на искусственной вентиляции легких, пациенты с центральными сосудистыми катетерами);
- отделений повышенного риска (отделения реанимации, ожоговые отделения, хирургические отделения).
С целью выявления случаев ИСМП в медицинской организации разрабатывают перечень стандартных определений случаев ИСМП, т. е. набор критериев, позволяющих определить, есть или нет у пациента инфекционного заболевания или состояния, связанного с лечебно-диагностическим процессом. Данные критерии используют лечащие врачи и врачи-эпидемиологи для постановки клинического или эпидемиологического диагноза.
Если у пациента выявлены признаки ИСМП, заполняется карта эпидемиологического наблюдения. В ней указываются:
- общие данные о пациенте;
- сведения о факторах риска возникновения ИСМП;
- критерии, на основании которых был поставлен диагноз ИСМП.
К сведению
В стационаре должны быть разработаны карты эпидемиологического наблюдения для различных видов ИСМП, актуальных для данной медицинской организации.
Выявленные ИСМП регистрируются в установленном порядке. На каждый случай заполняется экстренное извещение об инфекционном заболевании по форме 058/у, которое направляется в органы, уполномоченные осуществлять государственный санитарно-эпидемиологический надзор, информация вносится в журнал учета инфекционной заболеваемости (форма 060/у).
Ретроспективный анализ заболеваемости ИСМП у пациентов позволяет выявить фоновый уровень заболеваемости, основные источники инфекции, ведущие факторы передачи. На его основе разрабатываются профилактические и противоэпидемические мероприятия, адекватные конкретной эпидемиологической обстановке как в медицинской организации в целом, так и в конкретных отделениях.
Ретроспективный анализ заболеваемости медицинского персонала позволяет выявить источники инфекции и провести мероприятия, ограничивающие их роль в распространении ИСМП.
Сведения об ИСМП вносятся в электронные таблицы. Это позволяет накапливать, систематизировать и анализировать информацию.
К сведению
Используя базы данных, врач-эпидемиолог может рассчитать относительные частотные показатели заболеваемости, чтобы сравнивать и сопоставлять заболеваемость ИСМП в различные временные промежутки, а также в разных группах пациентов, выявлять факторы, влияющие на эпидпроцесс.
Чтобы рассчитать относительные частотные показатели заболеваемости, необходима информация об основных действующих факторах риска, таких как:
- количество дней искусственной вентиляции легких;
- количество дней катетеризации сосудов;
- количество дней катетеризации мочевого пузыря и т. д.
Данные собираются обо всех пациентах, подвергающихся фактору риска, вне зависимости от того, развивается у них ИСМП или нет.
Собирать данные должен персонал, который непосредственно осуществляет уход за пациентами, например медицинские сестры.
2. Микробиологический мониторинг
Программа микробиологического мониторинга разрабатывается для анализа микроорганизмов, циркулирующих в медицинской организации, выделенных от пациентов, персонала и с объектов внешней среды, а также для раннего выявления формирования госпитальных штаммов и вспышек ИСМП.
Мониторинг должен включать:
- бактериологические исследования биологического материала пациентов отделений стационара при наличии клинических или эпидемиологических показаний;
- санитарно-бактериологические исследования объектов больничной среды в плановом порядке и при наличии эпидемиологических показаний;
- анализ чувствительности/резистентности выделенных микроорганизмов с целью раннего выявления госпитальных штаммов и вспышек ИСМП;
- внесение данных, полученных в ходе проведения бактериологических исследований, в электронную базу данных аналитической компьютерной программы;
- анализ микробиологического пейзажа отделений стационара;
- разработку и корректировку протоколов определения чувствительности микроорганизмов к антимикробным препаратам, дезсредствам, бактериофагам;
- оценку и корректировку проводимой антимикробной терапии, коррекция лекарственного формуляра;
- оценку и корректировку дезинфекционных мероприятий в стационаре.
У человека чума, особенно ее септическая (в результате попадания бактерий в кровоток) и легочная формы, без лечения может быть очень тяжелым заболеванием с коэффициентом летальности 30-100%. Без раннего начала лечения легочная форма всегда приводит к смерти. Она носит особенно контагиозный характер и способна вызывать тяжелые эпидемии, передаваясь от человека человеку воздушно-капельным путем.
В 2010-2015 гг. во всем мире было зарегистрировано 3248 случаев заболевания чумой, в том числе 584 случая со смертельным исходом.
Признаки и симптомы
У человека, заразившегося чумой, по прошествии инкубационного периода от 1 до 7 дней обычно развивается острое лихорадочное состояние. Типичными симптомами являются внезапное повышение температуры, озноб, головная боль и ломота в теле, а также слабость, тошнота и рвота.
В зависимости от пути проникновения инфекции различаются две основные формы чумной инфекции: бубонная и легочная. Все формы чумы поддаются лечению, если выявляются достаточно рано.
Где встречается чума?
Как болезнь животных чума встречается повсеместно, за исключением Океании. Риск заболевания чумой человека возникает тогда, когда отдельно взятая популяция людей проживает на месте, где присутствует естественный очаг чумы (т.е. имеются бактерии, животные резервуары и переносчики).
Эпидемии чумы случались в Африке, Азии и Южной Америке, однако с 1990-х годов большая часть заболеваний человека чумой имела место в Африке. К трем наиболее эндемичным странам относятся: Мадагаскар, Демократическая Республика Конго и Перу. На Мадагаскаре случаи бубонной чумы регистрируются практически каждый год во время эпидемического сезона (сентябрь-апрель).
Диагностика чумы
Для подтверждения диагноза чумы требуется лабораторное тестирование. Образцовым методов подтверждения наличия чумы у пациента является изоляция Y. pestis из образца гноя из бубона, образца крови или мокроты. Существуют разные методы выявления специфического антигена Y. pestis. Одним из них является лабораторно валидированный экспресс-тест с использованием тест-полоски. Этот метод сегодня широко применяется в странах Африки и Южной Америки при поддержке ВОЗ.
Лечение
Без лечения чума может приводит к быстрой смерти, поэтому важнейшим условием выживания пациентов и профилактики осложнений является быстрая диагностика и раннее лечение. При своевременной диагностике чума успешно лечится антибактериальными препаратами и поддерживающей терапией. Нелеченая легочная чума может закончиться летальным исходом через 18-24 часов после появления симптомов, однако обычные антибиотики для лечения болезней, вызванных энтеробактериями (грам-отрицательными палочками), могут эффективно излечивать чуму при условии раннего начала лечения.
Профилактика
Профилактические меры включают в себя информирование населения о наличии зоонозной чумы в районе их проживания и распространение рекомендаций о необходимости защищать себя от укусов блох и не касаться трупов павших животных. Как правило, следует рекомендовать избегать прямого контакта с инфицированными биологическими жидкостями и тканями. При работе с потенциально инфицированными пациентами и сборе образцов для тестирования следует соблюдать стандартные меры предосторожности.
Вакцинация
ВОЗ не рекомендует проводить вакцинацию населения, за исключением групп повышенного риска (например, сотрудников лабораторий, которые постоянно подвергаются риску заражения, и работников здравоохранения).
Борьба со вспышками чумы
- Обнаружение и обезвреживание источника инфекции: выявление наиболее вероятного источника инфекции в районе, где выявлен случай (случаи) заболевания человека, обращая особое внимание на места скопления трупов мелких животных. Проведение надлежащих мероприятий инфекционного контроля. Следует избегать уничтожения грызунов до уничтожения блох – переносчиков инфекции, поскольку с мертвого грызуна блохи перейдут на нового хозяина и распространение инфекции продолжится.
- Охрана здоровья медицинских работников: информирование и обучение работников здравоохранения мерам инфекционной профилактики и инфекционного контроля. Работники, находившиеся в непосредственном контакте с лицами, заболевшими легочной чумой, должны носить средства индивидуальной защиты и получать антибиотики в качестве химиопрофилактики в течение семи дней или по меньшей мере в течение времени, когда они подвергаются риску, работая с инфицированными пациентами.
- Обеспечение правильного лечения: обеспечение получения пациентами надлежащего антибиотического лечения, а также наличия достаточных запасов антибиотиков.
- Изоляция пациентов с легочной чумой: пациенты должны быть изолированы, чтобы не распространять инфекцию воздушно-капельным путем. Предоставление таким пациентам защитных лицевых масок может сократить риск распространения инфекции.
- Эпиднадзор: выявление и отслеживание лиц, находившихся в близком контакте с больными легочной чумой, и проведение среди них химиопрофилактики в течение 7 дней.
- Получение образцов, которые следует собирать с осторожностью, соблюдая все профилактические меры и процедуры инфекционного контроля, после чего отправить в лаборатории для тестирования.
- Дезинфекция: рекомендуется регулярно мыть руки водой с мылом или использовать спиртосодержащие гели для дезинфекции рук. Для дезинфекции больших площадей можно использовать 10-процентный раствор бытового отбеливателя (раствор следует обновлять ежедневно).
- Соблюдение мер предосторожности при захоронении умерших: распыление антисептиков на лицо/грудь трупов больных, предположительно умерших от легочной чумы, является нецелесообразным и не рекомендуется. Следует накрывать территорию пропитанными антисептиком тканью или абсорбирующим материалом.
Эпиднадзор и контроль
Для осуществления эпиднадзора и контроля необходимо проводить обследование животных и блох, вовлеченных в чумной цикл в регионе, а также разработку программ по контролю за природными условиями, направленных на изучение природного зоонозного характера цикла инфекции и ограничение распространения заболевания. Активное продолжительное наблюдение за очагами проживания животных, сопровождаемое незамедлительными мерами реагирования во время вспышек заболевания среди животных, позволяет успешно уменьшить число вспышек заболевания чумой среди людей.
Для эффективного и результативного реагирования на вспышки чумы важным условием является наличие информированных и бдительных кадров здравоохранения (и местного сообщества), что позволит быстро диагностировать случаи болезни и оказывать надлежащую помощь инфицированным, выявлять факторы риска, вести непрерывный эпиднадзор, бороться с переносчиками и их хозяевами, лабораторно подтверждать диагнозы и передавать компетентным органам информацию о результатах тестирования.
Ответные действия ВОЗ
Целью ВОЗ является предупреждение вспышек чумы путем проведения эпиднадзора и оказания содействия странам повышенного риска в разработке планов обеспечения готовности. Поскольку резервуар инфекции среди животных может быть разным в зависимости от региона, что оказывает влияние на уровень риска и условия передачи инфекции человеку, ВОЗ разработала конкретные рекомендации для Индийского субконтинента, Южной Америки и стран Африки к югу от Сахары.
ВОЗ сотрудничает с министерствами здравоохранения для оказания поддержки странам, где происходят вспышки заболевания, в целях принятия на местах мер по борьбе со вспышками.
Читайте также: