Маркеры внутриутробных инфекций что это такое

В последние годы плацентарная недостаточность (ПН) занимает одно из ведущих мест в общей структуре перинатальной смертности и заболеваемости и остается важнейшей проблемой современного акушерства [1, 2]. В структуре акушерских осложнений частота встречаемости плацентарной недостаточности составляет 52,0 %. Внутриутробная инфекция (ВУИ) относится к тяжелым осложнениям беременности и зачастую обнаруживается вместе с плацентарной недостаточностью, существенно влияя на перинатальные исходы. Инфицирование плаценты и плода происходит в различные сроки беременности. В первом триместре беременности основными показателями УЗ обследования являются размеры плодного яйца и эмбриона, а также состояние и размеры желточного мешка и хориона. Большинство исследователей отмечают высокую диагностическую ценность данного метода обследования [3, 4, 5, 6].
Безусловно, определяя характерные признаки ВУИ, необходимо провести дифференциальную диагностику с пороками развития сердца, хромосомными заболеваниями, синдромами мальформаций, чтобы выявить группу инфекций, относящихся к TORCH (Т – токсоплазмоз, О – другие инфекционные агенты (корь, парвовирус В19, сифилис, ветряная оспа, вирус Коксаки, вирусы гепатита С, В, Е, Д, папилломавирус, листериоз, гонорея, боррелиоз, ВИЧ-инфекция, эпидемический паротит, микоплазма, грипп, малярия, инфекционный мононуклеоз, хламидии, стрептококки группы В), R – краснуха, C – цитомегаловирус, H – простой герпес). В связи с тем, что ультразвуковые маркеры в полной мере не могут исключить или подтвердить пренатальную инфекцию с точной достоверностью, обнаружение ультразвуковых критериев, типичных для ВУИ плода, имеет важное значение для выработки дальнейшей тактики ведения беременности.
Целью исследования явилось выявление ультразвуковых маркеров внутриутробного инфицирования плода у женщин с плацентарной недостаточностью.
Материалы и методы исследования
Для получения достоверной картины внутриутробного инфицирования у беременных мы провели исследования среди 169 женщин репродуктивного возраста, которые были разделены на 2 группы. Первую группу составили 123 женщины, обратившиеся за гинекологической помощью, т.е. имевшие на период проведения работу ту или иную гинекологическую заболеваемость. Вторую группу составили 46 женщин, которые в отмеченном периоде не имели текущей гинекологической заболеваемости. Возраст женщин колебался от 18 до 39 лет.
Критериями включения беременных в основную группу были следующие эхографические признаки ВУИ: изменение количества околоплодных вод, гиперэхогенный кишечник, синдром задержки развития плода, изменения кровотока у плода, инфекционная кардиопатия, гепатоспленомегалия, амниотические тяжи, кальцификаты или гиперэхогенные включения в паренхиматозных органах. Наличие этих маркеров, как единственных, так и в различных сочетаниях, явилось показанием проведения в дальнейшем динамической допплерометрии.
Состояние фетоплацентарного комплекса (ФПК) изучали с помощью инструментальных методов исследования, включающих комплексное ультразвуковое исследование (плацентографию, фетометрию, развитие внутренних органов плода и оценку количества околоплодных вод), допплерометрическое исследование кровотока в артериях пуповины (АП), маточных артериях (МА), венозном протоке плода (ВП) и средней мозговой артерии (СМА).
Диагноз плацентарной недостаточности устанавливали при выявлении двух и более из перечисленных ниже признаков:
– выявление по данным эхографии задержки внутриутробного роста плода;
– выявление по данным КТГ хронической внутриутробной гипоксии плода;
– выявление внутриутробной гибели плода на любом сроке беременности;
– выявление нарушения плодово-плацентарного кровотока по данным допплерографии;
– выявление маловодия по данным эхографии;
– выявление характерных изменений в структуре плаценты по данным УЗИ: обнаружение тромбозов, инфарктов и изменения в эхогенности базальной мембраны.
В ходе исследования использовались различные функции УЗИ: 2D-сканирование, 3D/4D сканирование плаценты, плода, пуповины, для оценки кровотоков в ФПК применялась спектральная допплерометрия. Статистический анализ данных осуществлялся с помощью программы электронного пакета Microsoft Excel 2007, которые были сформированы в соответствии с запросами настоящего исследования.
Результаты исследования и их обсуждение
В ходе проведенных исследований произведен анализ эхографических особенностей ФПК. Выявленные эхографические признаки, характеризующие внутриутробное инфицирование плода, представлены в табл. 1.
При проведении эхографического исследования у плодов основной группы определялись различные сочетания ультразвуковых признаков, характерных для ВУИ. При помощи УЗИ в I триместре беременности было установлено, что наиболее часто у беременных встречалось многоводие, которое в 1 группе беременных составило соответственно – 55,2 ± 4,5 % и во 2 группе беременных – 45,6 ± 7,3 %, значительно реже наблюдалось маловодие (соответственно – 17,0 ± 3,4 % и 10,9 ± 4,6 в группах; χ2 = 21,43, р Примечание . Одновременно у пациенток выявлялись 2 и более признаков.
Эхографические признаки, характеризующие состояние ФПК в III триместре беременности
8.11. СОВРЕМЕННЫЕ ПРИНЦИПЫ ДИАГНОСТИКИ ВНУТРИУТРОБНОЙ ИНФЕКЦИИ ПЛОДА
Учитывая частое бессимптомное течение заболевания у женщин, от-сутствие четких клинических критериев внутриутробной инфекции у ново-рожденных, клиническая диагностика данной патологии становится практи-чески невозможной без современных лабораторных тестов. Современные ме-тоды диагностики внутриутробной инфекции предполагают поэтапное ис-пользование комплекса клинико-лабораторных обследований беременной, плода и новорожденного. Данный алгоритм включает в себя:
1. Тщательный анализ клинических проявлений инфекционной патоло-гии у матери, а также использование традиционных неинвазивных инстру-ментальных и лабораторных методов обследования.
2. Идентификацию инфекционного патогенного агента.
3. Определение иммунного статуса.
4. Оценку вторичных неспецифических метаболических расстройств, свойственных синдрому системного воспалительного ответа.
Учитывая неспецифичность клинических проявлений внутриутробного инфицирования плода, пренатальная диагностика данной патологии является наиболее сложной, поэтому весьма рациональна поэтапная диагностика па-тологии (Федорова М.В., 1996).
На первом этапе на основе сбора анамнестических данных и общекли-нического обследования выявляется группа высокого риска по развитию ВУИ.
На втором этапе при помощи комплексного ультразвукового обследо-вания определяют эхографические маркеры ВУИ, а также признаки фетопла-центарной недостаточности с оценкой степени её тяжести (Воеводин С.М., 1998). Непосредственно регистрируются признаки гипоксического пораже-ния плода (биофизический профиль плода, допплерометрическое исследова-ние плодового кровотока).
На третьем этапе диагностики ВУИ ряд авторов (Кира Е.Ф., 1996), ре-комендует использовать инвазивные методы, когда объектом исследования служит сам плод. В этих целях, по мнению автора, необходимы биопсия хо-риона, амниоцентез, кордоцентез с последующим бактериологическим ис-следованием. Однако такие методы сопряжены с опасностями для плода и матери и применяются редко.
Информативным и чрезвычайно важным в диагностике ВУИ является гистологическое исследование последа (Савельева Г.М, 1991; Цинзерлинг А.В., 1997; Сидорова И.С., 1999). Н.Г. Глуховец (1999) считает, что развитие восходящего инфицирования в тканях последа манифестируется последова-тельно: вначале развитием экссудативного процесса, который отмечается в плодных оболочках, а затем распространяется на плаценту и в конечном ито-ге охватывает пуповину. Восходящее инфицирование последа нередко ос-ложняется тромбозом сосудов плацентарного ложа с преждевременной от-слойкой плаценты, дистонией сосудов пуповины. З.С. Зайдиева (1999) отме-чает наличие диссоциированного развития ворсинчатого хориона, развитие воспалительных изменений во всех слоях плаценты с выраженной лимфоид-но-макрофагальной инфильтрацией в базальной пластинке и хорионе, причем максимально эти изменения выражены при герпетической инфекции. Усили-вающиеся иммунологические нарушения под действием микроорганизмов приводят к снижению блокирующих антител, появляются антитела к самой плаценте, которая может отторгнуться как аллотрансплантат.
Клинические проявления внутриутробной инфекции у новорожденных неспецифичны. Они характеризуются развитием гипоксии разной степени тяжести; респираторного дистресс-синдрома; болезнью гиалиновых мембран; врожденной пневмонии; неврологических нарушений в виде общей вялости, снижения мышечного тонуса и рефлексов; врожденной гипотрофией 2-3-й степени; желтухой; отечным синдромом; геморрагическим синдромом; сры-гиванием; отказом от еды; морфофункциональной незрелостью; наличием стигм дизэмбриогенеза; аномалий и пороков развития; гепатолиенальным синдромом. Выявление двух или более из указанных признаков позволяет отнести новорожденного в группу высокого риска по внутриутробной ин-фекции. Всем новорожденным с типичными проявлениями внутриутробной инфекции, а также детям из групп высокого риска развития ВУИ, в случае ухудшения их состояния в раннем неонатальном периоде, должно прово-диться целенаправленное лабораторное обследование на TORCH-инфекции с целью установления или объективного подтверждения этиологии заболева-ния.
Материалом для исследования у новорожденных являются мазки из конъюнктивы, задней стенки глотки, вульвы, моча, аспират желудка, меко-ний, спинномозговая жидкость.
Важно отметить, что диагноз внутриутробной инфекции является кли-нико-лабораторным. Отсутствие клинических проявлений или инструмен-тально выявляемых признаков инфекционного заболевания в перинатальном периоде в большинстве случаев делает нецелесообразным лабораторное об-следование на TORCH-инфекции. Исключение может составлять плановое обследование клинически здоровых новорожденных от матерей, больных ту-беркулезом, сифилисом и генитальным герпесом, в случае его обострения не-задолго до родов (Кира Е.Ф., 1996).
Важными в диагностике внутриутробной инфекции являются иденти-фикация возбудителя инфекции у матери, плода и новорожденного, а также оценка сдвигов иммунного статуса как следствия воздействия инфекционных антигенов-аллергенов на организм беременной женщины.
В зависимости от способов идентификации возбудителя методы лабо-раторной диагностики могут быть разделены на две группы: прямые, позво-ляющие выявить микроорганизмы в биологических жидкостях или тканях, и непрямые, определяющие характер специфического иммунного ответа на воздействие антигенов и аллергенов инфекционной природы.
К прямым методам идентификации возбудителя относятся микроско-пия нативных и окрашенных мазков слизистой влагалища, цервикального ка-нала и уретры беременной; выявление вирусных или бактериальных антиге-нов в различных биологических средах (в том числе одноэтапными иммуно-ферментными и иммунохроматографическими методами); определение ДНК и РНК возбудителя (полимеразная цепная реакция); а также культуральный метод обнаружения возбудителя в биологических жидкостях и тканях (Ан-кирская А.С., 1985; Кира Е.Ф., 1996).
Прямые методы лабораторной диагностики позволяют обнаружить присутствие возбудителя (его антигена, фрагментов ДНК) в биологических жидкостях или биоптатах тканей. Каждый из указанных методов имеет свои достоинства и недостатки, различную диагностическую ценность. Их чувст-вительность и специфичность существенно зависят от типа выявляемого воз-будителя, качества лабораторного оборудования и реактивов, поэтому ре-зультаты обследования, проведенного в разных клинических и исследова-тельских лабораториях, могут быть различны. Методы диагностики, осно-ванные на прямой микроскопии, менее чувствительны и менее специфичны.
Для идентификации определённых фрагментов ДНК или РНК - клеток возбудителя используются два метода - метод молекулярной гибридизации (простой, удобный, но менее чувствительный) и наиболее чувствительный метод определения ДНК - полимеразная цепная реакция. Этот тест имеет ви-довую специфичность, сравнимую с методом культуры клеток и чувстви-тельность 10 молекул ДНК. В последние годы бурно развивается именно ме-тод полимеразной цепной реакции как высокочувствительный и специфич-ный.
Наиболее доступным для практического применения и высокочувстви-тельным в настоящее время является метод прямой иммунофлюоресценции с помощью моноклональных антител. Чувствительность данного теста дости-гает 96-98% и зависит от концентрации возбудителя в исследуемом материа-ле. Ложноотрицательные ответы могут быть связаны с малым числом возбу-дителя в пробе, ложноположительные – с неспецифической адсорбцией кра-сителя на обрывках ткани и лейкоцитах. Для повышения точности диагно-стики при использовании данного метода исследования материал должен быть правильно взят (соскоб) и своевременно доставлен в лабораторию.
К непрямым (косвенным) относятся так называемые серологические методы, из которых наиболее информативным является иммуноферментный метод определения специфических IgG и IgM (иммуноферментный анализ). Иммуноферментный анализ основан на определении IgM и IgG, специфич-ных для той или иной инфекции или антигенов соответствующих возбудите-лей. Результаты данного исследования позволяют оценить не только состоя-ние противомикробной защиты, на фоне которого развиваются инфекцион-ные осложнения, но и понять возможные причины частых послеродовых ос-ложнений. В основу ELISA – метода (метод твёрдофазного иммунофермент-ного анализа) положено определение тест-системой моноклональных антител в жидкостях и средах организма.
Показатели чувствительности и специфичности серологических мето-дов выявления инфекций у новорожденных детей существенно хуже, чем у детей старшего возраста и взрослых, что связано с особенностями иммунного ответа и присутствием в их крови материнских антител. С технической точки зрения, данные методы достаточно просты, что делает возможным их ис-пользование для первичного скрининга на внутриутробную инфекцию. Од-нако серологические тесты являются вспомогательными, так как при боль-шинстве процессов, вызываемых внутриклеточными возбудителями, анти-генная стимуляция невелика. Так например, из-за низкой иммуногенности у 50% больных хламидиозом антитела не обнаруживают. Таким образом, от-сутствие у новорожденного специфических антител не означает отсутствия инфекции, а наличие специфического IgG может быть связано с передачей его от матери.
Помимо бактериологических и иммунологических методов в целях ди-агностики внутриутробного инфицирования возможно использование и ряда интегративных показателей крови, отражающих интенсивность развития сис-темного воспалительного ответа при формировании инфекционного процесса в организме беременной.
Метаболические проявления синдрома системного воспалительного ответа или реакции острой фазы в настоящее время четко определены. К бел-кам острой фазы относятся: С - реактивный белок, гаптоглобин, церулоплаз-мин, плазминоген, -1-антитрипсин, антитромбин III, фракция С3 компле-мента и другие (Газазян М.Г, Пономарева Н.А, Саруханов В.М., 1999). Рост концентрации указанных белков в крови является маркером острого воспали-тельного процесса или обострения хронического воспаления. Наряду с пози-тивными маркерами синдрома системного воспалительного ответа очевидны и негативные маркеры, в частности альбумин, трансферрин, уровень которых в крови отрицательно коррелирует со степенью тяжести инфекционного вос-паления различной локализации, в том числе и в урогенитальном тракте.
Очевидно, что определение содержания в крови вышеуказанных мар-керных белков острой фазы может быть использовано в качестве дополни-тельных диагностических критериев инфекционно-воспалительного процес-са, а также критериев оценки эффективности терапии при внутриутробном инфицировании плода.
Характерной особенностью воспаления инфекционной или инфекци-онно-аллергической природы является активизация В- или Т-систем лимфо-цитов, обеспечивающих развитие иммунных или аллергических реакций. В связи с этим очевидна целесообразность определения в крови матери или в пуповинной крови плода уровня иммуноглобулинов. Повышение концентра-ции IgМ в пуповинной крови более 200-300 мг/л свидетельствует об антиген-ной стимуляции плода или о его внутриутробном инфицировании (Стефани Д.В., Вельтищев Ю.Е., 1996).
Важная роль в каскаде местных и системных реакций матери при внут-риутробном инфицировании плода отводится провоспалительным цитоки-нам, в частности, ИЛ-1, ИЛ-6, ИЛ-8, ФНО- и другим, индуцирующим раз-витие лихорадочной реакции, освобождение гормонов адаптации, обладаю-щих цитотоксическим и протективным действием.
Перспективным для прогнозирования развития и диагностики внутри-утробной инфекции представляется определение уровней провоспалитель-ных цитокинов. Повышение содержания интерлейкина–6 в слизи цервикаль-ного канала во II и III триместрах беременности у пациенток со смешанной вирусной инфекцией служит маркером латентно протекающей внутриутроб-ной инфекции у плода. В то же время снижение уровня интерлейкина–6 в слизи и клетках цервикального канала ниже 250 нг/мл, отсутствие в сыворот-ке исследуемой крови провоспалительных цитокинов являются диагностиче-ским тестом, предоставляющим информацию об эффективности проводимой терапии.
Типовым процессом дезинтеграции клеточных структур в условиях па-тологии инфекционной природы является активация процессов свободнора-дикального окисления, в частности, липопероксидации. Активация процессов перекисного окисления липидов на фоне абсолютной или относительной не-достаточности антиоксидантной системы описана при различных бактери-альных инфекциях и интоксикациях, ишемии, гипоксии, стрессовых ситуа-циях (Владимиров Ю.А., Арчаков А.И., 1972). Избыточное накопление про-межуточных или конечных продуктов липопероксидации в крови или тканях является объективным критерием системной дестабилизации биологических мембран под влиянием свободных радикалов (Фридорович И., 1979; Лобань-Череда Г.А., Мищенко В.П., Коровина Л.Д. с соавт., 1991; Иванова О.М., 1998). Очевидно, перспективным направлением в диагностике и прогнозиро-вании течения беременности, осложненной внутриутробным инфицировани-ем плода, является определение содержания в крови малонового диальдеги-да, диеновых и триеновых конъюгатов, а также показателей активности фер-ментного и неферментного звеньев антиоксидантной системы (Цебржинский О.И., 1998). Последнее значительно расширяет возможности прогнозирова-ния внутриутробного инфицирования плода, объективной оценки состояния беременной и плода, а также исхода родов.
Информативным показателем степени выраженности интоксикации служит уровень молекул средней массы (МСМ) в крови (Владыка А.С., Ле-вицкий Э.Р., Поддубная Л.П., Габриэлян Н., 1987). Средние молекулы – это гетерогенные группы соединений с молекулярной массой от 500 до 5000Д, включающие олигопептиды с высоким содержанием дикарбоновых амино-кислот, продукты деградации сывороточных белков, жизнедеятельности бак-терий, низкомолекулярные белки и другие соединения. Средние молекулы обладают выраженным токсическим действием на лимфоцитарную и моно-нуклеарно-фагоцитарную системы.

Одной из важнейших проблем современной перинатологии является прогрессирующий рост инфекционной патологии у плода и новорожденного. В структуре заболеваемости новорожденных внутриутробные инфекции (ВУИ) занимают второе место после гипоксии и асфиксии в родах [4].
В структуре перинатальной смертности удельный вес ВУИ достигает 65,6% [11]. В настоящее время насчитывается более 2500 возбудителей, способных вызывать внутриутробное инфицирование плода, при этом количество их постоянно пополняется [14]. Чаще диагностируется смешанное инфицирование вирусно-бактериальной, вирусно-вирусной природы и их различные ассоциации с трихомонадами и дрожжевыми грибами рода Candida [12].
Возбудители этих инфекций обладают прямым и непрямым действием на фето-плацентарную систему. Дегтярев Д.Н. и соав. (1998) утверждают, что чем меньше гестационный возраст плода, тем более выражена альтерация тканей. В результате этого основным клиническим проявлением инфекции плода, возникающих на ранних сроках беременности являются пороки развития [2]. По мере увеличения сроков беременности в клинической картине инфекционного заболевания плода начинают преобладать симптомы классического системного воспаления, обусловленные выраженной пролиферацией и экссудацией, что проявляется в виде гепатита, пневмонии менингита, энтероколита и других заболеваний [6].
Непрямое воздействие возбудителей на фето-плацентарную систему приводит к таким осложнениям беременности как угроза прерывания, внутриутробная гипоксия плода, ЗВУР, метаболические нарушения без специфических клинически признаков ВУИ 8.
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика ее затруднена и возможна лишь в результате сочетания клинических и лабораторно-инструментальных методов исследования [5]. Метод ультразвуковой диагностики является доступным, высоко информативным, не инвазивным и позволяет провести эхографическую оценку структурной патологии плода, плаценты, амниона, а также определить степень гемодинамических нарушений фето-плацентарного комплекса у беременных с высоким инфекционным индексом [3,12].
Материалы и методы
Под наблюдением находились 123 беременных женщины, которым проводились все необходимые клинико-лабораторные обследования, а также ультразвуковое исследование в сроке 30-36 недель гестации. В зависимости от выраженности ВУИ и степени тяжести состояния все новорожденные разделены на 4 клинические группы.
1 группа (n=40) - контрольная, новорожденные от матерей с неосложненной беременностью, состояние ребенка при рождении удовлетворительное. 2-я группа (n=30) - состояние ребенка при рождении удовлетворительное или средней степени тяжести с локальными проявлениями ВУИ в виде пиодермии, ринита, отита, конъюнктивита, пневмонии. 3-я группа (n=25) - состояние ребенка при рождении тяжелое или средней степени тяжести с ухудшением в раннем неонатальном периоде с локальными формами ВУИ в виде пневмонии, энтероколита, менингита, фетального гепатита и др. заболеваний. 4-я группа (n=28) - состояние ребенка при рождении тяжелое или крайней степени тяжести с генерализованными или локальными проявлениями ВУИ, потребовавшими проведения искусственной вентиляции легких. Матери детей 2-4 групп имели высокий инфекционный индекс.
Таблица 1.
Фетометрия позволила установить соответствие размеров плода гестационному сроку, диагностировать задержку внутриутробного развития.
При исследовании сердечной деятельности плода использовали шкалу Фишера, 1976., основными показателями которой были: базальная частота сердечных сокращений, амплитуда осцилляций, частота осцилляций, акцелерации, децелерации. Критерии состояния плода следующие: 8 - 10 баллов - нормальное состояние; 5 - 7 баллов - сомнительное; 0 - 4 балла - неудовлетворительное.
Таблица 2. Заболеваемость беременных урогенитальными инфекциями
Диагностическими критериями нарушения маточно-плацентарного и плодово-плацентарного кровотока при доношенной беременности считали следующие числовые значения СДО: в артерии пуповины 3,0 и выше, а также нулевые и отрицательные значения диастолического кровотока; в маточных артериях 2,4 и выше; в аорте плода 8,0 и выше; для средней мозговой артерии менее 4 и более 7 у.е. [10].
Для оценки степени нарушений маточно-плацентарно-плодовой гемодинамики пользовались шкалой А.Н. Стрижакова (1991).
I А степень - изолированное нарушение кровотока в маточных артериях; I Б степень - изолированное нарушение кровотока в артерии пуповины; II степень - сочетанное нарушение кровотока в маточных артериях и артерии пуповины; III степень - критическое нарушение плодового кровотока, характеризующееся нулевым или ретроградным диастолическим компонентом в артерии пуповины.
Результаты исследований
На основании ранее проведенных исследований [1] выделяют 3 группы эхографических маркеров внутриутробного инфицирования: 1) маркеры внутри-утробного инфицирования плаценты (плацентит); 2) маркеры внутриутробного инфицирования околоплодных вод (амнионит); 3) маркеры внутриутробного
инфицирования плода (инфекционные фетопатии).
По данным ультразвукового исследования структурной организации плаценты получены следующие результаты. В контрольной (первой) группе нарушения зарегистрированы у 4 (10%) женщин, из них у 2 (5%) отмечалось преждевременное созревание плаценты, которое регистрировалось с 33 недель, и у 2 (5%) - расширение межворсинчатого пространства, что связано с низким артериальным давлением в период плацентации. Сочетания признаков не отмечалось. Во второй клинической группе преждевременное созревание плаценты зарегистрировано в 5 (16,6%) случаях, увеличение толщины плаценты в 2 (6,6%) случаях, расширение межворсинчатого пространства в 6 (20%) случаях. В 4 (13,3%) случаях отмечалось сочетание признаков. В третьей клинической группе преждевременное созревание плаценты выявлено у 9 (36%) женщин, а незрелость плаценты (I степень) у 2 (8%) женщин. Увеличение толщины плаценты отмечалось у 6 (24%) женщин, расширение межворсинчатого пространства у 9 (36%) женщин. Сочетание признаков наблюдалось в 12 (48%) случаях. В 4 клинической группе преждевременное созревание плаценты отмечалось у 12 (42,8%) женщин, незрелость плаценты у 5 (17,8%) женщин, увеличение толщины плаценты у 10 (35,7%) женщин, расширение межворсинчатого пространства у 15 (53,6%) женщин. Количество сочетания признаков увеличилось до 19 (67,8%) случаев, причем, наиболее частыми сочетаниями были преждевременное созревание плаценты и расширение межворсинчатого пространства (вне зависимости от клинических групп). Кроме того, в 4 группе у 6 (21,4%) пациентов плацента была кистозно изменена, в двух случаях (7,1%) отмечено формирование псевдокист.
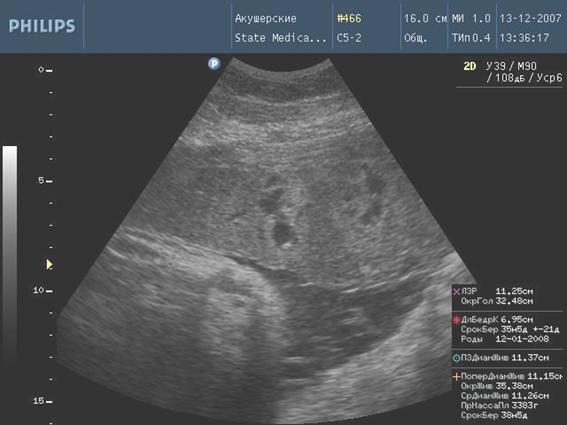
Рис. 1. Формирование псевдокист
При оценке объема и качества околоплодных вод были выявлены следующие закономерности. В контрольной группе данная патология определялась у 6 (15%) пациентов, из них у 1 (2,5%) в виде умеренно выраженного маловодия, у 2 (5%) - в виде умеренно выраженного многоводия, гиперэхогенные включения в околоплодных водах зарегистрированы у 3 (7,5%) пациентов. Сочетания признаков не выявлено. В основных группах патология околоплодных вод обнаружена у 63 (75,9%) пациентов. Так, во 2 клинической группе маловодие выявлено у 6 (20%) женщин, многоводие - у 2 (6,6%) женщин, гиперэхогенные включения отмечались у 8 (26,6%) женщин. Сочетание признаков зарегистрировано в 5 (16,6%) случаях. В 3 клинической группе маловодие наблюдалось в 11 (44%) случаях, многоводие в 5 (20%) случаях, гиперэхогенные включения в 9 (36%) случаях. Кроме того, в 2 (8%) случаях было зарегистрировано наличие амниотических тяжей, свободно располагающихся в амниотической полости. В 4 клинической группе маловодие выявлено у 18 (64,3%) беременных, многоводие у 7 (25%) беременных; наличие гиперэхогенных включений и амниотических тяжей в 12 (42,8%) и 4 (14,3%) случаях соответственно. Кроме того, в основных группах многоводие с множественными гиперэхогенными включениями сочеталось в 26 (31,3 %) случаях, у 4 (4,8 %) беременных многоводие сочеталось с амниотическими тяжами.
Рис. 2. Эхографический маркер внутриутробного инфицирования околоплодных вод (свободно расположенный амниотический тяж)
При ультразвуковом исследовании у плодов с инфекционными фетопатиями обнаружены следующие эхографические особенности. Расширение чашечно-лоханочной системы выявлено у 4 (14,3%) плодов 4-ой группы и у 2 (8%) плодов третьей группы (рис. 3), вентрикуломегалия у 4-х (14,3%) плодов 4 группы и у 2 (8%) плодов 3 группы (рис. 4), гепатомегалии у 5 (17,8%) плодов 4 группы и у 2 (8%) плодов в 3 группе. Кардиомегалия с гидроперикардом зарегистрированы у 2-х (7,1%) плодов 4 группы. Отмечено появление линейных гиперэхогенных включений в перивентрикулярных зонах головного мозга плода в 4 (14,3%) случаях в 4 клинической группе, в 2 (8%) случаях в 3 клинической группе и в 1 (3,3%) случае во 2 группе. Кисты в сосудистых сплетениях головного мозга плода обнаружены в 2 (7,1%) случаях в 4 группе, в 1 (4%) случае в 3 группе и в 1 (3,3%) случае во 2 группе. Патологическое расширение петель толстого кишечника зарегистрировано у 2 (7,1%) плодов 4 группы и у 1 (4%) плода в 3 группе. Асцит выявлен у 1 (3,6%) плода 4 группы. Таким образом, наибольшее число инфекционных фетопатий было выявлено у беременных 4 клинической группы.
Рис. 3. Эхографический маркер внутриутробного инфицирования плода (правосторонняя пиелоэктазия)
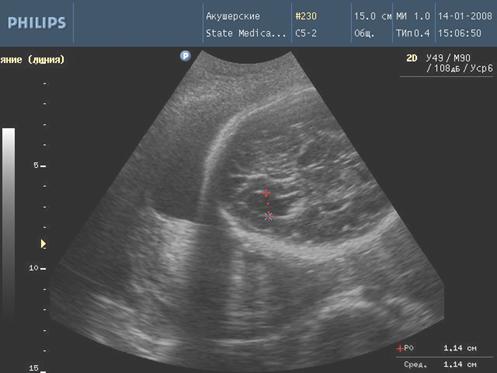
Рис. 4. Вентрикуломегалия
ЗВУР плода зарегистрирована в 29 случаях (34,9%) в основных группах и в 1 (2,5%) случае в контрольной группе. Во 2 клинической группе ЗВУР I-II степени выявлена у 7 (23,3%) плодов. В 3 клинической группе ЗВУР диагностирована у 8 (32%) плодов, из них у 5 (20%) зарегистрирована ЗВУР плода I степени, у 2 (8%) - II степени, у 1 (4%) - III степени. В 4 клинической группе количество случаев ЗВУР плода увеличилось до 14 (50%), причем ЗВУР I степени отмечалась у 8 (28,6%) плодов, ЗВУР II степени - у 4 (14,3%) плодов, ЗВУР III степени у 2 (7,1%) плодов.
Исследования биофизической активности плода выявили следующие результаты. При оценке дыхательной активности плода в 1 клинической группе максимальная продолжительность одного эпизода дыхательных движений более 60 секунд определена у 35 (87,5%) плодов. У 5 (12,5%) отмечалось снижение дыхательной активности, из них у 4 (10%) продолжительность составила от 30 до 60 сек. и у 1 (2,5%) отмечалось резкое снижение данного параметра. В этой группе адекватная двигательная активность сохранялась у 38 (95%) плодов, небольшое снижение двигательной активности зарегистрировано у 2 (5%) плодов. Тонус у плодов был удовлетворительным в 100% случаев.
Во 2 клинической группе снижение дыхательной активности наблюдалось у 14 (46,6%) плодов, из них у 2 (6,6%) она не регистрировалась вообще. Снижение тонуса и двигательной активности отмечалось одномоментно у 3 (10%) плодов.
В 3 клинической группе снижение дыхательной активности наблюдалось у 16 (64%) плодов, из них у 11 (44%) продолжительность одного эпизода дыхательных движений составила от 30 до 60 сек., а у 5 (20%) плодов - менее 30 сек. В 4 группе в 82,1% случаев отмечалось снижение дыхательной активности, у 9 (32,1%) плодов - резкое снижение данного параметра. Тонус и двигательная активность плода являются наиболее точными маркерами тяжести внутриутробного страдания плода. Так в 3 клинической группе снижение данных показателей отмечалось у 17 (68%) плодов, в 4 группе - у 25 (89,2%) плодов, причем отсутствие общей двигательной активности за время наблюдения определялось у 6 (24%) плодов 3 группы и у 15 (53,5%) плодов 4 группы.
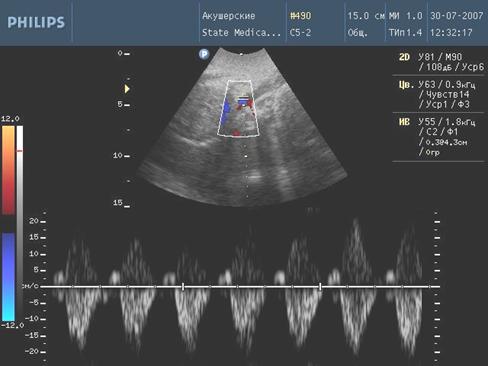
Рис. 5. Нарешение гемодинамики III ст. (ретроградный кровоток)
С целью изучения особенностей гемодинамических нарушений в фетоплацентарном комплексе у беременных с высоким инфекционным индексом были использованы значения систоло-диастолического отношения (СДО) в маточных артериях, артерии пуповины и средней мозговой артерии.
Таблица 3. Средние значения СДО в изучаемых сосудах
Читайте также:


