Лихорадка при остром инфаркте миокарда

Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Симптомы инфаркта миокарда
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое
Осложнения инфаркта миокарда
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца - кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии(могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.

Болезни сердца и сосудов занимают одно из первых мест среди причин смертности в мире. Инфаркт миокарда является наиболее опасным заболеванием, на фоне острого инфекционного процесса он часто возникает и развивается внезапно, оставаясь нераспознанным. Организация инфаркта миокарда (ИМ) является очень сложным, комплексным процессом, начиная с первых минут коронарной атаки и заканчивая формированием соединительнотканного рубца [1].
Лихорадка денге (ЛД) – вирусная трансмиссивная инфекция, протекающая с выраженной интоксикацией, лимфоаденопатией, гепатоспленомегалией, поражением суставов, позвоночника и, преимущественно, суставов нижних конечностей. На территории РФ все случаи заболевания являются завозимыми, а география в 96% случаев представлена странами Южной и Юго-Восточной Азии. По оценкам ВОЗ, ежегодно более 2,5 миллиарда человек подвергаются риску заражения ЛД, 50–100 миллионов заболевают, из них 500 тысяч – в тяжелой форме [2]. За последние 10-15 лет в мире значительно ухудшилась эпидемиологическая ситуация по заболеваемости лихорадкой денге. Более 70% больных регистрируется в Бирме, Индонезии, Таиланде и других странах Юго-Восточной Азии и западной части Тихого океана [3]. Применение комплекса клинико-эпидемиологических и лабораторно-диагностических исследований позволяет своевременно выявлять больных лихорадкой денге, что особенно актуально при развитии туристического бизнеса и доступности отдыха в азиатском регионе у россиян [4]. В нашей стране регистрируются только завозимые случаи, число которых растет с каждым годом: в 2010-2012 гг. – 71 случай, в 2013 году – 170, в 2014 году – 105 случаев, в 2015 году – 136, в 2016 году – 140 (по данным Роспотребнадзора). Наибольшее количество заболевших выявлено в гг. Москве, Санкт-Петербурге, в Новосибирской области и Хабаровском крае [5].
Традиционно в классификации выделяются три формы ЛД: классическая, геморрагическая и шоковый синдром денге [6]. В 2009 г. эксперты ВОЗ предложили классифицировать ЛД на нетяжелую и тяжелую [2]. Геморрагическая форма лихорадки денге развивается у лиц, перенесших классическую форму болезни. В генезе геморрагической формы лихорадки денге значительную роль играют иммунные комплексы, вызывая повреждение эпителия капилляров. Роль капиллярного русла в патогенезе ИМ в настоящее время широко обсуждается. Это связано, в первую очередь, с доказанной ролью сохраняющейся обструкции капилляров даже при восстановлении магистрального кровотока [1]. Трудности диагностики ЛД обусловлены недостатком необходимых знаний врачами первого звена клиники завозимых инфекционных заболеваний. Если исходить из этой концепции, то большую настороженность должны вызывать пациенты, ранее посещавшие эндемичные районы, даже при отсутствии в анамнезе лихорадочных состояний, ассоциированных с прошлыми поездками [7]. Кроме того, наличие хронической соматической патологии может приводить к более тяжелому течению любого инфекционного заболевания, в том числе и ЛД. Распознавание безболевой формы инфаркта миокарда на фоне экзотического тяжелого инфекционного заболевания является крайне сложным, если не учитывать в анамнезе наличия хронических сопутствующих заболеваний.
Целью исследования явился анализ клинического случая повторного инфаркта миокарда на фоне тяжелого инфекционного заболевания с геморрагическим синдромом.
Полученные результаты и их обсуждение. При эпидемическом анализе было установлено, что пациент вместе с женой посетил Таиланд. Отмечали при посещении зоопарков укусы обезьян и укусы комаров. Ранее пациент неоднократно посещал Таиланд по роду трудовой деятельности, после посещений отмечал периодически гриппоподобные заболевания, по поводу которых за медицинской помощью не обращался. В течение десяти лет больной страдал гипертонической болезнью, принимал гипотензивные препараты. Иногда после стрессовой нагрузки отмечал непродолжительные боли за грудиной, по поводу которых за медицинской помощью не обращался. Ежегодно проходил диспансеризацию по роду своей деятельности. Диагноз ишемической болезни сердца был установлен два года назад. Пациент вел малоподвижный образ жизни, злоупотреблял жирной пищей, статины не принимал. В июне 2017 года пациент прошел диспансеризацию, при которой проводилась ЭКГ, патологии не было выявлено. Заболевание началось 13.12.2017 г. в Пхукете, через неделю после приезда. Внезапно повысилась температура тела, появился озноб, боли в позвоночнике и крупных суставах, однократно отмечал жидкий стул, обратился к врачу в гостинице Таиланда, врач диагностировал грипп. Пациент самостоятельно принимал ципрофлоксацин, жаропонижающие препараты, 14.12.2017 г. заметил на голенях сыпь. 15.12.2017 г. появилась боль в эпигастрии, наросла головная боль, тошнота. 16.12.2017 г., по возвращении домой, вызвал бригаду скорой помощи. Был осмотрен врачом, поставлен диагноз: острая пневмония, геморрагический синдром, тяжелое течение, больной был доставлен в инфекционный стационар. Врач приемного покоя, осмотрев больного и собрав эпидемические данные, заподозрила лихорадку Денге. При поступлении пациент предъявлял жалобы на головную боль, сухой кашель, одышку, боль вверху живота, сыпь, резкую слабость. Состояние пациента было расценено как тяжелое, при осмотре на коже нижних конечностей была обильная петехиальная сыпь, при аускультации в легких выслушивалось ослабленное дыхание. Больной был направлен в отделение интенсивной терапии. Была назначена противовирусная, антибактериальная, дезинтоксикационная и патогенетическая терапия. В гемограмме от 16.12. 2017 г. эритроциты составили 4,24 · 10 12 , тромбоциты - 74 · 10 9 /л, лейкоциты - 4,2 · 10 9 /л, нейтрофилы - 82%, скорость оседания эритроцитов (СОЭ) была 6 мм/час. Биохимическое исследование крови от 16.12. 2017 г. установило: АСТ 104,77 ед./л, АЛТ 117,75 ед./л, креатинкиназа МВ 34,5 ед./л, билирубин общий 10,13мкмоль/л. Проведена рентгенография органов грудной клетки 18.12.2017 г., диагностирована двусторонняя полисегментарная плевропневмония, малый гидроторакс справа, кардиомегалия 1 ст.
17.12 2017 г. методом ПЦР выделена РНК вируса лихорадки Денге 2 типа.
Ввиду сохраняющейся одышки проведена ЭКГ от 18.12. 2017 г., у пациента заподозрен острый инфаркт миокарда по задней и переднеперегородочной области и верхушке левого желудочка. В динамике в гемограмме усилилась тромбоцитопения. От 18.12.2017 г. данные анализа крови составили 82%, СОЭ - 23 мм/час. Проведено повторное биохимическое исследование крови: креатинфосфокиназа составила 1046 ед/л, креатиназа МВ - 96.0 ед./л, С-реактивный белок - 62.9 мг/л, АЛТ - 96.0 ед./л, АСТ - 78,0 ед/л, ПТИ - 75%, активированное частичное тромбопластиновое время (АЧТВ) - 34 секунды. Самочувствие больного не соответствовало изменениям на ЭКГ, в связи с чем 20.12.2017 г. была проведена эхокардиография, при которой выявлены изменения в миокарде левого желудочка, дилатация ствола легочной артерии, трикуспидальная недостаточность второй степени, дилатация левого желудочка.
В инфекционном стационаре лихорадка сохранялась до пяти дней, одышка в покое и тошнота исчезли, кашель стал влажным. Боль в эпигастрии сохранялась до семи дней. В динамике в гемограмме тромбоцитопения исчезла, лейкоциты составили 8,3 · 10 9 /л, нейтрофилы - 39%, СОЭ - 30 мм/час.
После консультации кардиолога больной был переведен в кардиологическое отделение городской больницы с диагнозом: острый инфаркт миокарда левого желудочка. К моменту выписки из инфекционного стационара лихорадка исчезла, высыпания на коже конечностей угасли, боль в эпигастрии не повторялась. При поступлении в кардиологическое отделение 25.12.17 г. пациент предъявлял жалобы на слабость, одышку при физической нагрузке. Ангинозные боли и боли в грудной клетке отмечал периодически в течение трех недель. Кожные покровы были бледными, с участками гиперпигментации по всему телу. Отмечались отеки стоп, лица. В гемограмме от 26.12 эритроциты составили 4,2 · 10 12 , уровень тромбоцитов значительно увеличился и составил 354 * 10 9 , лейкоциты - 8,8 · 10 9 /л, СОЭ - 22 мм/час. Данные коагулограммы: нормализовалось АЧТВ до 34 секунд, протромбиновый индекс повысился до 100%, фибриноген составил 3,3 г/л. В биохимических показателях снизились уровни трансаминаз: АСТ до 47 ЕД/л, АЛТ до 83 ЕД/л, нормализовался уровень С- реактивного белка. Уровень ГГТП оставался высоким и составил 221 ед./л, а уровень КФК МВ снизился до 26 ед./л.
Проведенная повторно электрокардиография 25.12.17 г. выявила закономерную динамику повторного переднего острого инфаркта миокарда на фоне рубцовых изменений по передней и задней стенке левого желудочка. Учитывая перечисленные данные, пациент был переведен в отделение кардиореанимации и интенсивной терапии. Крупноочаговые изменения по передней и задней стенке левого желудочка при отрицательных маркерах некроза были расценены как перенесенный крупноочаговый распространенный передний инфаркт миокарда, произошедший в период с июня по декабрь 2017 года. В стационаре у пациента был верифицирован повторный не-Q-мелкоочаговый инфаркт миокарда, осложненный развитием двусторонней интерстициальной пневмонии, двустороннего гидроторакса. 27.12.17 г. больному была проведена коронарография. На видеограмме установлен правый тип кровоснабжения. Выявлен стеноз в среднем отделе передней межжелудочковой артерии до 90%, в огибающей артерии в среднем отделе выявлена окклюзия на протяжении 3 см, дистальнее с контрастированием по внутрисистемным коллатералям. В правой коронарной артерии выявлена неровность контура. Была проведена коронарная ангиопластика со стентированием передней межжелудочковой артерии. При контрольном контрастировании целевой стеноз был устранен. Решено было выполнить попытку реканализации окклюзии огибающей артерии, однако баллон в окклюзию завести не удалось, поэтому, учитывая малый диаметр артерии 2.0 мм, хронический характер окклюзии, от дальнейших попыток ангиопластики огибающей артерии решено было отказаться. Через сутки нахождения в отделении кардиореанимации больной был переведен в отделение, где ему проводилось консервативное лечение. При назначении стандартной двойной дезагрегантной терапии было учтено разрешение геморрагического синдрома, повышение уровня тромбоцитов до нормы. Пациенту назначены ацетилсалициловая кислота, клопидогрель. Продолжена терапия конкором, розувастатином, спироналактоном, панангином. На фоне проводимой терапии состояние больного улучшилось, ангинозные боли и боли в грудной клетке не повторялись, сердечная и дыхательная недостаточность не нарастали. Одышки в покое не было, однако сохранялась одышка при умеренной физической нагрузке. На эхоэлектрокардиограмме (ЭХО КГ) в контроле определялись зоны гипокинезии, акинезии по передней стенке и передней перегородочной области левого желудочка. Сократительная функция миокарда была снижена. Диастолическая функция была по первому типу, аорта - умеренно уплотнена. При дальнейшем при компьютерной томографии 6.01.17 г. в теле левого надпочечника обнаружено новообразование, что потребовало дальнейшего обследования. Также были выявлены признаки лимфоаденопатии внутригрудных лимфоузлов. Обнаружен индуцированный очаг в сегменте S2 левого легкого. Проведено холтер-мониторирование от 09.01.18 г. За время обследования наблюдался синусовый ритм, наджелудочковая экстрасистолия (всего 8), одиночная полиморфная желудочковая экстрасистолия (всего 3). Проведена оценка ишемических изменений на фоне исходных данных, значимых изменений сегмента ST не выявлено. Интервал QT удлинен в ночное время. Пациент был выписан в удовлетворительном состоянии с заключительным диагнозом ИБС (ишемическая болезнь сердца), не-Q-повторный мелкоочаговый острый инфаркт миокарда от 16.12.17 г. тип 1, постинфарктный кардиосклероз (острый инфаркт миокарда по передней стенке левого желудочка и задней стенке левого желудочка неизвестной давности). Проведена коронарография 27.12.17 г. и коронарная ангиопластика со стентированием межжелудочковой артерии.
Диагностированы ишемическая кардиопатия (фракция выброса 49% по Симпсону), хроническая сердечная недостаточность (ХСН) 2А, функциональный класс 2. Лихорадка Денге 2 типа с геморрагическим синдромом, формированием двусторонней пневмонии, двустороннего малого гидроторакса. Дыхательная недостаточность (ДН) 0.
Данный клинический случай представляет профессиональный интерес, поскольку лихорадка Денге - редкое заболевание, нехарактерное для жителей РФ, а особенно северного региона. Развитие геморрагического синдрома при инфекционном заболевании влияет на течение инфаркта миокарда. Течение такого инфаркта не является типичным. У пациента при нашем клиническом наблюдении отмечались периодически возникающие боли в эпигастрии и однократный жидкий стул, которые были расценены врачами как проявление инфекционного заболевания. Учитывая дальнейшее течение болезни, вышеперечисленные симптомы можно расценить как клинические признаки инфаркта задней стенки левого желудочка. При анализе научных работ особого внимания заслуживает атипичное течение инфаркта миокарда, в частности его абдоминальная форма, которая встречается в 1,8-2,5% случаев и сопровождается клинической симптоматикой острых заболеваний органов брюшной полости. При абдоминальной форме инфаркта миокарда наиболее часто происходит трансмуральное поражение задней либо нижне-диафрагмальной стенки миокарда [8]. Следует отметить, что болевой синдром может быть следствием как абдоминальной патологии, так и иррадиации при патологии других органов, в том числе и сердца. Дифференциальная диагностика между кардиогенными болями и острыми заболеваниями брюшной полости весьма затруднительна [8; 9].
Лечение пациента с инфарктом миокарда после инфекционного заболевания с геморрагическим синдромом представляет сложности. Клиническое наблюдение показывает, что тромболитическая терапия, являясь золотым стандартом терапии пациентов с инфарктом миокарда и элевацией сегмента ST, может способствовать увеличению числа разрывов сердца. Предиктором надвигающегося разрыва является появление идиовентрикулярного ритма. Если в течение ближайших 1,5-2 часов возможно проведение первичного чрескожного коронарного вмешательства, то следует предпочесть баллонную ангиопластику и стентирование коронарных артерий [8; 9]. Таким образом, хронические фоновые заболевания могут рассматриваться как факторы, способствующие тяжелому течению ЛД [10]. В нашем клиническом наблюдении оказалось, что на фоне лихорадки Денге у пациента развился повторный инфаркт миокарда. О перенесенном трансмуральном первичном перенесенном инфаркте сам больной даже не подозревал. На момент установления диагноза у пациента был геморрагический синдром с выраженной тромбоцитопенией, поэтому от тромболитической терапии пришлось отказаться. Так как был разгар инфекционного заболевания, с сопутствующей пневмонией и пневмотораксом, инвазивные методы лечения стеноза коронарных сосудов были невозможны. Полноценная инфузионная терапия была невозможна из-за риска развития острой сердечной недостаточности [11]. Была выбрана выжидательная тактика, которая себя оправдала. После разрешения геморрагического синдрома больной был переведен в кардиореанимацию. Ему было проведено стентирование коронарных сосудов, после чего назначена двойная дезагрегантная терапия. В дальнейшем отмечалась стойкая положительная динамика, о чем свидетельствовало полное восстановление функции сердца с отсутствием ангинозных болей, исчезновение одышки. В удовлетворительном состоянии больной был выписан домой 11.01.18 г. В дальнейшем пациент наблюдался в сердечно-сосудистом центре, где ему была продолжена дезагрегантная терапия. В настоящее время состояние пациента удовлетворительное, активных жалоб не предъявляет, получает терапию. Сочетание двух заболеваний (ЛД и инфаркта миокарда) привело к значительным трудностям в постановке диагноза и лечении данного пациента.
Таким образом, клиническое наблюдение повторного инфаркта миокарда на фоне лихорадки денге свидетельствует о целесообразности выжидательной тактики ведения больного в период разгара инфекционного заболевания с повреждением сосудов и раннем применении стандартной двукомпонентной дезагрегантной терапии с кардиохирургическим вмешательством в периоде ранней реконвалесценции этой инфекции.
Сердце — это мышечный орган, который состоит из четырех камер (двух предсердий и двух желудочков). С внешней стороны оно покрыто перикардом — это плотная соединительно-тканная сумка, внутри которой находится самый толстый слой сердца — миокард. Внутри желудочки сердца выстилаются эндокардом. Итак, миокард — это самый толстый слой, вся толща сердечной мышцы, именно к нему подходит большинство сосудов.
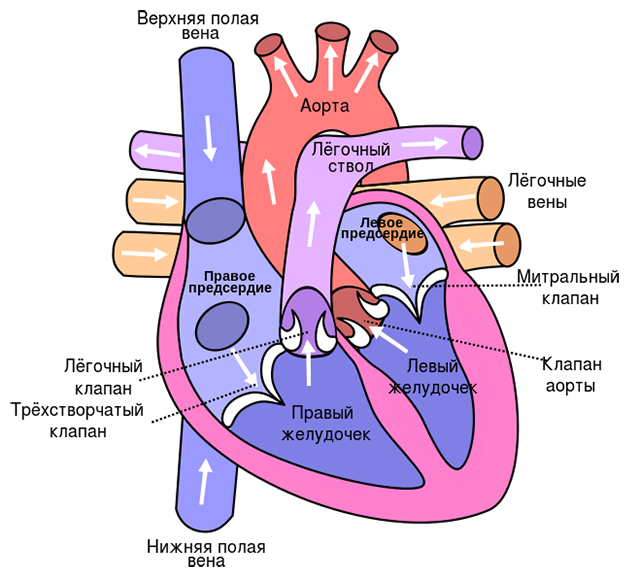
Сердце очень требовательно к поступлению крови. Его ресурсы и энергетический запас минимальны, поэтому оно постоянно нуждается в притоке большого количества крови. Если руку, например, можно пережать жгутом на час и потом жгут этот отпустить, ничего катастрофического не случится, а для сердца уже несколько минут пребывания без кровотока технически крайне опасно. То есть время, в течение которого сосуды к сердцу могут быть перекрыты, после чего может произойти восстановление, составляет всего 30 минут. Спустя эти 30 минут после того, как кровоток к сердцу прекратился (как правило, закрылся тромбом), начинается прогрессивная гибель клеток сердца. В бассейне, который кровоснабжается закупоренной артерией, через два часа после закупорки в живых остается только половина клеток. А через шесть часов их остается около 10%.
Остальные факторы — это лишний вес, сахарный диабет, неправильное питание, низкий уровень физической активности, депрессия, стресс и общее состояние, в том числе различные воспаления. При системном воспалении (то есть при воспалении внутри организма, а не связанном, например, с повреждением кожных покровов) формируется С-реактивный белок, который повышает риск инфаркта.
В случае разрыва бляшки ее содержимое устремляется в кровь, и срабатывает система свертывания крови. Сначала на разрыв начинают налипать тромбоциты. Потом образуется белый тромб, а затем — так называемый красный тромб с включением нитей фибрина — белка, образующегося под действием фермента тромбина. Параллельно с процессом тромбообразования активируется система, которая противостоит тромбообразованию и делает так называемый тромболизис. Это наша внутренняя система, которая и создана для того, чтобы противостоять возникновению тромбов. Ее мощность обычно значительно меньше, чем мощность системы тромбообразования, поэтому в подавляющем большинстве случаев тромб формируется. То есть система свертывания крови, которая спасает жизнь при кровотечениях, здесь активируется на полную мощность, что порой приводит к смерти.
При этом важно понимать, что чем крупнее сосуд, который закупоривается, и чем ближе к устью сосуда образуется тромб, тем более тяжелый инфаркт. Тем не менее иногда есть счастливый сценарий: если произошел разрыв небольшой атеросклеротической бляшки, то система, противостоящая тромбообразованию, может рассосать этот тромб, тогда инфаркта не будет.
Человек при инфаркте начинает внезапно чувствовать сильную боль в грудной клетке или в некоторых случаях в животе — если поражена задняя стенка. У пациентов с сахарным диабетом инфаркты могут сопровождаться слабой болью, поэтому им нужно быть особенно внимательными. Если в течение шести часов препятствия току крови будут устранены при помощи тромболитиков, то, скорее всего, последствия инфаркта будут не очень страшными. В противном случае есть риск, что большая часть клеток сердца погибнет и его насосная функция сильно упадет, что приведет к сердечной недостаточности.

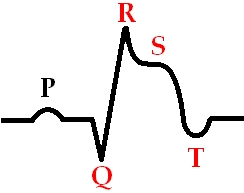
Мы разделяем инфаркт миокарда на разные категории, в первую очередь по проявлениям на кардиограмме — это очень удобно с клинической точки зрения. Нужно сказать, что есть три ключевых признака при диагностике инфаркта миокарда: первый — сильная боль в грудной клетке; второй — характерное для инфаркта миокарда изменение на кардиограмме; и третий — это попадание в кровь белков сердца, которые называются тропонинами. Сердечная мышца погибает, и высвобождается тропонин. Чтобы поставить диагноз, нужно, чтобы сошлись эти три признака. На самых-самых ранних этапах инфаркта еще не успевает увеличиться концентрация тропонина в крови. Тогда диагноз устанавливается клинически — достаточно боли и еще ряда признаков, чтобы начать действовать.
На кардиограмме очень хорошо видно инфаркт. Один вид инфаркта протекает с так называемой депрессией сегмента ST, а другой — с элевацией сегмента ST. Депрессия говорит о том, что, скорее всего, закупорена не очень большая артерия, которая снабжает внутренний слой сердечной мышцы. А элевация, то есть повышение сегмента ST, говорит о закупорке крупной артерии. В случае депрессии, как правило, пронзающего всю толщу сердечной мышцы рубца не образуется. А если есть элевация сегмента ST на кардиограмме, обозначающая поражение крупного сосуда, то это значит, что поражается стенка сердца на всю толщу. Раньше это называлось трансмуральный инфаркт миокарда, а сейчас мы его обозначаем как Q-образующий инфаркт миокарда. Если на кардиограмме есть глубокие зубцы Q, значит, на сердце есть большой и глубокий рубец, в котором нет живых мышечных клеток, а есть только соединительная ткань.
Как уже отмечалось ранее, значительную опасность могут представлять не только большие, но и маленькие бляшки с тонкой фиброзной покрышкой. Такие часто бывают у мужчин, особенно молодых, у которых бляшка только начала расти. Соответственно, это разные клинические сценарии: разрыв маленькой бляшки и разрыв большой бляшки. Они разнообразны, но оба приводят к инфаркту.

Инфаркт нужно отличать от других форм перебоев с поставкой крови к сердцу. Например, от ишемии — кислородного голодания. Оно может длиться достаточно долго и не приводить к развитию инфаркта. Сосуд может быть закрыт наполовину, бляшка выросла, и в покое сердце может даже не ощущать того, что бляшка есть, потому что крови, которая проходит через закрытый наполовину сосуд, достаточно для того, чтобы удовлетворить потребность в кислороде. Если человек, например, бежит, то крови, которая поступает через закупоренный наполовину сосуд, становится недостаточно, и сердце начинает болеть.
Наблюдение пациентов с инфарктом в клинических условиях пришло в практику в 60-х годах XX века. В частности, одним из адептов лечения пациентов в условиях реанимации был живущий ныне российский кардиолог Абрам Львович Сыркин, заведующий кафедрой кардиологии в МГМУ. История борьбы с инфарктом миокарда достаточно свежая, потому что до сих пор живы люди, которые разрабатывали подходы к лечению этого заболевания.
Что касается препаратов, то в первую очередь появились те, которые понижают сердечный ритм. Если понизить сердечный ритм, то падает потребность сердца в кислороде, шансы выжить у сердечной мышцы выше. К тому же появились препараты, которые растворяют тромбы в сосудах. Что интересно, эти препараты были получены из продуктов жизнедеятельности бактерий, и они активируют нашу внутреннюю противосвертывающую систему крови.
Одними из самых распространенных лекарств являются тромболитики — препараты, которые разжижают кровь. Но они, во-первых, не очень эффективны, потому что не все тромбы растворяются. Во-вторых, они могут быть опасными, потому что активируют противосвертывающую систему во всех органах и тканях, из-за чего могут развиваться сильные кровотечения. Поэтому более правильный подход — это подойти с помощью катетера к пораженному сосуду сердца, вытащить из него маленький проводник и пройти через тромб. По этому проводнику, как по монорельсу, провести баллон, раздуть баллон, и в этот момент тромб, который находится в сосуде сердца, вдавливается в стенки сосуда — так, как будто вы ступаете ногами по мокрому песку. После этого баллон сдувается, и кровоток восстанавливается. Это самая прогрессивная техника. Она называется ангиопластика.
В максимальном варианте крайне важно дополнять раздувание баллона установкой внутри сосуда своеобразного корсета — стента. Стент будет поддавливать изнутри остатки этой атеросклеротической бляшки и не даст образоваться новому тромбу. Потому что, как вы понимаете, если сосуд в каком-то месте поврежден, то там будет и дальше происходить налипание на это же место тромбоцитов, поэтому простая ангиопластика без стентирования не очень эффективна.
На фоне снижения уровня холестерина активируется система, которая начинает выносить холестерин из различных участков сосудов, в том числе из бляшек. Удаляется холестерин с желчью. Бляшка становится плотнее, покрышка становится плотнее, риск ее разрыва снижается, даже если человек продолжает курить и вести нездоровый образ жизни. Главное при профилактике инфаркта — сделать покрышку менее склонной к разрыву. Второй важнейший аспект — это контроль артериального давления, потому что оно является провоцирующим фактором разрыва бляшки. Поэтому почти все препараты, которые снижают артериальное давление, предотвращают инфаркт миокарда.

Расчет риска инфаркта — это достаточно сложная вещь. Если риск низкий, то можно обойтись без лекарств вообще. Если риск средний, тогда, может быть, достаточно только статина. Если риск высокий, например если у человека уже был инфаркт или у него есть боль в грудной клетке, связанная с тем, что есть бляшки, тогда крайне важно применять одновременно и статин, и препарат, снижающий артериальное давление, и пульсурежающий препарат (для снижения нагрузки на миокард). Очень распространено заблуждение, что для того, чтобы принимать статин, нужно знать, какой у тебя холестерин. Нет разницы, какой холестерин у человека. Если у него уже болит сердце или был инфаркт, ему обязательно нужно принимать статин.
Святой Грааль сегодня — открыть надежные, неинвазивные способы оценки стабильности фиброзной покрышки атеросклеротической бляшки. Тогда можно будет найти людей, которым требуется исключительно массированная профилактика инфаркта. Кроме того, изыскиваются способы упрощения процедуры лечения инфаркта. Сейчас уже созданы устройства, которые позволяют очень быстро провести реваскуляризацию, то есть восстановить кровоток в закупоренных сосудах, но очень важная проблема здесь — это как не допустить повторного инфаркта в том же или расположенном рядом поврежденном участке сосуда, питающего сердце. Атеросклеротическая бляшка настолько агрессивна, что прорастает сквозь сетку стента, даже если на нее были нанесены мощнейшие препараты, которые умерщвляют живые клетки. Важно научиться останавливать рост бляшки после инфаркта миокарда.
Еще один вопрос: как сделать так, чтобы после перенесенного инфаркта миокарда кровь была достаточно текучей, чтобы избежать повторного инфаркта и снизить риск кровотечений? Есть препараты, разжижающие кровь, а также те, которые влияют на способствующую тромбообразованию активность тромбоцитов. После того как произошел инфаркт, насосная функция сердца падает, и сердце не может удовлетворить потребность организма в кислороде — это называется сердечной недостаточностью. Поэтому очень большие усилия направлены на то, чтобы лечить именно ее. Для этого используются и стволовые клетки, которые вводят, чтобы они селились внутрь рубцовой ткани, и различные препараты, улучшающие функционирование оставшихся в живых клеток сердца, и это устройства для поддержания кровообращения — искусственное сердце или какие-то более миниатюрные девайсы.
Также важную роль играет профилактическая кардиология: инфаркт миокарда проще предупредить, чем лечить. Нужно сказать, что для обывателей, в первую очередь в России, нужно организовать нормальную систему транспортировки пациентов, чтобы скорая помощь привозила людей вовремя, в течение первых шести часов после появления боли в грудной клетке, когда еще можно сделать ангиопластику. Тогда функция сердца будет восстановлена, а у инфаркта миокарда не будет тяжелых последствий. В отношении того, что можно сделать после инфаркта миокарда, — организовать нормальную систему лечения и применения средств, которые прекрасно себя зарекомендовали.
Во всем мире частота смертей от инфаркта миокарда снижается, но статистика в данном случае — вещь очень лукавая. Инфаркт миокарда, развившаяся вследствие него сердечная недостаточность и развивающийся сходным образом инсульт находятся на первом месте среди причин смерти в развитых странах мира.
Читайте также:


