Лечение при гепатите цитомегаловирусной инфекции
4. Клинические проявления врожденной цитомегаловирусной инфекции
Большинство новорожденных, инфицированных ЦМВ внутриутробно, не имеют признаков врожденной болезни и гестационный возраст может быть важен в определении конечных последствий пренатальной инфекции. Только половина новорожденных из имеющих клинические признаки дают генерализованную цитомегаловирусную болезнь. Другие 50% этих новорожденных имеют незначительные или атипичные клинические проявления. 90—95% детей рождаются с субклинической, но хронической инфекцией.
Клинически врожденная цитомегаловирусная болезнь (ЦМВБ) обычно характеризуется вовлечением многих органов. К наиболее частым признакам, характеризующих манифестную форму ЦМВИ у новорожденных, относят гепатомегалию, спленомегалию, микроцефалию, желтуху и петехии. К менее частым проявлениям ЦМВИ относят внутриутробную задержку развития и недоношенность. Клинические проявления, наблюдаемые при врожденной ЦМВИ, включают также гидроцефалию, гемолитическую анемию и пневмонию. Большинство летальных исходов наступает в неонатальном периоде и обычно связано с поражением многих органов, с тяжелым расстройством функции печени, кровоточивостью, диссеминированной внутрисосудистой коагуляцией и вторичной бактериальной инфекцией. Если летальный исход наступает после первого месяца жизни, но в течение первого года, то он обычно обусловливается прогрессивным печеночным заболеванием, тяжелой печеночной недостаточностью. Летальные исходы после года жизни редки и обычно связаны с тяжелыми неврологическими дефектами, истощением, пневмонией и присоединением других инфекций.
Гепатомегалия является одним из наиболее частых симптомов, обнаруживаемых у новорожденных с манифестной формой врожденной ЦМВИ. Край печени пальпируется гладким и плотным и обычно определяется на 3—6 см ниже правого реберного края.
Наши наблюдения показали, что в ряде случаев цитомегаловирусный гепатит является ведущим клиническим проявлением врожденной ЦМВБ. Диагноз устанавливался на основании анамнестических, клинических и биохимических данных с обязательным подтверждением диагноза обнаружением маркеров ЦМВИ. У всех больных исследовали маркеры парентеральных вирусных гепатитов.
Цитомегаловирусный гепатит может протекать в безжелтушной и желтушной форме. Безжелтушная форма ЦМВ-гепатита протекает с очень скудной клинической симптоматикой, состояние детей остается удовлетворительным. Выявление безжелтушной формы гепатита возможно в связи с обнаружением гепатомегалии и повышенного уровня аминотрансфераз. Активность аминотрансфераз повышается незначительно (в 1,5—2,0 раза) с преобладанием АсАТ над АлАТ.
При желтушной форме гепатита выделено две группы больных: одна с благоприятным течением и постепенным выздоровлением и другая группа с прогрессирующим заболеванием печени и формированием билиарного цирроза вследствие развития облитерирующего холангита.
Состояние детей с желтушной формой ЦМВ-гепатита существенно не нарушалось. У них отмечалась гепатоспленомегалия. Желтуха у большинства детей обнаруживалась в первые дни после рождения. В биохимическом анализе крови выявлялась отчетливая гиперферментемия с преобладанием АсАТ (160,0±25,6 мкмоль/мин.л) над АлАТ (120,0±25,6 мкмоль/мин.л) и гипербилирубинемия (112,0±8,5 мкмоль/л) с преобладанием прямой фракции (62,0±6,7 мкмоль/л).
Таким образом, желтушная форма ЦМВ-гепатита с благоприятным течением характеризуется неяркой желтухой кожных покровов, темной мочой и окрашенным калом, гепатоспленомегалией, умеренной гиперферментемией с преобладанием АсАТ над АлАТ, повышением уровня билирубина с преобладанием прямой фракции, а также наличием маркеров активной репликации ЦМВ.
Одним из вариантов цитомегаловирусного поражения печени при врожденной ЦМВИ является формирование билиарного цирроза печени, приводящего к летальному исходу, как правило, во 2-ой половине первого года жизни.
При врожденной ЦМВИ нередко выявляется спленомегалия. Она может являться единственным признаком, указывающим на инфекцию при рождении. В некоторых случаях единственным проявлением заболевания является спленомегалия в сочетании с петехиальной сыпью. Спленомегалия обычно персистирует дольше, чем гепатомегалия.
Поражение желудочно-кишечного тракта, которое встречается при врожденной ЦМВИ, в клинической практике диагностируется редко. Преобладает диспептический синдром и прогрессирующая дистрофия, отражающие развитие энтероколита.
Нередко отмечается поражение почек. Нефропатия при ЦМВ-инфекции характеризуется как интерстициальный нефрит. В моче обнаруживаются следы белка, единичные гиалиновые цилиндры, лейкоциты, редко эритроциты.
Имеются доказательства, что ЦМВ оказывает прямое действие на мегакариоциты костного мозга, что приводит к тромбоцитопении и локализованной или генерализованной петехиальной сыпи. Петехии редко присутствуют при рождении, но они часто возникают спустя несколько часов. Они могут являться единственным клиническим проявлением ЦМВИ. Однако более часто петехии ассоциируются с увеличением печени и селезенки. Персистенция петехий может продолжаться в течение нескольких недель после рождения. Содержание тромбоцитов в крови падает и определяется обычно на уровне менее 100000.
Изменения со стороны центральной нервной системы занимают существенное место в симптоматологии врожденной ЦМВИ. Дети рождаются с малой массой тела, рефлексы угнетены, иногда наблюдаются расстройства актов глотания и сосания. Часто отмечается косоглазие и нистагм, мышечная гипотония, сменяющаяся повышенным тонусом мышц конечностей. Могут выявляться микроцефалия и гидроцефалия. При ультразвуковом исследовании находят кисты в веществе головного мозга.
Основным поражением, относящимся к глазам, является хориоретинит с возможной атрофией зрительного нерва, что может привести к слепоте. Реже наблюдается развитие увеита и катаракты.
Сенсорноневральная глухота, вероятно, является обычным дефектом, вызываемым врожденной ЦМВИ. Причиной утраты сенсорноневрального слуха у детей могут являться как манифестные, так и субклинические формы врожденной ЦМВИ. ЦМВ считается одной из наиболее частных причин нарушения слуха в детстве.
Пневмония относится к редким клиническим проявлениям врожденной ЦМВИ у новорожденных. Интерстициальная пневмония более вероятна у младенцев с перинатально приобретенной инфекцией.
Наиболее часто врожденная ЦМВИ протекает в субклинической форме, при этом в раннем неонатальном периоде не выявляются симптомы, характерные для ЦМВИ. И хотя считается, что асимптомная врожденная инфекция не дает внутриутробной задержки развития и не приводит к недоношенности, тем не менее мы смогли отметить у новорожденных с субклинической формой ЦМВИ более низкую оценку по шкале Апгар, более выраженную физиологическую убыль массы тела и менее быстрое ее восстановление, тенденцию к сокращению сроков гестации. Антропомерические показатели, характеризующие физическое развитие новорожденного с субклинической формой ЦМВИ, не отличались от таковых в контрольной группе.
В заключение приводим последовательность действий врача в постановке диагноза врожденной ЦМВБ, который может быть установлен при следующих условиях:
1) если выделен ЦМВ в одном из клинических материалов, взятых у новорожденного в первые 3 недели жизни (кровь, моча, слюна, другие секреты);
2) если у новорожденного присутствует один или более клинических симптомов или выявлены отклонения в лабораторных показателях: петехии, геморрагическая пурпура, спленомегалия, гепатомегалия, желтуха при рождении, микроцефалия, гидроцефалия, хориоретинит, необъяснимые неврологические нарушения, внутричерепные кальцификаты, гипербилирубинемия (с преобладанием прямой фракции), тромбоцитопения, повышение уровня АлАТ;
3) исключаются другие заболевания, которые могли бы вызвать эти отклонения.
Если вирус цитомегалии впервые выявляется у ребенка после 3-х недель жизни и в последующие месяцы, то это может отражать как возможное врожденное заболевание, так и заболевание, связанное с перинатальным инфицированием.
Первые симптомы перинатально приобретенной ЦМВИ могут появиться спустя 4 недели после рождения или в более поздние сроки — до 4-х месяцев. Чаще всего перинатально приобретенная форма ЦМВИ протекает в субклинической форме и в отличие от врожденного ЦМВ-заболевания при ней редко поражается центральная нервная система и более часто вовлекается в процесс бронхолегочная система.
Вирусные гепатиты, вызываемые вирусами из семейства Herpesviridae. Цитомегаловирусная инфекция
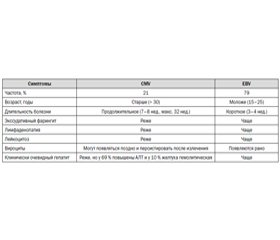
Статья опубликована на с. 27-31
Традиционными возбудителями острого вирусного гепатита принято считать вирусы гепатита А–Е. Однако существует немало других причин, которые могут привести к развитию острого воспаления печени. Среди инфекционных следует выделить группу герпесвирусов, которые, пожалуй, являются второй по частоте причиной вирусных поражений печени после классических гепатотропных вирусов.
1. Picone O., Vauloup-Fellous C., Cordier A.G. et al. A series of 238 cytomegalovirus primary infections during pregnancy: description and outcome // Prenat. Diagn. — 2013 Aug. — 33(8). — 751-8.
2. Pass R.F. A key role for adolescents in the epidemiology of cytomegalovirus and genital herpes infection // Clin. Infect. Dis. — 2004. — 39. — 1439-1440.
3. Gandhi M.K., Khanna R. Human cytomegalovirus: clinical aspects, immune regulation, and emerging treatments // Lancet Infect. Dis. — 2004. — 4. — 725-738.
4. Bernard S., Germi R., Lupo J., Laverrière M.H. et al. Symptomatic cytomegalovirus gastrointestinal infection with positive quantitative real-time PCR findings in apparently immunocompetent patients: a case series // Clin. Microbiol. Infect. — 2015 Dec. — 21(12). — 1121.
5. Kytö V., Vuorinen T., Saukko P. et al. Cytomegalovirus infection of the heart is common in patients with fatal myocarditis // Clin. Infect. Dis. — 2005. — 40. — 683-688.
6. Stagno S., Pass R., Dworsky M. et al. Congenital cytomegalovirus infection: The relative importance of primary and recurrent maternal infection // N. Engl. J. Med. — 1982. — 306. — 945-949.
7. Stagno S., Whitley R. Herpesvirus infections of pregnancy. Part I: Cytomegalovirus and Epstein — Barr virus infections // N. Engl. J. Med. — 1985. — 313. — 1270-1274.
8. Hui L., Wood G. Perinatal outcome after maternal primary cytomegalovirus infection in the first trimester: a practical update and counseling aid // Prenat. Diagn. — 2015 Jan. — 35(1). — 1-7.
9. Crumpacker C.S., Wadhwa S. Cytomegalovirus / Ed. by Mandell G.J., Bennett J.E., Dolin R. // mandell, Douglas and Bennett’s Principles and Practice of Infectious Diseases. — 6th edn. — Philadelphia, PA: Elsevier, 2005. — Р. 1786-1800.
10. Gallegos-Orozco J.F., Rakela-Brödner J. Hepatitis viruses: not always what it seems to be // Rev. Med. Chil. — 2010 Oct. — 138(10). — 1302-11.
11. Yaghobi R., Zamani S., Gramizadeh B., Rahsaz M. Etio–logy of DNA virus infections in liver transplant recipients with neonatal hepatitis // Transplant Proc. — 2010 Apr. — 42(3). — 837-8.
12. Watanabe S., Arima K., Nishioka M., Yoshino S., Hasui H., Fujikawa M. Comparison between sporadic cytomegalovirus hepatitis and Epstein-Barr virus hepatitis in previously healthy adults // Liver. — 1997. — 17. — 63-9.
13. Wreghitt T.G., Teare E.L., Sule O. et al. Cytomegalovirus infection in immunocompetent patients // Clin. Infect. Dis. — 2003. — 37. — 1603-1606.
14. Kunno A., Abe M., Yamada M. et al. Clinical and histological features of cytomegalovirus hepatitis in previously healthy adults // Liver. — 1997. — 17. — 129-132.
15. Mosley J.W., Redeker A.G., Feinstone S.M. et al. Mutliple hepatitis viruses in multiple attacks of acute viral hepatitis // N. Engl. J. Med. — 1977. — 296. — 75-78.
16. Amory J.K., Rosen H., Sukut C. et al. Clinical problem-solving. A jaundiced eye // N. Engl. J. Med. — 2006. — 354. — 1516-1520.
17. Tonolini M., Bianco R. HIV-related/AIDS cholangiopathy: pictorial review with emphasis on MRCP findings and differential diagnosis // Clin. Imaging. — 2013 Mar — Apr. — 37(2). — 219-26.
18. Blumberg R., Kelsey P., Perrone T., Dickersin R., Laquaglia M., Ferruci J. Cytomegalovirus- and Cryptosporidium-associated acalculous gangrenous cholecystitis // Am. J. Med. — 1984. — 76. — 1118-23.
19. Jacobson M., Cello J., Sande M. Cholestasis and disseminated cytomegalovirus disease in patients with the acquired immunodeficiency syndrome // Am. J. Med. — 1988. — 84. — 218-224.
20. Winston D.J., Busuttil R.W. Randomized controlled trial of sequential intravenous and oral ganciclovir versus prolonged intra- venous ganciclovir for long-term prophylaxis of cytomegalovirus disease in high-risk cytomegalovirus-seronegative liver transplant recipients with cytomegalovirus-seropositive donors // Transplantation. — 2004. — 77. — 305-308.
21. Paya C.V. Prevention of cytomegalovirus disease in recipients of solid-organ transplants // Clin. Infect. Dis. — 2001. — 32. — 596-603.
22. Preiksaitis J.K., Brennan D.C., Fishman J. et al. Canadian society of transplantation consensus workshop on cytomegalovirus management in solid organ transplantation final report // Am. J. Transplant. — 2005. — 5. — 218-227.
23. Cope A.V., Sabin C., Burroughs A. et al. Interrelationships among quantity of human cytomegalovirus (HCMV) DNA in blood, donor-recipient serostatus, and administration of methylprednisolone as risk factors for HCMV disease following liver transplantation // J. Infect. Dis. — 1997. — 176. — 1484-1490.
24. Lautenschlager I., Halme L., Hockerstedt K. et al. Cytomegalovirus infection of the liver transplant: virological, his- tological, immunological, and clinical observations // Transpl. Infect. Dis. — 2006. — 8. — 21-30.
25. Shinkai M., Bozzette S.A., Powderly W. et al. Utility of urine and leukocyte cultures and plasma DNA polymerase chain reaction for identification of AIDS patients at risk for developing human cytomegalovirus disease // J. Infect. Dis. — 1997. — 175. — 302-308.
26. Imbert-Marcille B.M., Cantarovich D., Ferre-Aubineau V. et al. Usefulness of DNA viral load quantification for cytomegalovirus disease monitoring in renal and pancreas/renal transplant recipients // Transplantation. — 1997. — 63. — 1476-1481.
27. Flexman J., Kay I., Fonte R. et al. Differences between the quantitative antigenemia assay and the cobas amplicor monitor quantitative PCR assay for detecting CMV viraemia in bone marrow and solid organ transplant patients // J. Med. Virol. — 2001. — 64. — 275-282.
28. Emery V.C., Sabin C.A., Cope A.V. et al. Application of viral-load kinetics to identify patients who develop cytomegalovirus disease after transplantation // Lancet. — 2000. — 355. — 2032-2036.
29. Piiparinen H., Hockerstedt K., Lappalainen M. et al. Monitoring of viral load by quantitative plasma PCR during active cytomegalovirus infection of individual liver transplant patients // J. Clin. Microbiol. — 2002. — 40. — 2945-2952.
30. Martin W.I., Smith T. Rapid detection of cytomegalovirus in bronchoalveolar lavage specimens by a monoclonal antibody method // J. Clin. Microbiol. — 1986. — 23. — 1006-1008.
31. Humar A., Gregson D., Caliendo A.M. et al. Clinical utility of quantitative cytomegalovirus viral load determination for predicting cytomegalovirus disease in liver transplant recipients // Transplantation. — 1999. — 68. — 1305-1311.
32. Espy M., Paya C., Holley K., Ludwig J., Hermans P.F., Wiesner R.H. et al. Diagnosis of cytomegalovirus hepatitis by histopathology and in situ hybridization in liver transplantation // Diag. Microbiol. Infect. Dis. — 1991.
33. Plotkin S., Starr S., Bryan C. In vitro and in vivo responses of cytomegalovirus to acyclovir // Am. J. Med. — 1982. — 73. — 257-261.
34. Razonable R.R. Cytomegalovirus infection after liver transplantation: current concepts and challenges // W. J. Gastroenterol. — 2008. — 14. — 4849-60.
35. Falagas M.E., Snydman D.R., Griffith J. et al. Clinical and epidemiological predictors of recurrent cytomegalovirus disease in orthotopic liver transplant recipients. Boston Center for Liver Transplantation CMVIG Study Group // Clin. Infect. Dis. — 1997. — 25. — 314-317.
36. Sia I.G., Wilson J.A., Groettum C.M. et al. Cytomegalovirus (CMV) DNA load predicts relapsing CMV infection after solid organ transplantation // J. Infect. Dis. — 2000. — 181. — 717-720.
37. Delice S., Gökahmetoğlu S., Kaynar L., Karakükcü M. Investigation of ganciclovir resistance in CMV UL54 and UL97 gene regions in immunocompromised patients receiving gancyclovir treatment // Mikrobiyol. Bul. — 2015 Jul. — 49(3). — 393-402.
(цитомегалия)
, MD, Brigham and Women’s Hospital, Harvard Medical School
Last full review/revision February 2018 by Kenneth M. Kaye, MD
Цитомегаловирус (герпесвирус человека тип 5) передается через кровь, или другие биологические жидкости, а также с пересаженными при трансплантации органами. Инфекция может быть приобретена трансплацентарно или во время рождения.
Распространенность увеличивается с возрастом; у 60–90% взрослых имеется цитомегаловирусная инфекция (результат длительно существующей латентной инфекции). Группы с низким социально-экономическим статусом склонны иметь более высокую распространенность.
Врожденная ЦМВ-инфекция может быть как бессимптомной, так и вызвать выкидыш, мертворождение или смерть после родов. Осложнения включают обширное поражение печени и ЦНС.
Приобретенные инфекции являются часто бессимптомными.
Острое заболевание с лихорадкой, которое называется ЦМВ-мононуклеозом, может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом, сходным с инфекционным мононуклеозом, вызванным вирусом Эпштейна–Барр (ВЭБ).
Постперфузионный синдром (после переливания) может развиться через 2–4 недели после переливания препаратов крови, содержащих цитомегаловирус. Это состояние сопровождается лихорадкой, длящейся 2–3 недели, и такими же проявлениями, как при цитомегаловирусном мононуклеозе.
У пациентов с ослабленным иммунитетом цитомегаловирус – главная причина заболеваемости и смертности. Болезнь часто следует после реактивации скрытого вируса. Легкие, ЖКТ или ЦНС могут быть поражены. На последней фазе СПИДа цитомегаловирусная инфекция вызывает ретиниту 40% пациентов и обуславливает видимые при помощи специальной аппаратуры нарушения сетчатки глаз. Язвенное поражение ободочной кишки (с болью в животе и крово-течениями ЖКТ) или пищевода (с дисфагией) может иметь место.
Диагностика
Обычно клиническая оценка
Обнаружение антигенов или ДНК ЦМВ
Культура мочи у младенцев
Часто биопсия у пациентов с ослабленным иммунитетом
ЦМВ-инфекцию можно подозревать у следующих категорий лиц:
Здоровые люди с мононуклеозоподобными синдромами
Пациенты с иммунодефицитом и симптомами нарушений ЖКТ, ЦНС или сетчатки
Новорожденные с системным заболеванием
Цитомегаловирусный мононуклеоз можно иногда дифференцировать от инфекционного мононуклеоза по отсутствию фарингита, отрицательному результату исследования на гетерофильные антитела и серологическому исследованию. Цитомегаловирусная инфекция может быть дифференцирована от вирусного гепатита по серологическому анализу на гепатит. Лабораторное подтверждение первичной цитомегаловирусной инфекции необходимо только для того, чтобы дифференцировать ее от других, особенно поддающихся лечению состояний или серьезного заболевания.
При сероконверсии происходит появление антител к цитомегаловирусу, что указывает на развитие новой ЦМВ-инфекции. Однако в организме человека с ослабленным иммунитетом многие формы ЦМВ-заболеваний обусловлены реактивацией скрытой инфекции. Реактивация цитомегаловируса может привести к распространению вируса в мочу, другие жидкости тела или ткани, но наличие ЦМВ в жидкостях тела или тканях не всегда указывает на болезнь, а может просто представлять собой распространение вируса по организму. Поэтому биопсия, доказываюшая наличие вызванных цитомегаловирусом отклонений, часто необходима, чтобы подтвердить поражение того или иного органа. Количественное обнаружение антигена цитомегаловируса или ДНК в периферической крови может также быть очень полезным, потому что повышенные или прогрессирующие титры цитомегаловируса очень часто наводят на размышления об актуальном инфекционном процессе.
Диагноз у ЦМВ-инфекции у младенцев может быть сделан при посеве мочи.
Лечение
При тяжелой болезни – противовирусные средства (например, ганцикловир, валганцикловир, фоскарнет, цидофовир)
Ретинит, вызванный цитомегаловирусом, который в основном встречается у больных СПИДом, лечат системными противовирусными средствами.
Препараты против цитомегаловируса используются, чтобы лечить тяжелую болезнь, а не ретинит, но являются менее последовательно эффективными, чем при ретините.
Препараты, применяемые для лечения ЦМВ-ретинита при индукционных и поддерживающих схемах терапии включают
Ганцикловир или валганцикловир
Фоскарнет, с ганцикловиром или без него
Цидофовир (в РФ не зарегистрирован)
Большинство пациентов, получают индукционную терапию одним из следующих препаратов:
Ганцикловир назначают по 5 мг/кг внутривенно каждые 12 часов в течение 2 - 3 недель
Валацикловир 900 мг перорально каждые 12 ч в течение 21 дня
Если индукция терпит неудачу не один раз, должен использоваться другой препарат.
Поддерживающая (супрессивная) терапия назначается после индукции и состоит из:
Ганцикловир 5 мг/кг внутривенно 1 раз/день
Валганцикловир 900 мг перорально 1 раз/день
В качестве альтернативы можно давать фоскарнет с или без ганцикловира. Дозировка такова:
Индукция: Фоскарнет по 60 мг/кг внутривенно каждые 8 часов в течение 2-3 недель
Поддерживающяя терапия: Фоскарнет по 90-120 мг/кг внутривенно 1 раз в день
Отрицательные воздействия внутривенного фоскарнета являются существенными и включают нефротоксичность, симптоматическую гипокальцимию, гипомагниемию, гиперфосфатемию, гипокалиемию и воздействие на ЦНС. Комбинированная терапия ганцикловиром и фоскарнетом увеличивает и эффективность, и отрицательные воздействия.
Терапия цидофовиром - однин из альтернативных методов лечения. Она состоит из
Индукции: Цидофовир по 5 мг/кг внутривенно 1 раз в неделю в течение 2 недель
Поддерживающей терапии: Цидофовир по 5 мг/кг внутривенно 1 раз в две недели
Эффективность цидофовира такая же, как ганцикловира или фоскарнета. Существенные отрицательные воздействия, включая почечную недостаточность, ограничивают использование цидофовира. Данный препарат может вызвать воспаление радужной оболочки или гипотонию глаз (внутриглазное давление ≤ 5 мм рт. ст.). Потенциал для нефротоксичности может быть уменьшен, если давать пробенецид и проводить предварительную гидратацию с каждой дозой. Однако отрицательные воздействия пробенецида, включая сыпь, головную боль и лихорадку, могут быть достаточно существенными, чтобы его не использовать.
При любой из схем лечения лечащий врач может рассматривать возможность прекращения терапии у ВИЧ-инфицированных пациентов, которые принимают антиретровирусную терапию (АРТ) и имеют количество CD4 ≥ 100 клеток/мкл в течение 3 месяцев.
Интравитреальная противовирусная терапия должна использоваться в сочетании с системной терапией у пациентов с ЦМВ-ретинитом, при котором прогрессивно ухудшается зрение (т.е. заболевания зрительного нерва или возле него, макулы). Даже пациенты, получающие глазные инъекции, нуждаются в системной терапии, чтобы предотвратить развитие цитомегаловирусной инфекции в другом глазу и тканях, расположенных вне глаза.
Доведение количества CD4 до > 100 клеток/ мкл с помощью системной антиретровирусной терапии должно предотвратить потребность в глазных имплантах и химиопрофилактике.
Профилактика
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции у пациентов после трансплантации органов или реципиентов гемопоэтических клеток, инфицированных ЦМВ и с риском развития ЦМВ инфекции. Используемые препараты включают ганцикловир, валганцикловир и фоскарнет.
Основные положения
60–90% взрослых людей имеют латентную цитомегаловирусную инфекцию.
У здоровых детей и взрослых, как правило, проявляются легкие, неспецифические симптомы или иногда синдром, подобный мононуклеозу.
Врожденная инфекция может привести к мертворождению или тяжелым, иногда фатальным постнатальным осложнениям, включая обширное повреждение печени или ЦНС.
У пациентов с тяжелым иммунодефицитом могут развиться тяжелые формы заболевания, с поражением сетчатки, легких, ЖКТ или ЦНС.
Противовирусные препараты могут помочь в лечении ретинита, но менее эффективны в случае повреждения других органов.
Пациентам после трансплантации с риском развития цитомегаловирусной инфекции требуется прием профилактических противовирусных препаратов или тщательный мониторинг для раннего диагностирования инфекции.
ВЫБОР АНТИМИКРОБНЫХ ХИМИОПРЕПАРАТОВ ПРИ ВИРУСНЫХ ИНФЕКЦИЯХ. ЦИТОМЕГАЛОВИРУСНЫЕ ИНФЕКЦИИ.
Цитомегаловирус вызывает различные заболевания. Наиболее тяжелые поражения наблюдаются у пациентов с иммунодефицитом и у новорожденных. ЦМВ способен персистировать в организме хозяина в латентном состоянии после острой инфекции. Реактивация может возникать при развитии иммунной супрессии, что сопровождается репликацией вируса в эпителии протоков почек, секреторных железах и его экскрецией со спермой, слюной, влагалищным отделяемым, грудным молоком.
Первичные ЦМВ-инфекции возникают у серонегативных пациентов, никогда прежде не инфицированных ЦМВ. Вторичные инфекции представляют собой активацию латентной инфекции или реинфекцию у сероположительного пациента. Первичные инфекции, как правило, имеют более тяжелое течение.
ЦМВ-ИНФЕКЦИИ У ПАЦИЕНТОВ БЕЗ НАРУШЕНИЯ ИММУНИТЕТА
Первичная ЦМВ-инфекция у подростков и взрослых может протекать в виде синдрома инфекционного мононуклеоза. При этом ЦМВ-инфекция может сопровождаться рядом осложнений, например, интерстициальной пневмонией. Другими редкими осложнениями ЦМВ-инфекции могут быть гепатит, синдром Гийена-Барре (постинфекционная демиелинизирующая полинейропатия), менингоэнцефалит, миокардит, тромбоцитопения и др.
ЦМВ-ИНФЕКЦИИ НОВОРОЖДЕННЫХ
ЦМВ - один из наиболее частых этиологических факторов внутриутробной и перинатальной инфекции. Наиболее важным источником являются первородящие женщины, впервые перенесшие ЦМВ-инфекцию во время беременности. При вторичных ЦМВ-инфекциях беременных частота внутриутробного заражения плода значительно ниже, а у инфицированных новорожденных она часто протекает бессимптомно. У 25% внутриутробно инфицированных новорожденных наблюдаются симптомы инфекции (желтуха, гепатоспленомегалия, петехии, микроцефалия, хориоретинит, кальцификаты мозга и др.). Последствиями ЦМВ-инфекции являются неврологические осложнения, микроцефалия и отставание умственного развития.
Перинатальное заражение новорожденных обусловлено носительством ЦМВ в слизистой оболочке шейки матки на поздних сроках беременности и кормлением грудью. Перинатальные инфекции новорожденных, как правило, протекают бессимптомно, но могут приводить к нарушению слуха и отставанию умственного развития.
ЦМВ-ИНФЕКЦИИ У БОЛЬНЫХ СПИДОМ
До появления эффективной антиретровирусной терапии ЦМВ-инфекции являлись наиболее частыми оппортунистическими инфекциями при СПИДе. Заболевание чаще развивается в результате реактивации латентной инфекции при уровне CD4+ лимфоцитов менее 0,5 x 10 9 /л. Наиболее частым проявлением является ретинит (85%), реже эзофагит, колит, полирадикулопатия, вентрикулоэнцефалит и др.
ЦМВ-ретинит у больных СПИДом первоначально носит односторонний характер, но без лечения всегда распространяется на другой глаз, приводя к потере зрения.
ЦМВ-ИНФЕКЦИИ В ТРАНСПЛАНТОЛОГИИ
Повышенная чувствительность реципиентов костного мозга и солидных органов к ЦМВ-инфекциям обусловлена использованием после трансплантации мощных иммуносупрессивных ЛС. Основными источниками инфекции являются донорский орган и переливаемая кровь, также может происходить и активация латентной инфекции у сероположительных реципиентов.
Наиболее угрожающей жизни инфекцией у реципиентов костного мозга является интерстициальная ЦМВ-пневмония, которая обычно развивается в течение 120 дней после пересадки. ЦМВ остается наиболее частым патогеном, выделяемым у реципиентов солидных органов, в частности печени. ЦМВ-гепатиты, особенно часто возникающие после первичной ЦМВ-инфекции, могут приводить к печеночной недостаточности, требующей повторной трансплантации. Кроме того, ЦМВ способствует развитию других оппортунистических инфекций и повышает риск отторжения трансплантата. Наиболее низкая заболеваемость ЦМВ-инфекциями наблюдается у реципиентов почек.
ДИАГНОСТИКА ЦМВ-ИНФЕКЦИЙ
Наиболее широко используется выявление ЦМВ-антигенемии (определение в лейкоцитах с помощью моноклональных антител оболочечного белка ЦМВ - рр65), а также обнаружение ДНК ЦМВ в клиническом материале (метод ПЦР и ДНК-гибридов). При этом виремия может быть обнаружена раньше (за 10-12 дней до появления симптомов заболевания) и чаще, чем при использовании культурального метода. Присутствие ДНК ЦМВ в крови является ранним показателем ЦМВ-инфицирования после трансплантации и предиктором развития ЦМВ-инфекции у пациентов с низким уровнем CD4+ лимфоцитов. Кроме того, оно может служить показателем эффективности проводимой терапии.
Серологические методы (обнаружение антител класса IgМ и/или существенного увеличения титров антител класса IgG к ЦМВ) недостаточно ни для установления факта активной репликации ЦМВ, ни для подтверждения диагноза манифестной ЦМВ-инфекции. В настоящее время эти методы используются в основном для определения серологического статуса донора и реципиента в трансплантологии.
ВЫБОР АНТИМИКРОБНЫХ ПРЕПАРАТОВ
Для противовирусной терапии ЦМВ-инфекций могут использоваться ганцикловир, валганцикловир, фоскарнет и цидофовир. Однако до настоящего времени многие аспекты терапии (оптимальные режимы, комбинирование препаратов, время начала лечения) остаются неясными.
Ганцикловир разрешен для лечения ЦМВ-ретинита у пациентов с иммунодефицитом, а также при ЦМВ-колите, ЦМВ-эзофагите, ЦМВ-гепатите и ЦМВ-менингоэнцефалите. Он может улучшать состояние при ЦМВ-пневмонии у больных СПИДом и реципиентов солидных органов, но, в то же время, малоэффективен при пневмонии у реципиентов костного мозга. Для повышения эффективности в этих случаях его необходимо сочетать с ЦМВ-иммуноглобулином.
В связи со значительной заболеваемостью и летальностью при симптоматической врожденной ЦМВ-инфекции ганцикловир может быть использован для лечения новорожденных, но только при точном установлении диагноза. На основании имеющихся данных можно судить о том, что фармакокинетика, эффективность и токсичность ганцикловира у детей сходны с таковыми у взрослых.
Лечение ганцикловиром обычно проводят в 2 этапа: индукция и поддерживающая терапия (табл. 1).
Таблица 1. Лечение ЦМВ-ретинита у пациентов со СПИДом
| Препарат | Этап | Режим дозирования |
|---|---|---|
| Ганцикловир (в/в) | Индукция | 5 мг/кг каждые 12 ч, 14-21 день; 7,5 мг/кг каждые 12 ч, 14-21 день при неэффективности обычной дозы |
| Поддерживающий | 5 мг/кг/сут (в диапазоне 5-10 мг/кг/сут) | |
| Ганцикловир (внутрь) | Поддерживающий | 1,0 г каждые 8 ч |
| Ганцикловир (внутриглазной имплант) * | 4,5 мг, 5-8 мес | |
| Ганцикловир (внутриглазное введение) * | 400 мкг 2 раза в неделю | |
| Фоскарнет (в/в) * | Индукция | 90 мг/кг каждые 12 ч, 14-21 день |
| Поддерживающий | 90-120 мг/кг/сут | |
| Фоскарнет (внутриглазное введение) * | 2,4 мг 2 раза в неделю | |
| Цидофовир (в/в) * | Индукция | 5,0 мг/кг 1 раз в неделю, 14 дней |
| Поддерживающий | 3-5 мг/кг каждые 2 нед |
* Не зарегистрирован в России
Поддерживающая терапия необходима для большинства пациентов с иммунодефицитом, особенно со СПИДом. Если во время подерживающей терапии происходит рецидив ЦМВ-инфекции, необходимо провести повторный курс индукции.
Пероральный ганцикловир используется в основном для поддерживающей терапии ЦМВ-ретинита (при умеренно выраженной инфекции), однако при этом чаще наблюдаются рецидивы по сравнению с в/в поддерживающей терапией.
Для уменьшения системной токсичности могут использоваться инъекции ганцикловира (а также фоскарнета и цидофовира) в стекловидное тело или внутриглазные импланты ганцикловира и фоскарнета, которые достаточно эффективно контролируют течение ретинита и значительно улучшают качество жизни у пациентов, не переносящих системную терапию. К осложнениям этого вида терапии относятся кровотечение, инфекции, изменение рефракции зрения и отслойку сетчатки. Кроме того, наблюдалось вовлечение в инфекционный процесс другого глаза и даже генерализация ЦМВ-инфекции.
Эффективность противовирусной терапии следует оценивать клинически и вирусологически (перед началом терапии необходимо исследовать образцы крови и мочи на присутствие вируса и затем повторять исследование каждую неделю).
Учитывая, что ганцикловир выводится почками, в процессе лечения необходимо мониторировать уровень кретинина крови и корригировать дозу в соответствии с клиренсом креатинина. Поскольку ганцикловир обладает миелотоксичностью, он должен с большой осторожностью применяться у пациентов, получавших или получающих другие миелотоксичные препараты, включая зидовудин. Для контроля следует ежедневно или через день определять уровень лейкоцитов или тромбоцитов в крови. При снижении их числа более чем на 50% по сравнению с исходным (или при абсолютном числе лейкоцитов менее или равном 0,5 x 10 9 /л или тромбоцитов менее 25 x 10 9 /л), следует прекратить прием препарата. Индуцированная ганцикловиром нейтропения обычно носит обратимый характер, и показатели возвращаются к норме через 5-7 дней после его отмены. После этого можно возобновить терапию ганцикловиром в прежних или меньших дозах.
Фоскарнет, при равноценнной с ганцикловиром эффективности, оказывает лучшее влияние на выживаемость при ЦМВ-инфекции у пациентов со СПИДом. Комбинация ганцикловира и фоскарнета характеризуется синергидным или, по крайней мере, аддитивным действием in vitro, и превосходит по эффективности монотерапию при рецидивирующем ЦМВ-ретините. Недостатком фоскарнета является худшая переносимость и необходимость наличия постоянного в/в катетера.
Основным преимуществом цидофовира является длительный внутриклеточный период полувыведения и возможность проведения поддерживающей терапии в виде одной инъекции каждые 2 нед.
ПРОФИЛАКТИКА ЦМВ-ИНФЕКЦИЙ
При появлении симптомов ЦМВ-инфекции у реципиентов костного мозга и солидных органов необходимо незамедлительно начинать противовирусную терапию. Препаратом выбора является ганцикловир в/в. У серонегативных реципиентов органов от сероположительного донора дополнительно можно применять ЦМВ-иммуноглобулин (однако его назначение в виде монотерапии при симптоматических ЦМВ-инфекциях недопустимо!).
В целом, существуют 2 стратегии предупреждения ЦМВ-инфекций в трансплантологии: профилактика и упреждающая терапия (табл. 2). Профилактика заключается в использовании противовирусного препарата или ЦМВ-иммуноглобулина немедленно после трансплантации всем пациентам или реципиентам из группы риска (ЦМВ-серонегативные реципиенты органов от ЦМВ-сероположительного донора). При упреждающей терапии противовирусный препарат назначается только при появлении лабораторных признаков репликации ЦМВ.
Таблица 2. Предупреждение ЦМВ-инфекций в трансплантологии
| Трансплантация почки | Трансплантация печени, сердца, поджелудочной железы | Трансплантация легких, кишечника | ||||
|---|---|---|---|---|---|---|
| Нет АЛА | АЛА | Нет АЛА | АЛА | Нет АЛА | АЛА | |
| Реципиент(+) | 1 | 2 | 3 (или 2) | 3 (или 2) | 3 | 3 |
| Донор(+)/Реципиент(-) | 3 (или 2) | 3 (или 2) | 3 | 3 | 3, 4 | 3, 4 |
Примечание:
АЛА - антилимфоцитарные антитела;
Донор(+) - ЦМВ-сероположительный донор;
Реципиент(+) - ЦМВ-сероположительный реципиент;
Реципиент(-) - ЦМВ-сероотрицательный реципиент.
1 - лечение ганцикловиром (в/в) при наличии симптомов заболевания в течение 2-3 нед или до достижения отрицательных результатов обнаружения антигенемии/ДНК вируса
2 - упреждающая терапия ганцикловиром (в/в) в течение 2-3 нед или до достижения отрицательных результатов обнаружения антигенемии/ДНК вируса или до окончания терапии АЛА
3 - профилактика ганцикловиром (1,0 г внутрь каждые 8 ч) в первые 3 мес после трансплантации
4 - ЦМВ-иммуноглобулин
Предпочтение профилактике следует отдавать в следующих ситуациях:
- у всех реципиентов легких и кишечника;
- у ЦМВ-сероотрицательных реципиентов сердца, печени, почек или поджелудочной железы от ЦМВ-сероположительных доноров;
- у ЦМВ-сероположительных реципиентов сердца, печени, почек или поджелудочной железы от сероположительных доноров, реципиентам немедленно после операции проводится индукция антителами к рецепторам Т-лимфоцитов.
ЦМВ-иммуноглобулин у реципиентов печени и почек значительно снижает частоту и тяжесть ЦМВ-инфекций, а также грибковых и паразитарных суперинфекций. Однако у пациентов из группы риска (см. выше) он недостаточно эффективен и не рекомендуется для монотерапии.
Наилучшие результаты достигаются при использовании ганцикловира (5-10 мг/кг/сут в/в или 3,0 г/сут внутрь). Длительность применения следует подбирать индивидуально, в зависимости от вида операции, ЦМВ-статуса реципиента и донора, но она должна составлять не менее 3 мес для предупреждения поздних ЦМВ-инфекций. Преимущества использования индукции ганцикловиром в/в в течение первых 2 нед, а также комбинации противовирусной терапии с ЦМВ-иммуноглобулином не доказано.
Упреждающая терапия ганцикловиром (в/в) имеет ряд недостатков. Во-первых, она не может полностью предупредить развитие ЦМВ-инфекций, а ее значение для профилактики других посттрансплантационных осложнений не изучено. Во-вторых, необходим тщательный мониторинг пациентов с еженедельными визитами в первые 2-3 мес после операции. В-третьих, необходимо иметь диагностические тесты для своевременного выявления активизации репликации ЦМВ. При этом отсутствуют общепризнанные значения уровня репликации вируса, при котором следует начинать упреждающую терапию.
Читайте также:


