Лечение гнойных инфекций у животных
Е.Н. Парийская, кандидат биологических наук, доцент, Л.Б. Захарова, кандидат биологических наук, доцент, О.Г. Орлова, кандидат биологических наук, доцент, О.В. Рыбальченко, доктор биологических наук, профессор, Н.Э. Голованова, кандидат биологических наук, доцент, И.В. Астратенкова, кандидат биологических наук, доцент 188663, Санкт-Петербургский государственный университет, 199034, Российская Федерация, Санкт-Петербург, Университетская наб., д. 7–9 Е-mail: nesh1764@mail.ru
Резюме. В настоящее время лечение гнойных осложнений мягких тканей является одной из самых распространенных проблем в медицинской практике. Постоянно совершенствуются методы воздействия и анализа влияния лекарственных средств на различных моделях гнойных ран животных. Модели, описанные в литературе, не всегда могут успешно воспроизводиться на практике. Рассмотрены несколько вариантов моделирования развития гнойно-воспалительного процесса в кожных ранах у крыс. На 1-м этапе для выбора наиболее эффективного иммуносупрессора проводили сравнительный анализ выживания крыс при воздействии гидрокортизона и метотрексата. Затем в качестве инфицирующих раны микроорганизмов апробировали бактерии 2 видов: Staphylococcus aureus 6 – представитель нормальной микробиоты кожи и Pseudomonas indica 23 – аналог наиболее распространенного вида псевдомонад – возбудителей внутрибольничных инфекций. Инфицирование ран проводили, используя однородную и смешанную суспензию 2 указанных выше бактериальных культур, а также монокультуры в виде биопленок. По результатам проведенных исследований определили наиболее оптимальную модель получения гнойных ран, а именно вариант с применением иммуносупрессии гидрокортизоном. Воздействие гидрокортизона в течение 7 сут (25 мг/кг), в отличие от метотрексата, не приводило к летальности животных. При этом однократное введение суспензионной смешанной бактериальной культуры S. aureus 6 и P. indica 23 вызывало развитие гнойно-воспалительного процесса в течение 48 ч. Увеличение диаметра внутреннего отверстия силиконового фиксатора, в котором располагается рана, позволило более точно проводить планиметрическую оценку повреждений и визуально наблюдать за скоростью краевой эпителизации.
Гнойная патология мягких тканей остается одной из самых распространенных и актуальных групп заболеваний человека. Как известно, широкий круг факторов влияет на все фазы заживления ран.
У здоровых людей гнойно-воспалительные раны встречаются редко. Они обычно возникают у пациентов с хроническими заболеваниями или получающих иммуносупрессивную терапию, например глюкокортикоиды. В настоящее время пациенты с гнойно-воспалительными заболеваниями составляют около 40% больных хирургического профиля, а послеоперационные гнойные осложнения развиваются в среднем у 30% больных [1]. Такие осложнения сопровождаются снижением показателей иммунитета (количества и функций иммунокомпетентных клеток); ингибированием ангиогенеза, пролиферации фибробластов и синтеза компонентов внеклеточного матрикса [2].
В опубликованных научных статьях для проведения экспериментов предлагаются разнообразные модели гнойных ран, что ставит исследователей перед сложным выбором, так как неотъемлемой частью изучения новых направлений в лечении ран является использование адекватной модели гнойно-воспалительного процесса мягких тканей in vivo.
Цель данной работы – получение модели гнойно-воспалительного процесса в кожных ранах крыс для последующего исследования лечебного воздействия на раневую поверхность холодной плазмы атмосферного давления, а также различных лекарственных препаратов.
Крыс содержали в индивидуальных клетках со свободным доступом к пище и воде. Эксперименты на животных проводили в полном соответствии с Директивой Европейского Совета по соблюдению этических принципов в работе с лабораторными животными (The European Council Directive (86/609/EEC)) и Директивой 2010/63/EU Европейского Парламента и Совета Европейского Союза.
Раны однократно инфицировали разными способами. В область дна раны вносили суспензию бактерий 10 9 КОЕ/мл в количестве 0,1 мл S. aureus 6 или P. indica 23 на рану. 2-й способ – внесение суспензии смешанной бактериальной культуры S. aureus 6 и P. indica 23 в концентрации 10 8-9 КОЕ/мл в количестве 0,1 мл на рану. В 3-м случае на рану наносили фрагменты плотной питательной среды со сформированной биопленкой (10 11-12 КОЕ/см 2 ) S. aureus 6 или P. indica 23. Для этого, вырезанные из плотной питательной среды фрагменты с биопленкой, равные по размеру диаметру раны (5 мм), помещали на дно раны. После внесения микроорганизмов раневую поверхность изолировали от внешней среды стерильной прозрачной пищевой пленкой на 2 сут. Пленка крепилась к поверхности силиконового круга благодаря своим свойствам, без постороннего клеящего средства.
Эвтаназия животных не осуществлялась.
В течение всего эксперимента раны ежедневно фотографировали. Полученные изображения переносили в компьютер, калибровали и измеряли площадь раневого поражения с помощью программы Scion Image (NIH, США). После чего рассчитывали площадь раневой поверхности на 3-и, 5-е и 7-е сутки. Результаты выражали в % от исходной площади. Количество микроорганизмов в инфицированных ранах определяли с помощью высевов. Для этого ежедневно отделяемое раны отбирали с помощью стерильного тампона и распределяли по поверхности плотной питательной среды (агар Мюллера–Хинтона). Посевы помещали в термостат и выдерживали в течение 24 ч при температуре 37ºС. Результаты посевов, т.е. количество колониеобразующих единиц, подсчитывали и выражали в КОЕ/см 2 .
Каждое животное взвешивали до начала эксперимента и в последующие дни.
Статистическую обработку полученных данных выполняли с помощью программы Statistics 19.
Заживление раны начиналось с пролиферативной стадии и выражалось в появлении краевой эпителизации, приводящей к уменьшению площади раны путем сокращения и фиброплазии (образование соединительной ткани). Динамику течения воспалительного процесса в эксперименте оценивали по появлению краевой эпителизации.


Введение метотрексата однократно в дозе 10 мг/кг привело к гибели 2 из 6 животных (
30%) на 3-й день от начала эксперимента. Введение препарата в дозе
0,15 мг/кг в течение 4 сут вызвало на 3-и сутки гибель 6 из 8 (75%) животных. Животные теряли примерно 20–30% массы тела. У выживших животных отмечалось воспаление слизистой оболочки глаз (слизистое или гнойное отделение из глаз), жидкий стул, снижение двигательной активности, потеря аппетита.
Метотрексат – антиметаболит группы структурных аналогов фолиевой кислоты. Препарат оказывает противоопухолевое, цитостатическое и иммунодепрессивное действия. Подавляет синтез и репарацию ДНК, клеточный митоз, в меньшей степени влияет на синтез РНК и белка. Наиболее чувствительны к препарату активно делящиеся клетки [7]. Согласно полученным результатам, использовать этот препарат нерационально.
Гидрокортизон входит в группу глюкокортикостероидов (ГКС), которые, как известно, предотвращают активацию фосфолипазы A2, стимулируя образование ее ингибитора – липокортина, нарушают синтез простагландинов и выделение макрофагального хемотаксического фактора, ингибируют активацию тканевых кининов, уменьшают миграцию макрофагов и лимфоцитов в очаг воспаления. Преимущество гидрокортизона в моделировании гнойно-воспалительного процесса обусловлено тем, что ГКС подавляют различные стадии иммуногенеза, но не оказывают митостатического действия [8]. Воздействуя на функции клеток, которые играют важную роль при заживлении ран, ГКС вызывают значительное замедление процесса репарации тканей. Известно, что у пациентов, принимающих ГКС или получающих другую иммуносупрессивную терапию, наблюдается значительное замедление заживления кожных ран [2].
В экспериментах с гидрокортизоном животные были разделены на 5 групп по 6 крыс в каждой в зависимости от способа инфицирования раны (см. таблицу).

Результаты исследования показали, что на всем протяжении эксперимента значения степени заживления у крыс I и II группы, практически не отличались, и на 5-е сутки эксперимента площадь раневой поверхности составила около 75%, на 7-е сутки – 55% от площади нанесенной раны (рис. 3). В этих группах не формировался гнойно-воспалительный процесс (рис. 4), и на 3-и сутки роста микроорганизмов не обнаружено.
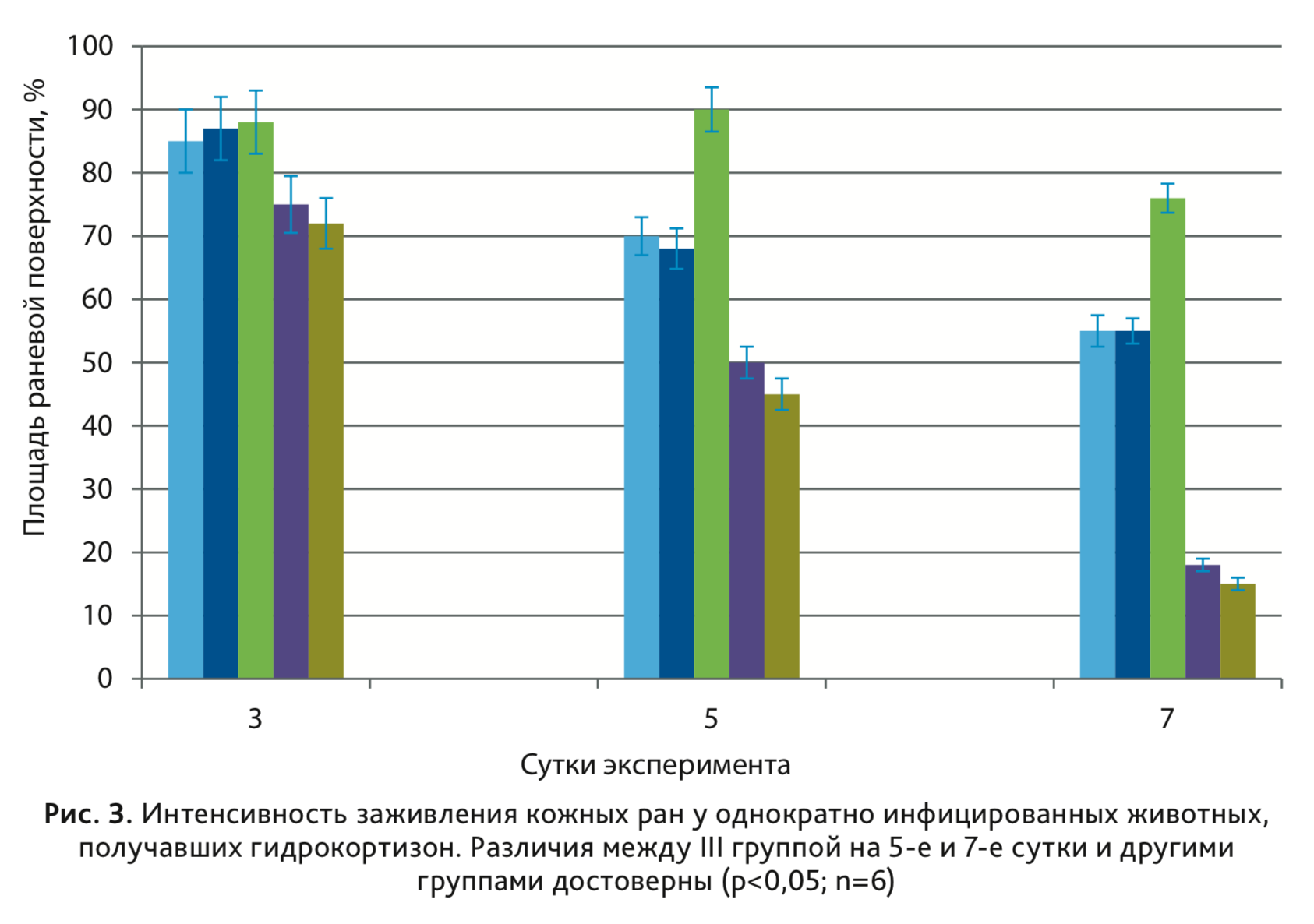
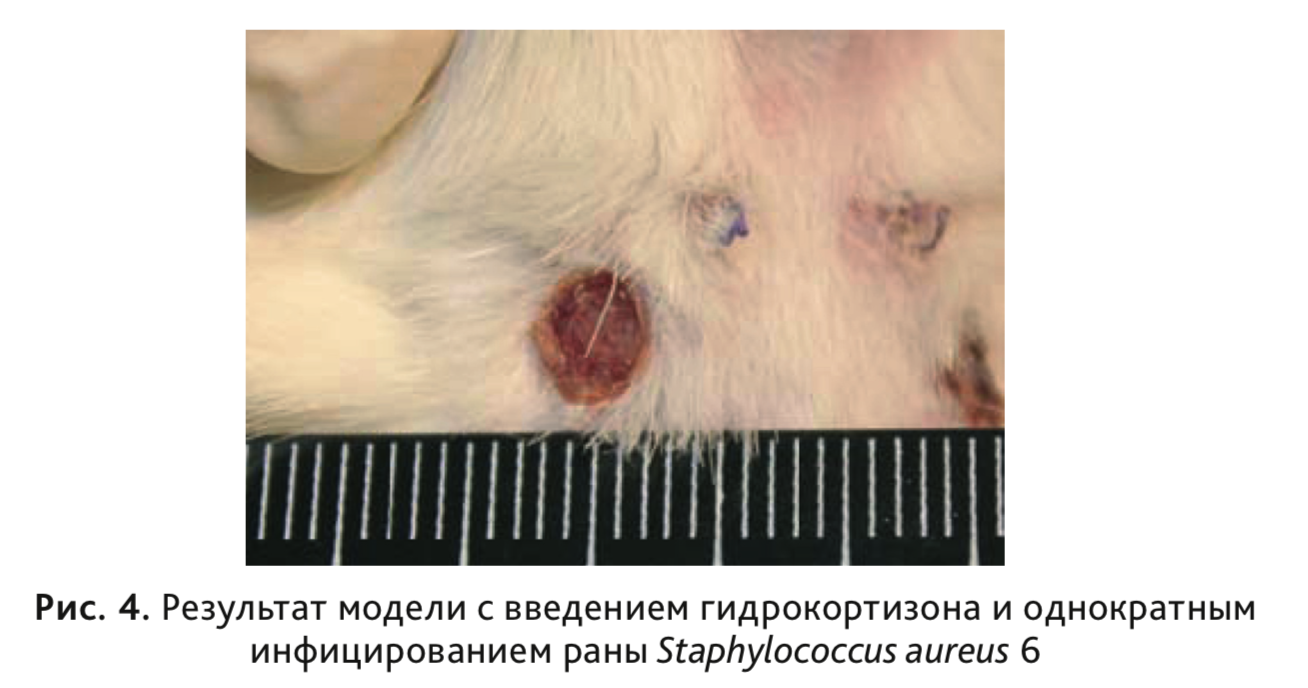
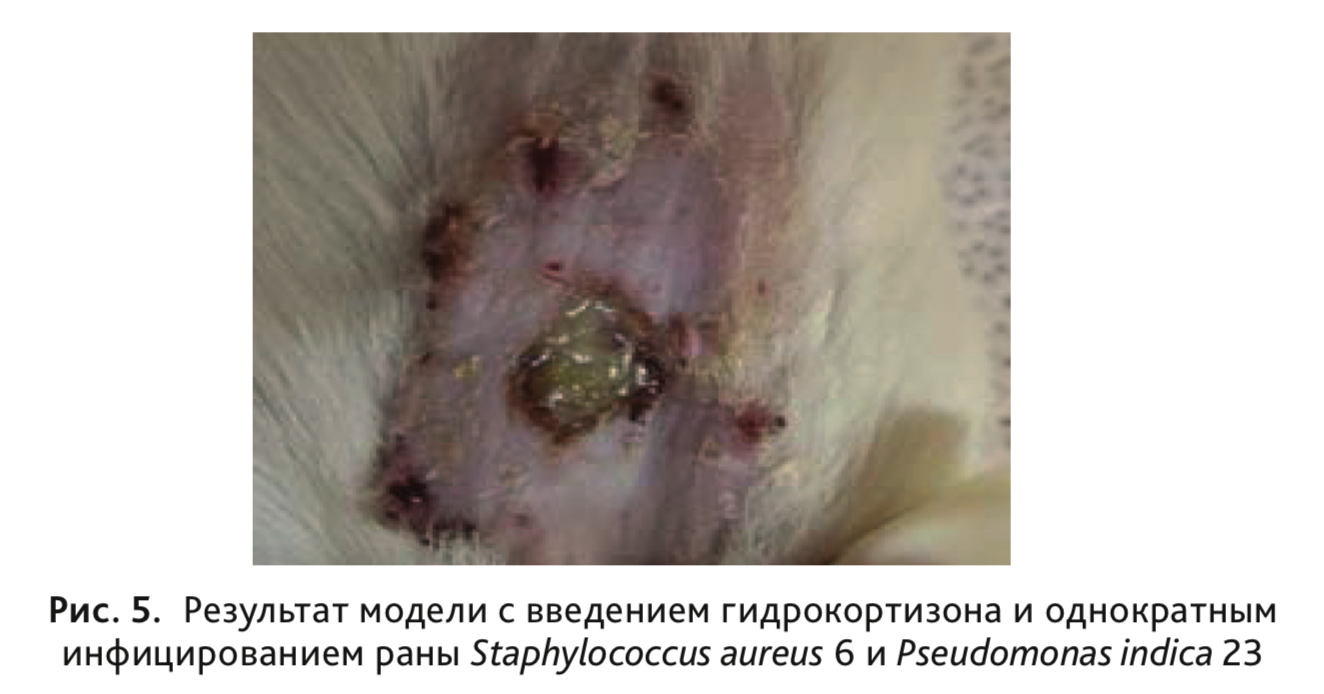
У животных III группы при использовании микробной суспензии в жидкой питательной среде, содержащей клетки S. aureus 6 и P. indica 23 в концентрации 10 8 КОЕ/мл в количестве 0,1 мл, на 2-е сутки от начала эксперимента получили гнойную кожную рану с заданной бактериальной обсемененностью, которая по своим характеристикам была максимально приближена к реальному клиническому течению раневого процесса (рис. 5). На 3-и сутки микробная обсемененность раны составила 10 6 КОЕ/см 2 , к 5-м суткам уровень обсемененности еще оставался высоким 10 5 КОЕ/см 2 , а к 7-м суткам обсемененность снижалась до 10 2 КОЕ/см 2 . Площадь раневой поверхности на 5-е сутки составляла 90%, а к 7-м суткам достигала 75% от площади исходной нанесенной раны (см. рис. 3).
В группах IV и V инфицирование осуществляли при помещении на рану кусочка плотной питательной среды со сформированной биопленкой S. aureus 6 или P. indica 23 в концентрации 10 11-12 КОЕ/мл. На сегодняшний день принято считать, что биопленка микроорганизмов – хорошо сформированное сообщество физиологически активных клеток, погруженных в биополимерный матрикс, обладающий повышенной устойчивостью к факторам окружающей среды. Развитие любого инфекционного процесса бактериальной природы связано с развитием биопленки [9]. Помещение хорошо сформированной биопленки на раневую поверхность может привести к развитию острого воспалительного процесса в ране. Однако результаты исследования показали, что на протяжении эксперимента показатели заживления у крыс были высокими. Так, на 5-е сутки эксперимента площадь раневой поверхности составила около 50%, на 7-е сутки – меньше 20% от площади нанесенной раны (см. рис. 3). В этих группах не отмечалось гнойно-воспалительного процесса, и на 3-и сутки обсемененность ран отсутствовала.
Одной из более вероятных гипотез, объясняющих это явление, является наличие агаризованной питательной среды в ране. Возможно, агар-агар проявляет сорбционные свойства и нейтрализует выделяемые микроорганизмами факторы патогенности в ране, тем самым улучшая показатели заживления. По результатам исследования на 7-е сутки инфицированные биопленками на агаре раны заживали лучше, чем при других условиях.
В результате проведенных исследований была выбрана оптимальная модель получения гнойной раны на фоне иммуносупрессии. Использование гидрокортизона (25 мг/кг в течение 7 сут), в отличие от метотрексата, не приводило к летальности животных, а однократное введение суспензии смешанной культуры S. aureus 6 и P. indica 23 вызывало развитие гнойно-воспалительного процесса в течение 48 ч. Увеличение диаметра внутреннего отверстия силиконового фиксатора краев раны позволило более точно проводить планиметрическую оценку ран и визуально наблюдать за скоростью краевой эпителизации.
Работа выполнена при поддержке гранта Санкт-Петербургского государственного университета № 037.218.2016

В настоящее время существует большое количество различных методов и способов лечения гнойных ран у животных. Однако проблему борьбы с хирургической инфекцией можно считать одной из основных проблем хирургии. Стандартная хирургическая практика обычно предусматривает радикальную хирургическую обработку раны, дренирование и промывание ран для удаления гнойного отделяемого и некротических масс, наряду с антибактериальной терапией.
Однако, в связи с устойчивостью многих штаммов микроорганизмов к антибиотикам, и соответственно недостаточной их эффективности при проведении антибактериальной терапии, снижением иммунитета у животных эти обстоятельства стимулируют поиск новых методов лечения гнойных ран. Одним из таких методов является вульнеросорбция – сорбция с поверхности гнойных ран.
Имеющиеся в медицине результаты исследований отечественных ученых, полученные на лабораторных животных и в клиниках, зарубежный опыт получения широкого спектра лекарственных препаратов на основе хитозана свидетельствуют о наличии антивирусных [1], антибактериальных [2], антидотных [4], антикоагулянтных [7], антиоксидантных [5], адгезионных [6], иммунокорригирующих [3] свойствах, уникальной способности к комплексообразованию хитозана, что позволяет использовать его в качестве энтеросорбентов для детоксикации организма при экзо- и эндотоксемии.
Работ посвященных использованию хитозана в хирургической практике в отечественной и зарубежной литературе крайне мало. Поэтому в нашей работе для вульнеросорбции было решено испытать сухой хитозан для вульнеросорбции, а в качестве лечебного препарата гель на основе хитозана водорастворимого.
Материал и методика
Опыт по изучению динамики заживления экспериментальных инфицированных кожно-мышечных ран проводился на 12-ти беспородных собаках обоего пола, живой массой 13,0 – 15,0 кг, в возрасте 3 – 5 лет, разделённых на две равные группы по принципу приближенных аналогов по 6 голов в каждой.
У собак моделировали экспериментальные кожно-мышечные раны путём рассечения мягких тканей латеральной поверхности бедра длиной 10 см и глубиной 2 см. После остановки кровотечения ткани поверхности раны инфицировали марлевой салфеткой, смоченной взвесью суточной культуры золотистого стафилококка (штамм Р-209) и взвесью фекалий, которую фиксировали в ране провизорными швами на 48 часов.
В контрольной группе животных после удаления инфицируемой салфетки и развития гнойного процесса в ране (3-4 сутки) лечение сводилось к промыванию полости раны раствором калия марганцевокислого (1:500) на фоне аппликации мази Вишневского в течение 7-10 дней.
В опытной группе с целью ускорения очищения ран от гнойного экссудата применяли порошок хитозана, который наносили на рану слоем 4-6 мм. Данные процедуры проводили один раз в день в течение 5-8 дней до очищения ран от гнойного экссудата и появления розовых грануляций. Кроме того, собакам опытной группы дополнительно per os вводили хитозан водорастворимый в форме 3%-ного гелиевого раствора в дозе 2 мл/кг массы животного ежедневно в течение 5 дней.
Результаты исследований
В процессе исследований было установлено, что после наведения туалета раны по общепринятой методике у контрольных и опытных животных видимые различия в состоянии ран начинали проявляться на 3-5-е сутки с начала лечения.
У контрольных животных после развития гнойного процесса в ране, отмечалась лихорадка, признаки угнетения, понижение пищевой возбудимости, болезненность и выраженная отёчность вокруг раны, воспалительный отёк удерживался более длительное время, болезненность была более выражена.
В контрольной группе животных, начиная с третьих суток раневого процесса, использовали дренаж с линиментом Вишневского.
Края и стенки ран у собак контрольной группы были покрыты фибрино-тканевым струпом темно-коричневого цвета, который был плотным, а его удаление сопровождалось капиллярным кровотечением.
На 10-12 сутки раневого процесса, края ран у собак контрольной группы оставались гиперимированными, болезненными с небольшим количеством гнойно-некротических масс.
Группы животных
Препараты
Сроки заживления ран, дни
Авторы: А. П. Полковниченко, А. С. Костин, Е. Н. Щербакова, Астраханский государственный университет.
Лечение и уход за ранами остается одной из важных проблем современной ветеринарной медицины. Больные животные, имеющие раны различного генеза, составляют значительную часть пациентов ветеринарных клиник. В последние годы происходит пересмотр многих представлений о способах лечения и ухода за ранами, а также ранее использовавшихся классификаций средств местного лечения ран различной этиологии. Выбор лечебных мероприятий определяется стадией воспалительного процесса, вирулентностью возбудителя, типом ответной реакции организма, локализацией очага поражения, видом животного, породой и возрастом. При остром течении заболевания и нарастании воспалительных явлений основная задача хирургического лечения сводится к ограничению зоны распространения патологического процесса и восстановлению равновесия между очагом воспаления и организмом пациента. В этой стадии заболевания лечебные мероприятия направлены на снижение вирулентности инфекционного агента и регуляцию иммунологических реакций. Своевременная хирургическая обработка с последующим дренированием ран является основным этапом лечения. Полная ревизия с удалением экссудата, обрывков мертвых тканей, части микроорганизмов и их токсинов, продуктов тканевого распада, позволяет в достаточной степени устранить основные эндогенные факторы и медиаторы воспаления. В комплексном лечении ран, в стадии гидратации, необходимо обеспечить хороший отток экссудата, путем адекватного дренирования гнойной полости. Этим обеспечивается снижение интоксикации организма больной собаки и предотвращает развитие гнойных осложнений.
Рис. 1.
Лечение гнойных ран должно соответствовать фазам течения раневого процесса.
В первой фазе — воспаления — рана характеризуется наличием гноя в ране, некроза тканей, развитием микробов, отеком тканей, всасыванием токсинов.
Задачи лечения:
Методы лечения
Использование этих способов должно поддерживаться соответствующей инфузионной и антибиотико- терапией.
Материалы и методы
В первой группе (8 собак) применялось активное дренирование поливинилхлоридными трубками, через которые в полость флегмоны вводились 1 % раствор диоксидина + 0,5 % раствор новокаина в соотношении 1:1. Далее в дренаж вводилась мазь левомеколь.
Во второй группе (8 собак) применялся бездренажный метод лечения, заключающийся в промывании полости вышеназванными растворами с дальнейшим введением мази левомеколь, каждые 12 часов.
В третьей группе (8 собак) применялось активное дренирование поливинилхлоридными трубками, через которые в полость флегмоны вводились 2 % раствор креолина, далее в дренаж вводился септогель каждые 12 часов. Септогель имеет широкий спектр антимикробного действия, соответствующий спектру активного йода. Обладает выраженным противовоспалительным и ранозаживляющим действием. К септогелю, как к препарату активного йода, отсутствует резистентность микроорганизмов.
Для исследования динамики заживления гнойных ран проводился регулярный клинический осмотр собак с визуальной оценкой состояния ран, исследование мазков отпечатков на 1, 3, 7 сутки.
Результаты и их обсуждение
Исследование мазков отпечатков показало, основным видом клеток, во всех случаях, в 1 сутки являются нейтрофилы с элементами распада и дегенерации. Определяется большое количество микробов с внеклеточным расположением. На третьи сутки отмечалась незначительная разница в цитограммах: в случае применения креолина и септогеля количество нейтрофилов заметно уменьшилось по сравнению с первыми группами. Отмечается значительное внутриклеточное расположение микрофлоры, что является показателем активного фагоцитоза, наблюдалось максимальное сокращение гнойной полости и улучшение общего состояния животных, по сравнению с бездренажным методом. Дренажные системы были удалены на 7 сутки.
Таким образом, метод лечения обширных гнойно-некротических процессов у собак с использованием креолина и йодсодержащего препарата септогель в общем комплексе противовоспалительного лечения был, в нашем случае, более эффективным.
Возбудителями гнойной инфекции являются гноеродные микроорганизмы: стафилококки, стрептококки, пневмококки, кишечная палочка, криптококки.
Данная инфекция протекает в виде гнойного воспаления органов или ткани. В зависимости от клинической картины различают следующие виды гнойной инфекции: абсцесс, фурункул, карбункул, флегмона, эмпиема, сепсис, пустула и папула.
Абсцесс (нарыв, гнойник) — ограниченное гнойное воспаление в органе или ткани с образованием полости, заполненной гноем. Возникает в результате воспалительного процесса, развивающегося вследствие проникновения в ткани гноеродных (стафилококков, стрептококков, кишечной палочки) и гнилостных микробов через поврежденную кожу и слизистые оболочки; при инъекциях, переливаниях крови (не соблюдая правила асептики); при переносе микробов кровью и лимфой из гнойного очага в здоровый; нагноении гематом и проникновении возбудителей некоторых заболеваний (актиномикоза, мыта, ботриомикоза и др.).
По течению выделяют горячий, холодный, натечный и метастатический абсцесс. При горячем абсцессе в первые 3-5 дней наблюдают слабо ограниченное, покрасневшее, горячее, болезненное, тестоватой консистенции припухание. К 7-10 дню припухлость отчетливо контурирована, в ее центре при пальпации определимся размягчение тканей, флюктуация. Кожа в месте поражения истончается и прорывается, гной изливается наружу, а гнойная полость заполняется грануляционной тканью.
Холодные (хронические) абсцессы обусловливаются патогенными возбудителями. Признаки острого воспаления практически отсутствуют, развиваются медленно, незначительно повышена температура тела, наблюдается небольшая припухлость, болезненность, флюктуация. Гной обычно жидкий, бледный.
Натечный абсцесс является осложнением холодного абсцесса. Он образуется в результате распространения гнойного воспаления по продолжению и затека гноя из первичного гнойного очага по рыхлым соединительнотканным пространствам вниз до первой фасциальной преграды, где и задерживается, образуя вторичную гнойную полость.
Метастатический абсцесс возникает при общей гнойной инфекции, холодных нарывах, флегмоне и других гнойных поражениях путем переноса патогенных микробов с лимфой и кровью в паренхиматозные органы, в которых формируется вторичный абсцесс.
Абсцессы наиболее часто встречаются у свиней и лошадей. Они могут находиться в различных участках тела (шея, затылок, холка, грудная и брюшная стенка).
При лечении животным необходимо предоставить покой. В первые 3—4 дня применяют спирт-ихтиоловые согревающие компрессы, повязки с мазью Вишневского, УВЧ-терапию, антибиотики с сульфаниламидными препаратами, короткие новокаиновыс блокады. С появлением флюктуации компрессы отменяют, очаги немедленно вскрывают и удаляют гной. Послеоперационное лечение проводят как при инфицированной ране.
Фурункул (чирей) — ограниченное гнойное воспаление одного волосяного мешочка и одной сальной железы вместе с окружающей их рыхлой клетчаткой, вызываемое обычно желтым или белым стафилококком. Появление одного фурункула за другим или появление их в большом количестве в разных участках тела называют фурункулезом.
Чаще поражаются те участки тела, где кожа склерозирована вследствие постоянного травмирования (холка, плечо, путовая область) или длительного воспаления, обусловленного такими причинами, как плохой уход за кожей (сильное загрязнение спины, шеи, конечности), ссадины, царапины, расчесы кожи, нарушение обмена веществ, гиповитаминозы А, В, С, слабая резистентность организма. Поэтому необходимо включать в корм животным дрожжи, красную морковь, люцерну, тимофеевку; плотоядным — рыбий жир и витамины.
Клиническими признаками фурункула являются следующие факторы. В первые 2-3 дня в коже вокруг волосяного мешочка возникает воспалительный отек, который может увеличиться до размера лесного ореха. В самом волосяном мешочке скапливается большое количество микробов, лейкоцитов. Припухлость гиперемирована, плотной консистенции, болезненна, имеет четкие границы. На вершине припухлости появляется желто-белое пятно, слои кожи истончаются, отмечается флюктуация. К 8-10-му дню волосяная луковица и сальная железа некротизируются и образуется стержень (гнойная пробка) фурункула, который выталкивается наружу, а на его месте образуется некротическая язва, покрытая розовато-красной грануляционной тканью и корками засохшего гноя. Язва быстро заживает с образованием небольшого рубца.
При лечении фурункула в первые дни обрабатывают кожу вокруг гнойного очага спиртовым раствором, йодом, дубящими веществами (перманганат калия, танин). Местно применяют сухое тепло (лампы соллюкс, Минина, УВЧ, ультрафиолетовые лучи); обкалывание фурункула через 1-2 дня новокаином с пенициллином. Не рекомендуется применять влажные повязки и компрессы, так как они способствуют распространению микроорганизмов по тканям, что приводит к образованию новых фурункулов.
Созревшие фурункулы вскрывают и лечат мазями (ихтиоловой, пенициллиновой, Вишневского) и линиментами стрептоцида, синтомицина.
Общее лечение осуществляют комплексно, с применением противосептических препаратов (антибиотики, сульфаниламиды). Хороший эффект получают от аутогемотерапии, переливании крови небольшими дозами, новокаиновой блокады (внутривенная, поясничная, короткая).
Карбункул (многоголовый чирей, углевик) — острое гнойно-некротическое воспаление группы волосяных луковиц и сальных желез вместе с окружающей их кожей и подкожной клетчаткой. Слияние нескольких фурункулов в крупные воспалительные очаги называют карбункулезом.
Возбудителями карбункула являются стафилококки и стрептококки, проникающие через устье волосяных мешочков. Развитию болезни способствуют кахексия, нарушение обменных процессов в организме (ожирение). Предрасполагающие причины такие же, как при фурункулезе.
Клиническими признаками карбункула являются: ограниченная красно-багровая, плотной консистенции, болезненная припухлость с множеством гнойников и отверстий, из которых выделяется густой гной. Отдельные отверстия могут сливаться, образуя большое отверстие в коже, из которого постепенно отторгается омертвевший стержень. Продолжительность процесса — 3—4 недели.
Заболевание может сопровождаться интоксикацией, образованием лимфогенных и гематогенных метастазов, повышением температуры тела.
Лечение такое же, как и при фурункулезе. Если в течение 2-3- х дней не наблюдается облегчение, прибегают к операции — делают разрез, иссекают некротические ткани, вскрывают гнойные затеки, полость заполняют тампонами, пропитанными мазью Вишневского, линиментами синтомицина или стрептоцида. В дальнейшем лечение проводят как при инфицированной рапе.
Флегмона — острое гнойное или гнилостное диффузное (разлитое) воспаление рыхлой клетчатки (подкожной, межмышечной, подфасциальной, забрюшинной), развивающееся в очагах с пониженной сопротивляемостью тканей. Возбудителями флегмона являются обычные микробы нагноения (стрептококки, стафилококки и комбинированные инфекции несколькими микробами). Наиболее опасными считаются флегмоны, вызванные стрептококками и анаэробными формами. Флегмоны могут также возникать в результате травматических повреждений как осложнение местных гнойных процессов (воспалившаяся рана, абсцесс, остеомиелит, гнойный артрит); при попадании под кожу сильных химических раздражителей (скипидар, раствор натрия хлорида и другие концентрированные химикаты).
По характеру экссудата выделяют серозную, гнойную, гнилостную и газовую флегмоны.
При серозной флегмоне в первые 2-3 дня наблюдают разлитую, покрасневшую, плотную, горячую болезненную припухлость, в центре которой на 4-7-й день определяют очаги размягчения (флюктуация), что является признаком гнойной гангрены. Повышается температура тела, животное становится угнетенным, нарушается аппетит, учащаются дыхание и пульс, отмечается желтушность видимых слизистых оболочек, ацидоз, некоторые изменения в крови и др.
Гнойная флегмона вызывается микрона микро-анаэробами. В ее развитии различают несколько стадий: стадия пропитки серозным экссудатом; гнойной инфильтрации; прогрессирующего некроза; формирование абсцессов и прорыв гноя наружу; самоочищение, гранулирование и рубцевание.
Для гнилостной и газовой флегмон характерно быстрое распространение воспалительного отека; при газовой — в центре припухлости при пальпации определяются газы, кожа холодная, болезненная, экссудат пенистый, с гнилостным запахом.
Флегмоны могут локализоваться в различных участках тела, особенно в облоги затылка, холки, венчика, бедра, голени, предплечья и суставов конечностей и проявляются неодинаковыми клиническими признаками. При флегмоне конечности наблюдают сильную хромоту.
При лечении больному животному предоставляют покой, обильную подстилку, частый водопой, хорошее кормление, но дачу концентратов уменьшают. В начальной стадии применяют согревающие спиртовые, спирто-ихтиоловыс, камфорные компрессы; общую противосептическую терапию (вводят антибиотики, антибиотики в сочетании с новокаином, сердечные препараты, физиологические растворы, уротропин, кальция хлорид). При таком комплексном лечении удается приостановить развитие флегмоны и предотвратить гнойное расплавление тканей или ускорить нагноение (абсцедирование). Созревшие абсцессы вскрывают, дренируют и лечат как гнойную рану.
При прогрессирующих формах необходимо срочное хирургическое вмешательство (глубокими разрезами раскрывают все гнойно-некротические очаги и обеспечивают отток гноя), после чего рану рыхло тампонируют марлей, пропитанной линиментами стрептоцида или синтомицина, мазью Вишневского.
Эмпиема (нагноение) — скопление гноя в какой-либо анатомической полости тела при гнойных воспалениях.
Наиболее часто поражаются эмпиемой плевра (при гнойных плевритах), воздухоносный мешок и гайморова полость у лошадей (при гайморитах), лобные пазухи у крупного рогатого скота при переломе рогов, а у лошадей при переломе лобных костей, пиемии и проникающих ранениях суставов.
Эмпиема — патология, часто осложняющаяся переходом процесса из местного в общий (пиемия).
Лечение осуществляется только оперативным путем. Вскрывают гнойно-воспалительную полость, удаляют гной, вставляют дренаж для его стока и лечат открытым методом с применением антисептических средств.
Пустула — гнойничок, развивающийся в коже и некоторых слизистых оболочках (например, в ротовой полости). Пустулы могут вызываться гноеродными бактериями (кокками при чуме собак), ультравирусами (оспа, контагиозный пустулезный стоматит лошадей) и появляются в виде мягких пузырьков, заполненных серой или красновато-серой мутной жидкостью и иногда окруженных красным ободком. После их вскрытия образуется корочка или язвочка. Пустула заживает бесследно при поверхностной локализации (в эпидермисе) и с образованием рубца при глубокой (собственно в коже).
Папулы — уплотненные участки, развивающиеся на коже при различных заболеваниях, не содержащие жидкости и несколько возвышающиеся над уровнем поверхности кожи. Язвенного распада обычно не дают и часто исчезают бесследно. Папулы возникают чаще при оспе различных видов животных, превращаясь сначала в везикулы (пузырьки, заполненные жидкостью), а затем в пустулы.
Хирургический сепсис — тяжелое инфекционное заболевание, вызываемое циркулирующими в крови гноеродными патогенными возбудителями и их токсинами при нарушенной реактивности организма.
Возбудителями являются стрептококки, стафилококки, кишечная палочка, реже — гнилостные и анаэробные микробы. Источником общей гнойной инфекции могут быть открытые переломы, ожоги, раны, флегмоны, артриты и другие гнойные воспалительные очаги.
Развитию сепсиса способствуют также оставление в ране инородных тел, мертвых тканей с затеком гноя, грубое нарушение покоя раны, несоблюдение асептики при выполнении операции, запоздалое рассечение инфицированных ран, несвоевременное оперативное вмешательство при гнойно-некротических процессах, недостаточное раскрытие раневых карманов, истощение, переутомление животного, гиповитаминозы.
Клиническими признаками являются следующие показатели. При общих признаках сепсиса повышена температура тела, отсутствует аппетит, присутствуют угнетение, слабость и потливость, прогрессирующее ухудшение состояния, расстройства со стороны всех систем организма: меняется состав крови, нарушаются функции паренхиматозных органов, в моче появляется белок, развиваются анемия, желтуха, возникают септические поносы.
Поверхность ран при развитии сепсиса сухая, безжизненная, внутри ран — налеты, некрозы.
При сепсисе возможны следующие осложнения: септические кровотечения, тромбоэмболии артерий, септический эндокардит, пневмонии. пролежни, травматическое (гнойно-раневое) истощение.
У больных сепсисом не отмечают каких-либо специфических патологоанатомических изменений. Обычно обнаруживают кровоизлияния, дегенеративные изменения внутренних органов, гнилостный распад тканей, тромбофлебиты. При сепсисе с метастазами — гнойники.
Лечение заключается в оперативном вмешательстве. Вскрывают гнойный очаг, ликвидируют затеки гноя, чтобы в кровь не поступили токсины, продукты распада тканей и микробов, удаляют омертвевшие ткани, инородные тела, обрабатывают антибиотиками и химическими антисептиками. Рекомендуется применять противосептические средства (антибиотики, сульфаниламидные препараты, хлорид кальция с глюкозой и кофеином), а также средства, улучшающие состояние центральной нервной системы и повышающие резистентность организма. Внутривенно вводят раствор новокаина, делают переливание крови небольшими дозами для повышения сопротивляемости организма, уменьшения интоксикации, повышения иммунобиологических сил. Больному животному предоставляют покой, дают хороший, легкопереваримый витаминизированный корм.
Профилактика хирургических инфекций предполагает раннюю, полную обработку ран, своевременное лечение первичных гнойных процессов, предупреждение механических повреждений кожного покрова, а также обеспечение полноценными витаминизированными кормами и хорошими условиями содержания животных.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Читайте также:


