Интерферон и индукторы интерферона в лечении герпетической инфекции
А. С. Боткина, канд. мед. наук, доц. кафедры госпитальной педиатрии им. акад. В. А. Таболина ФГБОУ ВО им. Н. И. Пирогова Минздрава России, Москва
Резюме: актуальность проблемы респираторных вирусных заболеваний обусловлена их чрезвычайно широким распространением, зачастую тяжелым течением, возможностью развития жизнеугрожающих осложнений и высоким экономическим ущербом, наносимым обществу в целом. В статье в сравнительном аспекте рассматриваются различные лекарственные средства, используемые в комплексной терапии острых респираторных вирусных инфекций у детей.
Ключевые слова: респираторные инфекции, индукторы интерферона, иммуномодуляция, дети, Циклоферон®
Abstract: the urgency of the problem of respiratory viral diseases is due to their extremely high spread, often severe, the possibility of developing life-threatening complications and the high economic damage caused to society as a whole. The article in a comparative aspect discusses the various drugs, used for the prevention and treatment of acute respiratory viral infections in children.
Keywords: respiratory infections, interferon inductors, immunomodulation, children, Cycloferon®
Этиологическими факторами данной группы заболеваний являются около 300 эпителиотропных вирусов, из которых наиболее часто встречающимися у детей являются риновирусы, парагрипп, аденовирусы, грипп. В последние годы нарастает удельный вес таких возбудителей, как корона-, бока- и метапневмовирусы. Также ежегодно увеличивается доля различных микст-инфекций, вызывающих более тяжелое по течению респираторное заболевание, что существенно усложняет диагностику и лечение таких пациентов.
Клинические симптомы респираторных вирусных инфекций у детей во многом похожи и проявляются различной по степени тяжести и длительности лихорадкой, интоксикацией, катаральным синдромом и поражением дыхательных путей (табл. 1).
Таблица 1. Тропизм различных вирусов, вызывающих ОРВИ
| Вирус | Наиболее часто поражаемый орган |
| Гриппа | Трахея, носоглотка, сосуды |
| Парагриппа | Гортань |
| Аденовирус | Глотка, конъюнктива, кишечник |
| Риновирус | Полость носа |
| Реовирус | Носоглотка, кишечник |
| Коронавирус | Носоглотка, бронхи, кишечник |
| РС-вирус | Бронхиолы, альвеолы |
| Бокавирус | Носоглотка, кишечник |
| Метапневмовирус | Носоглотка, трахея, бронхи |
При гриппе на первый план выходит выраженный интоксикационный синдром и лихорадка, аденовирусная инфекция характеризуется болью в горле, конъюнктивитом, продуктивным кашлем, нередко - развитием обструктивного синдрома и болями в животе; при парагриппе часты ларингиты с развитием стеноза гортани, а при респираторно-синцитиальной инфекции -бронхит и/или бронхиолит с выраженным и длительным обструктивным синдромом. Однако различия симптоматики в зависимости от этиологии вирусного заболевания не всегда четко различимы, следовательно, практикующему врачу важно иметь в своем арсенале средства, одинаково эффективные для профилактики и лечения как гриппа, так и других ОРВИ.
Выбор метода лечения ОРВИ у детей зависит от возраста ребенка, клинической картины заболевания, выраженности симптомов, степени тяжести и наличия осложнений. Лечение обязательно должно включать режим, диету, медикаментозную и немедикаментозную терапию. Лекарственная терапия респираторных заболеваний у детей ориентирована на использование всего арсенала современных препаратов, отвечающих определенным критериям [3, 4]:
- высокая эффективность относительно большинства возбудителей;
- минимальный спектр побочных эффектов;
- отсутствие токсичности;
- сочетание противовирусного и иммуномодулирующего эффекта;
- наличие различных лекарственных форм;
- этиотропные, действующие на возбудителя заболевания;
- патогенетические (иммуномодулирующие), исправляющие нарушения системы иммунитета, возникающие и развивающиеся в процессе болезни;
- симптоматические, предназначенные для купирования отдельных симптомов заболевания.
Таблица 2. Механизм действия различных противовирусных препаратов, применяемых при ОРВИ
| Действие | Механизм действия | Препарат |
| Ингибиторы нейраминидазы | Конкурентно и избирательно ингибирует нейроминидазу, что нарушает проникновение вируса в здоровые клетки, тормозит выход вирионов из инфицированной клетки | Осельтамивир, занамивир |
| Блокатор М-йонного канала (адамантаны) | Блокирует специфические ионные М-2 каналы, что приводит к нарушению процесса дезинтеграции вириона и высвобождению рибонуклеопротеида | Ремантадин, орвирем |
| Блокатор слияния, индуктор ИФН | Ингибирует слияние липидной вирусной оболочки с клеточной мембраной | Арбидол |
| Ингибитор РНК и ДНК вирусов | Конкурентное подавление образования гуанозин трифосфата, приводящее к нарушению синтеза вирусных РНК и ДНК | Рибавирин |
Так, ингибиторы нейраминидазы обладают избирательной активностью только против вирусов гриппа типа А и В, эффективны при назначении не позднее 48 ч от начала клинических симптомов заболевания, оказывают раздражающее действие на слизистую оболочку респираторного и пищеварительного тракта, вызывают тяжелые аллергические реакции вплоть до развития токсического эпидермального некролиза, а также имеют высокую стоимость. Препараты из группы адамантинов также обладают избирательной активностью против вируса гриппа А, вызывают побочные эффекты со стороны желудочно-кишечного тракта в виде тошноты и рвоты, нервной системы, проявляющиеся галлюцинациями и психозом, аллергическими реакциями. Кроме того, все противовирусные препараты эффективны только при раннем их применении, не позже 24-48 ч и приводят к возникновению штаммов вирусов с низкой чувствительностью или резистентностью к терапии. Лекарственная устойчивость является результатом мутаций вирусов и развивается, как правило, при многократном использовании препарата [5, 6].
Основными патогенетически действующими группами препаратов являются интерфероны и их индукторы. Интерфероны - это группа биологически активных белков или гликопротеидов, синтезируемых клеткой в процессе защитной реакции на чужеродные агенты (экзогенные и/или эндогенные). Образование и действие интерферона составляет важнейший механизм врожденного (естественного) иммунитета. Доказано, что течение и исход вирусных инфекций во многом зависит от способности системы интерферона быстро реагировать на внедрение возбудителя [7]. Всего в настоящее время описано более 100 различных эффектов интерферонов, основными из которых являются:
- подавление роста внутри- и внеклеточных инфекционных агентов вирусной и невирусной (хламидии, простейшие, бактерии) природы;
- антипролиферативная активность;
- антитуморогенный эффект;
- антимутагенный эффект;
- антитоксическое действие;
- радиопротективный эффект;
- иммуномодулирующий эффект(подавление или усиление продукции антител, стимуляция макрофагов, усиление фагоцитоза и др.).
Рис. 1. Побочные эффекты препаратов интерферонового ряда 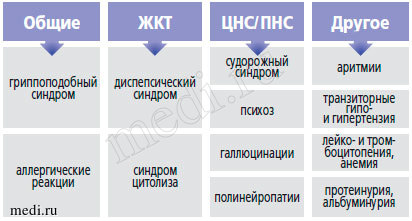
Таблица 3. Классификация индукторов интерферона (Ершов Ф.И., Романцов М.Г., Петров А.Ю., 2008)
| Химическая природа | Препарат |
| А. Синтетические соединения с основной интерферон-индуктивной активностью | |
| Низкомолекулярные: Флуореноны Акриданоны Олигопептиды Производное имидазо (4,5-С) квинолина | Амиксин Циклоферон® аллокин-альфа имиквимод |
| Полимеры (дс-РНК) | Полудан, полигуацил |
| Б. Природные соединения с основной интерферон-индуктивной активностью | |
| Полифенолы | Кагоцел, мегосин, саврац рагосин, гозалидон |
| Полимеры (дс-РНК) | Ридостин, ларифан |
| Производные флавонидов и аминокислот | протефлазид |
| В. Иммунотропные препараты с вторичной интерферон-индуктивной активностью | |
| Т-миметики | Тимоген, тактивин, изопринозин, гроприносин, иммунофан |
| Иммуномодуляторы бактериального происхождения - эубиотики | Лактобактерин, биоспорин |
| Вакциноподобные препараты | Бронхомунал, рибомунил, ИРС-19, уроваксом |
| Липополисахариды | Пирогенал, продигиозан |
| Производные нуклеиновых кислот | Натрия нуклеинат |
| Препараты пурина и пиримидина | Метилурацил, пентоксил |
| Производные бензимидазола | Дибазол |
| Производные индола | Арбидол |
| Растительные иммунокорректоры | Родиола розовая, экстракт эхинацеи |
| Г. Препараты других фармакологических групп с вторичной интерферон-индуктивной активностью | |
| Метилксантины | Теофиллин, эуфиллин, дипиридамол, кофеин |
| Производные изохинолина | Папаверин, дротавирин |
| Производные бензофурана | Кордарон |
| Производные хромена | Интеркордин |
Немаловажным является то, что образование эндогенного интерферона при введении его индукторов является более физиологичным процессом, чем повторное введение экзогенных интерферонов, которые, помимо побочных эффектов, быстро выводятся из организма и угнетают образование собственных (аутологичных) интерферонов по принципу отрицательной обратной связи, что может привести к формированию хронического инфекционного процесса в организме ребенка [10]. Имея основные свойства интерферона, его индукторы не обладают антигенностью и даже при однократном введении обеспечивают длительную циркуляцию синтезированных цитокинов на терапевтическом уровне. Стимулированный ими синтез эндогенного интерферона находится под контролем интерлейкинов и белков-репрессоров и не вызывает гиперинтерферонемии и развития связанных с ней побочных эффектов. Проведенные исследования показали, что индукторы интерферона обладают универсально широким диапазоном фармакологической активности, обладая одновременно прямым противовирусным и иммуномодулирующим действием. Введенные в организм индукторы интерферона стимулируют выработку эндогенного интерферона трех типов (α,β,γ) в разных пропорциях, что зависит от химической структуры индуктора. В зависимости от времени продукции интерферона в крови различают индукторы ранние (4-8 ч) и поздние (18-24 ч) [11].
Среди индукторов интерферона в профилактике и лечении ОРВИ у детей широко применяется препарат Циклоферон®, являющийся синтетическим производным акридонуксусной кислоты. Препарат повышает уровень интерферона α/β-типа в органах и тканях, содержащих лимфоидные элементы: в слизистой тонкого кишечника, селезенке, печени, легких, активирует стволовые клетки костного мозга, стимулируя образование гранулоцитов, преодолевает гематоэнцефалический барьер. Циклоферон® обладает чрезвычайно широким спектром биологической активности: прямым противовирусным, иммуномодулирующим и противовоспалительным действиями. Прямая противовирусная активность Циклоферона® доказана относительно различных респираторных вирусов и гриппа А и В, вируса простого герпеса 1-го и 2-го типов, цитомегаловируса, гепатитов В и С, клещевого энцефалита, вируса папилломы человека. Препарат нарушает репликацию вирусов, блокирует инкорпорацию вирусных ДНК и РНК в капсиды, что приводит к увеличению количества дефектных вирусных частиц и снижает вирус-индуцированный синтез белка в клетках. Иммунотропное действие препарата реализуется путем активации фагоцитов, Т-лимфоцитов и NK-клеток, нормализации баланса между CD4+- и СБ8+-клетками, снижении уровня В-лимфоцитов в периферической крови, с одновременным повышением синтеза высокоаффинных антител и индукции синтеза мРНК для ИФН-γ[12; 13]. Противовоспалительное действие Циклоферона® обусловлено ингибированием основных провоспалительных цитокинов (IL-1-p, IL-8, IL-10 и TNF-ot).
Циклоферон® относится к ранним индукторам интерферона, так как пик его выработки приходится на период от 4 до 8 ч с момента приема, что позволяет рекомендовать препарат для купирования вирусного заболевания на ранней стадии или в качестве экстренной профилактики. Кроме того, Циклоферон® хорошо сочетается с симптоматическими препаратами, вакцинами, химиопрепаратами, препаратами интерферона, усиливая действие последних и уменьшая побочные эффекты от их применения, что позволяет получить оптимальный фармакотерапевтический эффект. Исследование эффективности применения Циклоферона® в комплексном лечении ОРВИ у детей, проведенное Е.И. Кондратьевой, выявило более быстрое купирование симптомов интоксикации и выраженности катаральных явлений, обусловленное противовоспалительным и цитопротективным действием на слизистую оболочку дыхательных путей, а также увеличением уровня секреторного IgA. М.В. Гаращенко в своем исследовании отмечает почти 10-кратное уменьшение числа заболевших ОРВИ в период эпидемического подъема заболеваемости на фоне применения Циклоферона® (6 и 58% соответственно), а также более легкое течение и отсутствие осложнений [14; 15].
Помимо высокой эффективности, препарат отличается высоким профилем безопасности, который подтверждается отсутствием токсичности, аллергенности, мутагенности, хорошей растворимостью в биологических средах и проникновением в ткани, быстрым выведением из организма и отсутствием кумуляции [16].
Таким образом, широкий спектр биологической активности при низкой токсичности, наличие иммуномодулирующего действия позволяют рекомендовать Циклоферон® как препарат первой линии в лечении острых респираторных инфекций у детей. Для наибольшей эффективности рекомендуется начинать применять Циклоферон® как можно раньше, дополняя его препаратами направленного этиотропного действия и иммуномодуляторами, что обеспечит достижение оптимального фармакотерапевтического эффекта.
ЛИТЕРАТУРА
- Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных / Под ред. Д.К. Львова. М.: МИА, 2013. 1200 с.
- Грипп и гриппоподобные инфекции, включая особо опасные формы гриппозной инфекции. Фундаментальные и прикладные аспекты изучения // Бюллетень проблемной комиссии / Под ред. В.И. Покровского, Д.К. Львова, О.И. Киселева, Ф.И. Ершова. СПб.: Роза мира, 2008. 109 с.
- Ершов Ф.И., Коваленко А.Л., Романцов М.Г. Вопросы лечения гриппа и ОРВИ у детей // Экспериментальная и клиническая фармакология. 2011. № 6. С. 41-45.
- Ющук Н.Д., Бокова Н.О., Знойко О.О. Оптимизация диагностических подходов в тактике ведения больных гриппом // Лечащий врач. 2012. № 10. С. 64-67.
- Ершов Ф.И., Романцов М.Г. Лекарственные средства, применяемые при вирусных заболеваниях: Руководство для врачей. М.: ГЭОТАР-Медиа, 2007.
- Fiore А.Е., Fry A., Shay. D. Antiviral agents for the treatment and chemoprophylaxis of infl uenza. Recommendations of the advisory committee on immunization practices (ACIP) // Recommendations and Reports, 60 (RR01): 1-24 (2011).
- Ершов Ф.И., Наровлянский А.Н. Основные итоги изучения системы интерферона к 2011 году // Интерферон-2011: Сборник научных статей. М., 2012. С. 14-34.
- Григорян С.С. Индукторы интерферона: итоги и перспективы // Интерферону - 50 лет: Юбилейный сборник, посвященный открытию интерферонов / Под ред. акад. РАМН проф. Ф.И. Ершова. М., 2007. С. 66-71.
- Романцов М.Г., Ершов Ф.И. Иммунный ответ при вирусных инфекциях // Часто болеющие дети: современная фармакотерапия. М.: ГЭОТАР-Медиа, 2009. С. 134-142.
- Лыткина И.Н., Малышев Н.А. Профилактика и лечение гриппа и острых респираторных вирусных инфекций среди эпидемиологически значимых групп населения // Лечащий врач. 2010. № 10. С. 66-69.
- Романцов М.Г. и др. Антиоксиданты и иммунотропные препараты в терапии больных туберкулезом легких // Врач. 2005. № 9. С. 66-67.
- Применение Циклоферона при социально значимых заболеваниях у детей и подростков. Новейший справочник практикующего врача-педиатра / Под ред. М.Г. Романцова, Л.Г. Горячевой. А.А. Шульдякова. СПб., 2010. 165 с.
- Исаков В.А. и др. Эффективность Циклоферона® в терапии и профилактике гриппа и ОРЗ // РМЖ. 2011. № 23. С. 1-8.
- Кондратьева Е.И. Экстренная неспецифическая профилактика ОРВИ и гриппа препаратом Циклоферон® у детей в эпидемический период // Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. 2005. № 1.
- Гаращенко М.В. Новые технологии в медикаментозной профилактике острых респираторных заболеваний у детей школьного возраста в условиях мегаполиса: Автореф. дис. . канд. мед. наук. М., 2007.
- Татаурщиков Н.С., Сепиашвили Р.И. Современные подходы к использованию иммуномодуляторов в аллергологической практике. М: Тактик-Студио, 2012. 39 с.
- Специальность ВАК РФ 14.00.11
- Количество страниц 136
Оглавление диссертации кандидат медицинских наук Сабирова, Лола Махмуджоновна
Глава № 1 Обзор литературы.
1.1. Особенности эпидемиологии и клинического течения генитальной герпетической инфекции.
12. Характеристика вирусапросгого герпеса.
1.3. Патогенез герпесвирусной инфекции.
1.4. Лечение простого герпеса.
Глава № 2 Материалы и методы исследования.
2.1. Клиническая характеристика больных.
2.2. Лабораторные методы исследования.
2.2.1. Полимеразная цепная реакция.
2.2.2. Иммуноферментный анализ.
2.2.3. Интерфероновый статус.
2.2.4. Изучение противовирусного действия препарата на герпетическую инфекцию в культуре клеток in vitro.
2.3. Статистические методы.
3. Методы лечения.
Глава № 3 Результаты лечения больных генитальной герпетической инфекции препаратом Панавир.
3.1. Клиническая эффективность.
3.3. Влияние панавира на показатели эндогенных интерферонов.
Глава № 4. Изучение влияния панавира на герпетическую инфекцию в культуре клеток in vitro.
Герпесвирусные инфекции являются одними из наиболее распространенных заболеваний человека (Ю.К. Скрипкин с соавт., 1995; A.A. Кубанова с соавт., 1996, Т.Б. Семенова 2000, Wahlin J.B., 1995; Rabora G.W.,1996; Brugha R. 1997). За последние годы возросла заболеваемость генитальным герпесом (К.К. Борисенко 1996; М.В. Яцуха с соавт., 2000; Mindel G.J., Benedetti J., Aschley R., 1992, Terasaki S., 1996). Генитальный герпес — одна из наиболее распространенных форм герпетической инфекции, характеризующаяся разнообразием клинических проявлений и хроническим рецидивирующим течением. Герпесвирусная инфекция передается при тесном контакте с вирусовыделителем (слизистые, секреты, периферические очаги). Описаны случаи бессимптомного выделения ВПГ со спермой и заражения женщин при искусственном оплодотворении (A.B. Мошкалов 1992, К.К. Борисенко 1997). Передача воздушно-капельным путем и через бытовые предметы не свойственна ВПГ, так как он легко инактивируется при комнатной температуре (A.B. Мошкалов, 1992). Вирус может присутствовать в слизистых оболочках, как в период клинических проявлений, так и при их отсутствии. Наибольшее количество случаев передачи вируса сексуальным партнерам и новорожденным происходит именно вследствие бессимптомного выделения вируса (Wald А., 1998). Герпесвирусы уникальны тем, что они могут вызывать первичную инфекцию, находиться в латентном состоянии, и реактивироваться при изменении в иммунной системе (Severson J.L., 1999).
В патогенезе заболевания большая роль отводится способности ВПГ к пожизненному персистированию в нервных клетках и способностью переходить из латентного состояния в инфекционную форму независимо от наличия или отсутствия клинических проявлений (И.Ф. Баринский с соавт., 1995.; В.А. Исаков с соавт., 1997). Однако форма инфекционного процесса определяется не только свойствами вируса, но и индивидуальными особенностями иммунной системы организма хозяина (Ю.С. Бутов 2000; Kaufman D.S., Schoon R.A., Leibson P.J., 1992). Ведущая роль в предупреждении активации ВТТГ принадлежит клеточным факторам иммунитета (В.В. Дубенский 2000; А.Б. Зудин 2000).
В реализации естественной резистентности организма важная роль принадлежит ИФН, открытых в 1957 г. Lindemann.
Одним из специфических результатов иммунного ответа на первичное инфицирование и реактивацию BIT является синтез интерферонов (ИФ) -группы биологически активных белков и/или гликопротеидов, иначе называемых лимфокинами (Ф.И. Ершов 1996, С.А. Кетлинский 1998, А.Н. Чередеев, с соавт., 1999, Brown W.R. et all., 1994). Известные сегодня три антигенных типа человеческого ИФ закодированы генетически, а их продукция возможна лишь определенными типами клеток, значение которых в противогерпетическом иммунитете определяет и место в нем самих лимфокинов (Ф.И. Ершов 1996, Г.Т. Сухих 1996, Yu Z, Rouse В.Т. 1996). Исследованию системы ИФ при ПГ посвящено большое количество работ (П.А. Джумиго 1990, Ф.И. Ершов 1986, 1980, М.А. Самгин 1999, A.A. Халдин 1995, В.В. Дубенский 2001). Результатом их явилось заключение, что роль интерферонов в формировании противогерпетического иммунитета не ограничивается только подавлением репродукции вируса или санации организма от его активных форм, но и проявляется в иммуномодуляции защитных реакций, в частности повышения фагоцитарной активности макрофагов и усиления цитотоксичности ЕК (Feldman М. 1992, Kikuta Н. 1990,Singh A.K. 1996, Geiger K.D. 1997, Lewandowski G. 1998).
При герпесвирусной инфекции угнетается способность лейкоцитов к синтезу эндогенных интерферонов. Интерферон подавляет внутриклеточную репликацию вирусов. Продукция а-ИФН показывает противовирусную и неспецифическую защиту, а продукция у-ИФН - активность иммунной системы. Интерферон блокирует самые ранние этапы репродукции вируса. При хронической рецидивирующей герпетической инфекции уровень интерферонов значительно снижается. ( B.B. Дубенский 1999, М.А. Самгин 1999, A.A. Халдин 1995, Holberg-Petersen М., Bukholm G., 1996).
Лечение больных с герпетической инфекцией вызывает определенные трудности. Это связано в первую очередь склонностью ВПГ к пожизненному персистированию в организме хозяина, с высокой частотой латентных форм и к частому рецидивированию (Л.И. Афонина 1995; Ю.К. Скрипкин с соавт., 1995; A.A. Кубанова с соавт., 1996; De Clercg Е., 1997, Hamuy R., Berman В., 1998). Максимальный клинический эффект может быть получен при рациональной комплексной терапии лекарственных средств с различными механизмами действия: этиотропная терапия и препараты повышающие резистентность макроорганизма (В.А. Исаков, Д.К. Ермоленко, 1991; 1996, Л.Н. Хахалин 1997, Ф.И. Ершов 1998, В.В. Дубенский 2000, D.T. Leung et al., 2000; A.R. Margues et al., 2000; R.L. Miller et al., 2002).
В этиотропной терапии заболевания в соответствии с международными рекомендациями применяются аналоги естественных нуклеозидов (ацикловир, валацикловир, фамцикловир), которые строго специфически подавляют репликацию вируса. ( A.A. Кубанова, С.А. Масюкова 1996, Н.В. Кунгуров с соавт., 2000, De Clercg А., 1997, Kesson A.M., 1998, Lazarus H.M.; Belanger R., Candoni A, Marks L.; 1999). Для этого используются принципы поэтапного лечения: эпизодическая терапия (подавление репликации вируса в острую стадию, используется периодически, когда возникают рецидивы) и специфическая профилактика рецидива или супрессивная терапия (используется пациентами длительно, пролонгировано, на протяжении определенного времени для предупреждения и предотвращения рецидива) (В.А. Исаков 1996, A.A. Кубанова, А.Б. Зудин 2000, A.A. Халдин 2002). Нередко после отмены препаратов рецидивы заболевания сохраняются. К некоторым противовирусным препаратам происходит формирование резистентных штаммов (A.A. Кубанова с соавт., 1997, Г.Т. Сухих с соавт., 1997, Е.В. Владимирова 1998, Е.И. Губанова 2000, М.А. Самгин, A.A. Халдин 2000).
Цель настоящего исследования - оценка эффективности лечения больных генитальной герпесвирусной инфекцией с использованием комплекса полисахаридов и определение его корригирующего влияния на функционирование системы интерферона.
2) Исследовать показатели интерферонового статуса (уровень сывороточного интерферона и способность лейкоцитов к продукции интерферонов - а и - у) при рецидивирующей генитальной герпетической инфекции.
4) Исследовать влияние панавира на индукцию -а и -у -интерферонов лейкоцитами периферической крови у лиц с рецидивирующей герпетической инфекцией
Научная новизна работы.
Экспериментальное изучение показателей токсичности в эксперименте показало, что панавир обладает низкой токсичностью. Установлено in vitro на клетках Vero, что противогерпетическая активность более выражена при невысокой множественности инфицирования вирусом простого герпеса
Показано, что панавир позитивно влияет на восстановление способности к продукции интерферонов - а, что сопровождается выраженным клиническим эффектом.
Основные положения, выносимые на защиту:
Объем и структура диссертации Работа построена по традиционному плану и состоит из введения, обзора литературы и 3-х глав собственных исследований, заключения, выводов, практических рекомендаций и указателя литературы. Диссертация изложена на 138 страницах компьютерного текста, содержит 19 таблиц и 22 рисунка. Библиография включает 237 литературный источник, в том числе 114 отечественных и 123 зарубежных авторов.

АМИКСИН ® — современное противовирусное и иммуностимулирующее средство; способствует образованию в организме четырех видов интерферонов (альфа, бета, гамма и лямбда).
Узнать подробнее про АМИКСИН ® …


Противовирусные препараты с иммуностимулирующей активностью могут рекомендоваться как при лечении гриппа, так и других ОРВИ. С их помощью можно сократить сроки болезни и предотвратить развитие осложнений.

Прием противовирусного препарата АМИКСИН ® возможен на любой стадии простуды и гриппа по рекомендации врача.
Как принимать препарат?


В сезон простуды и гриппа прием противовирусных и иммуномодулирующих препаратов помогает снизить вероятность заболевания.

АМИКСИН ® — современный противовирусный и иммуномодулирующий препарат, используемый в комплексной терапии целого ряда вирусных инфекционных заболеваний, в том числе гриппа, ОРВИ и герпеса.
Подробнее о препарате…


Иммуномодулирующие препараты — одни из важных составляющих комплексной терапии гриппа и других ОРВИ.
Функции и механизм действия интерферона в человеческом организме
Интерферон — это белковая молекула, которая обеспечивает противовирусный иммунитет. При этом она обладает неспецифической активностью, то есть действуют не на возбудителя какого-то конкретного заболевания, а на все вирусные частицы в целом. Если сказать обобщенно, то интерферон — универсальный защитник организма, который начинает действовать еще до того, как в работу включатся остальные звенья иммунитета [1] . Препараты интерферона применяются даже в терапии онкологии: они подавляют опухолевый рост.
Клетки вырабатывают этот защитный белок в ответ на действие вирусов, бактерий, опухолевых клеток или продуктов их метаболизма. Стимулировать их выработку могут и лекарственные препараты — индукторы интерферона. Молекулы последних, попадая в кровь и межклеточную жидкость, связываются с рецепторами зараженных или поврежденных клеток. Они запускают сложный каскад реакций, приводящих к образованию специфических белков. В результате клетка перестает воспроизводить вирусные частицы, расщепляет их генетическую структуру, а поверхность этой клетки становится менее проницаемой для внутриклеточных паразитов.
Кроме действия на сами зараженные клетки, интерфероны стимулируют активность других звеньев иммунитета, контролируют воспалительную реакцию [2] и даже могут защитить организм от опухолей. Это свойство активно изучают и уже используют для борьбы с некоторыми видами рака [3] .
Молекулы интерферона отличаются между собой по генетической структуре, типу клеточных рецепторов, на которые они действуют, даже по участкам ДНК, которые кодируют их состав. Все интерфероны делят на 3 типа.
- К первому типу относят альфа-интерферон, который имеет 13 различных структурных вариантов, а также бета-, каппа-, эпсилон- и омега-.
- Второй тип представлен только одним типом, гамма-интерфероном.
- Относительно недавно, в 2002 году, был открыт и третий тип молекул, лямбда-. Это отдельное семейство интерферонов, которое отличается от всех предыдущих генетическим строением и даже типом рецепторов, с которыми они взаимодействуют. Но по своей биологической активности лямбда-интерфероны очень похожи на первый тип [4] .
Не стоит относиться к интерферонам как к панацее от всех бед. Во-первых, некоторые вирусы могут подавлять образование специфических белков внутри зараженных клеток, что значительно снижает эффективность противовирусной защиты.
Поэтому прежде чем начинать лечение препаратами интерферона, нужно внимательно изучить пользу и возможный вред от их приема.
Лекарственные средства на основе интерферона доказали свою эффективность [5] в лечении широкого круга заболеваний: герпетических инфекций, ВПЧ, острых и хронических форм вирусного гепатита, рассеянного склероза, волчанки, гриппа и многих других вирусных и бактериальных инфекций. Применяют интерферон и при терапии онкологических заболеваний, а также СПИДа. И это притом, что по меркам медицины открыли его совсем недавно. Это произошло в 1957 году при проведении опытов на мышах. Ученые обратили внимание, что животные, заразившиеся одним вирусом, становились невосприимчивы к другому вирусному заболеванию. Это явление было названо интерференцией, а вещества, которые ему способствовали — интерферонами. Оказалось, что интерфероны вырабатываются не только у мышей, но и у всех млекопитающих, в том числе у человека. Началось изучение возможности промышленного производства веществ, обладающих противовирусным эффектом.
Однако долгое время применение интерферонов было ограничено из-за несовершенства процедуры их получения. Выделять это вещество из крови человека-донора было сложно, дорого и неэффективно.
В 1980 году в Японии впервые использовали для производства интерферона специально выращенную культуру лимфобластных клеток. А в 1981 году в США вместо клеток человека использовали культуру дрожжевых грибков. С помощью генной инженерии в геном ввели ген, который кодирует производство молекулы интерферона. Это позволило значительно упростить производство препарата [8] .
По способу производства существует четыре основных разновидности этого препарата: лейкоцитарный, лимфобластоидный, рекомбинантный и пегилированный.
После получения такой препарат очищают и концентрируют. В него могут входить все виды интерферонов и другие биологически активные вещества. Это одновременно и плюс, и минус. Преимущество такого препарата — его высокий потенциал биологического действия. Недостаток — высокая вероятность побочных эффектов при внутримышечном введении.
Лимфобластоидный интерферон получают не от человека-донора, а из культуры лимфобластных клеток, которые также обрабатывают веществами, стимулирующими иммунный ответ. Такие препараты содержат определенное соотношение различных видов интерферона и не так часто вызывают побочные эффекты.
Пегилированные, или ПЭГ-интерфероны — это рекомбинантные белковые молекулы, соединенные с полиэтиленгликолем. Такое соединение увеличило срок действия интерферона в организме.
ПЭГ растворим в воде, не вступает в биологические реакции в организме и не вызывает иммунного ответа. При присоединении ПЭГ молекула интерферона значительно увеличивается в размерах. А это, в свою очередь, увеличивает период полувыведения препарата.
Объединить интерфероны в однородные группы по методу получения, формам выпуска и показаниям не получится. Каждый препарат имеет свои особенности применения, эффективность при определенных заболеваниях. В зависимости от степени очистки и других факторов какие-то препараты с одним и тем же видом иммуноглобулина могут применяться только местно, а какие-то можно использовать в виде инъекций.
Поэтому при выборе препарата интерферона стоит ориентироваться не только на общую характеристику группы веществ, но в первую очередь на рекомендации врача и инструкцию по применению конкретного препарата.
Интерферон в виде инъекций применяют при системных заболеваниях, таких как гепатит, опухоли или рассеянный склероз. Препарат в виде капель в нос подходит для лечения риносинуситов и профилактики ОРВИ. Капли в глаза помогут при конъюнктивите. Суппозитории можно использовать при многих заболеваниях, в том числе у детей. А гель подходит для смазывания носа или кожи.
Интерфероны защищают организм от вирусов, бактерий и опухолевых клеток. Они обладают сложным биологическим действием. Но современная медицина научилась создавать аналогичные вещества и использовать их. Однако подбор подходящего препарата — задача, которую может решить только врач.
Преимущества этого препарата — максимум выработки интерферона уже в первые сутки от начала приема и активация четырех видов интерферонов. Увеличение концентрации интерферонов в отдельных органах может достигаться уже через 4 часа.
Все индукторы интерферона обладают индивидуальными характеристиками, показаниями и противопоказаниями. Поэтому препарат нужно выбирать внимательно, только после прочтения инструкции. С особой осторожностью нужно подходить к выбору лекарства, если его нужно принимать детям. Для детей существуют отдельные формы выпуска.
И, конечно, никогда нельзя заниматься самолечением. Любые препараты нужно принимать только по согласованию с врачом.

Читайте также:


