Инфекционные заболевания генетическая предрасположенность

У некоторых людей повышенный риск развития легочных заболеваний может быть связан с генетической предрасположенностью, унаследованной от родителей.
Гены — это короткие участки ДНК, которые определяют характеристики любого живого организма. Несмотря на то что последовательности ДНК у разных людей совпадают более чем на 99%, остается пространство для более чем 10 млн различий между генными структурами двух человек.
Что это?
Некоторые заболевания, такие как муковисцидоз и дефицит антитрипсина альфа-1, полностью обусловлены генетическими факторами. Такие заболевания называются моногенными заболеваниями.
Другие заболевания, такие как астма и ХОБЛ, в большинстве случаев вызываются сочетанием генетических особенностей человека и факторов окружающей среды, таких как аллергены, раздражающие вещества, курение, диета, питательные вещества, лекарственные препараты, инфекции и травмы, которые могут вызывать данные заболевания. Такие заболевания называются сложными, или комплексными, заболеваниями.
Каковы же вредные последствия?
Некоторые гены связаны с функцией легких и развитием легких. Установлено, что причиной многих разных заболеваний являются изменения в генах, называемые мутациями. Эти мутации могут происходить под влиянием экологических факторов или при первом соединении сперматозоида и яйцеклетки.
Муковисцидоз (МВ) обычно вызывается дефектами гена, называемого трансмембранным регулятором муковисцидоза (CFTR).
Это заболевание описывается как генетическое заболевание с аутосомно-рецессивным типом наследования; это означает, что для развития заболевания мутации должны были произойти в обеих копиях гена.
Установлено, что более 1000 различных мутаций в гене CFTR связаны с развитием муковисцидоза. На экспрессию и функцию белка CFTR влияют различные мутации, так что нарушается регулирование водно-солевого обмена в клетках (дыхательных путей, кишечника и кожи).
Методы лечения ориентированы прежде всего на исправление главного дефекта в гене CFTR. Например, препарат ивакафтор ориентирован на одну специфическую мутацию, которая обозначается как G551D, и должен помочь смягчить симптомы и обострения.
Дефицит антитрипсина альфа-1 — также рецессивное наследственное заболевание, выявляемое у 1 на 2000 — 5000 человек в Европе.
Это заболевание характеризуется пониженными уровнями белка антитрипсина альфа-1 в крови. Этот белок кодируется геном SERPINA1. Мутации этого гена могут увеличивать риск развития дефицита антитрипсина альфа-1. Пациенты с дефицитом антитрипсина альфа-1 очень чувствительны к вредоносным факторам курения, которые у них приводят к развитию тяжелой эмфиземы уже в раннем возрасте.
ПЦД вызывается дефектами ресничек — крошечных, микроскопических волосоподобных элементов, выстилающих слизистые оболочки дыхательных путей, слуховых путей и синусов, в разных частях организма. Некоторые из этих проблем вызваны мутациями двух генов DNAI1 и DNAH5.
Исследования генетических причин астмы сосредоточены, в основном, на выявлении различных генов которые делают одного человека более восприимчивым к развитию астмы, а другого менее восприимчивым.
Многие гены связаны с астмой или с астмоподобными нарушениями, такими как аллергия. Роль этих генов, определяющих восприимчивость к астме, до конца не изучена, и исследования продолжаются, поскольку нужно понять, как эти гены, наряду с факторами окружающей среды, могут способствовать развитию астмы.
ХОБЛ вызывается, главным образом, курением или воздействием других загрязнителей воздуха. ХОБЛ развивается только примерно у 20% курильщиков, и это позволяет предположить, что определенную роль в развитии этого заболевания играют генетические факторы.
До сих пор твердо идентифицированы лишь несколько генов, влияющих на восприимчивость к ХОБЛ. Это, в частности, TNFα (α-фактор некроза опухолей), TGFβ1 (трансформирующий ростовой фактор β1), GSTP1 и GSTM1 (глютатион-S-трансферазы P1 и M1), SOD3 (пероксиддисмутаза 3).
Исследования ассоциаций на уровне генома применительно к ХОБЛ позволили выявить три основных пункта восприимчивости в генах: локус FAM13A на хромосоме 4q22, локус вблизи HHIP на хромосоме 4 и локус CHRNA3/CHRNA5 на хромосоме 15.
Результаты исследование показывают, что гены, которые влияют на функцию легких, в частности, на развитие и рост легких, также являются генетическими факторами риска применительно к ХОБЛ.
Чтобы помочь экспертам идентифицировать гены, ответственные за заболевания, им сначала приходится определять общие характеристики людей, страдающих данным заболеванием, такие как рост, вес и функция легких. Эти характеристики называются фенотипами. У астмы и ХОБЛ есть некоторые сходные черты. Некоторые гены, такие как TNFα, TGFβ1, MMP12 (матричная металлопротеиназа 12) и ADAM33, идентифицированы как гены, определяющие предрасположенность и к астме, и к ХОБЛ.
Чем вызывается фиброз легких — неизвестно, однако по имеющимся оценкам до 2% случаев фиброза легких объясняются наследственностью. Было показано, что некоторые мутации повышают восприимчивость к фиброзу легких:
Полагают, что саркоидоз вызывается сочетанием наследственных и экологических факторов. Вредные экологические факторы известны, и результаты исследование позволяют предположить, что играют роль также некоторые гены и локализации генов, а именно:
- HLA-DRB1 ген на хромосоме 6p21.3
- SS2, на хромосоме 6p21.32
- ANXA11 ген на хромосоме 10q22.3
Заболевания, характеризующиеся нарушениями иммунной реакции на инфекции, в целом называются иммунодефицитом.
Некоторые типы дефектов в легких, наряду с генетическими дефектами в иммунной системе, как считается, обуславливают повышенный риск заражения инфекционными заболеваниями легких. Это, в частности:
- Дефицит Toll-подобного рецептора 3 (TLR3) повышает восприимчивость к вирусным инфекциям
- Дефицит TLR5 увеличивает риск инфицирования бактериями Legionella
- Дефицит маннозо-связывающего лектина увеличивает риск инфицирования бактериями и грибками
Изменения в генах связаны с восприимчивостью или, наоборот, устойчивостью к M. tuberculosis, которая вызывает туберкулез (TB). Пока не совсем понятно, почему активная форма туберкулеза развивается лишь у 10% людей, инфицированных M. tuberculosis.
Генетическая восприимчивость или, наоборот, устойчивость к Mycobacterium tuberculosis
Специалисты выявили ген, ответственный за никотиновую зависимость и рак легких. Исследование ассоциаций на уровне генома позволило идентифицировать участок на хромосоме 15 (15q25.1), содержащий субъединичные гены никотин-ацетилхолинового рецептора CHRNA3 и CHRNA5. Специалисты пока не знают, увеличивается риск развития рака легких только из-за увеличения потребления никотина или это увеличивает риск развития рака легких независимо от курения.
Легочная эмболия возникает из-за образования тромбов в венах. Генетическая предрасположенность является фактором риска как для тромбообразования, так и для легочной эмболии. Мутация гена фактора коагуляции V (лейденовская мутация фактора V) увеличивает вероятность образования тромбов.
Если у человека две копии лейденовской мутации фактора V (гомозиготность), у него/нее вдвое увеличивается пожизненный риск развития тромбоза глубоких вен, с легочной эмболией или без нее.
Генный кластер CHRNA3 и CHRNA5 (никотин-ацетилхолиновый рецептор) на хромосоме 15q24-25 связан с зависимостью от никотина, измеряемой числом сигарет, выкуриваемых в день.
Сегодняшние и будущие потребности
- В будущем генетическое тестирование состояния легких должно быть ориентировано на несколько разных аспектов: это, в частности, ранняя диагностика, прогнозирование риска заболевания и прогнозирование реакции на лечение.
- По мере развития генетических исследований акцент необходимо делать на выявлении целевых объектов для разработки новых лекарств для лечения заболеваний легких.
- Финансирование программ ЕС, таких как Horizon 2020, должно охватывать и исследования в этой области.
Проекты:


Европейский пульмонологический фонд (European Lung Foundation — ELF) основан в 2000 г. Европейским респираторным обществом (European Respiratory Society — ERS) как площадка для совместной деятельности пациентов, общественности и специалистов в области легочных заболеваний с целью оказания положительного влияния на респираторную медицину. ELF- это некоммерческая организация, зарегистрированная как Британская компания ( НДС № GB 115 0027 74) и благотворительная деятельность (№ 1118930).
Генетические особенности организма играют важную роль в развитии инфекционных заболеваний, обусловливая восприимчивость к разнообразным бактериям, вирусам и грибам, а также оказывая влияние на течение болезни. Многочисленные исследования свидетельствуют о существовании аллелей предрасположенности к инфекциям. Кроме того, в настоящее время известно около 300 нозологических форм первичных иммунодефицитов (ПИД), которые представляют собой наследственные дефекты иммунитета. Своевременная диагностика таких состояний представляет значительные трудности, однако она крайне необходима для повышения качества лечения пациентов. Использование современных методов ДНК-анализа во многих случаях позволяет установить генетическую причину уязвимости по отношению к тем или иным инфекционным агентам.
3. Jepson A. Twin studies for the analysis of heritability of infectious diseases. Bull Inst Pasteur. 1998;96:71–81.
4. Hwang AE, Hamilton AS, Cockburn MG, Ambinder R, Zadnick J, Brown EE, Mack TM, Cozen W. Evidence of genetic susceptibility to infectious mononucleosis: a twin study. Epidemiol Infect. 2012 Nov;140(11):2089-95.
5. Rovers M, Haggard M, Gannon M, et al. Heritability of symptom domains in otitis media: a longitudinal study of 1,373 twin pairs. Am J Epidemiol. 2002;155:958–964.
6. Casselbrant ML, Mandel EM, Fall PA. The heritability of otitis media: a twin and triplet study. JAMA. 1999;282:2125–2130.
7. Thomsen SF, Stensballe LG, Skytthe A, et al. Increased concordance of severe respiratory syncytial virus infection in identical twins. Pediatrics. 2008 Mar;121(3):493-6.
8. Sorensen TI, Nielsen GG, Andersen PK, Teasdale TW. Genetic and environmental influences on premature death in adult adoptees. N Engl J Med. 1988;318:727–732. [PubMed: 3347221]
9. Brodin P, Jojic V, Gao T, et al. Variation in the human immune system is largely driven by non-heritable influences. Cell. 2015 Jan 15;160(1-2):37-47.
10. Ge D, Fellay J, Thompson AJ, et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature. 2009 Sep 17;461(7262):399-401.
11. Zhang F, Liu H, Chen S, et al. Identification of two new loci at IL23R and RAB32 that influence susceptibility to leprosy. Nat Genet. 2011 Oct 23;43(12):1247-51.
12. Jostins L, Ripke S, Weersma RK, et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 2012 Nov 1;491(7422):119-24.
13. Thye T, Owusu-Dabo E, Vannberg FO, et al. Common variants at 11p13 are associated with susceptibility to tuberculosis. Nat Genet. 2012 Feb 5;44(3):257-9.
14. Abel L, Alcaïs A, Schurr E. The dissection of complex susceptibility to infectious disease: bacterial, viral and parasitic infections. Curr Opin Immunol.2014 Oct;30:72-8.
15. Casanova JL. Severe infectious diseases of childhood as monogenic inborn errors of immunity. Proc Natl Acad Sci U S A. 2015 Dec 22;112(51):E7128-37.
16. Raniszewska A, Górska E, Kotuła I, et al. Recurrent respiratory tract infections in children – analysis of immunological examinations. Cent Eur J Immunol. 2015;40(2):167-73.
17. de Vries E; Clinical Working Party of the European Society for Immunodeficiencies (ESID). Patient-centred screening for primary immunodeficiency: a multi-stage diagnostic protocol designed for non-immunologists. Clin Exp Immunol. 2006 Aug;145(2):204-14.
18. Costa-Carvalho BT, Grumach AS, Franco JL, et al. Attending to warning signs of primary immunodeficiency diseases across the range of clinical practice. J Clin Immunol. 2014 Jan;34(1):10-22.
19. Латышева, Е.А. Первичные иммунодефициты: состояние проблемы на сегодняшний день JMF-центры в России / Е.А. Латышева // Вопросы современной педиатрии. – 2013. – Т. 12(6). – С. 73–77.
20. Yang L, Wu EY, Tarrant TK. Immune Gamma Globulin Therapeutic Indications in Immune Deficiency and Autoimmunity. Curr Allergy Asthma Rep. 2016 Jul;16(8):55.
21. Kuo CY, Kohn DB. Gene Therapy for the Treatment of Primary Immune Deficiencies. Curr Allergy Asthma Rep. 2016 May;16(5):39.
22. Fang M, Abolhassani H, Lim CK, Zhang J, Hammarström L. Next Generation Sequencing Data Analysis in Primary Immunodeficiency Disorders – Future Directions. J Clin Immunol. 2016 May;36 Suppl 1:68-75.
23. Gathmann B, Binder N, Ehl S, et al. The European internet-based patient and research database for primary immunodeficiencies: update 2011. Clin Exp Immunol. 2012 Mar;167(3):479-91.
24. Bousfiha AA, Jeddane L, Ailal F, et al. Primary immunodeficiency diseases worldwide: more common than generally thought. J Clin Immunol. 2013 Jan;33(1):1-7.
25. Modell V, Quinn J, Orange J, Notarangelo LD, Modell F. Primary immunodeficiencies worldwide: an updated overview from the Jeffrey Modell Centers Global Network. Immunol Res. 2016 Jun;64(3):736-53.
26. Modell F, Puente D, Modell V. From genotype to phenotype. Further studies measuring the impact of a Physician Education and Public Awareness Campaign on early diagnosis and management of primary immunodeficiencies. Immunol Res. 2009;44(1-3):132-49.
27. Al-Hammadi S, Al-Reyami E, Al-Remeithi S, et al. Attentiveness of pediatricians to primary immunodeficiency disorders. BMC Res Notes. 2012 Jul 31;5:393.
28. Arslan S, Ucar R, Caliskaner AZ, et al. How effective are the 6 European Society of Immunodeficiency warning signs for primary immunodeficiency disease? Ann Allergy Asthma Immunol. 2016 Feb;116(2):151-155.e1.
29. von Bernuth H, Picard C, Puel A, Casanova JL. Experimental and natural infections in MyD88and IRAK-4-deficient mice and humans. Eur J Immunol. 2012 Dec;42(12):3126-35.
30. Picard C, Al-Herz W, Bousfiha A, et al. Primary Immunodeficiency Diseases: an Update on the Classification from the International Union of Immunological Societies Expert Committee for Primary Immunodeficiency 2015. J Clin Immunol. 2015 Nov;35(8):696-726.
31. Bousfiha A, Jeddane L, Al-Herz W, et al. The 2015 IUIS Phenotypic Classification for Primary Immunodeficiencies. J Clin Immunol. 2015 Nov;35(8):727-38.
32. Bustamante J, Boisson-Dupuis S, Abel L, Casanova JL. Mendelian susceptibility to mycobacterial disease: genetic, immunological, and clinical features of inborn errors of IFNimmunity. Semin Immunol. 2014 Dec;26(6):454-70.
33. Puel A, Cypowyj S, Bustamante J, et al. Chronic mucocutaneous candidiasis in humans with inborn errors of interleukin-17 immunity. // Science. 2011 Apr 1;332(6025):65-8.
34. Ling Y, Cypowyj S, Aytekin C, et al. Inherited IL-17RC deficiency in patients with chronic mucocutaneous candidiasis. J Exp Med. 2015 May 4;212(5):619-31.
35. Gennery AR. The Evolving Landscape of Primary Immunodeficiencies. J Clin Immunol. 2016 May;36(4):339-40.
36. Samson M, Libert F, Doranz BJ, et al. Resistance to HIV1 infection in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature. 1996 Aug 22;382(6593):722-5.
37. Lindesmith L, Moe C, Marionneau S, et al. Human susceptibility and resistance to Norwalk virus infection. Nat Med. 2003 May;9(5):548-53.
38. Щербина, А.Ю. Аутовоспалительные заболевания – взгляд иммунолога / А.Ю. Щербина // Современная ревматология. – 2015. – № 1.– С. 48–54.
39. Al-Herz W, Notarangelo LD. Classification of primary immunodeficiency disorders: one-fits-all does not help anymore. Clin Immunol. 2012 Jul;144(1):24-5.
40. Stoddard JL, Niemela JE, Fleisher TA, Rosenzweig SD. Targeted NGS: A Cost-Effective Approach to Molecular Diagnosis of PIDs. Front Immunol. 2014 Nov 3;5:531.
41. Nijman IJ, van Montfrans JM, Hoogstraat M, et al. Targeted next-generation sequencing: a novel diagnostic tool for primary immunodeficiencies. J Allergy Clin Immunol. 2014 Feb;133(2):529-34.
42. Moens LN, Falk-Sörqvist E, Asplund AC, et al. Diagnostics of primary immunodeficiency diseases: a sequencing capture approach. PLoS One. 2014 Dec 11;9(12):e114901.
43. Al-Mousa H, Abouelhoda M, Monies DM, et al. Unbiased targeted next-generation sequencing molecular approach for primary immunodeficiency diseases. J Allergy Clin Immunol. 2016 Jun;137(6):1780-7.
44. Raje N, Soden S, Swanson D, et al. Utility of next generation sequencing in clinical primary immunodeficiencies. Curr Allergy Asthma Rep. 2014 Oct;14(10):468.
45. Casanova JL, Conley ME, Seligman SJ, Abel L, Notarangelo LD. Guidelines for genetic studies in single patients: lessons from primary immunodeficiencies. J Exp Med. 2014 Oct 20;211(11):2137-49.
- Обратные ссылки не определены.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.

Наследственные и наследственно-предрасположенные заболевания
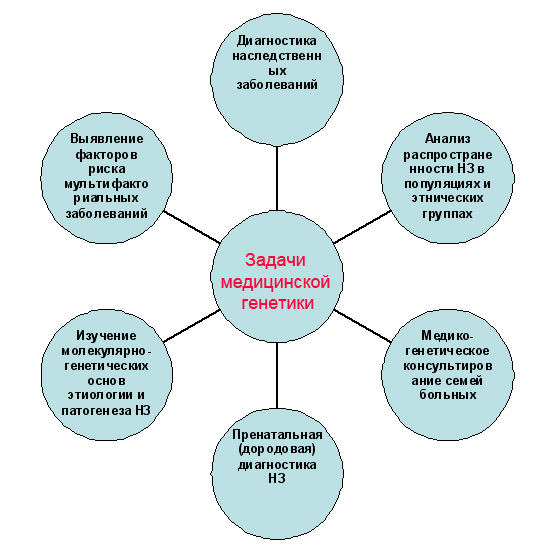
Основной целью медицинской генетики является изучение роли генетических составляющих в этиологии и патогенезе различных заболеваний человека. Эти болезни делятся на два класса: собственно наследственные болезни, куда входят хромосомные и генные заболевания, и болезни с наследственной предрасположенностью, которые называют мультифакториальными заболеваниями.
Хромосомными являются болезни, вызванные нарушением числа, либо структуры хромосом. Генные болезни обусловлены присутствием мутаций в генах. Моногеннными называются болезни, обусловленные присутствием мутаций в одном гене. В этиологии мультифакториальных заболеваний наряду с действием неблагоприятных внешних факторов существенное влияние оказывают состояния не одного, а многих генов. Количество этих генов, формирующих наследственную предрасположенность к заболеванию, иногда исчисляется десятками или даже сотнями. Суммарная частота наследственных заболеваний достигает 1,5%, из них на долю хромосомных болезней приходится 0,5% и на долю моногенных – до 1%. К мультифакториальным относятся большинство наиболее распространенных болезней человека.

Хромосомные болезни: В настоящее время описано около 1000 нозологических форм хромосомных болезней. Все они характеризуются рядом общих признаков, таких как: маленькая масса и длина тела при рождении, пренатальная гипоплазия; отставание в умственном и физическом развитии с момента рождения, особенно выраженное при аутосомных аномалиях; задержка и аномалии полового развития: гипогонадизм, крипторхизм, аменорея, бесплодие и др., более выраженные при аномалиях половых хромосом; множественные ВПР в большей степени при аутосомных аномалиях; комплекс разнообразных по проявлениям и тяжести дизморфогенетических и диспластических признаков, одновременно затрагивающих многие системы и органы больного. Хромосомные болезни редко наследуются, и более чем в 95% случаев риск повторного рождения в семье больного ребенка с хромосомной патологией не превышает общепопуляционного уровня. Исключение составляют те случаи, когда родители больного ребенка несут сбалансированные хромосомные перестройки, чаще всего транслокации, при которых не происходит утраты генетического материала. Носители сбалансированных транслокаций являются практически здоровыми людьми, но вероятность у них выкидышей, замерших беременностей или рождения детей с несбалансированными хромосомными перестройками, а значит с хромосомными болезнями, очень велика. Поэтому при бесплодии, мертворождениях, привычной невынашиваемости беременности, а также при наличии в семье ребенка с хромосомной патологией необходимо проводить анализ кариотипа каждого из родителей с целью диагностики сбалансированных хромосомных перестроек.
Моногенные болезни Разнообразие моногенных заболеваний достаточно велико и их количество по некоторым оценкам достигает 5000. Среди моногенных болезней значительный процент составляют ферментопатии, различные формы умственной отсталости, дефекты органов слуха, зрения, скелетные дисплазии, врожденные пороки развития, болезни нервной, эндокринной, соединительно-тканной, иммунной и других систем. Моногенные варианты течения заболевания в редких случаях встречаются среди любых нозологических форм, которые в общем случае не являются наследственными. Так, например, описаны моногенные формы гипертензии, болезней Альцгейаера и Паркинсона, эпилепсии и других больших психозов, иммунодефицитов, различных онкологических заболеваний и многих других патологических состояний. Моногенные варианты заболевания, как правило, отличаются от спорадических форм более тяжелым течением и ранним дебютом. Большинство мутаций, ассоциированных с моногенными заболеваниями, жестко детерминируют развитие болезни, и факторы окружающей среды не оказывают или оказывают небольшое влияние на развитие заболевания. Поэтому они так трудно поддаются коррекции. Однако немало примеров моногенных болезней с неполной пенетрантностью и варьирующей экспрессивностью, причины которых чаще всего остаются неизвестными. К счастью, моногенные заболевания встречаются достаточно редко. К числу наиболее известных моногенных болезней относятся фенилкетонурия, муковисцидоз, галактоземия, адреногенитальный синдром, гемофилия А и В, миодистрофия Дюшенна/Беккера, проксимальная спинальная мышечная атрофия, гепатолентикулярная дегенерация и многие другие болезни. Профилактика тяжелых неизлечимых моногенных заболеваний проводится на базе пренатальной диагностики.
Мультифакториальные заболевания обусловлены комбинированным действием неблагоприятных внешних и генетических факторов риска, формирующих наследственную предрасположенность к заболеванию. К мультифакториальным заболеваниям относятся подавляющее большинство хронических болезней человека, включая сердечно-сосудистые, эндокринные, иммунные, нервно-психические, онкологические и др. Генетические составляющие могут присутствовать в этиологии даже тех заболеваний, развитие которых целиком индуцируется внешними воздействиями и невозможно без их присутствия, таких, например, как инфекционные болезни. Однако и в этих случаях индивидуальная чувствительность к подобным внешним неблагоприятным воздействиям может быть генетически детерминирована. Например, на сегодняшний день известно, что в патологии бронхиальной астмы, лейкозов и их рецидивов участвуют белковые продукты таких генов системы детоксикации, как GSTM1, GSTT1, CYP1A1, GSTP1, NAT2 и др.Полная расшифровка генома человека открыла большие возможности для изучения ассоциации различных генов человека с моногенными и мультифакториальными заболеваниями. Эти исследования являются основой для планомерной разработки совместно со специалистами различных медицинских профилей новых патогенетических и этиологических методов лечения наследственных заболеваний, а также предупреждения развития тех заболеваний, к которым у человека имеется генетическая склонность.
В настоящее время не существует единой классификации наследственных болезней, и часто их смешивают с врожденными и семейными болезнями. Причиной развития наследственных болезней являются присутствующие в половых клетках родителей мутаций в определенных генах. Эти мутации могут передаваться потомству в ряду поколений. Врожденные заболевания проявляются сразу после рождения, и они могут быть как наследственными, так и приобретенными, например, под действием тератогенных факторов или осложнений в родах. Приобретенные врожденные пороки развития не передаются по наследству. Семейными называются болезни, присутствующие у нескольких членов одной семьи. Они также могут быть наследственными или обусловливаться средовыми влияниями, например неправильным питанием, вредными привычками или присутствием токсических соединений в окружающей среде. В свою очередь, наследственные болезни не обязательно являются врожденными или семейными.
В этиологии детской инвалидности и ограничений жизнедеятельности значительная доля принадлежит наследственным факторам. Так, в Республике Саха (Якутия) среди причин детской инвалидности на первом месте (28,5%) стоят врожденные пороки развития, на втором - заболевания нервной системы (23,9%), на третьем - психические расстройства (11,9%). По данным Росстата среди причин младенческой смертности врожденные пороки развития занимают второе-третье место в Республике Саха (Якутия) и в целом по Российской Федерации. Остается значительной доля врожденных и наследственных заболеваний среди причин детской смертности (в возрасте до 5 лет), в структуре которой на долю хромосомныхболезней приходится 2-3% (Новиков, 2008).
Язвенная болезнь – весьма широко распространенное хроническое заболевание, при котором в желудке и/или 12-перстной кишке человека образуются дефекты — язвы. Для заболевания характерно хроническое течение и сезонность: болезнь подтачивает здоровье своего хозяина годами, периоды обострения сменяются обманчивым спокойствием. Чаще всего обострения язвенной болезни приходятся на т.н. периоды межсезонья – весна — осень.
Хотя этиология язвенной болезни до настоящего времени остается поводом для дис-куссий, большинство авторов сходятся во мнении, что возникновению язвы способствуют:
- наличие хронических заболеваний желудочно-кишечного тракта (гастрит, панкреатит)
- неправильное питание
- длительный прием препаратов, которые обладают язвообразующими свойствами (ацетилсалициловая кислота, гормональные препараты и пр.)
- злоупотребление алкоголем и курение
- стресс
- генетическая предрасположенность
Гастрит — воспаление слизистой (внутренней) оболочки стенки желудка. Заболевание может быть острым — впервые возникшее с сильно выраженными симптомами, и хроническим — приступы повторяются не очень часто, но регулярно. Диагноз гастрита ставит врач-гастроэнтеролог после осмотра и проведения ряда исследований: эзофагогастродуоденоскопии, рентгенологического исследования желудка. При хроническом гастрите проводят исследование желудочной секреции и биопсию слизистой оболочки желудка.
Причины гастрита:
- Helicobacter pylori
- Неправильное или нерегулярное питание (употребление острой, горячей и грубой пищи, еда всухомятку)
- Злоупотребление алкоголем
- Длительный прием ряда лекарств (антибиотиков, гормонов и т.д.)
- Кишечные инфекции
- Заболевания печени, желчного пузыря, поджелудочной железы
- Хронические инфекции в полости рта и глотке
- Курение
- Стрессы
Панкреатит – воспаление поджелудочной железы, проявляющееся болями в верхней половине живота, повышением уровня ферментов в крови и моче, нарушением переваривания пищи. При остром панкреатите клинические и гистологические изменения в ткани железы полностью проходят после прекращения действия этиологического фактора. Напротив, при хроническом панкреатите, даже после прекращения действия этиологического фактора, данные изменения сохраняются. При панкреатите выделение пищеварительных соков нарушено, что приводит к нарушению пищеварения, когда пищеварительные соки воздействуют не на пищу, а на ткань поджелудочной железы. Это приводит к воспалению, которое без соответствующего лечения способствует замещению нормальной ткани на рубцовую.
Поджелудочная железа выполняет две основные функции: 1. Выработка ферментов, которые необходимы для переваривания пищи 2. Выработка инсулина, из-за нехватки кото-рого может развиться сахарный диабет.
Возникновению заболеванию способствуют ряд факторов:
- злоупотребление алкоголем (алкоголизм)
- заболевания желчного пузыря (желчекаменная болезнь, холецистит)
- заболевания двенадцатиперстной кишки
- инфекции (вирусные гепатиты В, С , эпидемический паротит и др)
- нарушение обмена веществ
- нарушения гормонального фона
- сосудистые заболевания
- заболевания щитовидной железы
- прием некоторых лекарств
- операционные травмы
Холецистит — воспалительное заболевание желчного пузыря, вызванное попаданием в орган бактерий, вирусов или имеющее паразитарную природу. Холецистит считается одним из самых распространенных заболеваний органов пищеварения, которым чаще страдают женщины. Как правило, заболевание развивается на фоне желчнокаменной болезни.
К предрасполагающим факторам относятся:
- заболевания органов желудочно-кишечного тракта
- наличие паразитов (лямблии, аскариды)
- травмы желчного пузыря и печени
- наличие очагов хронической инфекции
- нарушения иммунного статуса
- частые запоры
- нерегулярное питание
- частые переедания
- малоподвижный образ жизни
- беременность
Желчнокаменная болезнь – заболевание, при котором происходит образование кон-крементов в желчном пузыре и которое проявляется в виде желчной колики. Желчнокаменную болезнь следует отличать от камненосительства (наличие желчных конкрементов в пузыре не сопровождается клиническими симптомами). Как правило, в таких случаях наличие камней выявляется случайно при ультразвуковом исследовании или во время операции по другому поводу.
К факторам, которые способствуют возникновению и развитию болезни, относятся:
- возраст
- генетическая предрасположенность
- заболевания подвздошной кишки
- прием ряда препаратов (эстрогенов, фибратов и т.д.)
- чрезмерное употребление жирной пищи с высоким содержанием холестерина, мучных изделий, сахара
- голодание
- ожирение
- беременность
В большинстве случаев наличие конкрементов в желчном пузыре не вызывает ника-ких неприятных ощущений у пациентов, они относятся к группе камненосителей. Но у неко-торых больных заболевание проявляется в виде желчной колики.
Пациенты также жалуются на:
- вздутие живота
- боль в правом подреберье
- тошноту
- непереносимость жирной пищи
- горечь во рту
Желчная колика — это острый приступ боли, вызванный переходящей обструкцией конкремента пузырного протока. Колика может продолжаться от 15 мин до 5—б часов. Боль локализуется в эпигастральной области и иррадиирует в правое плечо, межлопаточную область. Если приступ продолжается более 6 часов, то причиной тому может быть острый холецистит.
Для диагностики заболевания важную роль играет обследование пациента во время приступа боли.
При этом наблюдается:
- усиление боли при пальпации
- перкуссии живота в области правого подреберья
- симптом мышечной защиты
Лечение желчнокаменной болезни заключается в:
- облегчении состояния больного при желчной колики
- удалении камней в случае рецидивирующих желчных колик
Для профилактики заболевания следует придерживаться диеты, нормализовать массу тела, избегать длительных периодов голодания и т.д. В случае, если колики повторяются, необходимо хирургическое вмешательство.
Дисбактериоз. Полноценное переваривание пищи проходит при участии микроорганизмов, живущих в кишечнике. При дисбактериозе изменяется состав микроорганизмов, населяющих кишечник (полезных бактерий становится меньше, а вредных больше), что приводит к нарушению работы желудочно-кишечного тракта. Дисбактериоз не развивается у здоровых людей, это своеобразный сигнал о неблагополучии в организме. Для подтверждения диагноза необходим бактериологический анализ кала, возможно, потребуются дополнительные методы лечения.
Основные причины развития болезни:
- наличие инфекции в органах желудочно-кишечного тракта
- заражение патогенными микробами (сальмонеллами, стафилококками и т.д.), как результат потребления некачественной пищи
- наличие глистов (в некоторых случаях) однообразное, неполноценное питание
- злоупотребление алкоголем
- нарушение правил санитарии
- длительный прием ряда антибиотиков
Читайте также:


