Инфекционные очаги на мрт

Рассеянный склероз (РС) является воспалительным, аутоиммунным демиелинизирующим заболеванием нервной системы, в генезе которого отмечают наличие наследственных факторов, перенесенных инфекций и травм, иногда – гормональных нарушений, беременности, токсических воздействий. Течение заболевания прогрессирующее, с определенной непредсказуемостью, приводящее вначале к ограничению трудоспособности, а затем – к инвалидности [2, 4, 7].
По распространённости РС различают зоны высокого риска – более 50 случаев, среднего риска – от 10 до 50 случаев, низкого риска – менее 10 случаев на 100000 населения. За последнее время отмечен отчетливый рост распространённости PC в большинстве стран Европы и отдельных регионов России [1, 5]. Исследование, проведенное в Томске (М.А. Титова, 2012), позволило отнести Томскую область к зоне среднего риска по распространенности рассеянного склероза. В 2010 году распространенность составила 27,11 на 100 тыс. населения (стандартизованный на европейское население показатель 23,96 на 100 тыс.). При сравнении с распространенностью РС в Томской области в 1980 году (22,0 случая на 100 тыс. населения) автор отмечает прирост этого показателя в 1,2 раза. Основными факторами риска развития РС в изученной популяции являлись: рождение второго и последующих по счету детей в семье; контакт с нефтепродуктами, органическими растворителями, красками, ядохимикатами, кислотами и щелочами, металлами, бензином, радиацией после 15 лет; наличие в анамнезе инфекций – кори, тонзиллита, кариеса зубов; раннее проявление синусита и герпетической инфекции [1]. Увеличение числа новых случаев РС в большинстве стран – и в первую очередь в РФ – следует связать с улучшением качества диагностики после внедрения магнитно-резонансной томографии, что позволило выявлять его на ранних стадиях [2, 4, 5]. Причем с появлением МРТ появилась возможность не только ранней диагностики, но оценки эффективности проводимой терапии. Чувствительность метода настолько высока, что некоторые исследователи относят его к оптимальным методам диагностики [11].
Цель исследования – оценка изменений очагов повреждения и их динамика по данным МРТ на фоне проводимой терапии вышеперечисленными иммуномодуляторами.
Материалы и методы исследования
Обследовано 39 пациентов с достоверным диагнозом рассеянного склероза, в соответствии с критериями Ч. Позера и соавт. (C.M. Poser et. al. 1983), подтвержденными данными МРТ головного мозга. Для оценки тяжести неврологического дефицита использовалась расширенная шкала инвалидизации Куртцке (Expanded Disability Status Scale или EDSS) [13]. Пациенты первой группы в составе 24 человек получали лечение препаратом копаксон (ТЕВА, Израиль). Продолжительность лечения была различная: в течение одного года терапию получали все пациенты этой группы, два года лечения закончили только 10 человек. Лечение препаратом Ребиф (Сероно, Италия) проводилось у 15 человек в течение одного года. Средний возраст пациентов, принимающих копаксон, составил 32,45 ± 1,7 (от 17 до 49 лет), среди них 10 мужчин (40 %), 14 женщин (60 %). Средний балл по шкале Куртцке на начало лечения был 2,86 ± 1,14, Возраст больных, получавших ребиф, составил в среднем 33,28 ± 1,91 лет (от 16 до 47 лет), из них 7 мужчин (46,6 %) и 8 женщин (53,4 %), средний балл по шкале EDSS составил к началу терапии 3,71 ± 0,19. МРТ головного мозга проводилась в лаборатории НИИ кардиологии г. Томска и включала в себя получение аксиальных и сагиттальных срезов в режиме спин-эхо по Т1 и по Т2. Исследования выполнялись на низкопольном МР-томографе Magnetom-Open (Siemens Medical) с напряженностью магнитного поля 0,2 Т. По необходимости, с целью оценки обострения процесса использовалось контрастирование парамагнетиком в стандартных дозах (магневист, омнискан – 0,2 мл на кг\веса). У всех больных проводили подсчет количества очагов на Т2 взвешенных изображениях до лечения, через год и два года от начала лечения, с расчетом физического объема повреждения (ФОП) головного мозга на Т2 взвешенных изображениях. Эта величина рассчитывалась по сумме объемов всех выделенных зон повреждения мозга (областей усиленного Т2)
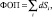
где d – толщина среза, а Si – площадь пораженного региона на срезе i.
Результаты исследования и их обсуждение
Данные анализа исследуемых МРТ-признаков в группе больных, получающих копаксон в течение двух лет, показали уменьшение количества Т2 гиперинтенсивных очагов. До лечения их было (в среднем) 9,3 ± 4,0, через два года их среднее количество равнялось 7,11 ± 3,4. Изменения ФОП ткани не достигали статистически значимых. При сравнении этих показателей до лечения и через год от начала лечения в группе больных, получающих Ребиф, была выявлена тенденция к уменьшению количества очагов и объема поражения белого вещества на Т2 взвешенных изображениях (таблица).
На рис. 1 представлена типичная картина формирования очагов при рассеянном склерозе и отражена их динамика через год после терапии ребифом.
Динамика МРТ-показателей при лечении ребифом
До лечения ребифом
Через год лечения ребифом
Количество очагов на Т2 изображении
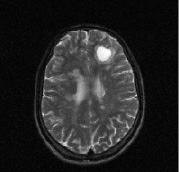
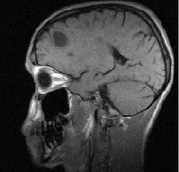
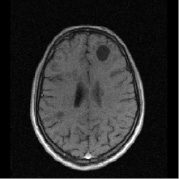
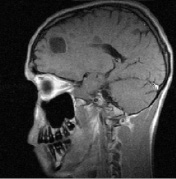
Рис. 1. Больной К., 19 лет, с диагнозом рассеянного склероза, исходные МР-томограммы до начала терапии ребифом: аксиальное Т2 (а), и сагиттальное Т1 (б) – сечение до контрастирования; в, г – после контрастирования омнисканом. На аксиальных Т2 и Т1 сечениях видны множественные очаги демиелинизации, один из которых с формированием полости с очерченной капсулой в лобной доле слева. Большинство очагов расположены перивентрикулярно, захватывают белое вещество, отмечается и прикортикальное их расположение. Вовлечены мозолистое тело, ножки мозга и мозжечка. На рис. в, г после введения парамагнетика контраст не выраженно, но всё же накапливается на отсроченных томограммах, что указывает на определенную степень активности процесса (б – до введения омнискана; в – на 7 минуте исследования; г – спустя 20 мин после введения). Более четкое включение контраста имеется в ножках мозга, по краю валика мозолистого тела
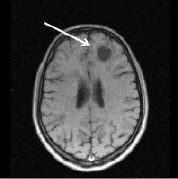
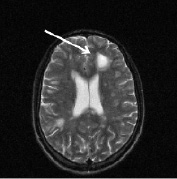
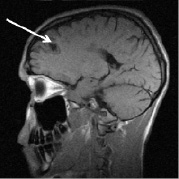
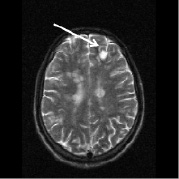
Рис. 2. Больной К., 19 лет. Три месяца (а, б) и шесть месяцев (в, г) спустя после назначения ребифа. Несмотря на то, что клинически отмечалось улучшение общего самочувствия больного, а на томограммах выявлялась положительная динамика в виде уменьшения диаметра и площади основного очага в левой лобной доле, определяется изменение интенсивности и миграция очагов перивентрикулярно у правого переднего рога бокового желудочка по сранению с исходной картиной (рис. 1, a). Такие изменения подтверждают факт сохранения активности процесса, его римиттирующего течения и оправдывают проведение дальнейшей терапии (стрелкой отмечен основной очаг и его динамика)
В наших наблюдениях более 90 % очагов выявлялись перивентрикулярно, в мозолистом теле и в белом веществе. Изменения, характерные для рассеянного склероза, в половине случаев определялись в ножках мозжечка и самом мозжечке. Стволовые структуры – ножки мозга, мост, продолговатый мозг до уровня краниовертебрального перехода повреждались реже – примерно в трети случаев.
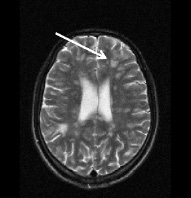
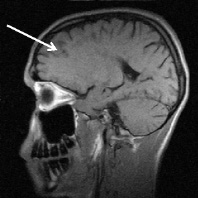
Рис. 3. Тот же больной К.: a – аксиальное Т2; б – сагиттальное Т1 сечения, спустя год от начала терапии. Выраженная положительная динамика по сравнению с исходными очагами (рис. 2) и последующими (через 3 и шесть месяцев) томограммами без контрастирования. В левой лобной доле остаточный очаг до 6 мм с исходом в глиоз с разряжением в центре. Сохраняются более мелкие перивентрикулярные очаги и очаги прикортикального расположения, лучше различимые в Т2 последовательности, для которых сохраняется определенная наклонность к миграции (очаг глиоза в левой лобной доле помечен стрелкой)
По современным представлениям, для подтверждения диагноза рассеянного склероза используются МРТ критерии, соотнесенные с возрастом. Для больных до 50 лет диагноз рассеянного склероза считается весьма вероятным при обнаружении у больного на Т2 взвешенных изображениях четырех или более очагов, или трех очагов, один из которых расположен перивентрикулярно (диаметр очагов не менее 3–5 мм). Для возрастной категории старше 50 лет вводятся два дополнительных критерия – диаметр очагов не менее 3–5 мм, при этом один или несколько очагов примыкают к стенке бокового желудочка и один или несколько очагов имеются в структурах головного мозга задней черепной ямки [2, 9].
В клинической практике нашли отражение и диагностические МРТ критерии рассеянного склероза по F.H. Fazekas – это наличие не менее трёх очагов, два из которых располагаются перивентрикулярно и их размер должен быть более 6 мм, или один очаг может располагаться субтенториально [2, 10, 14]. Для более детального описания рассеянного склероза используются критерии по F. Barkhof с соавт. [8], согласно которым очаги должны соответствовать 3 из 4 условий: первое – один очаг, накапливающий контраст, или 9 гиперинтенсивных очагов в Т2 режиме; второе – наличие как минимум одного субтенториального очага; третье – один или несколько очагов должны располагаться вблизи коры головного мозга; четвертое – должно быть не менее трёх перивентрикулярных очагов.
В целом эффективность лечения рассеянного склероза обычно оценивается по снижению частоты обострений и замедлению темпа наступления инвалидности. Однако обострения при рассеянном склерозе во многих случаях не очень часты, а при первично-прогрессирующем рассеянном склерозе их вовсе нет. Кроме того, как в определении обострений рассеянного склероза, так и в оценке степени нарастания инвалидности пациента есть определенная субъективность, по-разному определяемая врачом. С этих позиций оправдано проведение повторных МРТ исследований, в том числе и спинного мозга, при ухудшении состояния пациента и появлении новых жалоб с использованием парамагнетика.
Вместе с тем следует помнить, что при наличии клинического невыраженного обострения явного включения препарата в очаги может и не быть, особенно если не выдержаны соотношения дозы препарата и веса больного, т.е. случаи, когда контраст вводится в недостаточном объёме. Даже там, где тщательно соблюдена технология введения, очаги накапливают контраст не всегда. Так, у обследованных нами больных, отчетливое накопление контраста было только у 4-х пациентов. У 16-ти человек оно было сомнительным, не позволяющем утверждать о достоверном накоплении. Поэтому важно учитывать не только контрастирование, но и появление новых очагов повреждения, отсутствующих ранее, их размеры и миграцию, косвенно указывающих на обострение. С этой точки зрения, МРТ проведенное в динамике, как показано на рисунках выше, позволяет объективизировать результаты лечения, для чего бывает достаточной оценка всего двух параметров: числа новых очагов, выявленных в Т2 режиме и их общей площади, а также появления очагов, накапливающих контраст в Tl режиме.
Выводы
МРТ-исследования у больных, получающих иммуномодулирующую терапию копаксоном и ребифом, показали снижение распространенности процесса и уменьшение объема поражения белого вещества головного мозга, что вероятно связано с положительным терапевтическим эффектом этих препаратов. Проводимое контрастирование парамагнетиком может не давать указаний на обострение в течение основного заболевания и в то же время не исключает его наличия, если появляются новые очаги и их миграция. Магнитно-резонансная томография, проведенная в Т2 и Т1-IR и FLAIR последовательностях, может выступать в качестве контрольного метода на этапах терапии РС, позволяющего оценивать характер изменений в веществе головного мозга как исходно, так и на фоне проводимой терапии. В ряде случаев дополнительные сведения удается получить и при использовании PD-взвешенных последовательностей и спектроскопии, что больше характерно для высокопольных систем.
Демиелинизирующие заболевания ЦНС – это группа патологий, при которых происходит повреждение миелиновых оболочек трактов в головном и спинном мозге. В случае повреждения миелиновых оболочек, передача импульсов по трактам замедляется или вообще не происходит, приводя к развитию неврологической симптоматики. Дифференциальная диагностика демиелинизирующих заболеваний ЦНС крайне сложна, ввиду схожести клинической и радиологических картины, однако, поставить правильный диагноз важно для назначения соответствующей терапии. 
Этиология демиелинизирующих заболеваний до сих пор до конца не понятна, существует множество гипотез. С большей вероятностью демиелинизирующие заболевания имеют комбинированную этиологию, включающую в себя генетические факторы, автоиммунные реакции, инфекционных агентов и до сих пор не известные факторы. Ни одна из существующих гипотез не была убедительно доказана.
К группе демиелинизирующих заболеваний ЦНС принадлежат:
1) Рассеянный склероз (РС)
Это самая часто встречаемая патология среди демиелинизирующих заболеваний ЦНС; в мире приблизительно 2.1 миллиона человек больны рассеянным склерозом. Заболеваемость рассеянным склерозом лежит в границах от 2 до 150 больных на 10000 человек, в зависимости от региона.

Этиопатогенез
Считается что РС автоиммунное заболевание, которым страдают люди с генетической предрасположенностью, под действием внешних факторов. Повреждение образуется в результате того, что иммунная система организма атакует структуры собственной нервной системы. Обычно очаги повреждения локализованы в белом веществе головного мозга, перивентрикулярно, в стволе, базальных ганглиях и спинном мозге, а так же, не редко поражают зрительные нервы.

При РС поражены олигодендроциты – клетки, которые образуют миелин. Параллельно демиелинизирующему процессу, происходит воспалительная реакция, в которой участвуют Т лимфоциты, пересекая гематоэнцефалический барьер. Т лимфоциты атакуют миелин – это является триггером, запускающим воспалительную реакцию, в которую вступает множество цитокинов и антител. Доказано, что параллельно с Т лимфоцитами, в патологической реакции участвуют Б лимфоцыты.
Диагностика
Диагностика болезни сравнительно затруднительна ввиду того, что симптоматика похожа на другие заболевания. Разработаны диагностические критерии (McDonald criteria), которые были пересмотрены в 2010 году. Критерии основаны на клинической картине, лабораторных и радиологических данных.
Радиологические критерии заболевания, основаны на распространении процесса в пространстве и динамике, следовательно, в один момент диагноз установить не всегда возможно, иногда даже приходится проводить повторные МРТ. В пунктате спинномозговой жидкости можно обнаружить олигоклональные антитела (IgG) которые указывают на хронический воспалительный процесс. У 85% пациентов с РС в крови находят олигоклональные антитела.

Клиническая картина
Симптоматика при РС зависит от локализации очагов повреждения в ЦНС. Классическими симптомами считается межъядерная офтальмоплегия, симптом Лермитта, нарушения чувствительности проводникового типа, пирамидальная симптоматика, нейрогенный мочевой пузырь, оптический нейрит. Появление симптомов не прогнозируемо и в основном колеблется в диапазоне от 24 часов и более. Обычно симптоматика редуцируется медленно, ремиссии могут быть не полными. Любая инфекция, может спровоцировать псевдорецидив.
Существует клиническая классификация течения рассеянного склероза. Основываясь на нее, назначают лечение.
РС подразделяют на:
- рецидивирующее ремитирующее течение – обострения с полной/частичной ремиссией, между обострениями стабильное течение (50% в течении 10 лет переходят в вторично прогрессирующую форму);
- Вторично прогрессирующее течение – вначале рецидивирующее ремитирующее течение, за которой следует стабильно прогрессирующее ухудшение симптоматики, на фоне, или без обострений;
- Первично прогрессирующее течение – до 15% пациентов, без ремиссий, начиная с первого симптома;
Лечение
РС не является излечимым заболеванием.
Различают лечение острых эпизодов, иммуномодулирующую терапию, симптоматическое лечение и реабилитацию.
Лечение направленно на уменьшение воспалительного и демиелинизрующего процессов, на отдаление следующего рецидива и замедления прогрессирования инвалидности.
Для лечения обострений используют метилпреднизолон 1000мг / 3-5 дневным курсом в зависимости от тяжести обострения. В некоторых случаях, когда метилпреднизолон не даёт терапевтического эффекта, применяется плазмаферез.
В целях иммуномодулирующей терапии применяются медикаменты, которые снижают частоту рецидивов в случае рецидивирующе ремитирующего течения заболевания. К этой группе медикаментов пренадлежат: Interferon beta 1a (Avonex, Rebif); Interferon beta 1b (Betaferon, Extavia); glatiramer acetate (Copaxone); В целях иммуносупресивной терапии применяются: Natalizumab (Tysabri); Mitoxantrone.
Существую определённые критерии, соответствуя которым, по решению консилиума пациент может получить оплаченное государством медикаментозное лечение.
Как и у всех других, у этих медикаментов есть свои побочные эффекты, из-за которых пациент может отказаться принимать их.
Лечение РС – это командная работа, в которой следует принимать участие неврологу, нейрорадиологу, нейроофтальмологу и реабилитологу.
2) Оптиконевромиелит Девика
Оптиконевромиелит Девика(NMO от англ. neuromyelitis optica) обычно выражается клинически, монофазной воспалительной демиелинизацией ЦНС, которая в основном поражает зрительные нервы (ON англ. optic neuritis) и спинной мозг(LETM англ. longitudinally extensive transverse myelitis – Продольный трансверсальный миелит). Болезнь более распространена среди азиатов и женщин.

Патогенез
Аквапорин 4 (AQP4)– это трансмембранальный белок, который регулирует приток и отток воды из клеток ЦНС. AQP4экспрессируется в головном и спинном мозге, оптических нервах на мембранах астроцитов. Самая высокая плотность AQP4 обнаружена в гипоталамусе, перивентрикулярно вблизи 3 и 4 желудочка мозга, гиппокампе и мозжечке.
В ЦНС есть регионы, где взаимодействие между астроцитами и эндотелием не такое плотное и проницаемость гематоэнцефалического барьера (ГЭБ) выше. Диск зрительного нерва как раз является регионом с высокой проницаемостью ГЭБ, что доказано с помощью имунгистохимической окраски.Есть наблюдения, что ON и LETM могут развиться одновременно, однако чаще LETM присоединяется во время диссеминации болезни, а на ранних стадиях у пациентов клиника ON. Диссеминация с развитием LETM обычно происходит через несколько недель или месяцев с начала заболевания.
Диагностические критерии
Оптический неврит и миелит + 2 из 3:
- AQP4 + Av
- LEMT (длиной от и больше 3 позвонков)
- Изменения головного мозга на МРТ, которые не попадают под критерии РС
Болезни спектра оптиконевромиелита(ОНМ):
- NMO ограниченные формы – идиопатические рекуррентные продольные LEMT длиной от и больше 3 позвонков + AQP4 + Av;
- Азиатский оптикоспинальный вариант РС;
- ON или LEMT ассоциированный с системным автоиммунным заболеванием;
- ON или LEMT связанные с повреждениями головного мозга характерными для NMO (локализованные в гипоталамусе, перивентрикулярно, в стволе мозга);
Диагностика
Для диагностики NMO необходимы МРТ, консультация нейроофтальмолога и лабораторные анализы.

На ранних стадиях, обследование МРТ не выявляет никаких изменений или можно наблюдать не специфические поражения белого вещества, которые не соответствуют критериям РС. Повреждения обычно наблюдаются в областях мозга с высокой AQP4 экспрессией – в гипоталамусе, вблизи 3 или 4 желудочка мозга. Исключением является повреждение белого вещества в зоне ствола мозга, которое может быть изолированным или как распространение миелита с шейной части спинного мозга. Повреждение спинного мозга может быть размеров от 3 и больше сегментов шейных позвонков.
Офтальмоскопически диагностицируется атрофия зрительного нерва.
Данные лабораторной диагностики: AQP4 в сыворотке крови (70-75% чувствительность, 85-99% специфичность). Значения титров антител до сих пор не выяснено, ведутся исследования. Анализы спинномозговой жидкости выявляю плеоцитоз, у 30% могут быть позитивные олигоклональные антитела.

Лечение
I Острый период
1) Стероиды (первый эпизод или рецидив)
- Метилпреднизолон 1г i/v 3-5 дней, далее p/o, постепенно снижая дозу
- Перед началом процедуры обмена плазмы, следует рассмотреть повторный курс стероидов в высокой дозе, если на фоне происходят рецидивы.
2) Плазмаферез – если терапия стероидами не эффективна
- Всего, 7 сеансов, каждый второй день как при РС, исследований этого терапевтического режима для NMO не проводилось.
3) Интравенозный иммуноглобулин (IVIG)
- Исследований изучавших применение IVIG для лечения ON/LETM рецидивов при NMO или заболеваниях NMO спектра не проводилось
II Профилактика рецидивов
Препараты первой линии:
Препараты второй линии:
- Циклофосфамид и/в 7-25 мг/кг раз в месяц, полгода; особенно если NMO ассоциирован с SLE/SS;
- Митоксантрон и/в 12 мг/м 2 раз в месяц, полгода, затем 12 мг/м2 каждые 3 месяца, 9 месяцев;
- Микофенолята Мофеитил п/о 1-3 г каждый день;
- IVIG,Метотрексат;
- Интермитирующие плазмаферезы.
3) Острый диссеминированный энцефаломиелит
Острый диссеминированный энцефаломиелит (ADEM от англ. Acute disseminated encephalomyelitis)развивается после перенесённой инфекции или вакцинации. У болезни монофазное течение, но у 25% могут быть рецидивы. Заболеваемость составляет 0.4-0.8 больных на 100000, смертность до 5%, полная ремиссия происходит у 50-70%. Для болезни характерны сезонные пики заболеваемости зимой и весной.

Патология
Патогенетические механизмы этого демиелинизирующего заболевания до конца не изучены, не смотра на большое количество иммунологических сдвигов констатированных в процессе изучения болезни. Изучение болезни, в основном, опирается на наблюдения экспериментальных моделей болезни. При ADEM образуется обширное воспаление белого и серого вещества мозга, перивенозной локализации со сливающимися очагами демиелинизации. Инфильтрат состоит из макрофагов/моноцитов и лимфоцитов. В последних исследованиях обнаружено, что перивенозная демиелинизация связанна с активацией микроглии коры без потери миелина. Макроскопически наблюдается отёк мозга, а микроскопически – гиперэмия, отёк эндотелия, инфильтрация стенки сосудов и периваскулярный отёк.
В отличии от РС, в патогенез ADEM вовлечены про и антивоспалительные цитокины и гемокины: IL-1beta, 2, 4, 5, 8, 10; TNF-alfa, IFN-gamma.

Клиническая картина
В анамнезе перенесённая в последние дни-недели инфекция или эпизод с повишенной температурой; или вакцинация. Нейрологическая симптоматика нарастает быстро, в течении 2-30 дней после инфекции или вакцинации, но полностью не доказана роль инфекции или вакцинации как триггера заболевания.
Клинически, наблюдаются общие симптомы: высокая температура, цефалгия, менингизм, которые появляются перед началом очаговой ЦНС симптоматики. Классические ADEM симптомы – это энцефалопатия, судорожный синдром, двусторонний оптический нейрит и симптоматика в зависимости от локализации очагов поражения в ЦНС.
Диагностика
В спинномозговой жидкости классически выявляется плеоцитоз (100/3), олигоклональные антитела негативны, высокая концентрациябазового миелинового протеина (MBP).
На МРТ визуализируются обширные очаги поражения белого вещества головного и спинного мозга. Классически повреждения локализованы субкортикально и в центральной части белого вещества. Есть свидетельства о локализации повреждений так же, в сером веществе коры головного мозга и базальных ганглиях при ADEM.
Лечение
Стероиды: Метилпреднизолон 20 мг/кг/день 3-5 дней, иногда продолжая Преднизолон п/о, постепенно снижая дозу, в течении 4-6 недель.
IVIG: альтернативный метод лечения, дозировка 0.4-2 г/кг и/в2-3 дня.
Плазмаферез: используется как последнее средстро для лечения ADEM, когда пациент не реагирует на метилпреднизолон в высоких дозах. Плазмаферез улучшает клинику, но нет доказательств, того, что применение этого метода на ранних стадиях эффективно.
Дата публикации: 21 ноября 2018 .
Врач МРТ
Воронцова Жанна Ватиславовна
Дифференциально-диагностический ряд заболеваний белого вещества является очень длинным. Выявленные с помощью МРТ очаги могут отражать нормальные возрастные изменения, но большинство очагов в белом веществе возникают в течение жизни и в результате гипоксии и ишемии.
ПРИ КАКИХ БОЛЕЗНЯХ ВОЗНИКАЮТ ОЧАГИ
В БЕЛОМ ВЕЩЕСТВЕ?
Очаговые изменения сосудистого генеза
- Атеросклероз
- Гипергомоцистеинемия
- Амилоидная ангиопатия
- Диабетическая микроангиопатия
- Гипертония
- Мигрень
Воспалительные заболевания
- Рассеянный склероз
- Васкулиты: системная красная волчанка, болезнь Бехчета, болезнь Шегрена
- Саркоидоз
- Воспалительные заболевания кишечника (болезнь Крона, язвенный колит, целиакия)
Заболевания инфекционной природы
- ВИЧ, сифилис, боррелиоз (болезнь Лайма)
- Прогрессирующая мультифокальная лейконцефалопатия
- Острый рассеянный (диссеминированный) энцефаломиелит (ОДЭМ)
Интоксикации и метаболические расстройства
- Отравление угарным газом, дефицит витамина B12
- Центральный понтинный миелинолиз
Травматические процессы
- Связанные с лучевой терапией
- Постконтузионные очаги
Врожденные заболевания
- Обусловленные нарушением метаболизма (имеют симметричный характер, требуют дифференциальной диагностики с токсическими энцефалопатиями)
Могут наблюдаться в норме
- Перивентрикулярный лейкоареоз, 1 степень по шкале Fazekas
МРТ ГОЛОВНОГО МОЗГА: МНОЖЕСТВЕННЫЕ ОЧАГОВЫЕ ИЗМЕНЕНИЯ
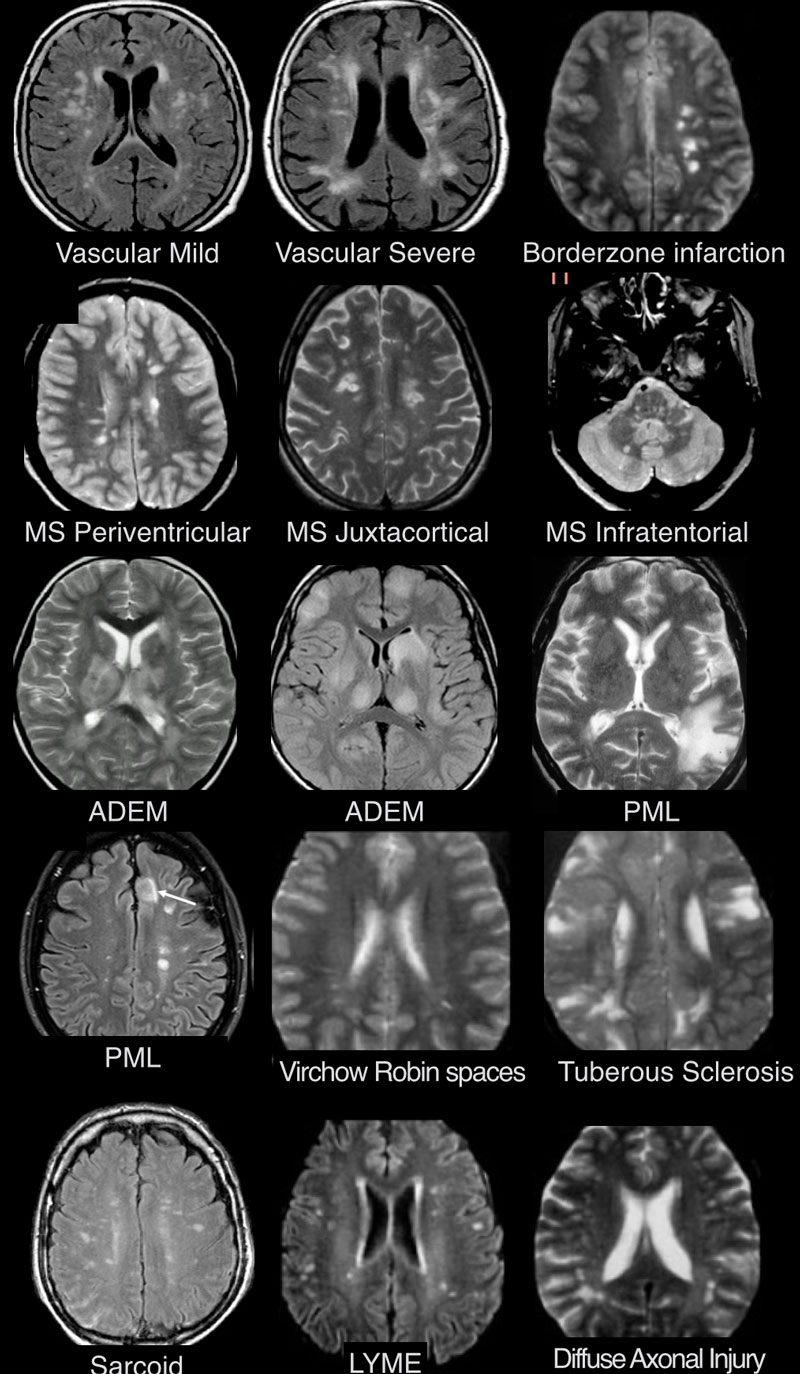
Острые нарушения мозгового кровообращения:
- Главное отличие инфарктов (инсультов) этого типа — это предрасположенность к локализации очагов только в одном полушарии на границе крупных бассейнов кровоснабжения. На МР-томограмме представлен инфаркт в бассейне глубоких ветвей.
Острый диссеминированный энцефаломиелит (ОДЭМ)
- Основное отличие: появление мультифокальных участков в белом веществе и в области базальных ганглиев через 10-14 дней после перенесенной инфекции или вакцинации. Как при рассеянном склерозе, при ОДЭМ может поражаться спинной мозг, дугообразные волокна и мозолистое тело; в некоторых случаях очаги могут накапливать контраст. Отличием от РС считается тот момент, что они имеют большой размер и возникают преимущественно у молодых пациентов. Заболевание отличается монофазным течением
- Характеризуется наличием мелких очажков размером 2-3 мм, имитирующих таковые при РС, у пациента с кожной сыпью и гриппоподобным синдромом. Другими особенностями являются гиперинтенсивный сигнал от спинного мозга и контрастное усиление в области корневой зоны седьмой пары черепно-мозговых нервов.
Саркоидоз головного мозга
- Распределение очаговых изменений при саркоидозе крайне напоминает таковое при рассеянном склерозе.
Прогрессирующая мультфокальная лейкоэнцефалопатия (ПМЛ)
- Демиелинизирующее заболевание, обусловленное вирусом Джона Каннигема у пациентов с иммунодефицитом. Ключевым признаком являются поражения белого вещества в области дугообразных волокон, не усиливающиеся при контрастировании, оказывающие объемное воздействие (в отличие от поражений, обусловленных ВИЧ или цитомегаловирусом). Патологические участки при ПМЛ могут быть односторонними, но чаще они возникают с обеих сторон и являются асимметричными.
- Ключевой признак: гиперинтенсивный сигнал на Т2 ВИ и гипоинтенсивный на FLAIR
- Для зон сосудистого характера типична глубокая локализация в белом веществе, отсутствие вовлечения мозолистого тела, а также юкставентрикулярных и юкстакортикальных участков.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА МНОЖЕСТВЕННЫХ ОЧАГОВ, УСИЛИВАЮЩИХСЯ ПРИ КОНТРАСТИРОВАНИИ
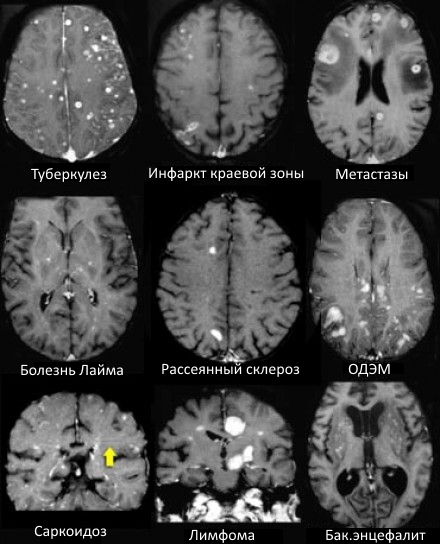
На МР-томограммах продемонстрированы множественные патологические зоны, накапливающие контрастное веществ (некоторые из них описаны далее подробнее).
- Большинство васкулитов характеризуются возникновением точечных очаговых изменений, усиливающихся при контрастировании. Поражение сосудов головного мозга наблюдается при системной красной волчанке, паранеопластическом лимбическом энцефалите, б. Бехчета, сифилисе, гранулематозе Вегенера, б. Шегрена, а также при первичных ангиитах ЦНС.
- Характеризуются выраженным перифокальным отеком.
Острые нарушения мозгового кровобращения
- Периферические инфаркты краевой зоны могут усиливаться при контрастировании на ранней стадии.
ПЕРИВАСКУЛЯРНЫЕ ПРОСТРАНСТВА ВИРХОВА-РОБИНА
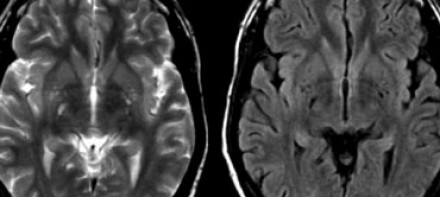
Слева на Т2-взвешенной томограмме видны множественные очаги высокой интенсивности в области базальных ганглиев. Справа в режиме FLAIR сигнал от них подавляется, и они выглядят темными. На всех остальных последовательностях они характеризуются такими же характеристиками сигнала, как ликвор (в частности, гипоинтенсивным сигналом на Т1 ВИ). Такая интенсивность сигнала в сочетании с локализацией описанного процесса являются типичными признаками пространств Вирхова-Робина (они же криблюры).
Пространства Вирхова-Робина окружают пенетрирующие лептоменингеальные сосуды, содержат ликвор. Их типичной локализацией считается область базальных ганглиев, характерно также расположение вблизи передней комиссуры и в центре мозгового ствола. На МРТ сигнал от пространств Вирхова-Робина на всех последовательностях аналогичен сигналу от ликвора. В режиме FLAIR и на томограммах, взвешенных по протонной плотности, они дают гипоинтенсивный сигнал в отличие от очагов иного характера. Пространства Вирхова-Робина имеют небольшие размеры, за исключением передней комиссуры, где периваскулярные пространства могут быть больше.
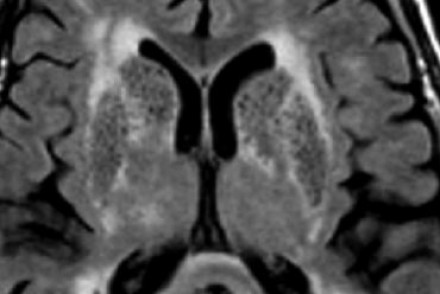
Пространства Вирхова-Робина увеличиваются с возрастом, а также при гипертонической болезни в результате атрофического процесса в окружающей ткани мозга.
НОРМАЛЬНЫЕ ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ
БЕЛОГО ВЕЩЕСТВА НА МРТ
К ожидаемым возрастным изменениям относятся:
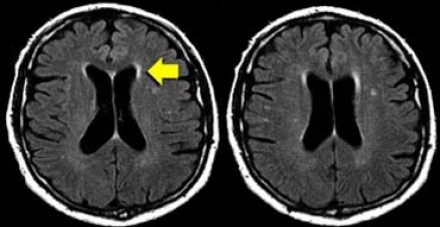
Клиническое значение возрастных изменений мозга недостаточно хорошо освещено. Тем не менее, имеется связь между очагами и некоторыми факторами риска возникновения цереброваскулярных расстройств. Одним из самых значительных факторов риска является гипертония, особенно, у пожилых людей.
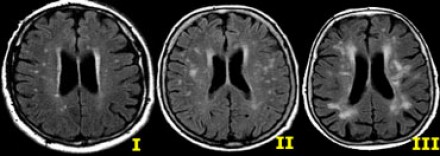
Степень вовлечения белого вещества в соответствии со шкалой Fazekas:
- Легкая степень – точечные участки, Fazekas 1
- Средняя степень – сливные участки, Fazekas 2 (изменения со стороны глубокого белого вещества могут расцениваться как возрастная норма)
- Тяжелая степень – выраженные сливные участки, Fazekas 3 (всегда являются патологическими)
ДИСЦИРКУЛЯТОРНАЯ ЭНЦЕФАЛОПАТИЯ НА МРТ
Очаговые изменения белого вещества сосудистого генеза — самая частая МРТ-находка у пациентов пожилого возраста. Они возникают в связи с нарушениями циркуляции крови по мелким сосудам, что является причиной хронических гипоксических/дистрофических процессов в мозговой ткани.
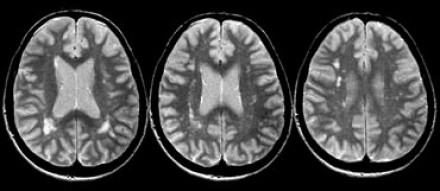
На серии МР-томограмм: множественные гиперинтенсивные участки в белом веществе головного мозга у пациента, страдающего гипертонической болезнью.
На МР-томограммах, представленных выше, визуализируются нарушения МР-сигнала в глубоких отделах больших полушарий. Важно отметить, что они не являются юкставентрикулярными, юкстакортикальными и не локализуются в области мозолистого тела. В отличие от рассеянного склероза, они не затрагивают желудочки мозга или кору. Учитывая, что вероятность развития гипоксически-ишемических поражений априори выше, можно сделать заключение о том, что представленные очаги, вероятнее, имеют сосудистое происхождение.
Только при наличии клинической симптоматики, непосредственно указывающей на воспалительное, инфекционное или иное заболевание, а также токсическую энцефалопатию, становится возможным рассматривать очаговые изменения белого вещества в связи с этими состояниями. Подозрение на рассеянный склероз у пациента с подобными нарушениями на МРТ, но без клинических признаков, признается необоснованным.
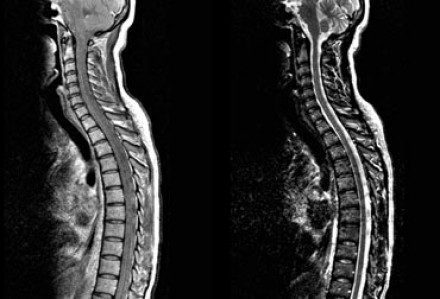
На представленных МР-томограммах патологических участков в спинном мозге не выявлено.
У пациентов, страдающих васкулитами или ишемическими заболеваниями, спинной мозг обычно не изменен, в то время как у пациентов с рассеянным склерозом в более чем 90% случаев обнаруживаются патологические нарушения в спинном мозге. Если дифференциальная диагностика очагов сосудистого характера и рассеянного склероза затруднительна, например, у пожилых пациентов с подозрением на РС, может быть полезна МРТ спинного мозга.
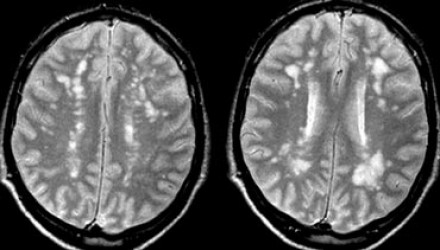
Вернемся снова к первому случаю: на МР-томограммах выявлены очаговые изменения, и сейчас они гораздо более очевидны. Имеет место распространенное вовлечение глубоких отделов полушарий, однако дугообразные волокна и мозолистое тело остаются интактными. Нарушения ишемического характера в белом веществе могут проявляться как лакунарные инфаркты, инфаркты пограничной зоны или диффузные гиперинтенсивные зоны в глубоком белом веществе.
Лакунарные инфаркты возникают в результате склероза артериол или мелких пенетерирующих медуллярных артерий. Инфаркты пограничной зоны возникают в результате атеросклероза более крупных сосудов, например, при каротидной обструкции или вследствие гипоперфузии.
Структурные нарушения артерий головного мозга по типу атеросклероза наблюдаются у 50% пациентов старше 50 лет. Они также могут обнаруживаться и у пациентов с нормальным артериальным давлением, однако более характерны для гипертоников.
САРКОИДОЗ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
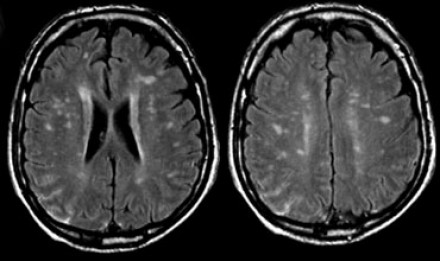
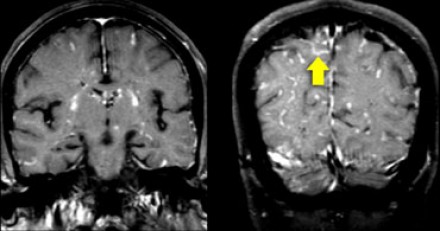
На Т1 взвешенных томограммах с контрастным усилением препаратами гадолиния, выполненных этому же пациенту, что и в предыдущем случае, визуализируются точечные участки накопления контраста в базальных ядрах. Подобные участки наблюдаются при саркоидозе, а также могут быть обнаружены при системной красной волчанке и других васкулитах. Типичным для саркоидоза в этом случае считается лептоменингеальное контрастное усиление (желтая стрелка), которое происходит в результате гранулематозного воспаления мягкой и паутинной оболочки.
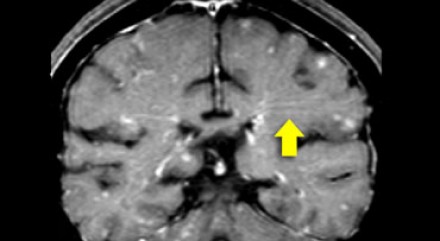
Еще одним типичным проявлением в этом же случае является линейное контрастное усиление (желтая стрелка). Оно возникает в результате воспаления вокруг пространств Вирхова-Робина, а также считается одной из форм лептоменингеального контрастного усиления. Таким образом объясняется, почему при саркоидозе патологические зоны имеют схожее распределение с рассеянным склерозом: в пространствах Вирхова-Робина проходят мелкие пенетрирующие вены, которые поражаются при РС.
БОЛЕЗНЬ ЛАЙМА (БОРРЕЛИОЗ)
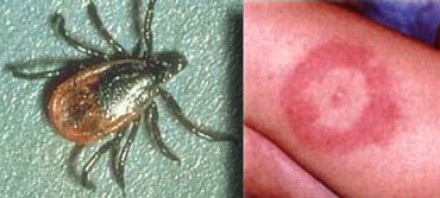
На фотографии справа: типичный вид сыпи на коже, возникающей при укусе клеща (слева) — переносчика спирохет.
Болезнь Лайма, или боррелиоз, вызывают спирохеты (Borrelia Burgdorferi), переносчиком инфекции являются клещи, заражение происходит трансмиссивным путем (при присасывании клеща). В первую очередь при боррелиозе на возникает кожная сыпь. Через несколько месяцев спирохеты могут инфицировать ЦНС, в результате чего появляются патологические участки в белом веществе, напоминающие таковые при рассеянном склерозе. Клинически болезнь Лайма проявляется острой симптоматикой со стороны ЦНС (в том числе, парезами и параличами), а в некоторых случаях может возникать поперечный миелит.
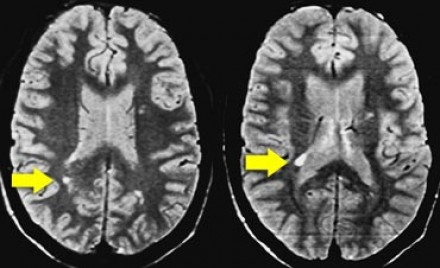
Ключевой признак болезни Лайма — это наличие мелких очажков размером 2-3 мм, симулирующих картину рассеянного склероза, у пациента с кожной сыпью и гриппоподобным синдромом. К другим признакам относится гиперинтенсивный сигнал от спинного мозга и контрастное усиление седьмой пары черепно-мозговых нервов (корневая входная зона).
ПРОГРЕССИРУЮЩАЯ МУЛЬТИФОКАЛЬНАЯ ЛЕЙКОЭНЦЕФАЛОПАТИЯ, ОБУСЛОВЛЕННАЯ ПРИЕМОМ НАТАЛИЗУМАБА
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) является демиелинизирующим заболеванием, обусловленным вирусом Джона Каннингема у пациентов с иммунодефицитом. Натализумаб представляет собой препарат моноклоанальных антител к интегрину альфа-4, одобренный для лечения рассеянного склероза , т. к. он оказывает положительный эффект клинически и при МРТ исследованиях.
Относительно редкий, но в то же время серьезный побочный эффект приема этого препарата — повышение риска развития ПМЛ. Диагноз ПМЛ основывается на клинических проявлениях, обнаружении ДНК вируса в ЦНС (в частности, в цереброспинальной жидкости), и на данных методов визуализации, в частности, МРТ.
По сравнению с пациентами, у которых ПМЛ обусловлен другими причинами, например, ВИЧ, изменения на МРТ при ПМЛ, связанной с приемом натализумаба, могут быть описаны как однородные и с наличием флюктуации.
Ключевые диагностические признаки при этой форме ПМЛ:
- Фокальные либо мультифокальные зоны в подкорковом белом веществе, расположенные супратенториально с вовлечением дугообразных волокон и серого вещества коры; менее часто поражается задняя черепная ямка и глубокое серое вещество
- Характеризуются гиперинтенсивным сигналом на Т2
- На Т1 участки могут быть гипо- или изоинтенсивными в зависимости от степени выраженности демиелинизации
- Примерно у 30% пациентов с ПМЛ очаговые изменения усиливаются при контрастировании. Высокая интенсивность сигнала на DWI, особенно по краю очагов, отражает активный инфекционный процесс и отек клеток
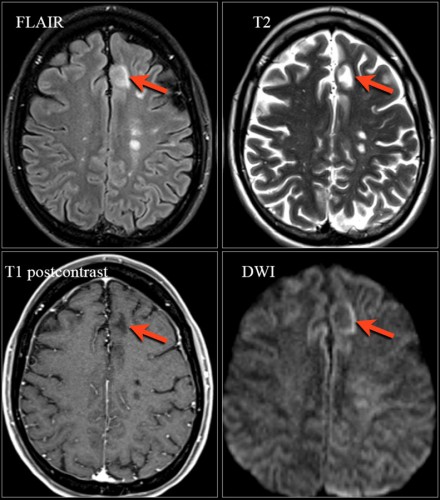
На МРТ видны признаки ПМЛ, обусловленной приемом натализумаба. Изображения любезно предоставлены Bénédicte Quivron, Ла-Лувьер, Бельгия.
Дифференциальная диагностика между прогрессирующим РС и ПМЛ, обусловленной приемом натализумаба, может быть достаточно сложной. Для натализумаб-ассоциированной ПМЛ характерны следующие нарушения:
- В выявлении изменений при ПМЛ наибольшей чувствительностью обладает FLAIR
- Т2-взвешенные последовательности позволяют визуализировать отдельные аспекты поражений при ПМЛ, например, микрокисты
- Т1 ВИ с контрастом и без него полезны для определения степени демиелинизации и обнаружения признаков воспаления
- DWI: для определения активной инфекции
Дифференциальная диагностика РС и ПМЛ
Читайте также:


