Инфекционное осложнение при эндопротезировании

Увеличение средней продолжительности жизни, несомненно, положительная тенденция настоящего времени, но обратной стороной медали является не всегда высокое качество жизни, особенно в старшем возрасте. Одним из факторов, снижающих это качество, всё чаще становятся заболевания суставов. Боль и ограничение способности к движению при этих заболеваниях со временем значительно осложняют жизнь пациентам. Наиболее эффективным способом лечения в этих случаях считается хирургическое вмешательство. Для лечения пациентов с тяжелыми посттравматическими осложнениями и дегенеративными заболеваниями суставов оптимальным методом считается эндопротезирование. Однако, несмотря на то что после тотального эндопротезирования коленного сустава наблюдается значительное улучшение состояния пациента, существует риск осложнения в виде парапротезной инфекции, при котором увеличиваются сроки и стоимость лечения. Кроме того, инфекционное осложнение может привести к неблагоприятному исходу хирургического лечения. Согласно исследованиям, проведенным в ряде разных центров, после тотального эндопротезирования коленного сустава инфицирование происходило в 0,5-5% случаев 3.
I. Uçkay с соавт. выполнили ретроспективный анализ 6101 случая реэндопротезирования крупных суставов с 1996 по 2008 г. Из них 2099 случаев – после эндопротезирования коленного сустава. Всего было удалено 234 (11,15%) протеза коленного сустава, из них по поводу инфекции удалено 24 (1,14%) протеза. Полученные результаты позволили авторам сделать вывод, что парапротезная инфекция – редкое осложнение [4; 5].
Внедрение эндопротезирования в клиническую практику в России происходило постепенно, и первоначальные результаты не внушали оптимизма. По данным H.Н. Корнилова с соавт., частота инфекционных осложнений в некоторых лечебных учреждениях, где выполнялось лишь несколько эндопротезирований в год, достигала 17% [5; 6].
Волошин В.П. с соавт. проанализировали опыт лечения 66 пациентов с тотальным эндопротезированием крупных суставов. В 87,9% случаев (58 пациентов), в сроки от 1,5 до 3 лет после эндопротезирования, отмечалось развитие гнойной инфекции. Глубокое нагноение отмечено у 6 пациентов (9,1%). В итоге 10 пациентам было выполнено артродезирование коленного сустава аппаратом Илизарова [5; 7].
Т.А. Куляба с соавторами проанализировали результаты лечения 44 пациентов, у которых после первичного и ревизионного эндопротезирования коленного сустава развилось инфекционное воспаление. Происходило это в разные сроки, у 18 пациентов (40,1%) в раннем послеоперационном периоде, а у 26 (59,1%) в отдаленном, но так или иначе, купировать воспаление и сохранить эндопротез удалось только у 10 (22,7%) больных. В подавляющем большинстве случаев потребовалось провести двухэтапное хирургическое лечение, которое позволило купировать гнойный процесс в 89,3% случаев. Артродез был выполнен у 4 (9,1%) больных [5; 8].
Инфицирование может происходить через прямую или гематогенную передачу бактериальной флоры. Некоторыми примерами прямой передачи являются: несоблюдение условий стерильности в операционных, передача от инфицированного пациента, небрежность хирургов и обслуживающего персонала. Гематогенное инфицирование наблюдается после эпизода бактериемии. Например, стрептококковая инфекция может развиться после стоматологического вмешательства, стафилококковая – как следствие кожного инфекционного заболевания, энтерококковая и анаэробные инфекции – в результате желудочно-кишечных инфекционных заболеваний и инфекций мочеполовой системы [9].
Отек, боль и дисфункция коленного сустава возникают после эндопротезирования коленного сустава и усиливаются по мере прогрессирования инфекции. На фоне инфекции происходит перипротезный остеолиз, приводящий к нестабильности эндопротеза. У пациентов, не получающих своевременного лечения, может развиться сепсис и опасный для жизни септический шок [10].
На основе метаанализа, проведенного Cancienne J.M. с соавт., описаны исходы лечения 18 533 пациентов с ранними инфекционными осложнениями (в течение 1 года) после тотального эндопротезирования коленного сустава [11]. Среди них:
- 691 пациент (3,7%) умер в стационаре;
- 574 пациентам (3,1%) потребовалась ампутация конечности;
- 852 пациента (4,5%) перенесли артродез коленного сустава;
- 2683 пациентам (14,5%) проведена вторичная хирургическая обработка, без реимплантации;
- 13743 (74,1%) пациента прошли через двухэтапное реэндопротезирование коленного сустава, из них 11420 пациентам (61,6%) в течение 1 года проведено удаление спейсера и реимплантация, а 2323 пациентам (12,5%) оставлен спейсер.
Nodzo S.R. и соавторы, при проведении двухэтапного реэндопротезирования, разделили пациентов на три группы в зависимости от типа используемого спейсера [12]. В первой группе использовались преформованные артикулирующие спейсеры, во второй – спейсеры из цемента изготавливались интраоперационно. В третьей группе – в качестве спейсера использовали автоклавированный бедренный компонент удаленного эндопротеза. Признаки санации инфекционного процесса отметили в первой группе пациентов в 82,7% случаях, во второй группе – в 88,4%. Наименьшее количество положительных результатов отмечено в третьей группе – 79,4%. Таким образом, использование цементных спейсеров, изготовленных интраоперационно с использованием антибиотика по чувствительности флоры, приносит максимально положительный результат.
Цель исследования: провести анализ частоты, структуры и причин возникновения инфекционных осложнений при тотальном эндопротезировании и реэндопротезировании коленного сустава и определить оптимальную тактику лечения при этих осложнениях.
Материал и методы. В Новосибирском НИИТО за период с 2007 по 2016 год было проведено 12 245 операций первичного эндопротезирования коленного сустава. Инфекционные осложнения возникли у 470 (3,84%) человек. При этом эпифасциальная (поверхностная) инфекция была зафиксирована у 252 (2,06%) пациентов. В эту группу включены пациенты с некрозом послеоперационного шва и подкожной клетчатки, лигатурными свищами. В случае распространения процесса в пределах 5-6 см по ходу операционного шва, пациентам проводилась одномоментная санация и ушивание кожного дефекта. В случаях распространения процесса на весь шов, пациентам проводились этапные санационные перевязки до очищения стенок раны с последующим вторичным швом раны. Как результат применения такой методики лечения, у всех пациентов отмечался положительный результат.
Группу пациентов с субфасциальной (глубокой) инфекцией, развившейся в разные сроки, составили 218 пациентов (1,8%), что соответствует мировым тенденциям. По нашим убеждениям, в случае глубокой парапротезной инфекции, на фоне сформированной биопленки, эндопротез сохранять бесполезно, и он подлежит удалению. Однако дальнейшая тактика зависит от патологической флоры и других факторов. После удаления выполняется либо одномоментная имплантация нового эндопротеза, либо проведение этапного лечения с целью санации и последующего реэндопротезирования. В случае невозможности выполнения последующего этапа реэндопротезирования, в рассматриваемых случаях выполнялся артродез коленного сустава.
Бактериальное исследование пациентов с глубокой парапротезной инфекцией дало следующие результаты:
· у 172 (78,9%) пациентов была выделена грамположительная кокковая флора: у 113 пациентов – MSSA, у 33 – MSSE, у 8 пациентов – MRSA, и у 18 пациентов – MRSE;
· грамотрицательные палочки (Klebsiella, Pseudomonas, E.coli) были выделены у 33 пациентов (15,1%);
· грамположительные палочки (Korinebacterium, Propionobacter) – у 2 пациентов (0,9%);
· у 11 пациентов (5,0%) была выявлена смешанная флора.
При выборе тактики хирургического лечения больных с глубокой парапротезной инфекцией анализировались сроки возникновения инфекции, степень стабильности компонентов эндопротеза и степень вирулентности возбудителя. Также немаловажную роль в выборе тактики оперативного лечения играли сопутствующая патология и желания самого пациента.
Одномоментное реэндопротезирование после удаления эндопротеза выполнялось пациентам без выраженной сопутствующей патологии, в раннем послеоперационном периоде (до 6 мес.), при отсутствии признаков нестабильности эндопротеза и в случае чувствительности флоры к возможному проведению антибиотикотерапии. В ходе данного вида оперативного лечения выполняли удаление эндопротеза, патологических грануляций мягких тканей и имплантировали новый эндопротез с добавлением в цемент антибактериальных препаратов, подобранных по чувствительности к флоре. В последующем проводили адресную антибиотикотерапию в течение 6 недель.
Этим способом были пролечены 28 пациентов. В 26 случаях инфекция была купирована. У двух пациентов наблюдался рецидив, потребовавший проведения двухэтапного ревизионного вмешательства. Таким образом, выживаемость имплантата составила 93%.
Клинический пример 1. Больная К., 62 года. Выполнено первичное эндопротезирование КС по поводу левостороннего гонартроза III ст.
Через 3 месяца после проведения оперативного лечения развилось осложнение в виде глубокой парапротезной инфекции. По результатам бактериологического исследования выявлен патогенный микроорганизм – MSSA. Больной выполнено удаление эндопротеза и одномоментное реэндопротезирование коленного сустава.
На контрольных осмотрах через 1 год, 3 и 5 лет признаков рецидива инфекции не было.
В зависимости от степени сохранности связочного аппарата устанавливался артикулирующий либо неартикулирующий спейсер с добавлением антибиотика по чувствительности бактериальной флоры. После первого этапа пациенты получали антибиотикотерапию в течение 6-8 недель. Второй этап лечения – удаление цементного спейсера и реэндопротезирование коленного сустава, проводился по истечении 3-8 месяцев при условии нормализации клинических анализов и отсутствии положительных бактериологических исследований пунктата синовиальной жидкости.
Клинический пример 2. Больная Г., 62 года. Первичное эндопротезирование коленного сустава было проведено по поводу гонартроза III ст. Через 3 года после проведенной операции перенесла рожистое воспаление голени, осложнившееся глубокой парапротезной инфекцией. По результатам бактериологического исследования был выявлен патогенный микроорганизм – MRSA. Больной было выполнено удаление эндопротеза, санация и имплантация цементного артикулирующего спейсера (рис. 1).
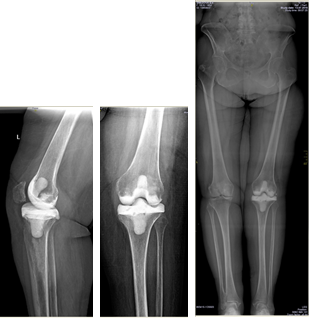
Рис. 1. Клинический пример 2. Рентгенограмма коленного сустава после
имплантации артикулирующего спейсера коленного сустава
Антибиотикотерапия поводилась в течение 6 недель. Через 6 месяцев, когда признаки инфекции были полностью купированы, больной выполнен второй этап оперативного лечения – удаление цементного спейсера и реэндопротезирование коленного сустава (рис. 2). На контрольных осмотрах через 1 и 3 года признаков рецидива инфекции не обнаружено.
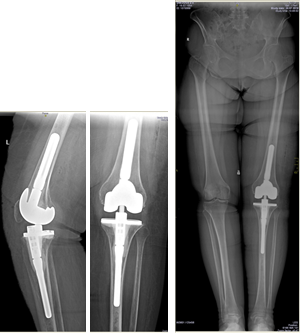
Рис. 2. Клинический пример 2. Рентгенограмма коленного сустава
после удаления спейсера и реэндопротезирования коленного сустава
За период наблюдения двухэтапное оперативное лечение было проведено 146 пациентам. У 124 пациентов признаки инфекции были купированы. Процедив отмечен у 22 пациентов. С целью купирования инфекционного процесса этим больным выполнялся артродез коленного сустава в аппарате внешней фиксации.
Первично артродез коленного сустава выполнялся пациентам с вирулентной флорой, на поддающейся антибиотикотерапии, с выраженной сопутствующей патологией, позволяющей оперировать пациента только по жизненным показаниям, и в случае желания пациента.
Клинический пример 3. Больная Л., 52 года. Первичное эндопротезирование коленного сустава было проведено по поводу вторичного артрозо-артрита коленного сустава III ст. на фоне ревматоидного полиартрита.
Через 6 месяцев после проведенного оперативного вмешательства у больной развилась глубокая парапротезная инфекция. Учитывая высокую активность основного заболевания, пациентка предпочла отказаться от дальнейших оперативных вмешательств, в связи с чем было выполнено удаление и артродез коленного сустава в аппарате внешней фиксации (рис. 3).
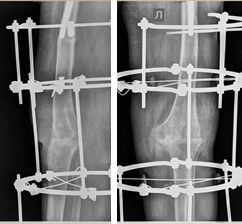
Рис. 3. Рентгенограмма коленного сустава после удаления эндопротеза и артродеза коленного сустава в аппарате внешней фиксации
По различным причинам артродез коленного сустава выполнялся в 66 случаях. В 54 случаях у пациентов сформировался костный анкилоз, и только в 12 случаях отмечалось формирование фиброзного анкилоза или неоартроза. Рецидива инфекции при выполнении артродеза коленного сустава зафиксировано не было.
Результаты. Таким образом, за 10 лет через отделение эндопротезирования коленного сустава Новосибирского НИИТО прошли 470 пациентов с парапротезной инфекцией. Эти пациенты получили следующее лечение:
- 252 (53,6%) пациентам с поверхностной инфекцией проведена вторичная хирургическая обработка, реимплантация эндопротеза не требовалась;
- 26 (5,5%) пациентам проведено одномоментное реэндопротезирование коленного сустава;
- 126 (26,8%) пациентов перенесли двухэтапное оперативное лечение;
- 66 (14,0%) пациентам по различным причинам выполнен артродез коленного сустава.
Ампутаций конечности и летальных исходов, вызванных инфекционным процессом, в отделении не отмечено.
Заключение. Инфекционные осложнения при первичном протезировании коленного сустава, невзирая на улучшение техники хирургического лечения и проводимой профилактики, остаются достаточно частыми и наиболее тяжелыми осложнениями. Как правило, они приводят к повторным оперативным вмешательствам, а зачастую и к инвалидизации пациентов. Обоснованный выбор хирургической тактики позволяет благополучно справиться с инфекционным осложнением и обеспечить пациенту приемлемое качество жизни.
Полный текст:
Цель исследования – разработка тактики лечения пациентов с периимплантной инфекцией тазобедренного сустава с применением различных модификаций спейсеров. Материал и методы. Проанализированы результаты лечения 168 пациентов с наличием клинических и лабораторных признаков нагноения после эндопротезирования тазобедренного сустава. Больные были разделены на две группы: у 87 пациентов группы сравнения была применена стандартная двухэтапная методика ревизионного эндопротезирования с установкой спейсера; в лечении 81 больного основной группы была использована предложенная авторами система предоперационного обследования, на основе которой осуществлялся выбор тактики оперативного вмешательства с установкой различных видов спейсеров и с последующим персонифицированным послеоперационным ведением. Результаты. Благодаря применению предложенной тактики периоперационного ведения пациентов с периимплантной инфекцией удалось снизить количество повторных ревизий с 43,6% (38 пациентов) до 24,7% (15 пациентов) в основной группе. Функциональное состояние пациентов основной группы через 1 и 3 месяца после выполнения первого этапа реэндопротезирования по поводу периимплантной инфекции характеризуется лучшими функциональными результатами по шкале Харриса по сравнению с больными, в лечении которых используются стандартные подходы. Выраженность болевого синдрома по ВАШ на протяжении трех недель после операции в основной группе была значительно ниже, чем в группе сравнения. Заключение. Применение системы комплексного лечения, включающей схему предоперационного обследования, алгоритм выбора антибактериального спейсера и способ его установки, персонифицированное послеоперационое ведение является эффективным и приводит к стойкому купированию хронического гнойно-воспалительного процесса.
1. Вырва О.Е., Бурлака В.В., Малык Р.В., Озеров К.И. Инфекционные осложнения первичного тотального эндопротезирования тазобедренного и коленного суставов. Ортопедия, травматология и протезирование. 2011;3:60-67.
2. Ежов И.Ю., Корыткин А.А., Бобров М.И., Загреков В.И., Шебашев А.В. проблема гнойно-некротических и ранних гнойно-септических осложнений при эндопротезировании тазобедренного сустава. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2010;5(1):22-25.
3. Куляба Т.А. Костная аллопластика при ревизионном эндопротезировании коленного сустава. Травматология и ортопедия России. 2009;3:148-150.
4. Лю Бо, Тихилов Р.М., Шубняков И.И., Разоренов В.Л., Денисов А.О., Божкова С.А., Артюх В.А., Клиценко О.А., Тотоев З.А. эффективность первого этапа двухэтапной ревизии при параэндопротезной инфекции тазобедренного сустава. Травматология и ортопедия России. 2014; 3 (73):5-14. DOI: 10.21823/2311-2905-2014-0-3-5-14.
5. Николенко В.К., Буряченко Б.П., Давыдов Д.В. Особенности ревизионного эндопротезирования тазобедренного сустава по поводу инфекционных осложнений. Инфекции в хирургии. 2008;6(2):50-55.
6. Павлов В.В., Садовой М.А., Прохоренко В.М. Современные аспекты диагностики и хирургического лечения пациентов с перипротезной инфекцией тазобедренного сустава (обзор литературы). Травматология и ортопедия России. 2015;1:116-128. DOI: 10.21823/2311-2905-2015-0-1-116-128.
7. Пичхадзе И.М., Кузьменков К.А., Жадин А.В., Цискарашвили А.В., Пичхадзе Е.И., Данелия Л.М., Реквава Г.Р., Шулашов Б.Н. Лечение больных с гнойно-воспалительными осложнениями после эндопротезирования тазобедренного сустава. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2009;
9. Шильников В.А., Тихилов Р.М., Денисов А.О. Болевой синдром после эндопротезирования тазобедренного сустава. Травматология и ортопедия России. 2008;(2): 106-109.
10. Ben-Lulu O., farno A., gross A.E., Backstein D.J., Kosashvilj y., Safir O.A. A modified cement spacer technique for infected total hip arthroplasties with significant bone loss. Arthroplasty. 2012;27(4):613-619. DOI: 10.1016/j.arth.2011.06.031.
11. Crockarell J.R., Hanssen A.D., Osmon D.R., Morrey B.f. Treatment of infection with debridement and retention of the components following hip arthroplasty. J Bone Joint Surg. 1998;80-A:1306-1313.
12. Cooper H.J., Della Valle C.J. The two-stage standard in revision total hip replacement. Bone Joint J. 2013;95-B(11 Suppl A):84-87. DOI: 10.1302/0301-620x.95B11.32906.
13. Engesater L.B., Dale H., Schrama J.C., Hallan g., Lie S.A. Surgical procеdures in the treatment of 784 infected THAs reported to the Norwegian arthroplasty register. Acta orthop. 2011;82(5):530-537. DOI: 10.3109/17453674.2011.623572.
14. fink B., grossmann A., fuerst M. Two-stage cementless revision of infected hip endoprotheses. Clin orthop relat res. 2009; 467(7): 1848-1858. DOI: 10.1007/s11999-008-0611-y.
15. Garvin K.L., Konigsberg B.S. Infection following total knee arthroplasty: prevention and management. Instr Course Lect. 2012;61:411-419.
16. Lee K., goodman S.B. Current state and future of joint replacements in the hip and knee. Expert rev Med Devices. 2008;5(3):383-93. DOI: 10.1586/17434440.5.3.383.
17. Mariconda M., Ascione T., Balato G., Rotondo G., Smeraqila F., Costa G.G., Conte M. Sonication of antibiotic-loaded cement spacers in a two-stage revision protocol for infected joint arthroplasty. BMC Musculoskelet Disord. 2013;24;14:193. DOI: 10.1186/1471-2474-14-193.
18. Neumann D., Hofstaedter T., List S. Two-stage cementless revision of late total hip arthoplasty infection using a premanufactured spacer. Arthroplasty. 2012;27(7): 1397-1401. DOI: 10.1016/j.arth.2011.10.022.
19. Wang S. Antibiotic-impregnated cement temporary spacer for surgical treatment of osteomyelitis and nonunion of bone caused by intramedullary nailing. Zhongguo Xiu Fu Chong JianWai Ke ZaZhi. 2011;25(8):972-975.
20. Waldman B.J., Hostin E., Mont M.A., Hunfergord D.S. Infected total knee arthroplasty treated by arthroscopic irrigation and debridement. Arthroplasty. 2000;15:430-436. DOI: 10.1054/arth.2000.4637
21. Winkler H. Bone grafting and one-stage revision of THR – biological reconstruction and effective antimicrobial treatment using antibiotic impregnated allograft bone. Hip Int. 2012; 22(Suppl 8):S62-68. DOI: 10.5301/HIP.2012.9572.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
| РЕДАКЦИЯ:
|


