Инфекции вызванные acinetobacter baumannii
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision July 2018 by Larry M. Bush, MD, FACP; Maria T. Perez, MD
Acinetobacter – грамотрицательные аэробные бациллы или коккобациллы, принадлежащие к семейству Moraxellaceae. Они встречаются повсеместно и могут выживать на сухих поверхностях в течение месяца, обычно обнаруживаются на коже медицинских работников, увеличивая вероятность колонизации пациентов и контаминации медицинского оборудования. Существует много видов Acinetobacter; все они могут вызвать заболевание человека, однако на долю A. baumannii (АВ) приходится около 80% инфекций.
Болезни, вызываемые Acinetobacter (АВ)
Наиболее распространенными проявлениями заболеваний, вызванных Acinetobacter, являются:
Инфекции AB, как правило, выявляют у пациентов, госпитализированных в критическом состоянии. Внебольничные инфекции (преимущественно, пневмония) чаще возникают в тропическом климате. Уровень смертности, связанный с инфекцией AB, составляет 19–54%.
Acinetobacter часто колонизирует места трахеостомы и может вызывать внебольничный бронхиолит и трахеобронхит у здоровых детей и трахеобронхит у взрослых с ослабленным иммунитетом. Приобретенные в больнице пневмонии, вызванные Acinetobacter, часто многодолевые и осложненные. Характерны вторичная бактериемия и септический шок, что предопределяет неблагоприятный прогноз.
Вид Acinetobacter может также вызывать раневые инфекции и гнойные инфекции (например, абсцессы) в любой системе организма, включая легкие, мочевыводящие пути, кожу и мягкие ткани; возможна бактериемия.
В редких случаях эти микроорганизмы вызывают менингит (прежде всего после нейрохирургических процедур), флегмону или флебит у пациентов с постоянным венозным катетером, глазные инфекции, эндокардит нативного или искусственного клапана, остеомиелит, септический артрит или абсцессы поджелудочной железы и печени.
Значимость Acinetobacter изолятов из клинических образцов, таких как секрет из органов дыхания у интубированных пациентов или из открытых ран, определить трудно, потому что они часто представлены колониями.
Факторы риска развития инфекции, вызванной Acinetobacter, зависят от типа инфекции (госпитальная, внебольничная, множественная полирезистентная—см. таблицу Факторы риска развития инфекции, вызванной Acinetobacter [Risk Factors for Acinetobacter infection]).
Фекальная колонизация с Acinetobacter
Пребывание в отделении интенсивной терапии
Продолжительность пребывания в больнице
Лечение антибиотиками широкого спектра действия
Хроническое заболевание легких
Проживание в тропической развивающейся стране
Контакт с колонизированными или зараженными пациентами
Механическая вентиляция, особенно если пролонгированно
Длительная госпитализация (особенно в отделении интенсивной терапии)
Назначение продуктов крови
Использование антибиотиков широкого спектра действия (например, цефалоспорины 3-ьего поколения, карбапенемы, фторхинолоны)
В последнее время появились штаммы АВ с множественной лекарственной устойчивостью (МЛУ), в частности, в отделениях интенсивной терапии у пациентов с иммуносупрессией, пациентов с серьезными первичными заболеваниями, а также пациентов, получавших лечение антибиотиками широкого спектра действия после инвазивных процедур. Распространение штаммов АВ в отделениях интенсивной терапии было связано с медицинским персоналом, у которых выявлена высокая колонизация данного микроорганизма, а также с зараженным оборудованием общего использования и зараженными растворами для парентерального питания. Кроме того, возросло число случаев мультирезистентности, вызванной АБ, среди военнослужащих, которые были ранены и проходили лечение в Ираке, Кувейте и Афганистане.
Лечение
Обычно, эмпирическая комбинированная лекарственная терапия при тяжелых инфекциях
Для пациентов с установленным инородным телом (например, катетер, шов), удаление инородного тела плюс местная обработка обычно существенны. Трахеобронхит после эндотрахеальной интубации может пройти благодаря только гигиене легких. Пациенты с осложненным течением заболевания должны лечиться антибиотиками с последующей санацией.
У AB давно регистрируется множественная резистентность к антибактериальным препаратам. Инфекция AB с множественной лекарственной устойчивостью определяется как штаммы, которые устойчивы к ≥ 3 классам антибактериальных препаратов; некоторые изоляты являются стойкими ко всем антибиотикам. До получения результатов чувствительности к антибиотикам в качестве стартовой терапии можно использовать карбапенемы (например, меропенем, имипенем, дорипенем), колистин или фторхинолоны вместе с аминогликозидами, рифампицином, или с обеими. У сульбактама (ингибитора бета-лактамазы) имеется свойственная ему бактерицидная активность против многих штаммов инфекции АБ данного типа. Тигециклин, антибиотик класса глицилциклинов также эффективен; однако отмечено ограничение его активности и появлении резистентности во время терапии. Миноциклин проявляет активность in vitro.
Инфекции легких (при среднетяжелых формах) могут реагировать на монотерапию. Раневые инфекции также можно лечить одним препаратом, например миноциклиномом.
Тяжелые формы АБ инфекций лечат, используя комбинированную терапию – как правило, карбапенемы (имипенем или меропенем) или препарат ампициллин/сульбактам в комплексе с аминогликозидом; при условии устойчивости к лекарственным препаратам, единственными доступными вариантами могут быть тигециклин или комбинация колистина и миноциклина.
Чтобы предотвратить распространение возбудителя, необходимо применять меры по предотвращению контакта (ручная стирка, барьер) и соответствующие меры по проветриванию и гигиене, связанной с пациентами, колонизированными или зараженными инфекцией такого рода.
Основные положения
A. baumannii (АВ) является причиной около 80% инфекций, вызванных Acinetobacter, часто встречается у больных в критическом состоянии, находящихся в стационаре.
Наиболее распространенным местом локализации инфекции является дыхательная система, однако некоторые виды Acinetobacter также могут вызвать гнойную инфекцию в любой системе органов.
Мультирезистентные штаммы АВ стали проблемой; проводить множественную лекарственную терапию следует после проведения исследований на чувствительность.

В молодости Ричард Армбрустер играл в младшей бейсбольной лиге. Тренироваться в свое удовольствие он продолжал даже в 70 лет — пока у него не заболело правое бедро. В феврале 2009 года он лег на обыкновенную операцию на тазобедренном.
В молодости Ричард Армбрустер играл в младшей бейсбольной лиге. Тренироваться в свое удовольствие он продолжал даже в 70 лет — пока у него не заболело правое бедро. В феврале 2009 года он лег на обыкновенную операцию на тазобедренном суставе в больницу в Сент-Луисе. В конце марта 78-летний Армбрустер умер.
Операция вызвала ряд осложнений. Однако последней каплей стало заражение крови. Бактерии в крови привели к септическому шоку и не поддавались лечению антибиотиками.
Организм, вызвавший заражение, удалось установить лишь в день смерти Армбрустера. Это оказалась акинетобактерия Баумана (Acinetobacter baumannii).
Этот микроб входит в категорию бактерий, которые, по некоторым оценкам, убивают десятки тысяч пациентов больниц каждый год. Хотя этим микроорганизмам уделяют меньше внимания, чем так называемому МРЗС (метициллин-резистентному золотистому стафилококку), некоторые специалисты по инфекционным заболеваниям считают, что в будущем они могут стать более серьезной угрозой.
Дело в том, что существуют лекарственные препараты (производство которых было разрешено относительно недавно), успешно борющиеся с МРЗС. Но сочетание ряда соображений делового порядка и некоторых научных проблем привело к тому, что фармацевтические компании почти не ведут разработку лекарств против акинетобактерий и других подобных им организмов, известных как грамотрицательные бактерии.
Бактерии, названные грамотрицательными из-за их реакции на окраску по методу Грама, могут вызвать тяжелую форму пневмонии и заражение мочевых путей, крови и других частей тела. Клеточная структура этих микробов делает антибиотики куда менее действенными против них, чем против грамположительных организмов вроде МРЗС.
Органы здравоохранения не располагают достоверной информацией относительно того, сколько случаев инфекционных заболеваний и смертей в США вызваны грамотрицательными бактериями. По оценке центров по контролю и профилактике заболеваний, около 1,7 млн случаев заражения пациентов больниц от всех видов бактерий приводит к 99 тысячам смертей в год.
По оценкам экспертов, в Европе грамотрицательные бактерии стоят за двумя третями смертей от внутрибольничных инфекций. Согласно отчету, опубликованному европейскими органами здравоохранения, от подобных инфекций в Европе каждый год умирает около 25 тысяч человек.
Конечно, МРЗС остается самой распространенной причиной внутрибольничных инфекций. Особые опасения вызывает то, что им могут быть заражены люди вне больниц.
Резистентные к лекарствам грамотрицательные бактерии, напротив, угрожают в первую очередь пациентам стационаров с ослабленной иммунной системой. Микробы могут долго жить в больницах и попадать в организм через раны, катетеры и аппараты искусственного дыхания.
Однако самое неприятное в грамотрицательных бактериях не их распространенность, а устойчивость к лекарствам.
При лечении резистентных штаммов грамотрицательных бактерий врачи зачастую вынуждены полагаться на два похожих антибиотика, выработанных в 40-х годах: колистин и полимиксин Б. От применения этих лекарств отказались несколько десятилетий назад, так как они могут вредить почкам и нервам. Но из-за того, что ими почти не пользовались, бактерии пока не успели выработать резистентность к ним.
Некоторые организации, выступающие за права пациентов, считают, что больницы должны больше усилий направить на профилактику инфекций: например, работники должны часто мыть руки, а все поверхности и инструменты проходить дезинфекцию. Что касается антибиотиков, говорят они, то ими нельзя пользоваться слишком часто, так как это способствует появлению резистентных бактерий.
Инфекции, связанные с оказанием медицинской помощи, выявляют у 5-10 % пациентов, находящихся в стационаре [1]. И, если ранее, наиболее частыми возбудителями нозокомиальных инфекций (НИ) были грамположительные бактерии, то в последние десятилетия в их структуре преобладают грамотрицательные микроорганизмы. В этой ситуации особую тревогу вызывает неуклонный рост числа НИ, вызванных неферментирующими грамотрицательными микроорганизмами, в том числе бактериями рода Acinetobacter. В Европе и США A. baumannii является этиологическим агентом 2-10 % всех грамотрицательных инфекций [2] и до 1 % всех НИ [3]. В 2006-2008 гг. A. baumannii в России был третьим по частоте (15,3 %) грамотрицательным возбудителем НИ [4], а по результатам многоцентрового эпидемиологического исследования МАРАФОН России в 2011-2012 гг. этот возбудитель составил 13,9 % из всех выделенных бактериальных возбудителей [5].
По данным ряда авторов в стационарах городов России A. baumannii достигает 15,5-39,8 % в спектре грамотрицательных возбудителей [6,7]. В многопрофильных стационарах Санкт-Петербурга доля карбапенемустойчивых штаммов A. baumannii в 2010-2014 гг. составила 41,4 % к меропенему, 47,5 % к имипенему и 34,3 % к меропенему и имипенему [8]. Среди возбудителей раневой ожоговой инфекции к бактериям рода Acinetobacter принадлежало 13,3 % микроорганизмов [9]. По данным РОНЦ им. Н.Н. Блохина частота выделения A. baumannii в общей структуре микроорганизмов возросла от 2,5 % в 2005г до 9,7 % в 2010 г. [10].
Особую тревогу вызывает быстрое распространение практически во всех странах мультирезистентных штаммов A. baumannii, что значительно ухудшает результаты и сокращает возможности лечения инфекций, вызванных этим возбудителем. В РОНЦ им. Н.Н. Блохина в 2010 г. PDR штаммы A. baumannii были выделены в 40,7 % случаев [10].
Наиболее эффективным и эпидемиологически значимым механизмом резистентности у нозокомиальных штаммов A. baumannii является продукция приобретенных карбапенем-гидролизующих β-лактамаз класса D (CHDL): ОХА-23, ОХА-40, ОХА-58-подобных, а также металло-β-лактамаз, таких как INB и VIM. Распространенность этих ферментов в разных странах существенно отличается [11]. Продукция карбапенемаз в России в настоящее время отмечается у 44 % госпитальных изолятов A. baumannii. Особое опасение вызывает стремительное распространение на всей территории России штаммов A. baumannii, продуцирующих карбапенемазы группы ОХА-24/40, доля которых в 2011-2012гг составила 35,7 % [5]. ОХА-продуцирующие A. baumannii были получены из Иркутска (ОХА-23), Новосибирска (ОХА-58), Москвы (ОХА-23 и 58) [11]. Преимущественная циркуляция ОХА-40-подобных карбапенемаз (85,2 %) была отмечена в Минске [12] и Ростове-на-Дону [13]. В последнем случае ОХА-40 карбапенемазы преобладали среди онкологических больных [14, 15]. A. baumannii был выделен у 27-37 % пациентов, 78 % выделенных культур были карбапенемрезистеными, доминировала карбапенемаза ОХА-40 (97 %) [16]. Было показано, что колонизация слизистых оболочек верхних дыхательных путей возбудителями госпитальных инфекций у детей с тяжелой черепно-мозговой травмой, находящихся в ОРИТ происходила после 4 дня госпитализации [16].
Целью настоящего исследования является изучение частоты колонизации слизистой оболочки кишечника и ротоглотки A. baumannii, продуцирующими ОХА-карбапенемазы, среди больных с солидными опухолями.
Материалы и методы исследования
Мазки отбирали в специальную транспортную среду, представляющую собой раствор фосфатного буфера с добавлением консерванта.
Всего было обследовано 230 пациентов, исследовано 368 образцов, в том числе 230 мазков из ротоглотки и 138 из прямой кишки.
Результаты исследования и их обсуждение
Молекулярный маркер A. baumannii (ген ОХА-51) был обнаружен у 39 (20,0 %) больных, в том числе у 28 (12,2 %) в мазках со слизистой ротоглотки, 11 (8,0 %) в мазках со слизистой прямой кишки. Ни у одного больного ген ОХА-51 не был обнаружен в двух локусах.
Различные гены ОХА-карбапенемаз были выявлены у 14 больных (6,1 % из числа обследованных и 35,9 % из колонизированных A. baumannii), в том числе в мазках из зева у 13 (5,7 % из обследованных и 46,4 % из колонизированных A. baumannii), в ректальных мазках у одного (0,7 % из обследованных и 25,6 % из от колонизированных A. baumannii). Гены металло-β-лактамаз групп VIM, IMP, NDM не были обнаружены ни в одном случае.
В проведенном ранее исследовании было показано, что в этиологической структуре пневмоний у онкологических больных преобладали A. baumannii (45,8 % от всех грамотрицательных возбудителей). Абсолютное большинство из них имели ген ОХА-40-подобных карбапенемаз [18]. Эти данные полностью коррелируют с полученной в настоящем исследовании информации о преимущественной колонизации A. baumannii, несущими генетические детерминанты резистентности к карбапенемам (ОХА-40), слизистой ротоглотки по сравнению со слизистой прямой кишки.
Чрезвычайно интересным представляется тот факт, что ДНК ОХА-карбапенемаз была обнаружена не только в образцах с молекулярным маркером A. baumannii (ОХА-51), но и в образцах без него. Ранее нами было показано обнаружение гена ОХА-40 в изоляте A. towneri, выделенном из внешней среды стационара [13]. Можно предположить, что штаммы Acinetobacter spp., циркулирующие во внешней среде, служат резервуаром генов ОХА-карбапенемаз. В этом случае, Acinetobacter spp., несущие гены ОХА-карбапенемаз, при определенных условиях и реализации горизонтального переноса генов карбапенемаз, могут стать источником эпидемического неблагополучия в стационаре.
В целом, с учетом всех образцов клинического материала, имеющих ген ОХА-51 и без него, различные генетические детерминанты резистентности (ОХА-23, ОХА-40 или ОХА-58) были обнаружены у 50 больных (21,7 % от числа обследованных). В материале из ротоглотки гены ОХА-карбапенемаз были обнаружены у 37 из 230 больных (16,1 %), в ректальных мазках у 10 из 138 (7,2 %), одновременно в ротоглотке и прямой кишке у 3 (2,2 %). Менее 1 % больных были носителями двух генов одновременно (ОХА-40 и 58). Всего с учетом mixt ген карбапенемазы ОХА-23 был обнаружен у 5 пациентов (2,2 %), ОХА-40 у 22 пациентов (9,6 %), ген ОХА-58 у 25 пациентов (10,9 %). Таким образом, гены ОХА-40 и ОХА-58 были распространены среди поступающих на оперативное лечение пациентов одинаково часто. При исследовании культур A. baumanii, изолированных из клинического материала при возникновении инфекционных осложнений, так же преимущественно был обнаружен ген ОХА-40 карбапенемаз [14].
При анализе частоты выявления ОХА-карбапенемаз среди больных с различной локализацией опухолевого процесса было установлено, что ОХА-40 чаще выявлялись при абдоминальной патологии (14,9 %), ОХА-58 при патологии мягких тканей/молочной железы (12,5 %) и женских репродуктивных органов (22,7 %). При этом было отмечено, что ОХА-58 чаще были обнаружены в образцах без молекулярного маркера A. baumannii, а ОХА-40 – с ним. Пока неясно, имеют ли эти данные клиническое значение или являются отражением эпидемической ситуации в конкретном стационаре.
Частота выявления генов ОХА-карбапенемаз A. baumannii (ОХА-51+) в различных локусах
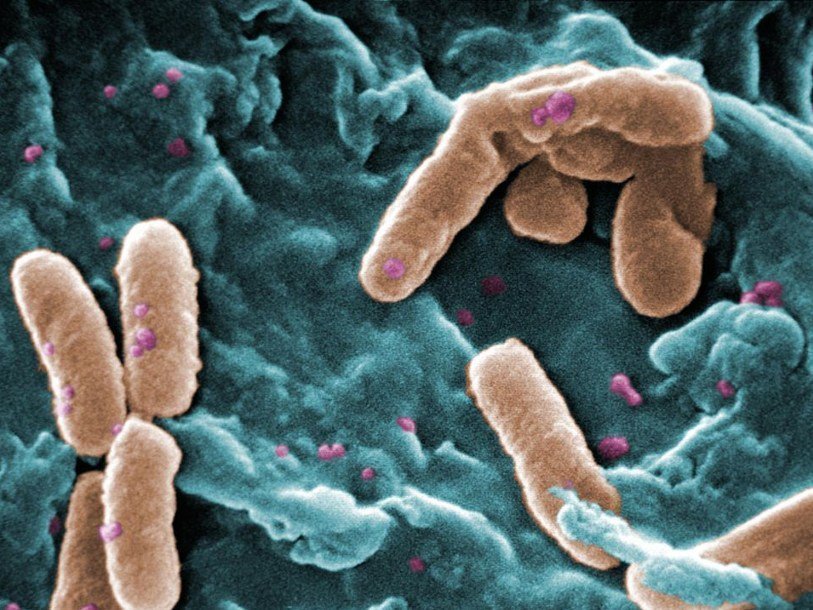
Всемирная организация здравоохранения опубликовала список из двенадцати бактерий, которые представляют наибольшую угрозу для человечества, так как у них имеются штаммы, устойчивые к антибиотикам.
Сейчас многие специалисты в области здравоохранения полагают, что резистентные к антибиотикам болезнетворные бактерии в ближайшем будущем станут более опасными для здоровья людей, чем онкологические заболевания. Если антибиотики потеряют эффективность, то смертельно опасными станут любые хирургические вмешательства, включая кесарево сечение или трансплантацию органов. Куда большую опасность, чем теперь будет представлять и химиотерапия, так как она угнетает иммунную систему пациента, и только антибиотики в этот момент способны его защитить.
Ежегодно в мире около 700 тысяч человек умирает от инфекций, вызванных бактериями, которые устойчивы к антибиотикам. По расчетам, к 2050 году число умерших возрастет до 10 миллионов в год.
Список особо опасных бактерий, устойчивых к антибиотикам
Критический уровень приоритетности
Данный вид бактерий все больше распространяется как внутрибольничная инфекция, поражая пациентов с ослабленной иммунной системой. Входит в группу ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp.) – патогенов, устойчивых к антибиотикам широкого спектра действия, ответственных за большинство внутрибольничных инфекций. Заражает также пациентов, получивших травматические повреждения кожи, например, при взрывах, проникая с загрязнением в рану. Часто инфекция отмечалась у американских военнослужащих, получивших ранения в Ираке и Афганистане. С перевозкой их по госпиталям распространялась и бактерия. Может долго сохраняться на искусственных поверхностях и противостоять высыханию. Способна распространяться через вентиляцию.
Acinetobacter baumannii. Фото: CDC/Janice Carr
2. Pseudomonas aeruginosa, синегнойная палочка, устойчива к карбапенемам
Часто обнаруживается при абсцессах и гнойных ранах, вызывает энтериты и циститы. Входит в группу ESKAPE, вызывая внутрибольничные инфекции и поражая людей с ослабленным иммунитетам. Бактерии обладают чувством кворума, то есть способны влиять на поведения друг друга, выделяя в окружающую среду особые сигнальные молекулы, что повышает их способность сопротивляться антибиотикам. О чувстве кворума подробнее можно прочитать в отдельном очерке.
Многочисленное семейство бактерий, среди которых есть как “мирные” представители человеческой кишечной микрофлоры, так и болезнетворные. Способны вырабатывать особые ферменты бета-лактамазы расширенного спектра действия (БЛРС). Эти ферменты разрушают бета-лактамное кольцо антибиотиков типа пеницилина и цефалоспорина. В результате выделяющие их бактерии устойчивы к действию целого ряда бета-лактамных антибиотиков, включая цефалоспорины третьего поколения.
Высокий уровень приоритетности
Ванкомицин-резистентные энтерококки впервые зафиксированы в 1980-х годах. Распространяются в больницах, входит в группу ESKAPE. Также отмечены у кур на птицефабриках.
5. Staphylococcus aureus, золотистый стафилококк, устойчив к метициллину, умеренно чувствителен или устойчив к ванкомицину
Вызывает широкий спектр заболеваний, от легких кожных инфекций до пневмонии, менингита, остеомиелита и эндокардита. Входит в группу ESKAPE. Исследование показало, что пациенты, заразившиеся золотистым стафилококком, вынуждены проводить в стационаре в среднем втрое больше времени (14,3 дня против 4,5 дней), причем риск смертельного исхода в этом случае впятеро выше (11,2 % против 2,3 %), чем у пациентов без этой инфекции. Вырабатывает пециниллазу – фермент, расщепляющий молекулы пенициллина. Для борьбы с золотистым стафилококком применялся модифицированный пенициллин – метициллин, молекула которого не разрушается этим ферментом, но в последние десятилетия возникли метициллин-устойчивые штаммы (MRSA).
Бактерия обитает в заднем отделе желудка человека и в большинстве случаев не вызывает никаких патологий, но в некоторых случаях влияет на стенки желудка, что приводит к возникновению гастрита и язвы желудка и двенадцатиперстной кишки.
Основным резервуаром бактерий этого рода служит домашняя птица, у которой заражение проходит, как правило, бессимптомно. Люди заражаются при употреблении в пищу продуктов питания или воды, загрязненных бактериями, или при уходе за птицами. Вид Campylobacter jejuni сейчас признан одной из главных причин пищевых инфекций в развитых странах. Для кампилобактериоза характерны воспаление, кровавый понос, судороги, лихорадка и боли. Симптомы обычно длятся от пяти до семи дней. Бактерия чувствительна к соляной кислоте в желудке человека, что несколько снижает вероятность инфекции, но означает повышенную опасность для больных с гастритом или язвой, принимающих препараты, которые снижают кислотность в желудке. В некоторых случаях бактерия может быть основной причиной синдрома Гийена-Барре.
8. Salmonellae, устойчивы к фторхинолонам
Род бактерий, ответственных за ряд тяжелых пищевых инфекций (сальмонеллезов). Поступают в организм с пищей, заселяя тонкий кишечник. Salmonella enterica серотип typhi вызывает брюшной тиф. В 2015 году был обнаружен устойчивый к антибиотикам штамм этой бактерии H58, который, по данным ученых, возник в Южной Азии и за последние 30 лет получил широкое распространение. Ныне он встречается в Юго-Восточной и Западной Азии, Восточной и Южной Африке и на островах Фиджи. Бактерия устойчива даже к новым антибиотикам, таким как ипрофлоксацин и азитромицин. Исследователи отмечают, что штамм H58 вытесняет другие штаммы брюшного тифа. В 2014 году в мире было зафиксировано приблизительно 22 миллиона случаев заболевания брюшным тифом и около 222 000 больных умерло. Брюшной тиф преимущественно распространен в Индии, странах Юго-Восточной Азии и Африки. Без лечения болезнь в 25 % случаев заканчивается смертью. При использовании антибиотиков смертность составляет 1 – 4 %. Всемирная организация здравоохранения рекомендует два типа вакцин против брюшного тифа, однако сейчас более распространено лечение при помощи антибиотиков.

Бактерии Salmonella Typhimurium (отмечены красным). Фото: Rocky Mountain Laboratories, NIAID, NIH
9. Neisseria gonorrhoeae, гонококк, устойчив к цефалоспоринам и фторхинолонам
Средний уровень приоритетности
10. Streptococcus pneumoniae, пневмококк, известен также как диплококк Вейксельбаума и диплококк Френкеля, не чувствителен к пенициллину
Один из основных возбудителей менингита, среднего отита, синусита, внебольничной пневмонии у детей и взрослых, также может вызвать эндокардит, септический артрит, первичный перитонит, флегмоны и другие инфекционные заболевания. Устойчивый к пенициллину штамм особенно распространен в Азии, Северной и Южной Америке. ВОЗ рекомендует использовать вакцинацию против пневмококковой инфекции.
11. Haemophilus influenzae, гемофильная палочка, палочка Пфайффера, устойчива к ампициллину
Латинское название объясняется тем, что до 1930-х годов бактерию ошибочно считали ответственной за заболевание гриппом (инфлюэнцей). Возбудитель гемофильной инфекции у детей, а также у взрослых с ослабленным иммунитетом. Болезнь проявляется в нескольких формах: гнойный менингит, острая пневмония, септицемия, воспаление подкожной клетчатки (целлюлит), эпиглоттит (воспаление надгортанника), гнойный артрит. Также возможны другие варианты: перикардит, синуситы, отит, заболевания дыхательных путей. Распространяется от человека к человеку воздушно-капельным путем. Во многих странах, в том числе и в России, предусмотрена обязательная вакцинация от гемофильной инфекции.
12. Shigella spp., устойчивы к фторхинолонам
Род бактерий, вызывающих шигеллезы (бактериальную дизентерию). Распространяются в основном через пищу и воду. При инфекции повышается температура, возникают озноб, жара, головная боль, падает артериальное давление. Боли в животе сначала постоянны и распространены по всей его площади, а затем приобретают схваткообразный характер и локализуются в нижней части живота.
О том, что Ближний Восток превращается в очаг распространения устойчивых к новейшим видам антибиотиков бактерий, на Западе начали говорить несколько лет назад, когда стало известно о гибели американских военных, подхвативших разновидность резистентных (устойчивых к антибиотикам) Acinetobacter baumannii. Со временем этот штамм даже получил особое название — иракская бактерия. Сейчас говорят уже о нескольких штаммах, которые буквально оккупировали Ближний Восток. Специалисты описывают происходящее как бесшумное цунами, которое грозит погрузить современное человечество во мрак Средневековья, когда инфекции выкашивали миллионы людей. Так что же это за бактерии и почему они вырвались на оперативный простор?
Ученые во главе с профессором Дэвидом Грэмом полагают, что опасные гены могли попасть сюда в кишечнике птиц или иных животных, а также, вероятно, путешественников, приходящих в этот район. В любом случае, они уверены, что мы явно недооцениваем масштаб распространения супербактерий на нашей планете.
По словам Романа Козлова, столь стремительное развитие инфекций, вызванных устойчивыми бактериями, зачастую сводит на нет дорогостоящее высокотехнологическое лечение, включая операции на сердце, трансплантацию органов и пересадку костного мозга.
Разработанная медиками карта позволяет моделировать картину резистентности в будущем, выявлять потребность в разработке новых антибиотиков, а также сравнивать эффективность новых лекарств.
Не секрет, что с разработкой и выпуском на рынок новых антимикробных препаратов сейчас огромные проблемы: начиная с 2000-х шли работы над 22 новыми антибиотиками, однако до прилавка не дошел ни один из них. Исключение — даптомицин и фидаксомицин, но это старые разработки, которые удалось модифицировать и затем вывести на рынок. К слову, компания, сделавшая это, заработала $1 млрд. Увы, это единственный пример эффективного внедрения антимикробного препарата.
Понятно, что производить антибиотики, которые из-за резистентности бактерий за несколько лет становятся неэффективными, крайне невыгодно (менее прибыльно только производство вакцин).
Впрочем, есть мнение, что будущее — за принципиально новыми препаратами. Например, за так называемыми звездообразными белками, которые первыми получили в 2016-м ученые из Университета Мельбурна (Австралия). По сути, они создали новый тип синтетических молекул — особые пептидные полимеры, имеющие форму звездочек с острыми краями, которые буквально вспарывают бактерии, но не причиняют вреда обычным клеткам. В основе — натуральные белки, производимые нашей иммунной системой для борьбы с инфекцией. Тесты звездообразных белков на мышах показали успешное лечение инфекций, вызванных суперинфекциями. Есть надежда, что звездообразные белки смогут заменить антибиотики.
Еда не для всех
Считается, что помимо военных конфликтов очагами воспроизводства супербактерий становятся животноводческие фермы, пищевые комбинаты и очистные сооружения больших городов. В апреле, например, были опубликованы данные масштабной проверки образцов, собранных на двух десятках станциях водоочистки в городах Великобритании: они впечатляют.
Впрочем, не менее громкой в свое время стала другая новость — о том, что в Россию из Индии пришли супербактерия Klebsiella pneumoniae, штамм которой оказался устойчивым к 26 разрешенным в стране антибиотикам. Первыми ее обнаружили медики в ряде больниц Санкт-Петербурга.
Например, в России антибиотики в пищевых продуктах маркируются как пищевая добавка Е700 — Е800. По мнению экспертов, сегодня как у нас, так и в мире не существует эффективных мер контроля пищевых продуктов по части содержания в них всех ныне используемых антибиотиков. Всего, напомним, известно несколько тысяч разнообразных натуральных и синтетических веществ, применяемых в качестве антибиотиков, при этом в России мониторят только несколько видов антибиотиков. По данным Роспотребнадзора, положительные пробы обнаруживают в 0,5% продуктов. Чаще всего в молоке и молочных продуктах.
В самом деле, уже сегодня супербактерии — причина смерти почти 700 тыс. (!) человек в год. По прогнозам ученых, к 2050 году число летальных исходов грозит вырасти до 10 млн. Именно поэтому специалисты, помимо стимуляции производителей фармпрепаратов, призывают вкладываться и в просвещение населения. Посчитано, например, что в среднем 7 из 10 пациентов, пришедших на прием с простудой, просят им назначить антибиотик. На Западе врачи проходят даже специальные тренинги, на которых их учат отказывать таким пациентам, разъясняя вред неоправданного потребления антибиотиков.
Еще деталь. Сейчас вкладываются серьезные средства в создание быстрого, недорогого и точного диагностического теста, который позволит определить, чем именно вызван недуг (от ангины до пневмонии) — вирусом или бактерией, а это сразу же исключит львиную долю бесполезных назначений антибиотиков. Чтобы поощрить исследования, правительство Великобритании учредило специальную номинацию в рамках известной премии Longitude. Научной группе, первой создавшей долгожданный тест, достанется не только благодарность потомков, но и солидный приз в 8 млн фунтов стерлингов.
Читайте также:



