Инфекции при апластической анемии
Апластической анемией (АА) называют заболевание, при котором костный мозг больного перестает производить достаточные количества всех основных видов клеток крови – эритроцитов, лейкоцитов и тромбоцитов. Отсюда и название болезни: она сочетает в себе анемию (недостаточное число эритроцитов, низкий уровень гемоглобина) и аплазию кроветворения (угнетение выработки всех клеток крови).
Апластическая анемия – редкая болезнь: ее частота составляет порядка 2-6 случаев на миллион жителей в год. АА может возникнуть как у детей, так и у взрослых; считается, что пики заболеваемости наблюдаются в молодом возрасте (15-30 лет) и затем в пожилом (свыше 60 лет). Мужчины и женщины заболевают одинаково часто.
В подавляющем большинстве случаев причина заболевания неизвестна – в этом случае говорят об идиопатической АА. Но иногда развитие болезни связано с некоторыми врожденными патологиями или с внешними факторами: использованием определенных лекарств (хинин, хлорамфеникол и др.), работой с токсичными веществами (гербициды, инсектициды, некоторые растворители, включая бензол), облучением или перенесенными инфекциями (инфицирование вирусами гепатитов, вирусом Эпштейна-Барр, ВИЧ; возможно, также цитомегаловирусом).
Считается, что идиопатическая АА обычно имеет аутоиммунную природу, то есть возникает тогда, когда иммунная система организма по какой-то причине начинает бороться против его собственных клеток костного мозга.
Проявления апластической анемии связаны с панцитопенией – дефицитом всех разновидностей клеток крови.
- Недостаток эритроцитов – бледность, слабость, одышка, учащенное сердцебиение, головокружения, головные боли.
- Недостаток тромбоцитов – кровотечения, в том числе из носа и десен; появление синяков и петехий (мелких подкожных кровоизлияний).
- Недостаток лейкоцитов – слабая сопротивляемость инфекциям. Могут возникнуть инфекционные заболевания, плохо поддающиеся терапии или часто повторяющиеся.
Апластическая анемия бывает разной степени тяжести: различают легкую, средней тяжести, тяжелую и сверхтяжелую формы АА.
Заподозрить АА можно при появлении у ребенка перечисленных жалоб и симптомов, а подтвердить – на основании результатов клинического анализа крови, где резко снижены количества эритроцитов, лейкоцитов и тромбоцитов. Производятся также другие клинические и лабораторные исследования, но окончательный диагноз ставится только по результатам анализа образца костного мозга, полученного с помощью пункции и/или трепанобиопсии. Исследование костного мозга необходимо для того, чтобы исключить другие возможные причины дефицита клеток крови, такие как лейкоз, миелодиспластические синдромы, миелофиброз и др.
При апластической анемии исследование костного мозга указывает на аплазию или гипоплазию кроветворения – то есть костный мозг практически не производит клетки крови или же производит их, но существенно меньше нужного. Таким образом специалисты могут сделать вывод, что дефицит клеток крови связан именно с их недостаточным образованием в костном мозге, а не, например, с их ускоренным разрушением в крови.
В ходе диагностических исследований необходимо также надежно отличать АА от врожденной анемии Фанкони, так как лечение этих болезней (включая протоколы трансплантации костного мозга) заметно различается. Для подтверждения или исключения анемии Фанкони могут использоваться цитогенетические исследования.
Лечение тяжелой и сверхтяжелой АА должно быть начато сразу после постановки диагноза, так как состояние серьезного дефицита всех клеток крови опасно для жизни. Если развитие АА вызвано определенной внешней причиной (лекарства, радиация), то в первую очередь надо убрать эту причину. Однако, как уже говорилось, какой-то внешний фактор развития болезни удается установить лишь в очень небольшом числе случаев.
Для проведения курса иммуносупрессивной терапии АА обычно необходима госпитализация. Основные осложнения в ходе лечения – это инфекции и кровотечения. Если нет ответа на первый курс терапии, могут быть проведены повторные курсы. Иммуносупрессивная терапия эффективна приблизительно в 70% случаев. К сожалению, у части больных после нее возникают рецидивы болезни.
В ходе лечения АА нужна интенсивная заместительная терапия компонентами крови (переливания донорских тромбоцитов, эритроцитов, в случае тяжелых инфекций – иногда и гранулоцитов). Однако если планируется трансплантация костного мозга, то нужно помнить, что множественные переливания перед трансплантацией повышают вероятность отторжения трансплантата.
Очень важны профилактика и лечение бактериальных, вирусных и грибковых инфекций, которые представляют большую опасность для больных АА. Для лечения применяют сочетания эффективных антибиотиков и противогрибковых препаратов, иногда на протяжении долгого времени.
В качестве дополнительной терапии используются также факторы роста – препараты, помогающие костному мозгу производить нужные клетки. Среди них можно назвать гранулоцитарный колониестимулирующий фактор (нейпоген, лейкостим, граноцит), который стимулирует выработку лейкоцитов, и эритропоэтин, стимулирующий выработку эритроцитов.
Без лечения больные тяжелыми формами апластической анемии погибают в течение нескольких месяцев. Однако при современном адекватном лечении прогноз достаточно хороший.
Как уже говорилось, во многих случаях эффективна иммуносупрессивная терапия. Больные после такой терапии могут продолжительное время чувствовать себя хорошо, однако у некоторых из них возникает рецидив (возвращение) болезни. Для своевременного обнаружения рецидива необходимы регулярные проверки, в первую очередь анализы крови.
Среди детей и молодых взрослых, получивших трансплантацию костного мозга от полностью совместимых родственных доноров, полностью излечиваются более 80%. При использовании неродственных доноров вероятность успеха в среднем ниже и зависит от многих факторов. Однако следует отметить, что в последние годы результаты неродственных трансплантаций при АА улучшились.
Н.Ю. Богачева, А.А. Масчан, Д.В. Литвинов, Г.А. Новичкова, Е.В. Самочатова
Медико-экономические аспекты стандартов современной терапии приобретенных апластических анемий у детей
НИИ детской гематологии МЗ РФ, Москва
Одной из составных частей организации любой системы медицинской помощи является введение так называемых стандартов терапии, которые применяются и хорошо зарекомендовали себя во многих странах [1]. Такие стандарты представляют собой протоколы лечения и чаще всего касаются отдельных нозологических форм. В гематологии введение системы стандартов терапии не является новостью, так как протоколы в этой области медицины давно и хорошо известны. Введение и использование протоколов имеет две стороны: медицинскую и экономическую. Единые стандартные протоколы лечения позволяют предсказать и запланировать затраты на лечение того или иного заболевания, а также проконтролировать правильность расходования средств. Зная заболеваемость для каждой нозологической формы, всегда можно прогнозировать, какой бюджет потребуется для ее лечения. С медицинской точки зрения выгоды использования протоколов также очевидны. Наличие протоколов позволяет систематизировать и контролировать ведение отдельных нозологических форм, например, в различных клиниках в одной стране или в различных странах. Они делают возможным анализ большого количества данных по результатам лечения и внесение своевременных изменений в состав и длительность терапии на основе полученной информации.
Хорошо известно, что критерием эффективности протокола является общая выживаемость пациентов и выживаемость без осложнений или обострений заболевания, а также продолжительность жизни больных. Эти же критерии важны и с экономической точки зрения: чем больше больных находятся в ремиссии или выздоравливают полностью, тем меньше больных нуждаются в каждый конкретный момент в лечении и тем соответственно меньше затраты на лечение. То же можно сказать и о рецидивах, поскольку каждый рецидив влечет за собой повторное обследование, госпитализацию, лечение, а следовательно, многократное увеличение затрат. Таким образом, можно сделать простой вывод: чем быстрее и эффективнее вылечен больной, тем выгоднее это тем, кто платит за это лечение.
Рассмотрим более подробно протоколы лечения приобретенной апластической анемии (АА) и обсудим, что необходимо для максимально эффективного их применения. Особо подчеркнем, что речь идет не о минимизации затрат на лечение, а о максимально эффективном использовании средств.
Общая схема протоколов терапии приобретенной АА у больных моложе 20 лет во всем мире выглядит сегодня следующим образом (см. рисунок).
Первый этап лечения — правильная постановка диагноза в оптимальные сроки. В случае приобретен ной АА план обязательного обследования включает:
1. НLA-типирование всей семьи.
2. Исследование костного мозга:
а) миелограмма образцов костного мозга, взятых из 3 анатомически различных точек;
3. Исследование периферической крови:
а) автоматизированный анализ крови с определением содержания ретикулоцитов, подсчетом лейкоцитарной формулы в мазках;
б) биохимический анализ крови: билирубин, лактатдегидрогеназа и ее фракции, аланинаминотранс фераза, аспартатаминотрансфераза, g- глутаминтран сфераза, щелочная фосфатаза, креатинин, мочевина, мочевая кислота.
4. Цитогенетическое исследование:
а) проба на чувствительность лимфоцитов периферической крови к диэпоксибутану.
5. Вирусологическое исследование:
а) выявление серологических маркеров вирусов гепатита B, C.
6. Рентгенография грудной клетки.
7. Ультразвуковое исследование брюшной полости.
В зависимости от наличия или отсутствия HLA-идентичного родственного донора больных АА подразделяют на две группы: больные, у которых имеется HLA-идентичный родственный донор, направляются на трансплантацию костного мозга (ТКМ); остальные получают лечение с использованием комбинированной иммуносупрессивной терапии (ИСТ). Результаты двух вариантов лечения на сегодняшний день сравнимы и позволяют добиться долгосрочной выживаемости у 70—80% больных [2]. Оба варианта лечения неоднократно обсуждались, однако мы остановимся более подробно на оптимальном их использовании. Для этого сравним затраты на эти варианты лечения (табл. 1).
Рисунок . Протокол лечения приобретенной апластической анемии.
АА — апластическая анемия; ТКМ — трансплантация костного мозга; ИСТ — иммуносупрессивная терапия.
Примечание . * —эти затраты складываются из затрат на лечение основного заболевания (апластическая анемия) и лечение осложнений (инфекции, трансфузионная зависимость). Кроме того, возможно развитие специфических осложнений — реакции "трансплантат против хозяина" (при ТКМ) и рецидивов или поздних клональных заболеваний, например пароксизмальная ночная гемоглобинурия, миелодистрофический синдром (при ИСТ), что требует значительных дополнительных затрат.
Для уменьшения затрат по первым четырем показателям необходимы длительное время и развитие новых медицинских технологий. По остальным же параметрам существует реальная возможность оптимизировать использование имеющихся средств и сил.
Первый и наиболее простой способ добиться экономии по показателю 5 — раннее начало лечения. Известно, что раннее начало терапии позволяет добиться лучших результатов в случае ТКМ за счет уменьшения числа трансфузий препаратов крови. Результаты выживаемости после ТКМ различаются в группах больных с разным количеством трансфузий в анамнезе. Для больных с частыми трансфузиями выживаемость составляет около 50%, а для больных, получивших менее 10 трансфузий, — 90% [3]. В случае более раннего назначения ИСТ больше вероятность достижения гематологического ответа, и меньше — развития резистентности к трансфузиям и соответственно риск возникновения смертельных кровотечений.
Если до начала терапии имеется длительный период нейтропении, то значительно увеличивается риск развития бактериальных и грибковых осложнений и, следовательно, ухудшается общий прогноз у больных и увеличиваются затраты на антибиотики, противогрибковые препараты и ростовые факторы.
Естественно, что при достижении ремиссии заболевания в ответ на первый курс ИСТ уменьшает ся вероятность затрат на последующие курсы антитимоцитарного иммуноглобулина (хотя последние не исключены при развитии рецидива АА).
Рассмотрим более подробно расходы, связанные с проведением одного курса лечения.
Трансфузии . Расходы на трансфузии складываются из следующих затрат:
— покупка и амортизация оборудования для приготовления концентрата тромбоцитов;
— оплата одноразовых систем для забора крови и расходных материалов. В научно-исследовательском институте детской гематологии для работы на аппарате "Baxter Fenwall CS3000+" используются соответственно системы компании "Baxter". Стоимость одной системы составляет около 130 долларов США. В итоге стоимость одной трансфузии концентрата тромбоцитов для среднестатистического больного АА с массой тела 40 кг составляет 80 долларов США;
— фильтры для очистки препаратов крови от примеси лейкоцитов.
Очевидно, что для уменьшения затрат выгодно уменьшить количество трансфузий, получаемых больным. Для этого необходимо добиться как можно более раннего ответа на терапию и восстановления числа собственных тромбоцитов. Кроме того, одна из основных причин увеличения числа трансфузий — развитие резистентности к ним. С целью предотвращения развития резистентности в настоящее время используются такие методы, как ограничение пула доноров для каждого больного и использование при заготовке препаратов крови (эритроцитной массы или тромбоцитов) банковских лейкоцитарных фильтров IV поколения производства компаний PALL или "Terumo".
Применение современных лейкоцитарных фильтров позволяет снизить частоту развития рефрактерности к трансфузиям тромбоцитов в 5—6 раз. Стоимость одного фильтра составляет 50 долларов США.
Лекарственные препараты, необходимые для базисной терапии. Протоколы ТКМ и ИСТ, позволяющие добиться максимального уровня выживаемости больных, включают следующие препараты (табл. 2.) [4].
Стоимость базисных препаратов сравнима при обоих вариантах лечения.
Сегодня максимальное число споров возникает по поводу того, насколько экономически оправданно использование ростовых факторов в сочетании с комбинированной ИСТ. В настоящее время показано, что использование гранулоцитарных колониести мулирующих факторов в сочетании с комбинирован ной ИСТ не дает преимуществ в частоте ответа на терапию, однако при этом в 90% случаев отмечается ответ нейтрофильного ростка, а выживаемость больных при использовании таких протоколов лечения составляет около 80%. На основании этого в большинство современных протоколов включено использование гранулоцитарных колониестимулирующих факторов для лечения тяжелой и очень тяжелой апластической анемии [5], а результаты их применения сравнимы с результатами ТКМ.
Лечение 11 больных с тяжелой и очень тяжелой АА в нашем институте с использованием комбинированной ИСТ и гранулоцитарных колониестимулирующих факторов позволило получить ответ у 8 (81%) больных. При этом у 10 (92%) из них отмечался ответ нейтрофильного ряда и у 7 количество гранулоцитов повышалось до 0,5·10 9 /л и более в первые 2—3 нед терапии [6].
Лечение осложнений. Инфекционные осложнения. Стоимость лечения инфекционных осложнений примерно одинакова как при ТКМ, так и при ИСТ (табл. 3.)
Очевидно, что более оправданно предупреждать инфекционные осложнения, чем их лечить. Первым этапом такой профилактики является простое обеспечение санитарного режима, включающего обычное мытье рук персонала, использование пищи с низким содержанием бактерий и т.д. [7].
Стерилизация воздуха в отделении ТКМ обеспечивается путем использования боксов с ламинарными потоками воздуха и HEPA (High Efficiency Particle Arresting) фильтрами, стоимость которых входит в стоимость койки в этих отделениях. В гематологических отделениях для больных с очень тяжелой и тяжелой АА возможно использование передвижных установок для HEPA-фильтрации воздуха ("Пеликан", Россия; стоимость одного фильтра около 2500 долларов США). Существуют также индивидуальные маски с HEPA-фильтрами (производятся компанией ЗМ; стоимость 1700 рублей), которыми больные в нашем институте пользуются в течение всего периода нейтропении.
Самыми тяжелыми осложнениями, требующими максимально интенсивного и дорогого лечения, на сегодняшний день являются грибковые инфекции, в частности инвазивный аспергиллез. Не следует забывать, что в стоимость лечения этих осложнений входит стоимость как оперативного лечения в случае некротизирующего аспергиллеза или аспергиллезом легких, так и послеоперационного наблюдения в отделении реанимации. В НИИ детской гематологии наблюдались 16 больных инвазивным аспергиллезом, у которых заболевание развилось на фоне приобретенной АА. Из них 15 умерли.
Трансфузионная зависимость . Лечение собственно трансфузионной зависимости не является дорогостоящим и чаще всего представляет собой пульс-терапию дексаметазоном в дозе 20 мг/м 2 . Однако увеличение потребности в трансфузиях влечет за собой огромные расходы, о которых упоминалось выше и, несомненно, требует профилактики.
Специфические осложнения. Основное осложнение при проведении ТКМ — РТПХ, для профилактики которой в настоящее время оптимальным является использование циклоспорина А в сочетании с коротким курсом метотрексата [8]. Для лечения больных с реакцией "трансплантат против хозяина" (РТПХ) затраты зависят от тяжести заболевания, однако, по нашему опыту, из 15 больных с приобретенной АА РТПХ III—IV степени развилась у 2 больных и в одном случае стала причиной смерти, т.е. при трансплантации по поводу приобретенной АА это осложнение не является частым.
Проблема лечения отдаленных осложнений гораздо более характерна для ИСТ. На сегодняшний день примерно у 30% больных, ответивших на один курс ИСТ, развивается рецидив заболевания [9], вследствие чего требуется повторный курс ИСТ и соответственно как минимум удваиваются затраты на лечение. Естественно, проведение повторного курса ИСТ показано также больным, не ответившим на первый курс. К отдаленным осложнениям относятся и поздние клональные аномалии (пароксизмальная ночная гемоглобинурия, миелодистрофический синдром), которые развиваются примерно у 10% пациентов [10], что вызывает необходимость в специальном лечении.
Основное отличие результатов ТКМ от результатов комбинированной ИСТ на сегодняшний день состоит в том, что успешная ТКМ позволяет говорить о полном выздоровлении больного и, следовательно, исключает расходы на длительное, многоэтапное лечение, которое требуется некоторым больным, получающим комбинированную ИСТ. Однако, с точки зрения длительной выживаемости, современные протоколы ИСТ позволяют получить результаты, сравнимые с таковыми при ТКМ.
Таким образом, существующие в настоящее время протоколы лечения приобретенной АА при правильном использовании позволяют добиться высокой выживаемости больных: 75% 5-летней выживаемости при ТКМ и 75% 5-летней выживаемости при использовании комбинированной ИСТ [11]. Такие результаты свидетельствуют о том, что использование этих протоколов выгодно сегодня как с медицинской, так и с экономической точки зрения.
1. The Managed Health Care Handbook. Aspen Publishers, Inc. Gaithersburg, Maryland 1996;9—15.
2. Bacigalupo A., Hows J., Gluckman E., et al. Bone marrow transplantation (BMT) versus immunosupression for the treatment of severe aplastic anaemia (SAA): A report of the EMBT SAA Working Party. Br J Haematol 1988;177:70.
3. Storb R., Prentice R.L., Thomas E.D: Marrow transplantation for treatment of aplastic anaemia. An Analysis of factors associated with graft rejection. N Engl J Med 1977;296:61—5.
4. Storb R., Erzioni R., Anasetti C., et al. Cyclophosphamide combined with antithymocyte globulin in preparation for allogeneic marrow transplants in patients with aplastic anemia. Blood 1994;84:941—9.
5. Bacigalupo A., Broccia G., Corda G., et al. Antilymphocyte globulin, cyclosporine and granulocyte colony-stimulating factor in patients with acquired severe aplastic anemia (SAA): A pilot study of the EBMT SAA working party. Blood 1995;85:1348—53.
6. Масчан А.А. Лечение приобретенных апластических анемий у детей. Детский доктор 1999;3:31—5.
7. Масчан А.А., Богачева Н.Ю. Сопроводительное лечение апластических анемий у детей. Методические рекомендации. НИИ ДГ 2000.
8. Passweg J.R., Socie G., Hinterberger W., et al. Bone marrow transplantation for severe aplastic anemia: Has outcome improved? Blood 1997;9:858—64.
9. Schrezenmeier H., Marin P., Raghavachar A., et al. Relapse of aplastic anemia after immunosupressive treatment: A report from the EBMT Group SAA Working Party. Br J Haematol 1993;85:371—7.
10. Tichelli A., Gratwohl A., Wursch A., Nissen C., Speck B. Late hematological complications in severe aplastic anaemia. Br J Haematol 1988;69:413—8.
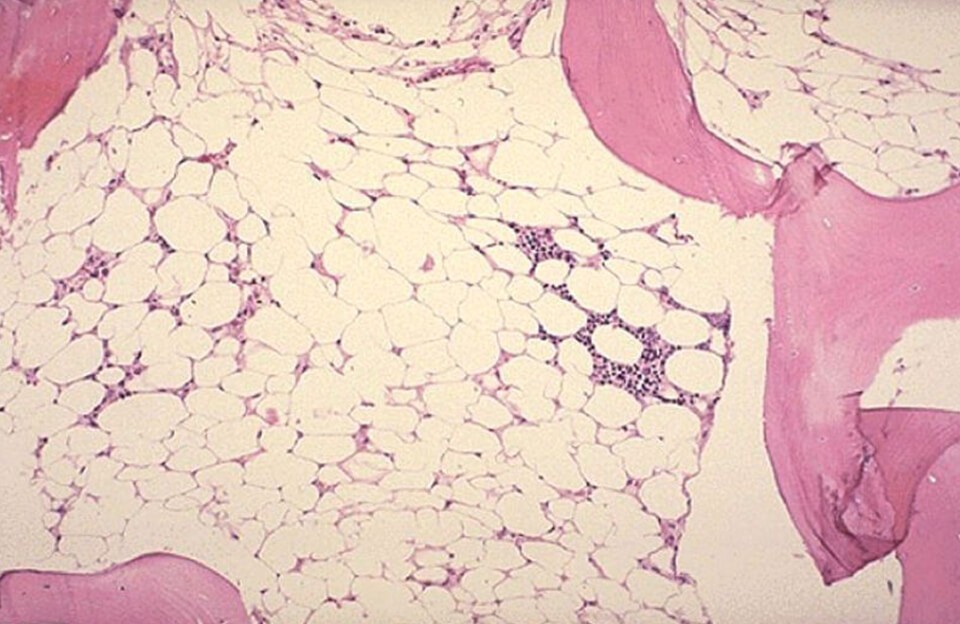
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри - физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом - выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О 2 и СО 2 ), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, - резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов - причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда - аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение - это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности - избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет - 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
Читайте также:


