Иммунный ответ при инфекционных заболеваниях
У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
Пик продукции цитокинов после стимуляции макрофагов наблюдается через 1-2,6,18-48 ч, а пик продукции интерферон-гамма наступает через 20 ч после первого выхода цитокина из клетки. Поскольку интерферон-гамма ингибирует миелопоэз, то нормализация числа нейтрофилов после элиминации инфекта связана с системой регуляции нейтропоэза. Через 6 ч после стимуляции интерферон-альфа для выполнения своих функций NK-rклетки (активность которых регулируется ИЛ-1, 4, 2) продуцируют гамма-интерферон, в результате чего происходит лизис инфицированных клеток.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
- Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. - СПб, 2003.
- Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. - СПб, 2003.
- Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. СПб, 2007. - 254 с.
- Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. - М., 2006. - С.226-247.
- Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. - М., 2005. - С.159-175.
- Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М., 2005. - С.287-292.
- Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. - М., 2002.
- Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. - М., 2004. - С.5-9.
- Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
- Романцов М.Г., Ершов Ф.И.Часто болеющие дети: Современная фармакотерапия. - М., 2006. - 192 с.
- Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. - Санкт-Петербург. - 2004. - С.82-95.
- Лекарственные средства в фармакотерапии патологии клетки / под ред. Т.Г.Кожока. - М., 2007.
Неспецифический иммунный ответ - это первый этап борьбы с инфекцией он запускается сразу же после попадания микроба в наш организм. В его реализации задействованы система комплимента, лизоцим, тканевые макрофаги. Неспецифический иммунный ответ практически одинаков для всех типов микробов и подразумевает первичное разрушение микроба и формирование очага воспаления. Воспалительная реакция это универсальный защитный процесс, который направлен на предотвращение распространения микроба. Неспецифический иммунитет определяет общую сопротивляемость организма. Люди с ослабленным иммунитетом чаще болеют различными заболеваниями.
Специфический иммунитет это вторая фаза защитной реакции организма. Основной характеристикой специфического иммунного ответа является распознавание микроба и выработка факторов защиты направленных специально против него. Процессы неспецифического и специфического иммунного ответа пересекаются и во многом дополняют друг друга. Во время неспецифического иммунного ответа часть микробов разрушается, а их части выставляются на поверхности клеток (например, макрофагов). Во второй фазе иммунного ответа клетки иммунной системы (лимфоциты) распознают части микробов, выставленные на мембране других клеток, и запускают специфический иммунный ответ как таковой. Специфический иммунный ответ может быть двух типов: клеточный и гуморальный.
Клеточный иммунный ответ подразумевает формирование клона лимфоцитов (К-лимфоциты, цитотоксические лимфоциты), способных разрушать клетки мишени, мембраны которых содержат чужеродные материалы (например, вирусные белки).
Клеточный иммунитет задействован в ликвидации вирусной инфекции, а также таких типов бактериальных инфекций как туберкулез, проказа, риносклерома. Раковые клетки тоже разрушаются активированными лимфоцитами.
Гуморальный иммунный ответ опосредован В-лимфоцитами, которые после распознания микроба начинают активно синтезировать антитела по принципу один тип антигена – один тип антитела. На поверхности одного микроба может быть множество различных антигенов, поэтому обычно вырабатывается целая серия антител, каждое из которых при этом направлено на определенный антиген. Антитела (иммуноглобулины, Ig) – это молекулы белков, способные прилипать к определенной структуре микроорганизма, вызывая его разрушение или скорейшее выведение из организма. Теоретически возможно формирование антител против любого химического вещества, имеющего достаточно большую молекулярную массу. Существует несколько типов иммуноглобулинов, каждый из которых выполняет специфическую функцию. Иммуноглобулины типа А (IgA) синтезируются клетками иммунной системы и выводятся на поверхность кожи и слизистых оболочек. В больших количествах IgA содержатся во всех физиологических жидкостях (слюна, молоко, моча). Иммуноглобулины типа А обеспечивают местный иммунитет, препятствуя проникновению микробов через покровы тела и слизистые оболочки.
20. Схема Th1 ответа. Эффекторы клеточного ответа.
Пусковым звеном в формировании клеточного типа иммунного ответа является продукция макрофагом, на территории которого идет процессинг антигена, интерлейкина ИЛ-12. События развиваются следующим образом.
Выделяют три основные группы Т- лимфоцитов- помощники (активаторы), эффекторы, регуляторы.
Первая группа- помощники (активаторы), в состав которых входят Т- хелперы1, Т- хелперы2, индукторы Т- хелперов, индукторы Т- супрессоров.
1. Т- хелперы1 несут рецепторы CD4 (как и Т- хелперы2) и CD44, отвечают за созревание Т- цитотоксических лимфоцитов (Т- киллеров), активируют Т- хелперы2 и цитотоксическую функцию макрофагов, секретируют ИЛ-2, ИЛ-3 и другие цитокины.
2. Т- хелперы2 имеют общий для хелперов CD4 и специфический CD28 рецепторы, обеспечивают пролиферацию и дифференцировку В- лимфоцитов в антителпродуцирующие (плазматические) клетки, синтез антител, тормозят функцию Т- хелперов1, секретируют ИЛ-4, ИЛ-5 и ИЛ-6.
3. Индукторы Т- хелперов несут CD29, отвечают за экспрессию антигенов HLA класса 2 на макрофагах и других А- клетках.
4. Индукторы Т- супрессоров несут CD45 специфический рецептор, отвечают за секрецию ИЛ-1 макрофагами, активацию дифференцировки предшественников Т- супрессоров.
Вторая группа- Т- эффекторы. В нее входит только одна субпопуляция.
5. Т- цитотоксические лимфоциты (Т- киллеры). Имеют специфический рецептор CD8, лизируют клетки- мишени, несущие чужеродные антигены или измененные аутоантигены (трансплантант, опухоль, вирус и др.). ЦТЛ распознают чужеродный эпитоп вирусного или опухолевого антигена в комплексе с молекулой класса 1 HLA в плазматической мембране клетки- мишени.
Третья группа- Т-клетки- регуляторы. Представлена двумя основными субпопуляциями.
6. Т- супрессоры имеют важное значение в регуляции иммунитета, обеспечивая подавление функций Т- хелперов 1 и 2, В- лимфоцитов. Имеют рецепторы CD11, CD8. Группа функционально разнородна. Их активация происходит в результате непосредственной стимуляции антигеном без существенного участия главной системы гистосовместимости.
7. Т- контсупрессоры. Не имеют CD4, CD8, имеют рецептор к особому лейкину. Способствуют подавлению функций Т- супрессоров, вырабатывают резистентность Т- хелперов к эффекту Т- супрессоров.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
В настоящее время острые респираторные инфекции (ОРВИ), включая грипп, представляют собой одну из самых актуальных медицинских и социально-экономических проблем. Терапия острых респираторных инфекций (ОРИ) у детей остается важной задачей практического здравоохранения. В статье приведены данные по эпидемиологии, этиологии ОРИ, представлена клиническая картина ОРИ. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути. В статье рассмотрены результаты исследований по изучению эффективности влияния пробиотических микроорганизмов на состояние мукозального иммунитета, а также продемонстрированы клинические эффекты. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12. Описаны пробиотические продукты, содержащие живые микробные культуры с доказанными пробиотическими свойствами, целесообразность их включения в рацион питания детей.
Ключевые слова: острые респираторные инфекции, мукоза-ассоциированная лимфоидная ткань, микробиота, Bifidobacterium lactis ВВ-12, пробиотик.
Для цитирования: Каннер Е.В., Максимов М.Л., Ермолаева А.С., Горелов А.В. Острые респираторные инфекции у детей: особенности иммунного ответа и пути коррекции. РМЖ. Медицинское обозрение. 2018;8(II):74-78.
Acute respiratory infections in children: features of the immune response and ways of correction
E. V. Kanner 1 , M.L. Maximov 2 , A.S. Ermolaeva 3 , A.V. Gorelov 1,3
1 Central Research Institute of Epidemiology, Moscow
2 Kazan State Medical Academy — Russian Medical Academy of Continuing Professional Education
3 Sechenov University, Moscow
Nowadays, acute respiratory infections (ARI), including influenza, are one of the most pressing medical and socio-economic problems. Therapy of acute respiratory infections (ARI) in children remains an important task of practical health care. The article presents data on the epidemiology, etiology and clinical picture of ARI. Interaction factors and mechanisms of a mucous membrane immune system of digestive and respiratory tracts are described in detail. It has been shown that an intestinal microbiota has a directly modulating effect on the immune response in relation to pathogens affecting the respiratory tract. The article discusses the results of studies on the effectiveness of probiotic microorganisms on the state of mucosal immunity and demonstrates clinical effects. The results of a number of studies demonstrating the clinical efficacy of the probiotic strain of bifidobacteria Bifidobacterium animalis subsp. lactis BB-12 are given. Probiotic products containing live microbial cultures with proven probiotic properties, the expediency of their inclusion in children diet are described.
Key words: acute respiratory infections, mucosal-associated lymphoid tissue, microbiota, Bifidobacterium lactis BB-12, probiotic.
For citation: Kanner E. V., Maximov M.L., Ermolaeva A.S., Gorelov A.V. Acute respiratory infections in children: features of the immune response and ways of correction // RMJ. Medical Review. 2018. № 8(II). P. 74–78.
В статье приведены данные по эпидемиологии, этиологии острых респираторных инфекций, представлена их клиническая картина. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12.
Иммунная система СО организма играет огромную роль в развитии, поддержании и регуляции иммунного гомеостаза, являясь важной составляющей многокомпонентной системы иммунитета, осуществляя защиту организма от генетически чуждых ему экзогенных и эндогенных элементов [10].
Структурной основой местного иммунитета является лимфоидная ткань, ассоциированная с СО (mucosal-associated lymphoid tissue (MALT)). В MALT принято выделять несколько отделов (рис. 1): TALT (носоглотка, евстахиева труба, ухо; NALT (носовая полость, рот и ротоглотка, конъюнктивы), BALT (трахея, бронхи, легкие, грудные железы у женщин), GALT (пищевод, желудок, кишечник и урогенитальный тракт), SALT (дерма) [11]. 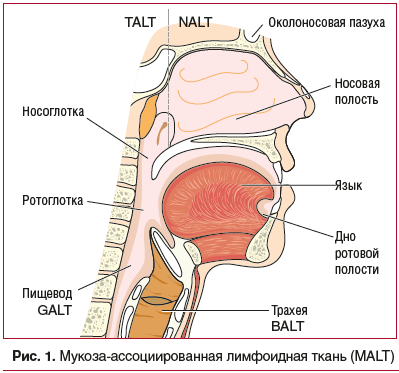
К факторам мукозальной иммунной системы относят сапрофитную микрофлору, защитный эпителий, слизеобразование, кератинизацию и слюнообразование, антимикробные пептиды (лизоцим, дефензины, лактоферрин, интерфероны, пропердин), фагоциты, комплемент, секреторный иммуноглобулин А (sIgA), IgG, врожденные лимфоидные клетки (ILC), включая NK-клетки, CD4+ и CD8+ Т-лимфоциты [10].
Несмотря на то, что в иммунной системе СО выделяют эффекторный и индуктивный отделы, это деление условно, потому что MALT-лимфоциты постоянно мигрируют, заселяя при этом характерные для каждой популяции зоны обитания. Такая закономерность получила название хоминг-эффекта [12]. Следствием этого является одновременное включение иммунного ответа во всех СО, вне зависимости от очага антигенного стимула.
В индуктивных зонах, к которым относят прежде всего пейеровы бляшки, происходит презентация антигена; антигенпрезентирующие клетки и антигенреактивные Т- и В-лимфоциты поступают в лимфу, затем в кровь, а оттуда мигрируют в собственную пластинку СО (эффекторный отдел). Направленная миграция осуществляется с помощью гуморальных факторов (интегрин α4b7, хемокиновый рецептор CCR9 и др.), а точками прикрепления являются хоминг-рецепторы клеток тканей [13]. В норме при отсутствии воспаления лимфоциты мигрируют предпочтительно в ту ткань, где они впервые обнаружили антиген, и поэтому их хоминг-рецепторы специфичны к лигандам, находящимся на клетках этих тканей [14]. Подобное взаимодействие именно между дыхательной и пищеварительной системами специфично, т. к. в экспериментах показано отсутствие такой взаимосвязи между другими органами [15].
Плазматические клетки собственной пластинки и пейеровых бляшек синтезируют димерную молекулу IgA, которая связывается на базальной поверхности эпителиальной клетки со специализированным трансмембранным белком, имеющим в своем составе гликопротеид — секреторный компонент. Пройдя с помощью трансцитоза эпителиальную клетку, димерная молекула IgA присоединяет секреторный компонент, превращается в sIgA, причем секреторный компонент делает молекулу иммуноглобулина устойчивой к протеолизу [16]; sIgA препятствует адгезии микроорганизмов, их токсинов, пищевых аллергенов на эпителии СО и тем блокирует их проникновение во внутреннюю среду организма. Адаптивный иммунитет СО обеспечивается главным образом антителами класса sIgA, в меньшей мере — IgM и IgG [17].
В настоящее время накоплены научные данные, свидетельствующие о том, что отделы СО различных систем организма тесно взаимодействуют между собой, подчиняясь единым регулирующим влияниям. Существует перекрестная регуляция иммунитета легких и кишечника, показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути [18, 19].
Теория единства иммунной системы анатомически не взаимодействующих СО была сформулирована J. Bienenstock около 40 лет назад [20]. Эта концепция предполагает, что различные отделы СО организма функционируют вместе как один системный орган, защищающий организм хозяина от чужеродных организмов. Стимуляция либо поражение слизистой одной системы в значительной мере влияет на СО другой системы. Подход к изучению иммунной системы слизистых как объединенного глобального органа является определяющим для дальнейших достижений в понимании иммунологии слизистых и в лечении многих заболеваний [21].
Особенно тесно такая взаимосвязь осуществляется между пищеварительным и респираторным трактом, т. к. они имеют общее эмбриональное происхождение, функционально сходны — их слизистые имеют контакт с внешней средой и осуществляют функцию первичной защиты от чужеродных патогенов, играя ключевую роль во врожденном и приобретенном иммунитете. В исследованиях было продемонстрировано, что вакцинация слизистой одного отдела ведет к повышению защитной функции слизистой другого отдела, инфицирование вирусом ведет к появлению вирусоспецифичных концентраций иммуноглобулинов в секрете слизистых другого отдела [19]. Также показано, что Т-клетки кишечника, зараженные ротавирусом, осуществляют защиту дыхательного тракта от ротавирусной инфекции [22].
Сообщается об увеличении числа нейтрофилов, эозинофилов и Т-клеток в мокроте пациентов с воспалительными заболеваниями кишечника (ВЗК) [23]. Микробиота ЖКТ играет защитную роль в отношении пневмококковой пневмонии [18].
На сегодняшний день нет точных доказательств существования единого медиатора, который выполнял бы роль связующего звена между кишечником и легкими, однако одним из кандидатов на эту роль является тимический стромальный лимфопоэтин (TSLP). TSLP является главным регулятором воспалительных процессов кожи и дыхательных путей, решающим фактором, регулирующим Th2-воспалительный ответ [24, 25]. Повышенная продукция TSLP в кератоцитах кожи ведет к появлению атопического дерматита с сопутствующим аллергическим воспалением в легких мышей [26].
Интерфероны (ИФН) I и III типа связываются с различными рецепторами на клеточной поверхности, но индуцируют сигналы сходной направленности, что приводит к экспрессии антивирусных эффекторных молекул-хозяев. Хотя было показано, что ИФН III типа (ИФН-λ) преимущественно воздействует на органы СО кишечника, в то же время отмечается и роль ИФН I типа (α), что сопровождается экспрессией рецепторов к нему на эпителиальных клетках, прежде всего дыхательной системы. ИФН-α оказывает влияние на дендритные клетки в лимфоэпителиальном глоточном кольце Пирогова — Вальдейера, активируя созревание незрелых дендритных клеток, стимулирующих, в свою очередь, созревание и пролиферацию В-клеток, а также способствует пролиферации СD4+ и CD8+ Т-23 клеток, усиливает цитотоксические свойства CD8+, макрофагов и NK-клеток [27].
Клетки эпителия кишечника, которые являются основными мишенями для ротавирусной инфекции, более сильно реагируют на ИФН III типа, чем на I тип. Таким образом, именно ИФН-λ (III тип) играет критическую роль в противовирусной защите эпителиальных клеток [28].
Сапрофитная микрофлора (в кишечнике и урогенитальном тракте это лактобактерии и бифидобактерии, в ротовой полости — сапрофитные нейссерии, в дерме — эпидермальный стафилококк) имеет определяющее значение для состояния мукозальной иммунной системы [11, 29]. Ее функции многообразны и включают антагонизм по отношению к патогенной микрофлоре за счет продукции органических кислот, перекиси водорода и бактериоцинов, синтез молочной кислоты и снижение рН, конкуренцию с патогенной флорой за адгезивные сайты (колонизационная резистентность), стимуляцию иммунных ответов за счет адъювантных свойств, стимуляцию муцинообразования [27, 30, 31].
И процессы возрастной эволюции, и закономерности реагирования на внедрение патогенов в биотопах кишечника и респираторного тракта во многом сходны. Так, количественный и качественный состав микробиоты приближается к схожему с таковым у взрослого человека в обоих биотопах к третьему году жизни. Известно, что существует перекрестная регуляция иммунитета легких и кишечника [18, 19, 32].
Это позволяет предположить, что воздействие на микробиоту кишечника может быть удобным инструментом для профилактики не только желудочно-кишечных, но и бронхолегочных заболеваний. Ряд исследований демонстрирует такой эффект при использовании диеты с высоким содержанием клетчатки, что стимулирует на реакцию дыхательных путей у мышей, или при приеме пробиотиков в дородовом или раннем послеродовом периоде для профилактики не только атопической экземы, но и бронхиальной астмы [33–36].
В биотопах человека функционируют устойчивые к инфекции молекулярно-клеточные компартменты, включающие пробиотические бактерии, синтезирующие лектиновые системы с разнообразным антипатогенным потенциалом [37]. Углубленное изучение механизмов участия микрофлоры биотопов в системе мукозального иммунитета позволило установить способность лектинов облигатных бактерий распознавать и связывать при развитии патологических состояний гликаны муцинов с остатками D-галактозамина или нейраминовой кислоты (NeuNAc, Neu5NAc) с участием системы комплемента [38, 39].
При совместном культивировании бифидобактерий и клеток кишечного мукозального барьера последние продуцируют повышенные уровни комплемента C3a, при этом бифидобактерии регулируют активность некоторых участвующих в воспалении генов. Bifidumbacterium breve IPLA20004 могут способствовать рекрутированию клеток врожденного иммунитета в мукозальную оболочку [40].
Только для зарегистрированных пользователей
Читайте также:


