Генферон кто лечил папиломо-вирусной инфекции
Группа вирусов ВПЧ входит в семейство папилломавирусов, которое включает 5 родов, порядка 43 разновидностей и почти 170 типов, именно ВПЧ является причиной образования бородавок. Существует его прямая взаимосвязь связь с раком шейки матки: в 92% случаев заболевания раком обнаруживается этот вирус.

Основные направления в исследовании — это определение вирусной нагрузки, то есть количественный показатель и определение типа вируса методом ПЦР.
По сути, папиллома — это доброкачественная опухоль, но она таит в себе и опасности. Во-первых, возможно повреждение ее целостности, приводящее к формированию рубцов, редко к заражению крови. Не рекомендуется удалять механически папилломы самостоятельно, это может привести к генерализации процесса и распространению папиллом по всему телу. Самая главная опасность папиллом заключается в том, что они вирусные. Большинство видов ВПЧ не представляют угрозу для здоровья и жизни человека, но ВПЧ 16 и 18 типа могут спровоцировать развитие злокачественных образований. Доброкачественные папилломы, как правило, доставляют много неприятностей человеку. Они могут увеличиваться до больших размеров, могут образовываться в области половых органов. Некоторые виды ВПЧ вызывают предраковые заболевания.
ВПЧ может передаваться различными путями. При контактно-бытовом способе передачи вирус через кожу при рукопожатиях и использовании средств личной гигиены, после примерки чужой одежды и нижнего белья, при посещении общественных бассейнов и саун. Особо опасным считается половой путь передачи вируса, так как при этом существует высокий риск заражения ВПЧ онкогенного типа. Вероятность передачи вируса половым путем намного выше, если у партнера есть остроконечные кондиломы. ВПЧ может передаваться от матери к ребенку во время родов, крайне редко это происходит во время беременности. При этом чаще всего у детей развивается папилломатоз гортани, опасный серьезными нарушениями дыхательной функции. Возможно заражение ребенка от матери при кормлении грудью.

Медикаментозное лечение вируса проводится с помощью лекарственных препаратов, которые воздействуют на причину заболевания, а также восстанавливают функцию иммунной системы. Существуют различные схемы внутривенного введения лекарств, врачи, как правило, назначают лечение индивидуально, стандартных схем нет. Какие препараты обычно назначают? Циклоферон, Интерферон альфа, Панавир, Ингарон. Таблетированные формы противовирусных препаратов: Изопринозин, Ликопид, Лавомакс, Алпизарин. Свечи: Генферон, Бетадин, Виферон. Мази: Оксолиновая мазь, San Fen Zhong мазь, Стефалин, Салициловая мазь. Витамины: Аевит, Алфавит.
Полностью избавиться от ВПЧ при современном уровне фармацевтической промышленности еще невозможно, но можно предупредить заражение инфекцией и для этого проводится вакцинация таким препаратом, как Гардасил. В некоторых странах эти прививки уже являются обязательными, в России сделать вакцинацию можно добровольно. При выборе такого способа профилактики ВПЧ необходимо пройти предварительное обследование на определение наличия вируса в организме. В состав вакцин входят синтетически модифицированные белки, сходные со структурой вируса. Введение в организм этих белков активизирует работу иммунной системы и приводит к выработке антител, защищающих от развития ВПЧ после проникновения возбудителя в организм. Разработчики вакцины советуют ставить препарат девочкам и мальчикам от 10 до 12 лет. Связано это с тем, что в этом возрасте половых контактов в подавляющем большинстве случаев нет, а иммунная система работает в полную силу, что способствует хорошей ответной реакции на препарат.
Самым опасным типом ВПЧ, вызывающий злокачественные образования считаются следующие: ВПЧ-16; ВПЧ-18; ВПЧ-31, 33, 45, 56, 58; ВПЧ-51, 59, 68; ВПЧ-35, 39, 52.
Наиболее часто рак шейки матки вызывается вирусом папилломы человека 16 и 18 типов, они же вызывают рак половых органов. ВПЧ 16 в 50% случае является причиной рака гортани.
ВПЧ передается половым путем, и при этом сами половые контакты становятся основной причиной заражения папиллома вирусом. Расскажем об этом подробнее.
Папилломы, расположенные на половом члене являются признаком папилломавирусной инфекции, следственно заражение половым путем вполне логично. Инкубационный период при ВПЧ длится от 1 до 12 месяцев. При этом сами папилломы могут совсем не вырастать, и только при снижении функции иммунной системы может произойти начало их образования. Поэтому обнаружение ВПЧ в организме на ранних стадиях развития заболевания возможно исключительно с помощью специальных анализов. В настоящее время, ВПЧ является одним из самых распространенных заболеваний и риск заражения партнера при незащищенном половом акте является практически 100%.
Все разновидности ВПЧ по степени риска возникновения злокачественного перерождения можно разделить на следующие: низкой степени риска, средней степени риска и высокой степени онкогенного (канцерогенного) риска.
Остроконечные кондиломы в области гениталий, как правило, не вызываются вирусом с высокой степень онкогенности. Плоскоклеточные папилломы являются злокачественными новообразованиями. Пациенты, у которых диагностируются плоскоклеточные папилломы находятся в группе повышенного риска и требуют незамедлительного лечения.
Если у пациента обнаружен ВПЧ онкогенной группы, для профилактики появления онкологических процессов в организме необходимо уделять внимание иммунной системе, регулярно сдавать анализы и наблюдаться у врача.

Если в организме женщины обнаружен ВПЧ, но при этом нет внешних проявлений в виде образования папиллом, то рожать можно спокойно и не волноваться. Если есть остроконечные кондиломы в области гениталий, то существует очень высокий риск заражения ребенка ВПЧ во время прохождения по родовым путям. Первый самостоятельный вдох ребенка может произойти прямо в родовых путях, вирус попав в горло малыша приводит к разрастанию папиллом на его голосовых складках. Поэтому при наличии генитальных папиллом и активной формы ВПЧ показано кесарево сечение.
По статистическим данным, в 85 % случаев ВПЧ после заражения устраняется организмом самостоятельно, благодаря хорошей работе иммунной системы. Этот процесс может длиться от нескольких месяцев до нескольких лет. Иногда пребывание вируса в организме человека можно не обнаружить даже при медицинском обследовании. Полностью подтвердить наличие ВПЧ можно при наличии образований на коже — папиллом.
- Избегать кожных повреждений и своевременно их лечить, так как даже микроскопические повреждения — это отличные возможности для инфекции попасть в организм.
- Поддерживайте чистоту тела и соблюдайте личную гигиену.
- Поддерживайте свою иммунную систему на должном уровне, регулярно принимайте витамины.
- Все препараты, направленные на повышение функции иммунной системы, необходимо принимать только по назначению врача.
- Если у вас на теле есть папилломы — обратитесь к врачу и удалите их.
Удалить папиллому можно медикаментозно. Но наиболее эффективным методом принято считать хирургическую методику, лазерную хирургию и электрохирургическое удаление. Обычный хирургический метод удаления применяется не часто, после него часто возникают рецидивы возникновения образований. Удаление с помощью лазера считается самым лучшим в мире, при этом удаление безболезненно и безопасно, не оставляет после себя шрамов и рубцов. Радиохирургическое удаление производят под местной анестезией, результат достаточно хороший и стойкий. 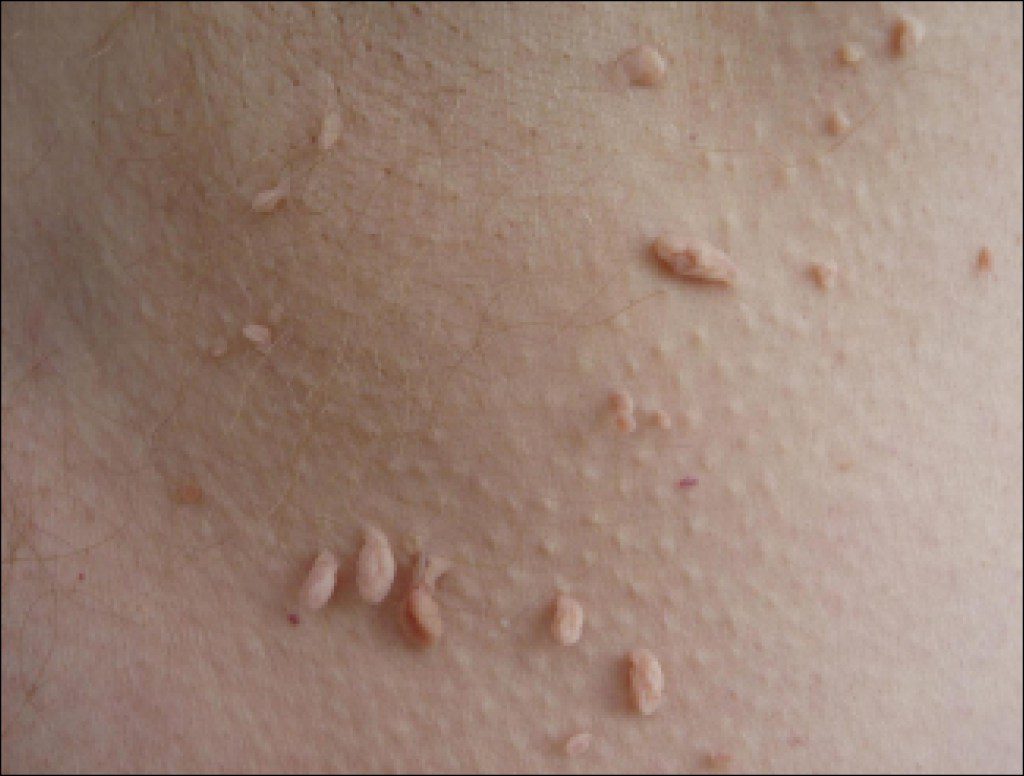
Чаще всего папилломы локализуются в области подмышек и в паху, рядом с половыми органами. Нередко образования встречаются под молочными железами, на шее, веках.
Папилломатоз гортани — весьма тяжёлое заболевание, при котором нарушается голосообразование и дыхательная функция. В детском возрасте распознают симптомы заболевания в возрасте от одного до пяти лет. Если вы отмечаете хриплый голос у ребенка, кашель, затруднение дыхания или ощущение кома в горле, необходимо сразу показать его врачу.


Автореферат диссертации по медицине на тему Клиническая эффективность и тактика применения генферона и йодантипирина при папилломавирусной инфекции гениталий
На правах рукописи
ЧУКАЕВА ЛАРИСА МИХАЙЛОВНА
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ И ТАКТИКА ПРИМЕНЕНИЯ ГЕНФЕРОНА И ЙОДАНТИПИРИНА ПРИ ПАПИЛЛОМАВИРУСНОЙ ИНФЕКЦИИ ГЕНИТАЛИЙ
14.00.25 - фармакология, клиническая фармакология 14.00.01 - акушерство и гинекология
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
доктор медицинских наук, профессор, заслуженный работник высшей школы РФ
доктор медицинских наук
доктор медицинских наук доктор медицинских наук
Венгеровский Александр Исаакович Шперлинг Игорь Алексеевич
Трифонова Ольга Юрьевна Махмутходжаев Алишер Шавкатович
Ведущая организация: ГОУ ВПО «Алтайский государственный
Защита состоится " 2.Ц " генферон > йодантипирин (табл. 2).
Противорецидивный эффект терапии зависел от варианта течения ПВИ гениталий. При вирусоносительстве высокая клиническая эффективность отмечалась при всех схемах терапии. В течение 1 года после начала лечения манифестации ПВИ у пациенток не было, кроме 1 случая после лечения генфероном (табл. 3). Данные результаты свидетельствуют о необходимости терапии носителей ВПЧ с целью профилактики манифестации заболевания. При клинических формах ПВИ максимальный лечебный эффект оказывала комбинация генферона и йодантипирина, что связано с непосредственным влиянием генферона на очаг инфекции и системным действием йодантипирина как стимулятора противовирусного иммунитета. При этом эффективность терапии была меньшей по сравнению с результатами лечения в 1 группе. Лучших результатов удалось добиться у пациенток, лечившихся по комбинированной схеме, менее значимых - при введении генферона: доля пациенток с рецидивами в И и III группах после лечения генфероном в сочетании с йодантипирином бы-
ла меньше на 43% относительно значений при терапии генфероном. Комбинированная терапия оказывала сравнительно большее противорецидивное действие: в течение 1 года после начала лечения частота рецидивов у больных с первым клиническим эпизодом была в 2,8 и 1,5 раза меньше, чем после приема генферона и йо-дантипирина, при рецидивирующем кондиломатозе - снижалась в 4,1 и 1,5 раза соответственно (табл. 3).
Выраженность клинических проявлений (в баллах) через 5 и 10 сут после деструкции кондилом у больных папилломавирусной инфекцией гениталий, вызванной вирусом папилломы человека 6,11 типов, Х*т
Показатели Исследуемые группы
Боль в области удаления кондилом, баллы 1,2±0,1 * 1,0 1,6*0.1 -н-1,3*0,1 10 1,0 10 ** 1,0 1.6*0.1 ++ 1,3*0,1 10 1,0
Эритема, баллы 1.5*0,1 *** 1,3*0,1 ** 2.6*0.1 +++ 1,9*0,1 +++ 1.2*0.1 1,0 1,6*0,1 * 1,2*0,1 2,2*0,2 + 1,5*0,1 1.5*0.1 1,1*0,1
Средняя сумма баллов 4,1*0,3 3,6*0,2 6,8*0.4 +++ 5,5*0,4 +++ 3,3*0,2 3,0 3,7*0,3 *** 3,1*0,1 * 5,7*0.3 +++ 4,0*0,4 + 3.6*0.3 3,1*0,1
Средняя продолжительность периода заживления после деструктивного лечения, сут 6,9*0,3 *** 12,4*0,4 +++. 6,6*0,3 6,4±0,2 «** 12,2*0,4 +++ 6,3*0,2
Примечание: в числителе - показатели через 5 сут, в знаменателе - показатели через 10 сут после начала лечения; * / ** / *** - уровень достоверности различий относительно соответствующих значений в подгруппе Б (р u£ix 13,7±1,3 15,7±1,2 4,9±0,6 16,4±1,7 6,7±1,1
ФНО-а, пг/мл 16,4±1,9 24,9±2,5 * 43,4±3,1 ****** 44,6±3,1 ****** 6,2±0,7 12,9±1,8 12,3±1,0 ### 15,9±1,9
Примечание: здесь и в табл. 7 в числителе - показатели через 40 сут, в знаменателе - через 3 мес после начала лечения; */**/***- уровень достоверности различий относительно соответствующих значений в группе здоровых доноров (р Чукаева, Лариса Михайловна :: 2009 :: Томск
ГЛАВА 1. Обзор литературы
Современные представления о механизмах действия и клиническое применение препаратов интерферона и индукторов интерферона при папилломавирусной инфекции гениталий.Ю
1.1. Механизмы действия препаратов интерферона и индукторов интерферона
1.1.1. Препараты интерферона.
1.1.2. Индукторы интерферона.
1.2. Роль цитокинов в противовирусной защите организма.
1.3. Этиопатогенез и клинические проявления папилломавирусной инфекции гениталий.
1.4. Применение препаратов интерферона и индукторов интерферона при папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов.
ГЛАВА 2. Материал и методы исследования.
2.1. Дизайн исследования.
2.1.1. Распределение больных по группам исследования.
2.1.3. Динамический контроль эффективности лечения.
2.2. Фармакологическая характеристика исследованных препаратов.
2.3. Клиническая характеристика больных.
2.4. Методы исследования.
2.4.1. Наружный осмотр.
2.4.2. Исследование тканей на присутствие ДНК ВПЧ.
2.4.3. Исследование иммунного статуса.
2.4.4. Определение уровня цитокинов в крови.
2.5. Статистическая обработка результатов.
ГЛАВА 3. Результаты исследования.
3.1. Влияние генферона, йодантипирина и их комбинированного применения на клинические симптомы и течение папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6,
3.2. Особенности иммунного статуса больных папилломавирусной инфекцией гениталий, вызванной вирусом папилломы человека 6, 11 типов, после лечения генфероном, йодантипирином и их комбинацией
3.3. Динамика уровня цитокинов в крови больных папилломавирусной инфекцией гениталий, вызванной вирусом папилломы человека 6, 11 типов, после лечения генфероном, йодантипирином и их комбинацией
3.4. Влияние генферона, йодантипирина и их комбинированного применения на элиминацию вируса папилломы человека 6, 11 типов из пораженных тканей.
3.5. Побочные эффекты генферона, йодантипирина и их комбинированного применения при лечении папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов
ГЛАВА 4. Обсуждение результатов.
4.1. Клинические эффекты генферона, йодантипирина и их комбинированного применения при папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов.
4.2. Иммунотропное влияние генферона, йодантипирина и их комбинированного применения при папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов.
4.3. Тактика применения генферона, йодантипирина и их комбинации при папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов. ЮО
Введение диссертации по теме "Фармакология, клиническая фармакология", Чукаева, Лариса Михайловна, автореферат
Актуальность проблемы. Проблема папилломавирусной инфекции человека в последние годы приобрела особую значимость, что обусловлено высокой контагиозностью, широкой распространенностью и онкогенным потенциалом ее возбудителя - вируса папилломы человека [Скрипкин Ю.К. и соавт., 1998; Александрова Ю.Н. и соавт., 2000; Jenkins D., 2001; Новик В.И., 2002]. Число инфицированных людей в мире за последнее десятилетие увеличилось более чем в 10 раз, в России регистрируется 34 случая папиллома-вирусной инфекции на 100 000 населения. Папилломавирусной инфекции подвержены люди всех возрастных групп, но пик заболеваемости приходится на репродуктивный период, что представляет серьезную медико-социальную проблему [Скрипкин Ю.К. и соавт., 1998; Адаскевич В.П. и соавт., 2003; Кулаков В.И., 2003; Исаков В.А. и соавт., 2007]
В общей структуре заболеваемости папилломавирусной инфекцией большую долю занимают поражения генитальной области. Папилломавирус-ные инфекции гениталий вызывает вирус папилломы человека низкоонко-генных (6, 11, 44, 53) и высокоонкогенных (16, 18, 31,33) типов. Инфицирование сопровождается иммунодефицитом, снижает противовирусную защиту, что способствует персистенции возбудителя и рецидиву заболевания [Du-puy С. et al., 1997; Дубенский В.В. и соавт., 2003; Роговская С.И., 2003]. В связи с этим в настоящее время оптимальной тактикой лечения папилломавирусной инфекции считается иммунокорригирующая терапия, направленная на активацию механизмов противовирусного иммунитета, в котором важнейшую роль играет система интерферона. Интерфероны участвуют в реакциях неспецифического противовирусного ответа и регулируют опосредованные лимфоцитами специфические механизмы, направленные на элиминацию вирусов [Arany I. et al., 1998; Ермоленко Д.К. и соавт., 2003; Дмитриев Г.А. и соавт., 2006; Бурместер Г.Р. и соавт., 2007; Исаков В.А., Ермоленко Д.К. и др., 2007].
Широкий спектр действия интерферонов, лежащий в основе их противовирусного, иммуномодулирующего и антипролиферативного эффектов, обосновал применение препаратов интерферона и индукторов интерферона при папилломавирусной инфекции гениталий [Сухих Г.Т. и соавт., 2000; Уд-жуху В.Ю. и соавт., 2005]. Это позволило существенно повысить эффективность лечения, но не решило проблему рецидивирования, что связано со сложным иммунопатогенезом, трудностью своевременной диагностики ранних стадий папилломавирусной инфекции, отсутствием общепринятых подходов к интерферонотерапии и критериев ее эффективности. Кроме того, фармакологические свойства препаратов интерферона и индукторов интерферона при различных формах папилломавирусной инфекции гениталий изучены недостаточно. Это диктует необходимость расширения знаний об особенностях лечебного действия данных групп препаратов с целью разработки патогенетически обоснованных подходов к их применению.
Цель исследования. Изучить особенности действия и обосновать тактику применения препарата интерферона генферона и индуктора интерферона йодантипирина при различных формах папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6,11 типов.
1. Оценить клиническую эффективность генферона, йодантипирина и их комбинации при различных формах папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов.
2. Выявить особенности изменений иммунного статуса и содержания цитокинов в крови больных с различными вариантами течения папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов, до и после лечения генфероном, йодантипирином и их комбинацией.
3. Разработать тактику применения генферона и йодантипирина при различных вариантах течения папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов.
С использованием современных методов исследования проведена сравнительная оценка клинической эффективности препарата интерферона (ген-ферон) и индуктора интерферона (йодантипирин) и их комбинации при различных вариантах течения папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6,11 типов. Показано, что при клинически выраженных формах папилломавирусной инфекции гениталий (первый эпизод, рецидивирующее течение кондиломатоза) генферон после деструкции кондилом быстро и эффективно купирует клинические симптомы, но мало эффективен для профилактики рецидивов инфекции; йодантипирин проявляет низкую активность в период клинических проявлений, но существенно снижает частоту рецидивирования инфекции; комбинированное применение генферона и йодантипирина сочетает клинические эффекты монотерапии: купирует клиническую симптоматику и предупреждает развитие рецидивов. Монотерапия генфероном или йодантипирином эффективна для профилактики манифестации папилломавирусной инфекции гениталий при бессимптомном вирусоносительстве вируса папилломы человека 6, 11 типов.
При папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6,11 типов, генферон существенно не влияет на иммунологический статус и концентрацию цитокинов в крови пациентов, йодантипирин стимулирует выработку а-, В-, у- интерферонов, восстанавливает баланс провоспалительных (интерлейкин-2, фактор некроза опухолей-а) и противовоспалительных (интерлейкин-10) цитокинов.
Установлено, что при комбинированной терапии йодантипирином и генфероном папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов, не увеличивается частота побочных эффектов, регистрируемых при монотерапии.
Практическая значимость работы.
Разработан и внедрен в клиничекую медицину алгоритм применения генферона и йодантипирина при генитальной папилломавирусной инфекции, вызванной вирусом папилломы человека 6, 11 типов, в зависимости от характера течения инфекции. При бессимптомном носительстве вируса папилломы человека 6, 11 типов, первом клиническом эпизоде кондиломатоза эффективно раздельное применение генферона и йодантипирина в сочетании с удалением кондилом. При рецидивирующем кондиломатозе необходимо проведение комбинированной терапии генфероном и йодантипирином.
Положения, выносимые на защиту.
1. При папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6,11 типов, генферон после деструкции кондилом купирует клинические симптомы, но не предотвращает развития рецидивов; йо-дантипирин эффективен для профилактики рецидивов.
2. При папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов, генферон существенно не влияет на иммунологический статус, лишь повышает в крови больных концентрацию а-интерферона; йодантипирин проявляет выраженную иммуномодулирующую активность, повышает в крови уровень а-, В-, у- интерферонов, восстанавливает баланс провоспалительных (интерлейкин-2, фактор некроза опухолей-а) и противовоспалительных (интерлейкин-10) цитокинов.
3. При клинических формах папилломавирусной инфекции гениталий, вызванной вирусом папилломы человека 6, 11 типов (первый клинический эпизод, рецидивирующее течение кондиломатоза) необходимо применять комбинированную терапию генфероном и йодантипирином при одновременном удалении кондилом; при бессимптомном вирусоносительстве генферон и йодантипирин в одинаковой степени ускоряют элиминацию вирусов из кожи и слизистых оболочек гениталий и предупреждают манифестацию инфекции.
Публикации. По теме диссертации опубликовано 12 работ, из них 4 в журналах, рекомендованных ВАК для публикации основных результатов диссертационных исследований на соискание ученой степени кандидата медицинских наук.
Объем и структура диссертации. Диссертация изложена на 130 страницах машинописного текста и состоит из введения, 4 глав, заключения, выводов, практических рекомендаций и библиографического списка, включающего 260 источников (186 отечественных и 74 зарубежных). Диссертация иллюстрирована 24 таблицами и 4 рисунками.
- КЛЮЧЕВЫЕ СЛОВА: папилломавирусная инфекция, шейка матки, беременность, ВИЧ, скрининг, дискариоз, кольпоскопия, Генферон
Множественные исследования, проведенные у пациентов с папилломавирусной инфекцией, фиксируют достоверные изменения в иммунной системе на системном и локальном уровнях. Это заставляет искать возможные консервативные средства, ускоряющие регресс данной патологии (27). Данные клинических испытаний различных иммуномодулирующих средств противоречивы (7). Опубликованные результаты мета-анализа не позволяют однозначно судить о возможности использования данных средств (10). Большие надежды возлагаются на потенциал экзогенных интерферонов, которые могли бы повысить локальный иммунитет и снизить активность вируса (2). Интерес представляет отечественный препарат Генферон® в форме суппозиториев, который успешно используется в лечении урогенитальных заболеваний вирусной и бактериальной этиологии. Его основными компонентами являются интерферон человеческий рекомбинантный α-2, таурин и анестезин (1).
Принимая во внимание широкий спектр терапевтических эффектов данного препарата (иммуномодулирующее, противомикробное, противовирусное, репаративное, противовоспалительное, мембрано- и гепатопротекторное, антиоксидантное, нормализующее метаболические процессы действие), он представляется перспективным для лечения LSIL, ассоциированных с высокоонкогенными типами ВПЧ (1, 2).
Изучение терапевтической эффективности и безопасности препарата Генферон® для лечения плоскоклеточных интраэпителиальных поражений шейки матки низкой степени, ассоциированных с вирусами папилломы человека (ВПЧ) высокоонкогенного риска по данным цитологического исследования цервикальных мазков и кольпоскопии, а также оценка возможности элиминации ВПЧ по данным Digene-теста.
Материалы и методы
Вариант исследования – сравнительное рандомизированное двойное слепое плацебо-контролируемое клиническое исследование. Исследование было выполнено на базе Научного центра акушерства, гинекологии и перинатологии Росмедтехнологий в течение 2007 года.
Материал – 40 женщин репродуктивного возраста, инфицированных ВПЧ высокоонкогенного риска по данным Digene-теста, результаты цитологического исследования у которых свидетельствовали о наличии LSIL (в соответствии с классификационной системой Бетесда).
ВПЧ Digene-тест – единственный метод, одобренный FDA для цервикального скрининга и лицензированный Федеральной службой РФ по надзору в сфере здравоохранения и социального развития, осуществлялся в лаборатории иммунологии Центра. Для проведения ПЦР-диагностики были использованы тест-системы, зарегистрированные в МЗ и СР РФ и/или получившие сертификаты производства ГИСК им. Л.А. Тарасевича. Забор материала для проведения исследований производился в одно и то же время суток (утром).
Пап-тест – микроскопическое исследование соскоба клеток цервикального эпителия, взятого с помощью специальных щеток – эндобрашей и шпателей, проводился в лаборатории патоморфологии Центра.
Кольпоскопия проводилась при помощи кольпоскопа фирмы Leisegang (Германия), с использованием традиционных сосудистых тестов и увеличением ×7,5, ×15, ×30.
Критериями включения в исследование были:
- возраст 18 – 50 лет, наличие интраэпителиального поражения шейки матки низкой степени (LSIL) по данным цитологического исследования цервикального мазка;
- наличие ВПЧ высокоонкогенного риска по данным Digene-теста; способность выполнять требования протокола;
- предоставление письменного информированного согласия.
Критериями исключения были:
- беременность;
- тяжелые нарушения функции сердца, легких, печени и почек в стадии декомпенсации; гиперчувствительность к интерферону или другим компонентам препарата, которая устанавливалась по данным анамнеза или в момент первого введения препарата;
- прием противовирусных или иммуномодулирующих препаратов в течение трех предшествующих месяцев;
- наличие более тяжелой патологии шейки матки;
- подтвержденная ВИЧ-инфекция;
- наличие психоневрологических заболеваний.
До начала исследования было получены одобрения Федеральной службы РФ по надзору в сфере здравоохранения и социального развития, национального и локального этических комитетов.
По результатам проводимой рандомизации (выбор одной из двух серий суппозиториев методом случайных чисел), включенным в исследование пациенткам назначались исследуемый препарат или плацебо. Введение суппозиториев Генферон®, содержащих 500000 МЕ интерферона α-2, или внешне неотличимых от них суппозиториев-плацебо, не содержащих ИФН-α и таурин, осуществлялось интравагинально 2 раза в сутки в течение 10 дней с последующим назначением 1 раз в сутки через день в течение трех месяцев. Кодировка суппозиториев осуществлялась в ФГУН ГИСК им. Л.А. Тарасевича.
На протяжении всего исследования женщины использовали барьерные методы контрацепции и вели дневник, в котором отмечались побочные эффекты терапии, их выраженность и продолжительность.
Через три месяца (визит 2) после первого введения суппозиториев проводились: Пап-тест, кольпоскопия, Digene-тест на ВПЧ высокого онкогенного риска, бактериоскопический анализ вагинального мазка, осуществлялась ПЦР-диагностика на другие инфекции в соскобе эпителия цервикального канала.
Через 6 месяцев (визит 3) женщинам, включенным в исследование, проводились: Пап-тест, Digene-тест и кольпоскопия, проверялись дневники, где были записаны все препараты, которые пациентки принимали на протяжении исследования с момента подписания информированного согласия до заключительного визита. Оценивались локальные и системные эффекты, которые могли бы быть связаны с использованием препарата. Переносимость и безопасность препарата оценивались по частоте и выраженности нежелательных явлений.
Возможность досрочного выбывания из исследования была предусмотрена на любом этапе клинических испытаний – как по инициативе пациентки, так и по инициативе исследователя. Причины выбывания указывались в истории болезни и индивидуальной регистрационной карте (ИРК). В случае проведения хирургического лечения плоскоклеточного интраэпителиального поражения шейки, а также применения противовирусных препаратов в процессе исследования, пациентка исключалась из исследования.
ИРК пациенток заполнялась на основании опроса и осмотра, данных клинического обследования и лабораторных исследований. По завершении исследования формировались два массива данных, которые подвергались анализу.
Критериями эффективности применения препарата являлись:
- регресс ВПЧ-ассоциированных изменений шейки матки по данным Пап-теста и кольпоскопии;
- достижение отрицательного результата Digene-теста на ВПЧ высокого онкогенного риска.
Показатели, полученные у обследованных пациенток, обрабатывали методами вариационной статистики – использовались описательная статистика и непараметрический анализ данных (Mann-Whitney U Test, Kolmogorov-Smirnov Test). Для статистического анализа частотных показателей использовался метод углового преобразования Фишера (вычисление ФИ* критерия) (30). Различие между сравниваемыми величинами признавалось достоверным при Р 0,05).
Основные исходные характеристики групп пациенток представлены в таблице 1.
У 9 из 40 испытуемых (у 5 женщин I группы и у 4 женщин II группы) в анамнезе зарегистрирована патология шейки матки (ШМ), по поводу которой они получали лечение. Предшествующая терапия шейки матки пациенток с LSIL включала: Ваготил – у 1 женщины, мазевые аппликации – у 2, криотерапия – у 3, лазеротерапия – у 1, диатермоэлектрокоагуляция – у 1, другие методы – у 1 пациентки.
Кольпоскопическая картина поражений шейки матки при LSIL характеризовалась наличием патологической зоны трансформации в 29 случаях из 40 (72%). Норма выявлена у 4 из 23 женщин I группы (17,4%) и у 7 из 17 женщин II группы (41,2%).
Обращала на себя внимание высокая специфичность признака ацетобелый эпителий (АБЭ) вне и в пределах зоны трансформации шейки матки (ЗТ ШМ) (отмечен у 24 из 40 женщин – 60%). Обнаруживались также йоднегативная и йодпозитивная мозаика, пунктация, гиперкератоз, йоднегативные участки. В двух случаях, наряду с плоскими поражениями, кольпоскопически были выявлены небольшие остроконечные кондиломы. Сильно выраженные аномальные признаки были у 7 из 23 и у 6 из 17 пациенток групп I и II, соответственно (отмечался густой АБЭ и высокоатипическая ЗТ ШМ). У остальных пациенток кольпоскопическая картина носила характер низкой атипии или нормы, т. е. процесс, по-видимому, был локализован внутри цервикального канала. Таким образом, кольпоскопическая картина пришла в норму через три месяца наблюдения у 3 и 2 женщин I и II групп, соответственно (13,0% и 11,8%), и у 6 и 4 женщин (28,6% и 26,7%) соответственно через 6 месяцев (Р > 0,05). Таким образом, статистически значимых различий между группами выявлено не было.
ШМ проводили всем женщинам обеих групп (n=40) трижды с перерывом в 3 месяца. Материал был представлен соскобом клеток с экзоцервикса и эндоцервикса, взятых с помощью шпателя и щетки-эндобраша, который наносили на предметное стекло. Выявлялись койлоциты, дискератоциты, дискариоциты, дистрофически измененные клетки, псевдодискариоз, нейтрофильные лейкоциты, лимфоциты, плазматические клетки, базальные/парабазальные клетки, двухядерные клетки, голые ядра (таблица 3).
Основным цитологическим признаком LSIL считается: наличие клеток с койлоцитозом, которые были обнаружены в мазках с ШМ у 34 из 40 женщин (85%); клеток с дискератоцитозом (обнаружены у 21 из 40 женщин – 52,5%), клеток с дискариозом (у 12 из 40 женщин – 30%); клеток с многоядерностью (у 6 из 40 женщин – 15 %).
В зависимости от локализации материала мазка и наличия эктопии с ЗТ, в мазки также попадали неизмененные клетки многослойного плоского эпителия, метапластические клетки, базальные/парабазальные клетки и клетки цилиндрического эпителия, клетки, свидетельствующие о хроническом воспалении.
Полученные результаты представлены в виде 4 основных групп, согласно классификации Бетесда: LSIL, HSIL, ASCUS, норма (таблица 4).
Digene-тест на выявление 13 онкогенных типов ВПЧ в клинически значимой концентрации был положителен у всех 40 женщин в начале исследования.
Данные цитологического, кольпоскопического исследования и Digene-теста на ВПЧ у женщин с LSIL шейки матки в динамике наблюдения (n=40) представлены в таблице 4.
Через 3 месяца после начала терапии у 9 из 23 пациенток (39,1%), получавших Генферон®, был достигнут отрицательный результат Digene-теста (менее 0,8 ЕД), через 6 месяцев отрицательный результат Digene-теста был достигнут у 15 пациенток из 22 (68,2%). В группе пациенток, получавших плацебо, отрицательный результат Digene-теста через 3 месяца был достигнут у 2 из 17 пациенток (11,8%), через 6 месяцев – у 4 пациенток из 15 (26,7%). У 4 из 17 наблюдалось увеличение содержания ВПЧ по данным количественного теста.
Проведение Пап-теста через 3 месяца после начала лечения выявило регресс ВПЧ-ассоциированных изменений шейки матки у 13 из 23 пациенток, получавших Генферон® (56,5%), через 6 месяцев – у 18 пациенток из 22 (81,8%). При этом регресс ВПЧ-ассоциированных изменений шейки матки у пациенток, получавших плацебо, через 3 месяца наблюдался только у 6 пациенток из 17 (35,3%), через 6 месяцев – у 6 из 15 (40%). У одной женщины I группы через 6 месяцев наблюдения было выявлено прогрессирование процесса в более высокую стадию (HSIL), по поводу чего ей была проведена эксцизия и диагноз CIN II был подтвержден гистологически.
Как видно из таблицы 4, в результате проведения кольпоскопии у трех пациенток из 23 (13,0%), получавших Генферон®, выявлен регресс патологических изменений эпителия шейки матки через 3 месяца и у 6 из 21 (28,6%) – через 6 месяцев. У пациенток, получавших плацебо, через три месяца регресс патологических изменений отмечен у 2 пациенток из 17 (11,8%), через 6 месяцев – у 4 из 15 (26,5%).
У 3 из 23 (13,0%) пациенток, получавших Генферон®, проведенная в начале исследования бактериоскопия вагинального мазка выявила II-III степень чистоты влагалища. У всех пациенток бактериоскопическая картина нормализовалась к 3 месяцу исследования без дополнительной терапии. У 1 пациентки данной группы было выявлено присутствие грибов Candida albicans без клинических проявлений, которые через 3 месяца приема препарата отсутствовали. У 1 пациентки при нормальной картине бактериоскопии вагинального мазка в начале исследования было обнаружено повышенное содержание лейкоцитов через 3 месяца наблюдения. Достоверной разницы с группой плацебо по данным показателям не отмечено.
ПЦР-диагностика выявила наличие у 1 пациентки первой группы вирусов простого герпеса (ВПГ) I и II типов в начале исследования и их отсутствие через 3 месяца. У 1 пациентки с отрицательным тестом на ВПГ в начале исследования, через 3 месяца был обнаружен ВПГ I типа. Проведение ПЦР в начале исследования выявило наличие ВПГ I типа и цитомегаловируса (ЦМВ) у 1 из 17 пациенток, получавших плацебо, через 3 месяца у этой пациентки был выявлен только ВПГ I типа. Кроме того, у одной пациентки II группы через 3 месяца был выявлен ВПГ I типа, не обнаруженный в начале исследования. Таким образом, достоверной разницы между группами по указанным параметрам обнаружено не было. Нежелательные явления наблюдались как у пациенток, получавших Генферон®, так и у пациенток, получавших плацебо. Эти нежелательные явления классифицировались как легкие, носили преходящий характер, не требовали медикаментозной коррекции и не привели к выбыванию пациенток из исследования. Серьезных побочных эффектов не было отмечено ни в одной из групп. У одной женщины первой группы были гриппоподобные симптомы, по одной пациентке из каждой группы жаловались на кратковременный зуд вульвы.
Таким образом, вагинальное применение препарата Генферон® в дозе 500000 МЕ по указанной выше схеме безопасно. Эффективность лечения по двум основным критериям (регресс ВПЧ-ассоциированных изменений шейки матки и отрицательный результат Digene-теста) была достоверно выше у пациенток, использовавших Генферон® в сравнении с группой пациенток, получавших плацебо.
К сожалению, специфических лекарственных средств, полностью элиминирующих ВПЧ, на сегодняшний день не создано. Однако при изучении состояния иммунной системы у женщин, страдающих ПВИ и другими урогенитальными инфекциями, были выявлены нарушения различных ее звеньев на локальном и системном уровне. В частности, было показано присутствие ингибиторов синтеза интерферона альфа и гамма типов. Это свидетельствует о целесообразности поиска средств иммунокоррекции, способствующих нормализации нарушенных при ПВИ звеньев иммунной системы (2). Так, в литературе широко представлен опыт применения при ПВИ Цидофовира, Имиквимода, индол-3-карбинола, а также препаратов интерферона для местного и системного применения (21).
Клинические исследования доказали, что препараты интерферона не только дают интерферонозамещающий эффект, но и стимулируют синтез эндогенного интерферона альфа и гамма типов (23). Именно поэтому они все интенсивнее внедряются в практику здравоохранения не только в нашей стране, но и за рубежом. Клиническая эффективность препаратов интерферона показана при ВПЧ-ассоциированной патологии коньюктивы глаза, респираторном папилломатозе, экзофитных кондиломах, плоскоклеточных интраэпителиальных поражениях шейки матки и т.п. (2). Однако данные об эффективности системного применения препаратов интерферона остаются противоречивыми (7). Кроме того, системное применение препаратов интерферона ограничивается их высокой стоимостью и значительными побочными эффектами (17). Принимая во внимание тот факт, что ВПЧ является эпителиотропным вирусом, предпринимаются попытки использования лекарственных форм интерферонов для местного применения (24, 25).
Препараты для местного применения (мази, суппозитории, капли и т.д.) являются более эффективными при ряде форм ПВИ. Они способны обеспечить более высокие концентрации действующего вещества непосредственно в очаге поражения при отсутствии побочных эффектов (7). Особый интерес представляют суппозиторные формы, показавшие эффективность при лечении целого ряда урогенитальных инфекций (7).
В нашем исследовании мы изучили терапевтическую эффективность и безопасность суппозиториев Генферон® для лечения LSIL, ассоциированных с ВПЧ высокоонкогенного риска.
Основными компонентами препарата Генферон® являются интерферон человеческий рекомбинантный α-2 типа, таурин и анестезин, комбинация которых обеспечивает усиление и расширение спектра действия препарата (1). Таурин широко применяется при целом ряде заболеваний и способствует нормализации метаболических процессов, обладает регенерирующими, репаративными, антиоксидантными, мембрано- и гепатопротекторными свойствами (26). Анестезин – местноанестезирующее вещество, наличие которого существенно повышает качество жизни пациентов, поскольку ПВИ нередко сопровождается локальным дискомфортом.
Несмотря на то что для местного применения препаратов интерферона не характерно наличие побочных эффектов, в отличие от системного применения (9), в данном исследовании важно было определить переносимость Генферона®, поскольку по рекомендуемой нами схеме он должен применяться длительно – на протяжении 3 месяцев. Показано, что нежелательные явления в данном исследовании были минимальными, они наблюдались как у пациенток, получавших Генферон®, так и у получавших плацебо. Они классифицировались как легкие, носили преходящий характер, не требовали медикаментозной коррекции и не привели к выбыванию пациенток из исследования. Серьезных побочных эффектов не было отмечено ни в одной из групп. У одной женщины первой группы были гриппоподобные симптомы, по одной пациентке из первой и второй групп жаловались на кратковременный зуд вульвы. Выявленная нами чрезвычайно низкая частота побочных эффектов Генферона® согласуется с данными других авторов (1) и объясняется, по-видимому, низкими концентрациями действующих веществ в системном кровотоке.
Основными критериями оценки эффективности исследуемого препарата были данные Пап-теста и Digene-теста на ВПЧ. Данные кольпоскопии, учитывая недостаточную специфичность этого метода (40-60%), учитывались, но не использовались в качестве основного критерия эффективности терапии.
Мы показали, что интравагинальное использование суппозиториев Генферон® привело к регрессии LSIL, по результатам Пап-теста до нормы в 61,9% случаев в группе лечения по сравнению с 33,3% в группе плацебо (P ® безопасен и хорошо переносится при лечении в дозе 500000 МЕ интравагинально 2 раза в сутки в течение 10 дней с последующим назначением 1 раз в сутки через день в течение 3 месяцев.
По данным цитологического исследования, применение препарата Генферон® способствует регрессу плоскоклеточных интраэпителиальных поражений шейки матки низкой степени до нормы через 6 месяцев наблюдения в 59,1% случаев по сравнению с 33,3% в группе плацебо. Более того, Генферон® способствует элиминации высокоонкогенных типов ВПЧ при LSIL в 68,2% случаев по сравнению с 26,7% в группе плацебо. Таким образом, Генферон® эффективен для лечения плоскоклеточных интраэпителиальных поражений шейки матки низкой степени, ассоциированных с вирусами папилломы человека (ВПЧ) высокоонкогенного риска.
Читайте также:
- Предупреждение инфекционных заболеваний в условиях применения противником бактериологических средств
- Посев на условно-патогенные возбудители кишечных инфекций
- Кафедра детских инфекционных болезней рниму им
- Как принимать бифидумбактерин для новорожденных при дисбактериозе
- Гнойная инфекция в ротовой полости лечение


