Эпидемиология вакцинопрофилактика инфекционных болезней
Вакцинопрофилактика – неотъемлемая часть профилактической медицины. Благодаря вакцинации удалось предотвратить распространение острых инфекционных заболеваний, угрожающих жизни.
Вакцинопрофилактика (иммунопрофилактика) - введение препаратов с целью предотвращения развития инфекционных заболеваний.

Для иммунопрофилактики используются зарегистрированные в соответствии с законодательством Российской Федерации отечественные и зарубежные иммунобиологические лекарственные препараты.
Для вакцинации используются препараты – вакцины, препараты антител или сывороток, анатоксины, иммуноглобулины и прочие лекарственные средства, предназначенные для создания специфической невосприимчивости к инфекционным болезням (адъюванты).
Вакцинация – один из способов формирования активного иммунитета – направлена на предупреждение, ограничение распространения и ликвидацию инфекционных болезней.
Вакцины взаимодействуют с иммунной системой человека, благодаря чему формируется иммунный ответ, подобный тому, который формируется в процессе перенесенной инфекции, но перенесенная инфекция подвергает человека осложнениям, порой, несовместимыми с жизнью.
В ответ на введение вакцины, организм вырабатывает антитела, защищающие от инфекции, распознавая и избавляясь от нее. Иммунитет, после проведения вакцинации длится годами, некоторые вакцины вызывают устойчивость организма к инфекции пожизненно (например, ветряная оспа).
Существуют два основных типа вакцин: живые и инактивированные (убитые).
Хранение иммунобиологических препаратов, предназначенных для вакцинации, очень строго контролируется, тщательно соблюдаются условия холодовой цепи.
После введения вакцинного препарата в организм человека происходит удвоение молекулы ДНК вируса или бактерии, что необходимо для выработки антител. После введения препарата инфекция не развивается, но, даже в тех редких случаях, когда развитие инфекции имеет место быть, заболевание протекает в легкой, чаще бессимптомной форме, исключающей развитие осложнений.
Инактивированные вакцины могут состоять либо из цельных вирусов, либо из бактерий, либо из фракций.
Федеральный закон от 17.09.1998 N 157-ФЗ (ред. от 07.03.2018) "Об иммунопрофилактике инфекционных болезней" - основной документ, устанавливающий правовые основы государственной политики в области иммунопрофилактики инфекционных болезней, осуществляемой в целях охраны здоровья и обеспечения санитарно-эпидемиологического благополучия населения.
В России вакцинация проводится строго в соответствии с Национальным календарем профилактических прививок, утвержденным Приказом министерства здравоохранения Российской Федерации от 21 марта 2014 г. № 125н. (ред. от 13.04.2017) (зарегистрировано в Минюсте России 25.04.2014 N 32115).
Календарь устанавливает сроки и порядок проведения профилактических прививок.
На сегодняшний день в календарь включены прививки против гепатита В, дифтерии, коклюша, кори, краснухи, полиомиелита, столбняка, туберкулеза, эпидемического паротита, гемофильной инфекции, пневмококковой инфекции и гриппа.
Именно эти заболевания несут угрозу распространения, вовлечения большого количества людей, вплоть до развития эпидемий, угрозу жизни и здоровью населения.
Сроки введения вакцин по Национальному календарю профилактических прививок установлены с учетом возраст - специфического риска инфицирования, развития осложнений, а также с учетом иммунобиологических свойств вакцин, а также выработки защитного уровня антител после проведенной вакцинации.
Помимо основных инфекций, включенных в календарь, есть и другие, например, сибирская язва, туляремия, ветряная оспа. Эти инфекции входят во вторую часть Национального календаря профилактических прививок - календарь по эпидемическим показаниям. Профилактические прививки по эпидемическим показаниям проводятся гражданам при угрозе возникновения инфекционных заболеваний, также лицам, выезжающим в опасные по заболеваниям регионы, включенным в календарь.
Календарь по эпидемическим показаниям включает вакцинацию против 24 инфекций, вакцинация против которых носит индивидуальный или групповой характер.
Перед введением вакцины, пациента осматривает врач и принимает решение о возможности введения препарата. Перед введением препарата пациент получает полную информацию о необходимости прививок, последствиях отказа от них, возможных поствакцинальных осложнениях.
Вакцинация проводится в медицинских организациях государственной системы здравоохранения (поликлиниках по месту жительства).
К принципам вакцинопрофилактики относятся:
Прежде чем применять вакцину, ее тщательно исследуют.
Каждая страна имеет орган, контролирующий безопасность вакцин.
Безопасность вакцин контролируется в 3 этапа:
- На этапе разработки
- На этапе производства (производитель контролирует безопасность препаратов на всех стадиях производства)
- Сертификация (все вакцинные препараты, в том числе зарубежные, подлежат обязательной государственной сертификации. Без сертификации вакцины не допускаются в продажу).
- В месте применения (специалисты Роспотребнадзора контролируют соблюдение правил хранения, транспортировки, реализации препаратов)
Вакцина, не соответствующая требованиям безопасности, отзывается и не допускается к реализации.
Иглы и шприцы, используемые для введения вакцин, всегда стерильны и предназначены для разового применения.
исходя из вышеизложенного, следует повторить, что перед введением вакцинного препарата, медицинский работник в обязательном порядке информирует родителя или законного представителя пациента о пользе, безопасности и риске вакцинации в доступной форме. Вакцина вводится после получения информированного согласия родителя или законного представителя ребенка.
В случае категорического нежелания проходить вакцинацию, пациент подтверждает отказ от проведения профилактических прививок в письменной форме.
Прививки в рамках календаря профилактических прививок проводятся бесплатно контингентам, подлежащим вакцинации.

Отказ от вакцинации повышает риск инфицирования не только самих непривитых, но и тех, кто по медицинским показаниям не подлежит вакцинации, включая младенцев, не достигших возраста, рекомендованного для введения той или иной вакцины.
С каждым годом устойчивость возбудителей инфекций к антибактериальным препаратам и другим лекарственным средствам увеличивается, в связи с чем лечение становится затруднительным. Многие инфекции, от которых проводится вакцинация, протекают молниеносно, приводят к летальным исходам или к инвалидности. По данным Всемирной организации здравоохранения, во всем мире ежегодно умирает более 12 миллионов детей, 2/3 этих смертей вызваны болезнями, которые могли бы быть предотвращены при помощи вакцин.
Вакцинопрофилактика касается не только детей. Взрослое население также должно проходить вакцинацию с целью защиты от инфекций.
Инфекционное заболевание может возникнуть у каждого из нас, у ребенка или взрослого. Пожилые люди, также как и дети, имеют высокий риск, заразившись той или иной инфекцией, получить серьезные осложнения, порой несовместимые с жизнью.
Для сохранения Вашего здоровья и здоровья Вашего ребенка примите решение в пользу вакцинации!
Инфекционные болезни преследовали человека на протяжении всей его истории. Наш организм может приобрести устойчивость к инфекционным заболеваниям (иммунитет) двумя путями. Первый — заболеть и выздороветь. Второй путь — вакцинация. В этом случае в организм вводятся ослабленные микроорганизмы или их отдельные компоненты, которые стимулируют иммунный защитный ответ.
Иммунопрофилактика инфекционных болезней - система мероприятий, осуществляемых в целях предупреждения, ограничения распространения и ликвидации инфекционных болезней путем проведения профилактических прививок.
Проведение профилактических прививок (вакцинация) направлено на борьбу с инфекционными заболеваниями и основано на применении вакцин и анатоксинов для защиты восприимчивого к инфекциям населения.
Часто родители стоят перед выбором, делать своему чаду прививки или нет.
Увидев однажды ребёнка больного коклюшем, или дифтерией, вопрос о необходимости прививки у родителей даже бы не возник, т. к. эти заболевания считаются очень тяжелыми, а клиническая картина ужасает страданиями. Многие заболевания, особенно это касается дифтерии, имеют очень высокую смертность. Следует совершенно чётко понимать, что та группа заболеваний, против которых проводится вакцинация, является опасными, ведь существует реальный риск заражения.
Обязанность каждого медицинского работника предупредить о неоправданном риске.
В итоге, вакцинация – это продуманный шаг, отказ от вакцинации - неоправданный риск.
Вы не можете оградить себя и своих близких от всех опасностей, но вы можете избежать грозных инфекционных заболеваний.
Вакцинация необходима всем независимо от возраста. Большинство людей сейчас не знают о том, что многие прививки, сделанные однажды в детстве, необходимо повторять в течение всей жизни.
В Москве прививки проводятся в условиях поликлиник, в медицинских кабинетах детских дошкольных учреждений, школ, колледжей. Прививочные кабинеты имеются во всех детских и взрослых поликлиниках. Вы можете сделать бесплатно прививки себе и своим детям в государственной поликлинике по месту прикрепления.
Для этого необходимо записаться на прием к врачу, что не составит особого труда. Записаться на прием можно следующими способами.



КЛЕЩЕВОЙ ЭНЦЕФАЛИТ и меры его профилактики.

Последствия заболевания: от полного выздоровления до нарушений здоровья, приводящих к инвалидности и смерти.
Возбудитель болезни передается человеку в первые минуты присасывания зараженного вирусом клеща вместе с обезболивающей порцией слюны:
- посещение неблагополучных по клещевому энцефалиту территорий в лесах, лесопарках, на индивидуальных садово-огородных участках,
- заражение людей, не посещающих лес, может произойти при заносе клещей животными или людьми на одежде, с цветами, ветками и т.д.,
- заражение возможно через молочные продукты, не прошедшие термической обработки (молоко коз, коров, зараженных вирусом клещевого энцефалита и продуктов на их основе),
- также возможно заражение через кожу при раздавливании и растирании клеща, или расчесывании места укуса.
В том случае, если у Вас нет прививки и Вы находились на неблагополучной в отношении клещевого энцефалита территории, необходимо в течение 96 часов после присасывания клеща ввести специфический человеческий иммуноглобулин.
Детям в Детской городской клинической больнице №13 им.Н.Ф.Филатова, по адресу: Садовая-Кудринская, д.15.
Информацию о возможном риске заражения на интересующей территории можно получить в поликлинике.
Человеческий иммуноглобулин против клещевого энцефалита возможно применять перед вероятным контактом с вирусом клещевого энцефалита - укусом клеща в эндемичном районе (доэкспозиционная профилактика - в случае, если пройти курс вакцинации вы не успеваете и отложить поездку в неблагополучную территорию не представляется возможным). Защитное действие препарата начинается через 24-48 часов и продолжается около 4-х недель.
Как можно защититься от клещевого энцефалита?

Специфическая профилактика.
- Предупредить заболевание клещевым энцефалитом можно при помощи профилактических прививок, которые в обязательном порядке проводятся лицам, выезжающим на работу или отдых в неблагополучные территории.
- Предупредить заболевание клещевым энцефалитом можно при помощи профилактических прививок, которые в обязательном порядке проводятся лицам, выезжающим на работу или отдых в неблагополучные территории.
- Прививаться отечественной вакциной следует не позднее, чем за 1,5 месяца до выезда в неблагополучную территорию.
- Прививка отечественной вакциной состоит из 2-х инъекций, минимальный интервал между ними – 1 месяц.
- После последней инъекции должно пройти не менее 14 дней до выезда в очаг, за это время вырабатывается иммунитет.
Базовые поликлиники по СВАО ГБУЗ ГП №218 ДЗМ ф.IV (ГП№153) по адресу: ул. Грекова, д.12, ГБУЗ ГП №218 ДЗМ ф.II (ГП№34) по адресу: ул. Лосевская, д.2 или в поликлинике по месту жительства (о наличии вакцины уточняйте по телефону).
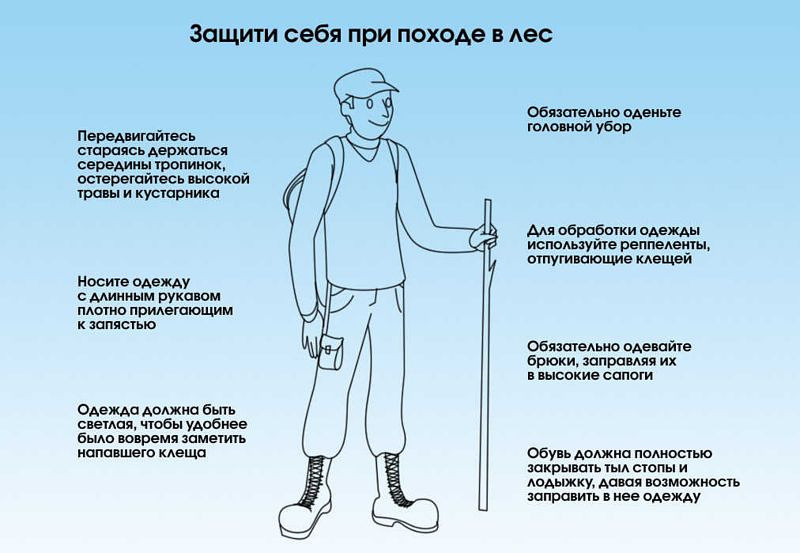
- ношение специальных защитных костюмов или использование приспособленной одежды максимально закрывающей кожные покровы преимущественно светлого оттенка (для более быстрого обнаружения ползающих клещей),
- применение репеллентов с целью индивидуальной защиты от нападения клещей (нанесение на кожу и одежду),
- регулярные само- и взаимоосмотры,
- осмотры домашних животных.
Как снять клеща?
Снимать клеща следует очень осторожно, чтобы не оборвать хоботок, который глубоко и сильно укрепляется на весь период присасывания.
При удалении клеща необходимо соблюдать следующие рекомендации:
- Захватить клеща пинцетом или обернутыми чистой марлей пальцами, как можно ближе к ротовому аппарату и держа строго перпендикулярно поверхности укуса повернуть тело клеща вокруг оси и извлечь его из кожных покровов,
- Место укуса продезинфицировать любым пригодным для этих целей средством (70% спирт, 5 % йод, одеколон и т.д.),
- после извлечения клеща необходимо тщательно вымыть руки с мылом,
- снятого клеща следует сжечь или залить кипятком,
- если произошел отрыв головки клеща или хоботка, место отрыва следует обработать 5% йодом и оставить до естественного отторжения.
Клещевой боррелиоз

Клещевой боррелиоз – острая бактериальная инфекция с широким спектром разнообразных симптомов.
Переносчиками также являются иксодовые клещи. Заражение людей происходит при присасывании инфицированного клеща.
Места заражения аналогичны таковым при клещевом энцефалите (см.выше).
Введение антибиотиков всем пострадавшим от нападения переносчиков без предварительного исследования присосавшегося клеща нецелесообразно, поскольку неоправданное употребление антибиотиков может оказаться в дальнейшем небезвредным для здоровья!
Специфическая профилактика клещевых боррелиозов в настоящее время не разработана!
Неспецифическая профилактика аналогична профилактике клещевого энцефалита (см.выше).
Клещей, извлеченных из кожи, возможно доставлять в лаборатории, где проводят исследования их на зараженность боррелиями и вирусом клещевого энцефалита (на платной основе).
На исследование снятых клещей можно направлять в:
Будьте здоровы!
В 2013 г. из 53 административных территорий московской области 2 являются эндемичными по клещевому вирусному энцефалиту: Дмитровский и Талдомский районы.
Полный текст:
2. Салтыкова Т.С. Заболеваемость гриппом и отсроченная смертность лиц старше 60 лет. Автореф. дис.. к-та мед. наук. Москва; 2010: 23.
3. Фельдблюм И.В., Наумов О.Ю., Девятков М.Ю., Полушкина A.B. Вакцинация против гриппа как возможный путь снижения смертности от болезней системы кровообращения. Материалы научно-практической конференции Вакцинопрофилактика: итоги, проблемы и перспективы развития. Пермь. 2010: 119 - 123.
4. Наумов О.Ю., Фельдблюм И.В. Заболеваемость гриппом и ОРВИ как популяционный атрибутивный риск смертности от болезней системы кровообращения. Гигиенические и медико-профилактические технологии управления рисками здоровью населения в промышленных регионах: материала научн.- практ. конференции с международным участием. Пермь. 2010: 262 - 265.
6. Краснопольский В.И., Логутова Л.С., Зароченцева Н.В. Папилломавирусная инфекция у девочек-подростков: информационно-методическое письмо. Москва; 2010.
7. Ferlay J, Bray F, Pisani P, Parkin DM. International Agency for Research on Cancer (IARC). GLOBOCAN 2002: Cancer Incidence, Mortality and Prevalence Worldwide. CancerBase No. 5, version 2.0. Lyon, France: IARC Press; 2004.
8. Franco E.L., Monsonego J. (ed.) New Developments in Cervical Screening and Prevention. Blackwell Science; 1997: 14 - 22.
10. Исаева Н.В., Павроз К.А., Гальбрайх Р.Б., Трясолобова М.А. Риск возникновения циррозов печени и наступления летальных исходов при вирусных гепатитах смешанной этиологии. Эпидемиология и инфекционные болезни. 2013; 4: 50 - 53.
11. Chunfeng Q., Taoyang C., Chunsun F., Qimin Z., Yuting W., Jianhua L. et al. Efficacy of Neonatal HBV Vaccination on Liver Cancer and Other Liver Diseases over 30-Year Follow-up of the Qidong Hepatitis B Intervention Study: A Cluster Randomized Controlled Trial. PLoS Med 2014; 11.12: e1001774.
12. Camille Locht, Nathalie Mielcarek New pertussis vaccination approaches: en route to protect newborns? FEMS Immunol. Med. Microbiol. 66 (2012); 121 - 133.
13. Guiso N. Pertussis vaccination and whooping cough: and now what? Expert Rev Vaccines. 2014; 13 (10): 1163 - 1165.
14. Esposito S., Principi N. Immunization against pertussis in adolescents and adults. Clinical Microbiology and Infection. 2016; 22: 89 - 95.
15. Королева И.С., Белошицкий Г.В., Закроева И.М., Королева М.А. Менингококковая инфекция в Российской Федерации. Медицинский алфавит. Эпидемиология и гигиена. 2015; 6: 27 - 28.
16. Костюкова Н.Н., Бехало В.А., Чернышева Т.Ф. Менингококковая инфекция в России: прошлое и ближайшие перспективы. Эпидемиология инфекционные болезни. Актуальные вопросы. 2014; 2: 73 - 79.
17. Матосова С.В., Миронов К.О., Платонов А.Е., Шипулина О.Ю., Нагибина М.В., Венгеров Ю.Я. и др. Молекулярно-биологический мониторинг Neisseria Meningitidis на территории Москвы в период с 2011 по 2015 г. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2016; 2: 4 - 9.
18. Tran Hien Nguyena, Minh Huong Vub, Van Cuong Nguyena, Lien Huong Nguyena, Kohei Todac et al. A reduction in chronic hepatitis B virus infection prevalence among children in Vietnam demonstrates the importance of vaccination. Vaccine. 2014; 32: 217 - 222.
19. Кригер Е.А., Самодова О.В., Рогушина Н.Л., Борисова Т.А. Отношение родителей к вакцинации детей и факторы, связанные с отказом от прививок. Педиатрия. Журнал им. Г.Н. Сперанского. 2016; 95 (2): 91 - 95.
20. Костинов М.П., Лукачев И.В. Возможности усовершенствования вакцинопрофилактики в современной России. Журнал микробиологии, эпидемиологии и иммунобиологии. 2016; 4: 60 - 65.
21. Баранов А.А., Брико Н.И., Намазова-Баранова Л.С., Федосеенко М.В. Правовые и этические основы информированного согласия на вакцинацию в России: необходимость изменения подхода. Педиатрическая фармакология. 2016; 13 (2): 116 - 130.
22. Фельдблюм И.В. Эпидемиологический надзор за вакцинопрофилактикой: актовая речь. Пермь: ГБОУ ВПО ПГМА им.ак. Е.А. Вагнера Минздрава России; 2014. 56 с.
23. Брико Н.И., Намазова-Баранова Л.С., Лобзин Ю.В., Харит С.М., Начарова Е.П., Фельдблюм И.В. Совершенствование мониторинга неблагоприятных событий поствакцинального периода (в порядке дискуссии). Эпидемиология и Вакцинопрофилактика. 2016; 15 (6): 95 - 101.
24. Львова И.И., Фельдблюм И.В., Корюкина И.П., Ушакова Т.А. Мониторинг событий поствакцинального периода. Эпидемиология и инфекционные болезни. 2004; 5: 19 - 22.
25. Heidi J., Alexandre de Figueiredo, Zhao X., William S., Pierre V., Iain G., et al. The State of Vaccine Confidence 2016: Global insights through a 67-country survey. EbioMedicine. 2016; 12: 295 - 301.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Актуальность. Стратегия развития вакцинопрофилактики в Российской Федерации в числе прочих направлений предполагает совершенствование Национального календаря профилактических прививок и обеспечение его гибкости с учётом складывающейся эпидемической ситуации и появления новых вакцин.
Цель: Оценить социально-экономический ущерб от пяти вакциноуправляемых инфекций при различных сценариях вакцинопрофилактики.
Материалы и методы: Была построена имитационная ретроспективная модель с временным горизонтом 3 года (2016-2018 гг.), предполагающая оценку изменений в потерянных/сохраненных годах жизни с поправкой на нетрудоспособность, в т. ч. в монетарном выражении, в контексте дифференцированных исходов заболеваний и затрат на вакцины при разных сценариях охвата вакцинацией и алгоритма вакцинопрофилактики.
Результаты и обсуждение. Так, исследование показало, что в случае сохранения сложившегося алгоритма и охвата вакцинацией возрастной когорты детей до 2 лет ежегодные потери лет жизни с поправкой на нетрудоспособность будут оставаться на высоком уровне. Напротив, расширение охвата прививками пятикомпонентной вакциной до 60% детей возрастной группы от 3 до 18 месяцев снизит потери до 20 215 лет, сохранив 10 263 лет жизни (на 33,7% больше в сравнении с текущим алгоритмом) и еще в большей степени - при охвате близком к 100%, что может обеспечить 28 344 сохраненных лет жизни (на 93% больше в сравнении с текущим алгоритмом). Чем шире применяется комбинированная пятивалентная вакцина, тем меньше средние затраты на сохранение каждого дополнительного года жизни.
Выводы. Расширение охвата пятикомпонентной комбинированной вакциной обеспечивает наибольшие дополнительные выгоды за счет более быстрого прироста числа сохраненных лет жизни (выгод) в сравнении с приростом затрат (стоимости вакцин).
Актуальность. Отсутствие системы эпидемиологического надзора за хронической инфекцией легких (ХИЛ) у больных муковисцидозом (МВ) сделало бесконтрольным распространение возбудителей ХИЛ среди больных МВ в стационарах, о чем свидетельствовали многочисленные случаи инфицирования больных МВ, лечившихся в различных клиниках России.
Цель исследования - определить направления эпидемиологического надзора (ЭН) за ХИЛ у больных муковисцидозом и профилактических мероприятий, необходимых для противодействия перекрестному инфицированию больных МВ и распространению доминирующих возбудителей хронической инфекции легких в стационаре.
Материалы и методы. В статье проанализированы данные, полученные нами в результате исследований эпидемиологических и микробиологических особенностей ХИЛ у больных муковисцидозом. Использовали эпидемиологические, бактериологические и молекулярно-генетические (ПЦР, мультилокусное секвенирование, секвенирование полного генома) методы исследования.
Результаты и обсуждение. Основываясь на результатах исследований эпидемиологических и микробиологических особенностей инфекций, вызванных вышеуказанными возбудителями, были определены направления ЭН и профилактических мероприятий при МВ. Обоснованы задачи информационно-аналитического блока, включающего мониторинг заболеваемости и микробиологический мониторинг. Установлено, что в рамках микробиологического мониторинга необходимо проводить бактериологическое исследование биоматериала из дыхательных путей больных МВ не реже чем 1 раз в квартал, а также при каждом амбулаторном посещении и госпитализации. Показана необходимость: исследования фенотипических свойств возбудителей, способствующих длительной персистенции в организме больного МВ; определения и мониторинга антибиотикочувствительности микроорганизмов, выделенных от больного в динамике; исследования гипермутабельности. Одной из основных задач мониторинга является молекулярно-генетический анализ возбудителей методом ПЦР с целью внутривидовой идентификации, типирования возбудителей и выявления эпидемических маркеров и клонов (в том числе и международных), идентификации генов детерминант антибиотикорезистентности.
Выводы. Внедрение ЭН за хронической инфекцией легких позволит улучшить качество этиологической диагностики, своевременно выявлять источники инфекций и предупреждать распространение возбудителей ХИЛ среди больных МВ как в стационарах, так и во вне госпитальных условий, а также оптимизировать тактику антимикробной терапии ХИЛ. Основными направлениями предупреждения распространения возбудителей ХИЛ должны быть разделение потоков больных с разными инфекциями при амбулаторном обследовании и госпитализации.
Актуальность. Вирусы подтипа H3N2 отличаются от других типов вирусов гриппа более высокой изменчивостью и патогенностью, часто превалируя в эпидсезонах и вызывая высокую смертность, превышающую ее показатели даже в период пандемий.
Цель. Выявить особенности некоторых молекулярных характеристик H3N2, которые потенциально могли бы обусловливать высокую изменчивость H3N2 и его доминирование над другими подтипами в эпидсезонах, и обсудить возможную природу будущей пандемии гриппа.
Материалы и методы. Для компьютерного анализа были использованы доступные в Интернете базы данных первичных структур гемагглютининов (НА) и нуклеопротеинов.у штаммов H3N2, H1N1, В\Yamagata(B\yam) и В\Victoria (B\vic), выделенных у человека в эпидсезон гриппа 2009-2019 гг. На основе первичных структур генов гемагглютининов и нуклеопротеинов определяли трансляционный код каждого гемагглютини-на и нуклеопротеина и существующие в них запреты. Для прослеживания траектории эволюции подтипа H3N2 в последнем десятилетии сравнивали доминантные последовательности смежных эпидсезонов, выявляя произошедшие в них замены. Результаты. Выявлено, что H3, по сравнению с Н1 и НА у B\yam и B\vic, обладает большим содержанием цистеина, у птиц продолжает еще циркулировать и близкородственный вирусу гонконгского гриппа штамм. Трансляционный код Н3 гена содержит наименьшее количество запретов. За последнее десятилетие доминантная последовательность Н3 эпидсезонов эволюционировала быстрее, чем доминантная последовательность Н1. Нуклеопротеин у вирусов подтипа H3N2 отличался более высоким содержанием лизина и меньшим содержанием аргинина.
Заключение. Из проведенного сравнения H3N2, H1N1, B\yam и B\vic, можно заключить, что природа менее всего ограничила H3N2 в возможностях изменяться и соответственно лучше адаптироваться изменениям окружающей среды. Вероятно, что последующая пандемия гриппа будет порождена подтипом H1N1, а не подтипом H3N2 , и будет также умеренной по количеству инфицированных людей, как и пандемия 2009 г.
Актуальность. Вакцины на основе капсульных полисахаридов пневмококка не активны в отношении серотипов, не входящих в состав вакцины, бескапсульных штаммов и не защищают от носительства, вызванного другими серотипами. Их применение приводит к замещению доминирующих серотипов пневмококка, появлению высоковирулентных штаммов, изменению микробного пейзажа слизистых оболочек за счет появления других этиологически значимых возбудителей заболеваний респираторного тракта. Это требует создания внутривидового противопневмококкового иммунитета, чему будет способствовать разработка серотипнезависимых препаратов, в состав которых будут входить белоксодержащие антигены пневмококка.
Цель работы. Исследование серотипнезависимой протективной активности белоксодержащих антигенных компонентов, полученных из свежевыделенных и музейных штаммов S. pneumoniae.
Актульность. Несмотря на успехи, достигнутые в элиминации кори и краснухи в Европейском регионе, в настоящее время ситуация по кори ухудшилась - четыре страны региона утратили статус элиминировавших корь.
Цель - оценка популяционного иммунитета к кори в Республике Беларусь, определение его возрастных и региональных характеристик для идентификации групп повышенного риска распространения инфекции.
Результаты и обсуждение. Представлены результаты выполненного в 2019 г. исследования по определению уровня IgG к вирусу кори у 2229 жителей Республики Беларусь в возрасте 2-75 лет в условиях многолетнего (с 1967 г. - одна прививка, с 1987 г. - две прививки) применения вакцинации. Антитела определяли с использованием иммуноферментной тест-системы Serion ELISA classic measles virus IgG производства Virion\Serion, Германия. Выявление антител в концентрации 150 мМЕ/мл и более расценивали как свидетельство защищенности от кори. Установлено, что уровень популяционного иммунитета к кори в Республике Беларусь в 2019 г. составил 84,6%, что ниже порогового уровня (90-95%), достаточного для предотвращения широкой трансмиссии вируса в случае его завоза. Уровень серопозитивных был наиболее высоким среди детей 2-5 лет (96,9%), а также среди взрослых 46 лет и старше (93,0% и более) и не достигал 90% во всех остальных возрастных группах. Наиболее восприимчивыми к кори являлись взрослые 31-40 лет (1979-1988 года рождения) - антитела в защитной концентрации были выявлены менее чем у 80% обследованных (31-35 лет - 78,9% и 36-40 лет -78,4%). Средняя концентрация антител у серопозитивных также различалась в возрастных группах населения. Высокая концентрация (более 1000 мМЕ/мл) отмечалась у детей 2-5 лет, а также у взрослых старше 40 лет. Среди последних концентрация антител повышалась с возрастом: 41-45 лет - 1069 мМЕ/мл, 46-55 лет - 1212 мМЕ/мл, 56-65 лет - 1582 мМЕ/мл, 66-75 -1849 мМЕ/мл. Среди лиц 6-35 лет она находилась в пределах 500-600 мМЕ/мл и была несколько выше среди лиц 36-40 лет (781 мМЕ/мл).
Выводы. Для дальнейшего контроля инфекции, наряду с поддержанием высокого (97% и более) уровня рутинной иммунизации, необходимо обеспечить выявление и проведение подчищающей иммунизации не привитых лиц и лиц без данных о прививках.
Актуальность. Преждевременные роды (ПР) в этиопатогенетическом отношении - клинический синдром, характеризующийся полиэтиологичностью, хроническим течением процесса, участием плода в патогенезе, разнообразием клинической симптоматики и вовлеченностью генетических факторов и факторов окружающей среды. Инфекционный фактор рассматривается в качестве ведущего по развитию риска ПР. По данным литературы более 40% ПР обусловлено наличием инфекционного процесса. Наиболее значимыми являются внутриматочная и цервико-вагинальная инфекции.
Целью исследования явилась клинико-микробиологическая оценка состояние влагалищного биотопа у рожениц с различными вариантами спонтанных преждевременных родов.
Материалы и методы. Диагностический комплекс включал бактериоскопические, бактериологические, а также молекулярно-генетические исследования. Объектом исследования явились беременные со своевременными физиологическими родами и с различными типами преждевременных родов, которые были госпитализированы в специализированные медицинские организации Нижегородской области. Всего обследовано 260 пациенток, проведено 1000 исследований Материалом для исследований было содержимое влагалища и цервикального канала.
Результаты. Состояние влагалищного биоценоза характеризовалось выраженной неравномерностью у пациенток с различными вариантами спонтанных преждевременных родов. У рожениц с преждевременным разрывом плодных оболочек достоверно часто встречался местный воспалительный процесс с преобладанием условно-патогенной микрофлоры над лактобактериями. Среди пациенток с истинными ПР и со своевременными физиологическими родами в составе влагалищного биотопа преобладала лактофлора. У женщин с преждевременными родами с истмико-цервикальной недостаточностью отмечались смешанные нарушения вагинального биоценоза.
Выводы. Риск развития спонтанных преждевременных родов достоверно определяется состоянием влагалищного биоценоза.
Цель: моделирование динамики эпидемического процесса в популяциях с различной вероятностью передачи ВИЧ-инфекции и отрицательным, нулевым, положительным приростом численности населения.
Материалы и методы. В качестве основного метода применялось компьютерное вероятностное моделирование методом Монте-Карло. Использованы следующие параметры для описания эпидемического процесса: численность населения, рождаемость, смертность, пораженность ВИЧ-инфекцией, летальность, вероятность передачи ВИЧ. Значения данных параметров были приближены к мировой статистике ЮНЭЙДС. В работе предполагается, что эффективные управленческие воздействия уменьшают вероятность передачи ВИЧ в популяции. Последовательно исследована динамика численности населения, заболеваемости и пораженности ВИЧ-инфекцией в популяциях с отрицательным, нулевым, положительным естественным приростом и вероятностью передачи ВИЧ в популяции от 50% до 10%. Статистическая проверка гипотез проводилась методом Стьюдента.
Выводы. Эффектуменьшения вероятности передачи ВИЧ в популяциях с отрицательным и нулевым приростом численности населения выражается в линейном снижении заболеваемости и пораженности (при фиксированной летальности). В популяциях с положительным естественным приростом уменьшения вероятности передачи ВИЧ менее 40% стратегически неэффективно, а при достижении 80% потенцируется резкое прекращение эпидемического процесса.
Читайте также:


