Энтеровирусные инфекции современные особенности

В настоящее время в литературе имеется достаточно обширный материал о роли энтеровирусов (ЭВ) в патологии человека. Активация энтеровирусной инфекции (ЭВИ) в последние годы отмечается во всех регионах мира, независимо от их социально-экономического развития.
Для ЭВИ характерны полиморфизм клинической симптоматики с вовлечениемв процесс всех возрастных групп детей [1,2,8].У детей, инфицированных ЭВ, с большой вероятностьюмогут встречаться такие клинические проявления заболевания как герпангина, пневмония, менингит, миокардит [4, 5, 7].
Имеются единичные публикации, проводящие параллель между степенью колонизации кишечника ЭВ и климатическими условиями [9].
Сезонные подъемы заболеваемости широко регистрируются в различных регионах Казахстана и других сопредельных республик [2, 3, 4, 5, 9, 10]. В странах с умеренным климатом ЭВИ встречаются преимущественно в летне-осенний период года.
Многие клинические формы ЭВИ склонны к эпидемическому распространению, а восприимчивость наиболее высока у детей от трех до десяти лет. Причем, болеют гораздо чаще мальчики, нежели девочки.
Цель исследования: изучить клинико-эпидемиологических параметров некоторых клинических форм ЭВИ у детей.
Материалы и методы исследования
Под наблюдением находилось 143 ребенка, больных с ЭВИ, госпитализированных в Областную инфекционную больницу г. Караганды в 2009-2011 годах.
Из них у 72 больных отмечалась малая болезнь, у 50 – серозный менингит, у 21 – паралитические формы.
Данные представлены на рисунке.
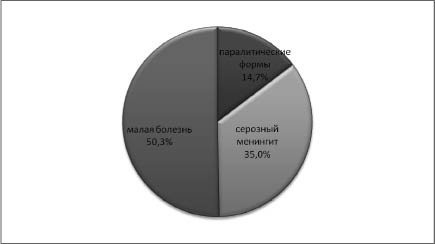
Распределение больных ЭВИ по нозологическим формам
Мальчиков было 86 (60,1 %), девочек 57 (39,9 %).
Клинический диагноз ЭВИ был подтвержден вирусологическими и (или) серологическими методами исследования. Принимались во внимание также эпидемические параметры и полиморфизм клинических проявлений болезни. При постановке клинического диагноза мы пользовались классификацией по А.П. Зинченко,1986 [6].
Подъем заболеваемости ЭВИ приходился на летний период года с пиком в июне-июле месяце, а минимальная заболеваемость зарегистрирована в январе-марте.
Результаты исследования и их обсуждение
Под наблюдением находилось 50 больных серозным менингитом энтеровирусной природы. Из них детей от года до трех лет было 1 (2,0 %), с трех до семи – 18 (36,0 %), с семи до пятнадцати – 31 (62,0 %). Мальчиков было 32 (64,0 %), девочек – 18 (36,0 %).
Заболевание у большинства детей начиналось остро с симптомов интоксикации (повышение температуры, анорексия, вялость, тошнота) и синдрома ликворной гипертензии (рвота, головная боль). Менингиальный синдром был стабилен у всех больных и присоединялся к концу первых суток заболевания. Наиболее постоянными были ригидность затылочных мышц и симптом Кернига. Для менингиальных знаков были характерны нестойкость, их диссоциация и быстрое исчезновение после проведенной люмбальной пункции.
У трех больных дошкольного возраста наблюдались быстропроходящие, обусловленные циркуляторными нарушениями, энцефалитические реакции в виде горизонтального нистагма, повышения сухожильных рефлексов и общего беспокойства.
Клеточный состав спинномозговой жидкости в начальном периоде болезни носил лимфоцитарно-нейтрофильный характер с последующей сменой на лимфоцитарныйплеоцитоз. Концентрация белка оставалась в пределах нормативных величин, а содержание сахара в ликворе имело некоторую тенденцию к снижению или оставалось в пределах нормы.
С малой болезнью (трехдневная лихорадка, энтеровирусная лихорадка)наблюдалось 72 ребенка как одной из наиболее частых форм ЭВИ. В возрасте до одного года был один больной 1,4 %, с одного до трех – 6 (8,3 %), с трех до семи – 19 (26,4 %), с семи до пятнадцати – 46 (63,9 %).
Заболевание у 54 (75,0 %) детей начиналось остро, с повышения температуры до субфебрильных у 20 (37,1 %) детей и фебрильных цифру 30 детей (55,5 %). У четырех (7,4 %) детей температурная кривая была в пределах субнормальных показателей. Продолжительность температурной кривой в среднем составляла 3-4 дня с последующим критическим или литическим спадом. Лишь у 5 (6,9 %) больных она продолжалась до 8 дней. В первый день заболевания у всех больных появлялись умеренные катаральные явления: скуднаяринорея, заложенность носа, першение в горле, катаральный конъюнктивит, гиперемия слизистой ротоглотки.
У четырех (5,5 %) больных школьного возраста на слизистой оболочке небных дужек и твердого неба были выявлены мелкие пузырьки до 2-3 мм в диаметре и красные папулы. У 6 (8,3 %) больных на второй день болезни на фоне интоксикации и катаральных явлений на кожных покровах всего тела появлялась бледно-розовая сыпь в виде средне-пятнистых элементов без какой-либо излюбленной локализации. На следующий день, реже через двое суток, сыпь бесследно исчезала. У 6 (8,3 %) детей дошкольного возраста отмечались боли в животе и синдром водянистой диареи.
У больных с первых дней заболевания отмечалась диффузная головная боль, на высоте которой появлялась рвота. Рвота однократная была зарегистрирована у двадцати (27,7 %) больных, повторная – у 34 (47,2 %).
Лицо практически у всех больных было гиперемировано, сосуды склер инъецированы, отмечалась лимфоаденопатия основных групп до II-III размера. У восемнадцати (25,0 %) больных была выявлена гепатоспленомегалия.
С паралитической формой ЭВИпод наблюдением находился 21 больной в возрасте от 2 до 7 лет.
Заболевание начиналось остро, с подъема температуры у 19 (90,4 %) больных, умеренных катаральных явлений – у15 (71,4 %), инъекции склер, покашливания. У 8 (38,0 %) детей с первых дней заболевания отмечалась однократная рвота, у 3 (14,2 %) кратковременная дисфункция кишечника.
Одновременно с гипорефлексией у 9 (42,8 %) детей развивались гипотрофия и гипотония мышц пораженной конеч ности.
Полное восстановление функций при паралитических формах ЭВИ происходило через 2-3 недели.
Эпидемические подъемы ЭВИ в Карагандинской области приходятся на летний период года, минимальная – в зимний период.
Для современного течения ЭВИ присущ выраженный полиморфизм клинических проявлений, в виде поражения нервной системы (серозный менингит, паралитические формы) и лихорадки.
Для всех клинических форм ЭВИ характерен ряд общих симптомов, которые облегчают диагностику этой инфекции : диарея, экзантема, гиперемия лица, интоксикация.
В последние годы наметилась чёткая тенденция активизации энтеровирусной инфекции (ЭВИ) в мире, о чём свидетельствует постоянная регистрация в разных странах эпидемиологических подъёмов заболеваемости. ЭВ являются распространёнными возбудителями инфекционной болезни детей и взрослых. При этом они вызывают поражение разных органов и тканей, что приводит к разнообразию клинической картины ЭВИ у пациентов разных возрастных групп. Всё это создаёт трудности диагностики отдельных клинических форм ЭВИ и решения вопросов относительно проведения противоэпидемических мероприятий и их лечения.
Цель работы – улучшить диагностику энтеровирусных инфекций у детей и взрослых на основании анализа эпидемиологических особенностей определённых клинических форм в сезоне 2016 года.
Материалы и методы. Работа проведена в рамках реализации грантового договора между Запорожским государственным медицинским университетом (ЗГМУ) и Региональным учебным центром по научным исследованиям в системе здравоохранения (Республика Казахстан). Нами проанализирована медицинская документация 185 стационарных пациентов, которые имели клинические симптомы, характерные для разных форм энтеровирусной инфекции. По результатам ПЦР кала и/или ликвора, проведённой в лаборатории молекулярно-генетических исследований ЗГМУ, выделены группы пациентов с и без ЭВИ. Проанализированы особенности в каждой группе.
Результаты. У 36,7 % (68 больных) выделено ЭВ. Среди них превалировали пациенты с менингитом (35). По 9 больным имели следующие клинические формы ЭВИ: экзантема, гастроэнтерит и герпангина. Отмечен подъём заболеваемости ЭВИ в августе–ноябре с превалированием ЭВ менингитов в августе–сентябре, ЭВ экзантем – в ноябре. Чаще ЭВИ регистрируется у детей 7–12 лет и у детей раннего возраста, с доминированием у детей школьного возраста менингитов, раннего возраста – экзантем.
Выводы. ЭВ являются распространёнными возбудителями менингитов, экзантем и везикулёзного поражения ротовой полости детей раннего и младшего школьного возраста. Отмечена чёткая сезонность и возрастные особенности определенных клинических форм ЭВИ.
Nair, H., Brooks, W. A., Katz, M., Roca, A., Berkley, J. A., Madhi, S. A., et al. (2011) Global burden of respiratory infections due to seasonal influenza in young children: a systematic review and meta-analysis. Lancet, 378(9807), 1917–1930. doi: 10.1016/S0140-6736(11)61051-9.
Marova, A. A., Oksanich, A. S., Kaira, A. N., Meskina, E. R., Medvedeva, E. A., Ivanova, O. E., et al. (2012) Primenenie metoda multipleksnoj PCR-RV dlya differencial’noj diagnostiki kishechnykh virusnykh infekcij [Experience of application of multiplex QPCR for intestine viral infection differential diagnostics]. Zhurnal mikrobiologii, e´pidemiologii i immunobiologii, 6, 39–45. [in Russian].
Xu, W., Liu, C.-F., Yan, L., Li, J.-J., Wang, L.-J., Qi, Y., et al. (2012) Distribution of enteroviruses in hospitalized children with hand, foot and mouth disease and relationship between pathogens and nervous system. Virol J., 9, 8. doi: 10.1186/1743-422X-9-8.
Seiff, A. (2012) Cambodia unravels cause of mystery illness. Lancet, 380(9838), 206. doi: 10.1016/S0140-6736(12)61200-8.
Böttcher, S., Neubauer, K., Baillot, A., Rieder, G., Adam, M., & Diedrich, S. (2015) Stool screening of Syrian refugees and asylum seekers in Germany, 2013/2014: Identification of Sabin like polioviruses. Int J Med Microbiol., 305(7), 601–6. doi: 10.1016/j.ijmm.2015.08.008.
Park, N., Schweers, N. J., & Gustin, K. E. (2015) Selective Removal Of FG-Repeat Domains From The Nuclear Pore Complex By Enterovirus 2Apro. J Virol., 89(21), 11069–79. doi: 10.1128/JVI.00956-15.
Gu, H., Liu, Z., Zhang, L., Chen, Y., Yang, S., Zhang, W., & Li, X. (2015) The etiological and clinical characteristics of hospitalized children with hand, foot and mouth disease in Beijing in 2013. Zhonghua Er Ke Za Zhi, 53(6), 459–63.
Song, Y., Cheng, X., Yang, X., Zhao, R., Wang, P., Han, Y., et al. (2015) Early growth response-1 facilitates enterovirus 71 replication by direct binding to the viral genome RNA. Int J Biochem Cell Biol., 62, 36–46. doi: 10.1016/j.biocel.2015.02.012.
Smura, T., Blomqvist, S., Vuorinen, T., Ivanova, O., Samoilovich, E., Al-Hello, H., et al. (2014) The Evolution of Vp1 Gene in Enterovirus C Species Sub-Group That Contains Types CVA-21, CVA-24, EV-C95, EV-C96 and EV-C99. PLoS One., 9(4), e94579. doi: 10.1371/journal.pone.0094579.
Khong, W. X., Yan, B., Yeo, H., Tan, E. L., Lee, J. J., Chow, V. T. et al. (2011) A non mouse-adapted Enterovirus 71 (EV71) strain exhibits neurotropism causing neurological manifestations in a novel mouse model of EV71 infection. J Virol. 86(4), 2121–2131. doi: 10.1128/JVI.06103-11.
Lukashev, A. N., Shumilina, E. Y., Belalov, I. S., Ivanova, O. E., Eremeeva, T. P., Reznik, V. I., et al. (2014) Recombination strategies and evolutionary dynamics of the Human enterovirus A global gene pool. J Gen Virol., 95(4), 868–873. doi: 10.1099/vir.0.060004-0.
Liao, C. C., Liou, A. T., Chang, Y. S., Wu, S. Y., Chang, C. S., Leee, C.-K., et al. (2014) Immunodeficient Mouse Models with Different Disease Profiles by in vivo Infection with the Same Clinical Isolate of Enterovirus 71. J Virol., 88(21), 12485–12499.
Lashkevich,V. A., Koroleva, G. F., Lukashev, A. N., Karmysheva, V. Ya., Mustafina, A. N., Khudyakova, L. V., & Shumilina, E. (2011) Enterovirus 71: HFMD-like disease, encephalomyelitis, acute pulmonary edema Epidemiology. Yu.Infect. Bol, 6, 38–47.
- На текущий момент ссылки отсутствуют.

Энтеровирусная инфекция характеризуется большим клиническим полиморфизмом, поражением центральной нервной системы, желудочно-кишечного тракта, кожных покровов и мышц. Тропность энтеровирусов к нервной ткани обеспечивает частое вовлечение в патологический процесс вещества головного мозга и мозговых оболочек, разнообразие клинических вариантов, длительность и тяжесть заболевания. 65-70% всех энцефалитов у детей составляют формы с изолированным поражением головного мозга [1, с. 4]. По данным ряда авторов, средний возраст детей с энцефалитами колеблется от 4,2+1,5 до 5,5 лет [2; 3]. Основными клиническими проявлениями энцефалитов являются нарушения сознания (86,5%) и эпилептические приступы (76,9%). Они же в совокупности с этиологическим фактором, состоянием жизненных функций, степенью выраженности общемозговой и очаговой симптоматики являются факторами, определяющими исход заболевания 4. Доля вирусов в этиологической структуре энцефалитов достигает 80-89% среди всех этиологических факторов, вызывающих заболевание [1, с. 4]. Среди вирусных причин энцефалитов выделяют энтеровирус (12%), вирус простого герпеса (5%) и цитомегаловирус 2% [3; 6].
Цель исследования: изучение региональных особенностей эпидемиологии, клинической картины энцефалитов энтеровирусной этиологии у детей на фоне терапии.
Материалы и методы исследования. С 2013 по 2017 год в Ставропольском крае не наблюдалось эпидемиологических вспышек энтеровирусной инфекции и энтеровирусных энцефалитов, регистрировались только спорадические случаи. В динамике отмечается рост заболеваемости и дальнейшее увеличение доли энтеровирусных энцефалитов в структуре энцефалитов у детей. Общая численность больных детей с подтвержденным энтеровирусным энцефалитом за указанный период времени составила 35 человек, из них 22 – за 2016 и 2017 годы.
Результаты исследования и их обсуждение. Анализ заболеваемости энтеровирусными энцефалитами подтвердил преобладание летне-осенней сезонности - 74,23% заболевших, с максимумом в августе-сентябре (54,3% больных). Средний возраст больных энтеровирусными энцефалитами 6,04+0,84 года. Доля мальчиков среди больных с энтеровирусными энцефалитами составляет 65,7%. Анализ возрастных особенностей энтеровирусных энцефалитов в Ставропольском крае выявил преобладание среди пациентов мальчиков 11-14 лет (37,5%), 6-7 лет (25%), 3-5 лет (18,8%). Среди девочек наблюдалось преобладание следующих возрастов: 3-5 лет (41,7%) и 7-9 лет (25%). Внутригодовая динамика энтеровирусных энцефалитов по результатам наблюдений в 2013-2017 годах следующая: декабрь-февраль (11,42%), апрель (8,57%), май (5,71%), июнь (5,71%), июль (8,57%), август (34,3%), сентябрь (20%), октябрь (5,71%). В марте, ноябре за указанный период времени заболеваний энтеровирусными энцефалитами не зарегистрировано. В редких случаях выявлено участие водного фактора передачи в развитии заболевания (5,71%) и контакта с больными ОРВИ (17,1%). В наших исследованиях преобладало изолированное поражение головного мозга. Энцефаломиелополирадикулоневриты в структуре энтеровирусных энцефалитов составили 5,7%. Другими проявлениями энтеровирусной инфекции у пациентов были гепатит, гастроэнтерит, герпетическая ангина, панкреатит, экзантема, частота встречаемости которых колебалась от 2,86 до 11,4%.
Для энтеровирусных энцефалитов характерно острое начало заболевания. В дебюте энцефалита у 88,6% пациентов регистрировались повышение температуры: до субфебрильных (38,7%) и фебрильных цифр (54,8%). Пиретическая лихорадка наблюдалась в 6,45% случаев. На вялость и слабость разной степени выраженности указывали 60% пациентов. Неврологическая симптоматика у пациентов с энтеровирусными энцефалитами дебютировала как признаками гипервозбудимости (ВЧГ, двигательные нарушения, судороги), так и признаками угнетения ЦНС. Общемозговая симптоматика была характерна для 57,1% пациентов: головная боль разной интенсивности, головокружение (37,1%), рвота разной частоты и интенсивности (34,3%), нарушения сознания (сопор, аменция) (8,57%). Судорожный синдром наблюдался у двух пациентов (3 и 13 лет). Синдром внутричерепной гипертензии зарегистрирован только у пациентов первого года жизни. Развитие очаговой симптоматики наблюдалось на 2-8-й день болезни. В дебюте энтеровирусного энцефалита синдром очагового поражения головного мозга проявлялся мозжечковой атаксией, нарушениями стояния и походки (42,9% пациентов), реже - глазодвигательными нарушениями (косоглазие, диплопия, птоз) (20%), редко – расстройствами речи (афазия) (2,86%). В дебюте заболевания у 57,1% пациентов наблюдалось сочетание 2 неврологических синдромов, у 42,9% - моносиндромность.
В результате исследования ЦСЖ при энтеровирусных энцефалитах в 56,7% случаев выявлен плеоцитоз. У 6 пациентов содержание клеток в ликворе превышало 100 х 10 6 /л. В остальных случаях средний уровень цитоза составил 18,8 х 10 6 /л х 10 6 /л. Плеоцитоз носил лимфоцитарный и преимущественно лимфоцитарный (лимфоциты более 70% клеток) характер. Только в 3 случаях уровень белка в ЦСЖ не превышал возрастные нормы. Во всех остальных случаях уровень белка был повышен, в единичных случаях до 1,1-1,9 г/л. Средний уровень белка в ЦСЖ при энтеровирусных энцефалитах составил 0,67 г/л. По данным Скрипченко Н. В. [2, с. 35], выявляемость возбудителя при энцефалитах может достигать 90% при проведении диагностических мероприятий в ранние сроки и в оснащенной лаборатории. Для этиологической диагностики энтеровирусного энцефалита использовали выявление энтеровируса в ЦСЖ и в кале методом ПЦР. Возбудители заболевания методом ПЦР выявлялись в 77,1% случаев.
Терапия энцефалитов энтеровирусной этиологии соответствовала современным требованиям к лечебно-охранительному режиму, этиотропной, патогенетической и симптоматической терапии. Целью проводимой терапии явилась коррекция ликворной гипертензии, нарушений гемоликвородинамики, метаболических нарушений. Комплексная терапия заключалась в применении парентеральных осмодиуретиков, таблетированных ингибиторов карбоангидразы, препаратов, улучшающих мозговое кровообращение и мозговой метаболизм, современных антигипоксантов, ноотропов. Для проведения этиотропной терапии использовали рекомбинантный интерферон альфа2 (виферон) в свечах, циклоферон для инъекций. Частота применения указанных препаратов колебалась от 34% в возрастной группе детей старше 12 лет до 81% в возрастной группе до 7 лет. Длительность этиотропной терапии зависела от возраста ребенка, тяжести сопутствующей патологии, динамики клинических симптомов. Дегидратационную терапию (осмодиуретик маннитол, диакарб) получали все пациенты с энтеровирусными энцефалитами, гормональную терапию (дексазон 1 мг/кг/сут) – пациенты с нарушением сознания, выраженными неврологическими нарушениями и энцефаломиелополирадикулоневритами. Длительность парентеральной дегидратации колебалась от 6 до 11 дней и зависела от возраста ребенка, наличия сопутствующей неврологической симптоматики. Препараты, улучшающие микроциркуляцию в ЦНС за счет вазодилатации (кавинтон, винпоцетин), применялись парентерально с последующим переходом на энтеральный путь введения для детей старше 7 лет. С целью улучшения обмена нуклеиновых кислот и стимуляции обменных процессов в нервной ткани в остром периоде назначались ноотропные препараты парентерально всем пациентам. Перевод на энтеральный путь введения осуществлялся на фоне положительной клинической динамики состояния и самочувствия пациентов. С нейротрофической и репарационной целью вводили актовегин в дозах, соответствующих возрасту пациента, парентерально с последующим переходом на таблетированные препараты (актовегин драже в течение 1-2 месяцев). Антигипоксанты и антиоксиданты, повышающие активность антиоксидантных ферментов и улучшающие мозговой кровоток (мексидол, цитофлавин) в остром периоде энтеровирусного энцефалита получали 100% пациентов. Пациенты с полинейропатией дополнительно к вышеуказанным препаратам получали препараты, улучшающие миелинизацию нервных волокон и проведение импульса в ЦНС (глиатилин, нейромидин). Системная энзимотерапия (вобэнзим) использовалась с целью улучшения реологических свойств крови и повышения эффективности противовирусных препаратов. Учитывая таблетированную форму выпуска, препарат назначался в возрастной группе старше 7 лет.
У подавляющего большинства пациентов наблюдалось острое течение заболевания с положительной динамикой основных синдромов заболевания. Волнообразное течение заболевания встречалось у 2 пациентов. Средняя длительность лечения пациентов с энтеровирусными энцефалитами в специализированном отделении составила 23,9 дня. Волнообразное течение заболевания регистрируется у больных с резидуально-органическим поражением ЦНС (22,9% пациентов, ПРОП ЦНС в виде синдрома вегето-висцеральных нарушений, эмоционально-лабильного расстройства, гидроцефального синдрома, атрофических изменений лобных долей, головного мозга, кистозного арахноидита), хронической соматической патологией. Для энтеровирусных энцефалитов у детей характерны следующие ранние исходы заболевания: клиническое выздоровление на момент выписки (28,57%); клиническое выздоровление с сохранением астеновегетативных проявлений, умеренной или слабо выраженной внутричерепной гипертензии (37,1%); формирование неврологического дефицита (наличие очаговой неврологической симптоматики разной степени выраженности, атаксический синдром, спастический тетрапарез), требующего лечения в специализированном психоневрологическом отделении (31,4%). Летальный исход наблюдался в 1 случае. Клиническое выздоровление характерно для пациентов со среднетяжелой или тяжелой формой нейроинфекции, при умеренных неврологических проявлениях, отсутствии выраженных изменений при проведении НСГ исследования, МРТ ГМ, КТ. Соответственно, летальный исход и формирование неврологического дефицита более типично для пациентов с тяжелой формой заболевания, имеющих выраженные и/или длительные неврологические проявления, грубые изменения по результатам инструментального исследования. Анализ отдаленных исходов энтеровирусных энцефалитов и менингоэнцефалитов не проводился.
Заключение. Таким образом, в Ставропольском крае не зарегистрировано эпидемиологических вспышек энтеровирусных энцефалитов и заболеваемость энтеровирусными энцефалитами носит спорадический характер. Максимальная заболеваемость наблюдается в августе-сентябре месяце и совпадает с ростом общей заболеваемости энтеровирусными инфекциями. Проведен анализ результатов динамического наблюдения за пациентами в возрасте от 0 до 17 лет с энтеровирусными энцефалитами (n=35), жителями Ставропольского края. Средний возраст детей с энтеровирусными энцефалитами составил 6,04+0,84 года, что достоверно меньше, чем у детей с энтеровирусными менингитами (9,5+0,55 года) [7, с. 17, 19]. При энтеровирусных энцефалитах доля пациентов мужского пола ниже (65,7%), чем при энтеровирусных менингитах (75%). Для пациентов с энтеровирусными энцефалитами характерна меньшая выраженность интоксикационного синдрома, общемозговой симптоматики, синдрома внутричерепной гипертензии по сравнению с пациентами с энтеровирусными менингитами. Для энтеровирусного энцефалита характерен более низкий плеоцитоз, чем при энтеровирусных менингитах. Возбудители заболевания методом ПЦР выявлялись в 77,1% случаев. Острое течение заболевания с выздоровлением в большинстве случаев обусловлено проведением комплексной терапии (парентеральные осмодиуретики, таблетированные ингибиторы карбоангидразы, препараты, улучшающие мозговое кровообращение и мозговой метаболизм, современные антигипоксанты, ноотропы).
Полный текст:
Инфекции, вызываемые энтеровирусами Коксаки и ECHO, — группа острых заболеваний, характеризующихся многообразием клинических форм: от вирусоносительства и легких лихорадочных состояний до манифестных проявлений в виде энтеровирусной экзантемы, серозного менингита, миалгий и т. д. Проявления отличаются полиморфизмом, ≤нередко связаны с поражением центральной нервной системы, мышц, миокарда и кожных покровов. В разных регионах Российской Федерации и странах ближнего и дальнего зарубежья регистрируются эпидемические вспышки и/или подъемы заболеваемости. В статье освещены особенности патогенеза инфекции, рассмотрены пути ее передачи и особенности профилактики. Учитывая распространенность, особенности течения и сезонность, необходима настороженность специалистов в отношении данных возбудителей.
1. Сейбиль В. Б., Малышкина Л. П. Всемирная организация здравоохранения и проблема ликвидации инфекционных заболеваний в мире. Вопросы вирусологии. 2005; 50: 3.
2. Амвросьева Т. В., Богуш З. Ф. и др. Вспышка энтеровирусной инфекции в Витебске в условиях загрязнения питьевой воды. Вопросы вирусологии. 2004; 1: 7–9.
3. Ежлова Е. Б., Чернявская О. П., Михайлов М. И. Эпидемио логический надзор и профилактика энтеровирусной (неполио) инфекции. Методические указания 3.1.1.2363-08. Москва. 2008.
4. Кузнецова В. Г., Мечетина А. А. и др. Клинико-эпидемиологическая характеристика энтеровирусного менингита по данным вспышки 2004 года. Сборник материалов XV Научно-практической конференции врачей. Новосибирск. 2005. С. 415–416.
5. Лашкевич В. А., Дроздов С. Г., Грачев В. П. и др. Неполиомиелитные энтеровирусные инфекции: Эпидемиология, характеристика энтеровирусов, клиника, диагностика, профилактика. Методическое пособие. Федеральный центр Госсанэпиднадзора РФ. Москва. 2004.
6. Melnick J. L., Shaw E. W., Curnen E. C. A virus irom patients diagnosed as non-paralytic poliomyelitis or aseptic meningitis. Proc. Soc. Exp. Biol. 1949; 71: 344–349.
7. Abubakar S., Chee H. Y., Shafee N. et al. Molecular detection of enteroviruses from an outbreak of hand, foot and mouth disease in Malaysia in 1997. Scand. J. Infect. Dis. 1999; 31 (4): 331–335.
8. Ang L. W., Koh B.K., Chan K. P. et al. Epidemiology and control of hand, foot and mouth disease in Singapore, 2001–2007. Ann. Acad. Med. Singapore. 2009; 38 (2): 106–112.
9. Энтеровирусные заболевания: клиника, лабораторная диагностика, эпидемиология, профилактика. Методические указания (МУ 3.1.1.2130-06). Москва. 2006.
10. Ding N. Z., Wang X. M., Sun S. W. et al. Appearance of mosaic enterovirus 71 in the 2008 outbreak of China. Virus Res. 2009; 45 (1): 157–161.
11. Osterback R., Vuorinen T., Linna M. et al. Coxsackievirus A6 and hand, foot and mouth disease, Finland. Emerg. Infect. Dis. 2009; 15 (9): 1485–1488.
12. Yamashita T., Ito M., Taniguchi A., Sakae K. Prevalence of coxsackievirus A5, A6, and A10 in patients with herpangina in aichi prefecture. J. Infect. Dis. 2005; 58: 390–391.
13. Бочаров Е. Ф., Ерман Б. А., Фомин В. В. и др. Энтеровирусная инфекция: Новые аспекты. Новосибирск: Наука. Сибирское отделение РАМН. 1990. С. 224.
14. Лозовская Л. С. и др. Значение вертикальной передачи энтеровирусов в эпидемиологии врожденных вирусных инфекций. Акушерство и гинекология. 1995; 2: 26–30.
15. Mori M., Takagi K., Kuwabara S. et al. Guillain-Barre syndrome following hand-foot-and-mouth disease. Intern. Med. 2000; 39 (6).
16. Cabral L. A., Almeida J. D., de Oliveria M. L., Meza A. C. Hand, foot and mouth disease: a case report. Quintessence Int. 1998; 29: 194–196.
17. Злобин В. И. Энтеровирусные инфекции. Инфекционные болезни. 1999. С. 302–307.
18. Демина А. В., Маркович Н. А., Нетесов С.В. Энтеровирусы. Часть 1. История открытия, таксономия, строение генома, эпидемиология. Бюллетень СО РАМН. 2008; 1 (129): 92–100.
19. Демина А. В. и др. Энтеровирусы. Часть 2. Энтеровирусные инфекции: Многообразие клинических проявлений. Бюллетень СО РАМН. 2009; 6 (140): 116–125.
20. Лобзин Ю. В., Пилипенко В. В., Громыко Ю. Н. Менингиты и энцефалиты. СПб.: Фолиант. 2001. С. 55–110.
21. Михайлов Е. В., Штейнберг А. В., Еремеева И. Г. Менингиты энтеровирусной этиологии у детей: Современные подходы к диагностике и особенности клинического течения. Инфекционные болезни. 2008; 6 (1): 31–34.
22. McMinn P., Stratov I., Nagarajan L., Davis S. Neurological manifestations of enterovirus 71 infection in children during an outbreak of hand, foot, and mouth disease in western australia. Clin. Infect. Dis. 2001; 32 (2): 236–242.
23. Nix W. A., Oberste M. S., Pallansch M. A. Sensitive, seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimens. J. Clin. Microbiol. 2006; 44 (8): 2698–2704.
24. Logotheti M., Pogka V., Horefti E. et al. Laboratory investigation and phylogenetic analysis of enteroviruses involved in an aseptic meningitis outbreak in greece during the summer of 2007. J. Clin. Virol. 2009; 46 (3): 270–274.
25. Sasidharan C. K., Sugathan P., Agarwal R. et al. Hand-foot-andmouth disease in calicut. Indian J. Pediatr. 2005; 72 (1): 17–21.
26. Tu P., Thao N., Perera D. et al. Epidemiologic and virologic investigation of hand, foot, and mouth disease, southern vietnam, 2005. Emerging Infectious Diseases. 2007; 13 (11).
27. Zhang Y., Nan L. J., Wu G. S. et al. The epidemiologic and virological analysis of an outbreak of hand, foot, and mouth disease in inner Mongolia in 2007. Bing Du Xue Bao. 2009; 25 (3): 159–165.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Полный текст:
Актуальность. Ежегодные подъемы заболеваемости энтеровирусной инфекцией в Российской Федерации, в том числе в Сахалинской области, определяют необходимость постоянного мониторинга с применением молекулярно-генетических методов и филогенетического анализа. Цель исследования – выявить эпидемиологические и молекулярно-генетические особенности энтеровирусной инфекции в Сахалинской области в 2016–2018 гг. Материалы и методы. Анализ заболеваемости энтеровирусной инфекцией в Сахалинской области проведён на основании статистических форм отчетности. Типовой состав циркулирующих энтеровирусов определён с использованием молекулярно-генетических методов с последующим филогенетическим анализом. Результаты и обсуждение. С 2016 г. в Сахалинской области отмечено ухудшение эпидемической обстановки по энтеровирусной инфекции, проявившееся ростом заболеваемости и регистрацией эпидемических очагов в детских учреждениях. Молекулярно-генетическими методами исследования установлено, что в циркуляции преобладали Коксаки А-6 (2016 г.), Коксаки А-10 (2017 г.), Коксаки А-16 и ЕСНО-9 (2018 г.). Филогенетический анализ показал принадлежность нуклеотидных последовательностей вирусов Коксаки А-16 к двум геновариантам геногруппы В (В1а и В1b), длительно циркулирующим в России и Китайской Народной Республике. Кроме того, вирус ЕСНО-9 в 2018 г. обусловил не только спышечные очаги, но и спорадическую заболеваемость в Сахалинской области. Выводы. Неблагополучная эпидемическая ситуация в отношении энтеровирусной инфекции, сложившаяся в Сахалинской области в последние три года наблюдения, скорее всего, обусловлена появлением и дальнейшим широким распространением среди населения энтеровирусов Коксаки А 6, 10, 16 типов и эховируса 9 типа, имеющих российское или зарубежное происхождение.
Сапега Елена Юрьевна – кандидат медицинских наук, ведущий научный сотрудник, руководитель Дальневосточного регионального научно-методического центра по изучению энтеровирусных инфекций.
Хабаровск, ул. Шевченко 2, 680610.
+7 (421)246-18-52, +7-909-804-33-14.
Бутакова Людмила Васильевна – научный сотрудник Дальневосточного регионального научно-методического центра по изучению энтеровирусных инфекций.
Хабаровск, ул. Шевченко 2, 680610.
+7 (421)246-18-52, +7-914-203-67-31.
Троценко Ольга Eвгеньевна – доктор медицинских наук, директор.
Хабаровск, ул. Шевченко 2, 680610.
Фунтусова Ольга Алексеевна – руководитель.
693020, Южно-Сахалинск, ул. Чехова, 30А.
Ковтонюк Галина Петровна – заместитель руководителя Управления Роспотребнадзора по Сахалинской области.
693020, Южно-Сахалинск, ул. Чехова 30А.
1. Лукашев А.Н., Иванова О.Е., Худякова Л.В. Социально-экономическая значимость энтеровирусной инфекции и ее роль в структуре инфекционной патологии в мире // Журнал микробиологии, эпидемиологии и иммунобиологии. 2010. № 5. С. 113–120
2. Морозова Н.С., Чернявская О.П., Михайлова Ю.М. и др. Энтеровирусная (неполио) инфекция в Российской Федерации в сезон 2013 года // Здоровье населения и среда обитания. 2014. № 10 (259). С. 34–37.
3. Троценко О.Е., Каравянская Т.Н., Отт В.А. и др. Многолетний анализ проявлений эпидемического процесса энтеровирусной инфекции в Хабаровском крае и основные факторы, определяющие ухудшение эпидемиологической ситуации в условиях наводнения // Проблемы особо опасных инфекций. 2014. № 1. С. 75–78.
5. Петрухина М.И., Старостина Н.В. Статистические методы в эпидемиологическом анализе. Москва; 2006.
6. Nix W.A., Oberste M.S, Pallansch M.A. Sensitive, seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimens // Journal of Clinical Microbiology. 2006. Vol. 44, N 8. P. 2698–2704.
7. Drummond A.J., Suchard M.A., Xie D., et al. Bayesian phylogenetics with BEAUTi and the BEAST 1.7. // Molecular Biology and Evolution. 2012. Vol. 29, N 8. P. 1969–1973.
8. Shapiro B., Rambaut A., Drummond A.J. Choosing appropriate substitution models for the phylogenetic analysis of protein-coding sequences // Molecular Biology and Evolution. 2006. Vol. 23, N 1. P. 7–9.
9. Бутакова Л.В., Сапега Е.Ю., Троценко О.Е. и др. Молекулярно-эпидемиологическая характеристика групповой заболеваемости энтеровирусной инфекции, обусловленной вирусом Коксаки А6, среди населения Дальнего Востока Российской Федерации в 2016–2017 гг. // Тихоокеанский медицинский журнал. 2018. № 3. C. 92–97.
10. Голицына Л.Н., Зверев В.В., Парфенова О.В. и др. Эпидемические варианты неполиомиелитных энтеровирусов в России // Медицинский альманах. 2015. Т. 40, № 5. С. 136–140.
11. Hassel C., Mirand A., Farkas A., et al. Phylogeography of Coxsackievirus A16 Reveals Global Transmission Pathways and Recent Emergence and Spread of a Recombinant Genogroup // Journal of virology. 2017. Vol. 91, N 18. P. e00630–17.
12. Ji H., Fan H., Lu P.X., et al. Surveillance for severe hand, foot, and mouth disease from 2009 to 2015 in Jiangsu province: epidemiology, etiology, and disease burden // BMC Infectious Diseases. 2019. Vol. 19, N 1. P. 79.
13. Голицына Л.Н., Фомина С.Г., Новикова Н.А. и др. Молекулярно-генетические варианты вируса ECHO 9, идентифицированные у больных серозным менингитом в России в 2007–2009 гг. // Вопросы вирусологии. 2011. Т. 56, № 6. С. 37–42.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


