Enterococcus faecalis что за инфекция и как лечиться

Энтерококк фекальный или энтерококк фекалис (лат. Enterococcus faecalis) — вид энтерококков, входящий в состав нормальной микрофлоры пищеварительного тракта человека, а также некоторых млекопитающих.
Фекальные энтерококки — самые часто встречающиеся в организме человека и домашней птицы энтероккоки. Фекальные энтерококки также колонизируют кишечник крупного рогатого скота, свиней, собак, лошадей, овец и коз.
Фекальный энтерококк может являться возбудителем различных инфекций: мочевыводящих путей, интраабдоминальных, органов малого таза, раневых, эндокардита. Фекальные энтерококки, наряду с энтерококками вида фэциум являются наиболее патогенными видами среди энтерококков, они составляют 80–90% от всех выделенных в клиническом материале человека энтерококков. Фекальные энтерококки часто бывают причиной внутрибольничных инфекций (Бондаренко В.М. Суворов А.Н. Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции).
В то же время, фекальные энтерококки входят в состав нормальной микрофлоры желудочно-кишечного тракта человека и многих позвоночных, играют важную роль в обеспечении колонизационной резистентности слизистой оболочки. Основное место обитания фекального энтерококка в организме — тонкая кишка, но он также встречается в толстой кишке, губчатой части мочеиспускательного канала, в половых органах, и, иногда, в полости рта. Фекальные энтерококки присутствуют в кале 90 % взрослых людей. Количество фекальных энтерококков во внешней среде является значимым санитарным и эпидемиологическим показателем ее фекальной загрязненности.
Бактериурия — наличие бактерий в моче может является признаком воспаления в мочевыводящих путях, мочевом пузыре, почках. При отсутствии каких-либо симптомов, истинная бактериурия (инфекция мочевых путей) диагностируется при наличии не менее 10 5 микробных тел в 1 мл свежевыпущенной мочи, иначе предполагается, что загрязнение мочи происходит при ее заборе. При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. Часто бактериурия не сопровождается какими-либо симптомами, тогда она называется бессимптомной или асимптоматическая бактериурией. В то же время, бактериурия нередко сочетается с симптомами цистита, пиелонефрита, простатита, уретрита, а также встречается у беременных. Бессимптомная бактериурия не всегда требует немедленного лечения.
Одним из возбудителей воспалений мочевыводящих путей (ВМП) является фекальный энтерококк, на долю которого приходится от 1 до 18 % (в зависимости от типа заболевания) всех выявленных при бактериурии патогенных микроорганизмов. Остальные виды энтерококков практически не встречаются среди возбудителей ВМП.
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении Enterococcus faecalis: левофлоксацин, норфлоксацин, офлаксацин, рифаксимин, нифурател, доксициклин (не ко всем штаммам). Enterococcus faecalis умеренно чувствителен к ципрофлоксацину. 74 % штаммов Enterococcus faecalis не чувствительны к тетрациклину. Не активны в отношении Enterococcus faecalis линкомицин и клиндамицин. Чувствительные к ванкомицину и гентамицину штаммы Enterococcus faecalis чувствительны также к моксифлоксацину.
Для лечения острых неосложненных инфекций мочевыводящих путей, вызванных Enterococcus faecalis могут быть рекомендованы нитрофураны, цефалоспорины III поколения, гентамицин, фторхинолоны, последние — с оговоркой о неблагоприятных тенденциях к росту устойчивости. Следует отметить, что цефалоспорины лишены активности против энтерококков, а ранние фторхинолоны (ломефлоксацин, норфлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин) обладают слабой активностью против Enterococcus faecalis.
По современным представлениям вид Enterococcus faecalis относится к роду Enterococcus (энтерококки), который входит в семейство Enterococcaceae, порядок Lactobacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
По принятой ранее классификации энтерококки относились к стрептококкам серогруппы D и Enterococcus faecalis назвался Streptococcus faecalis. Традиционно он иногда называется фекальным стрептококком.
В последние годы значительно увеличилось число воспалительных заболеваний мужских половых органов, вызванных условно-патогенными микроорганизмами, доминирующих в микробиоте урогенитального тракта, проявляющих патогенный потенциал при экстремальных условиях (стресс, переохлаждение, травмы, облучение, интоксикации) [1, 4].
Негонококковые уретриты у мужчин до настоящего времени остаются трудно диагностируемой патологией в связи с широким спектром возможных этиологически значимых агентов, трудности их дифференцировки от представителей нормальной микрофлоры уретры, доказательством участия в воспалительном процессе и установления факторов, способствующих прогрессированию [12, 16, 13]. Медико-социальная значимость проблемы определяется тем, что негонококковые уретриты чаще встречаются у молодых людей репродуктивного возраста. Доказано, что 95,0 % мужчин 18-45 лет страдают хроническим воспалением предстательной железы вследствие перенесенного урогенитального заболевания, обусловленного патогенными или условно-патогеннными микроорганизмами. Эпидемиологическое и клиническое значение негонококковых уретритов заключается в повышении риска заболевания ВИЧ-инфекцией, генитальным герпесом, сифилисом, развитием осложнений (простатит, эпидидимит) [8, 7].
Формирование воспалительной симптоматики негонококковых уретритов связано не только с инфекцией, обусловленной Chlamydia trachomatis и/или Ureaplasma urealyticum, но и условно-патогенными грамположительными и грамотрицательными микроорганизмами: Escherichia coli, Enterococcus spp., Pseudomonas aeruginosa, Proteus spp. и др. Несмотря на то, что энтерококки являются представителями нормальной микрофлоры уретры, они все чаще расцениваются как возбудители инфекций мочевыводящих путей [3]. Энтерококки, ранее относимые к стрептококкам группы D – многочисленная группа бактерий рода Enterococcus, включает виды Е. faecalis, Е. faecium. E. faecalis продуцирует цитотоксин, вызывающий лизис эритроцитов, нейтрофилов. Штаммы E. faecalis, продуцирующие цитотоксин, проявляют высокую резистентность к антибактериальным препаратам [8]. E. faecalis способен длительно персистировать в мочеполовой системе, обладает высокой протеолитической активностью, гидролизирует коллаген, гемоглобин и другие белки [2].
Цель исследования: Видовая идентификация условно-патогенных микроорганизмов у пациентов с негонококковыми уретритами и оценка чувствительности к антибактериальным препаратам E. faecalis.
Материалы
и методы исследования
Критериями для постановки диагноза негонококковый уретрит, ассоциированный с условно-патогенными микроорганизмами являлись:
1. Отсутствие возбудителей инфекций, передаваемых половым путем (Neisseria gonorrhoeae, C. trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Herpes simplex, Cytomegalovirus);
2. Жалобы пациента (выделения из мочеиспускательного канала, зуд, рези, жжение, чувство дискомфорта в уретре, запах в области наружных половых органов);
3. Анамнестические данные (ранее перенесенные негонококковые уретриты, случайные половые связи, переохлаждения, злоупотребления алкоголем, хронические заболевания мочеполовой системы);
4. Наличие объективной клинической картины (выделения из канала, гиперемия кожи головки, гиперемия и отечность губок уретры, налет на головке полового члена);
5. Лабораторные данные: количество лейкоцитов более 4-5 в поле зрения при микроскопии мазков из уретры окрашенных метиленовым синим и по Граму; бактериологическое исследование, в котором рост условно-патогенных микроорганизмов определялся в концентрации 104 КОЕ/мл и выше.
Критерии включения в исследование – пациенты мужского пола в возрасте от 18 до 45 лет, подписавшие информированное согласие на участие в исследовании, наличие диагноза НГУ подтвержденного микроскопическим и микробиологическим методами.
Критерии исключения – возраст менее 18 лет и старше 46, наличие ИППП, острое течение воспалительного процесса в органах урогенитального тракта, другие инфекционные заболевания мочевыводящих путей (пиелонефрит, цистит и др.) Тяжелые соматические заболевания (сахарный диабет, лихорадка, эпилепсия, гипотиреоз и др.)
Результаты исследования
и их обсуждение
При исследовании микробной обсемененности передней уретры у 1335 пациента с негонококковыми уретритами, ассоциированными с условно-патогенными микроорганизмами, было установлено, что концентрация микроорганизмов превышала 104 КОЕ/мл и в ряде случаев доходила до 109 КОЕ/мл. Спектр и частота условно-патогенных микроорганизмов обследованных пациентов с негонококковыми уретритами, идентифицированных масс-спектрометрическим методом, представлены на рис. 1.
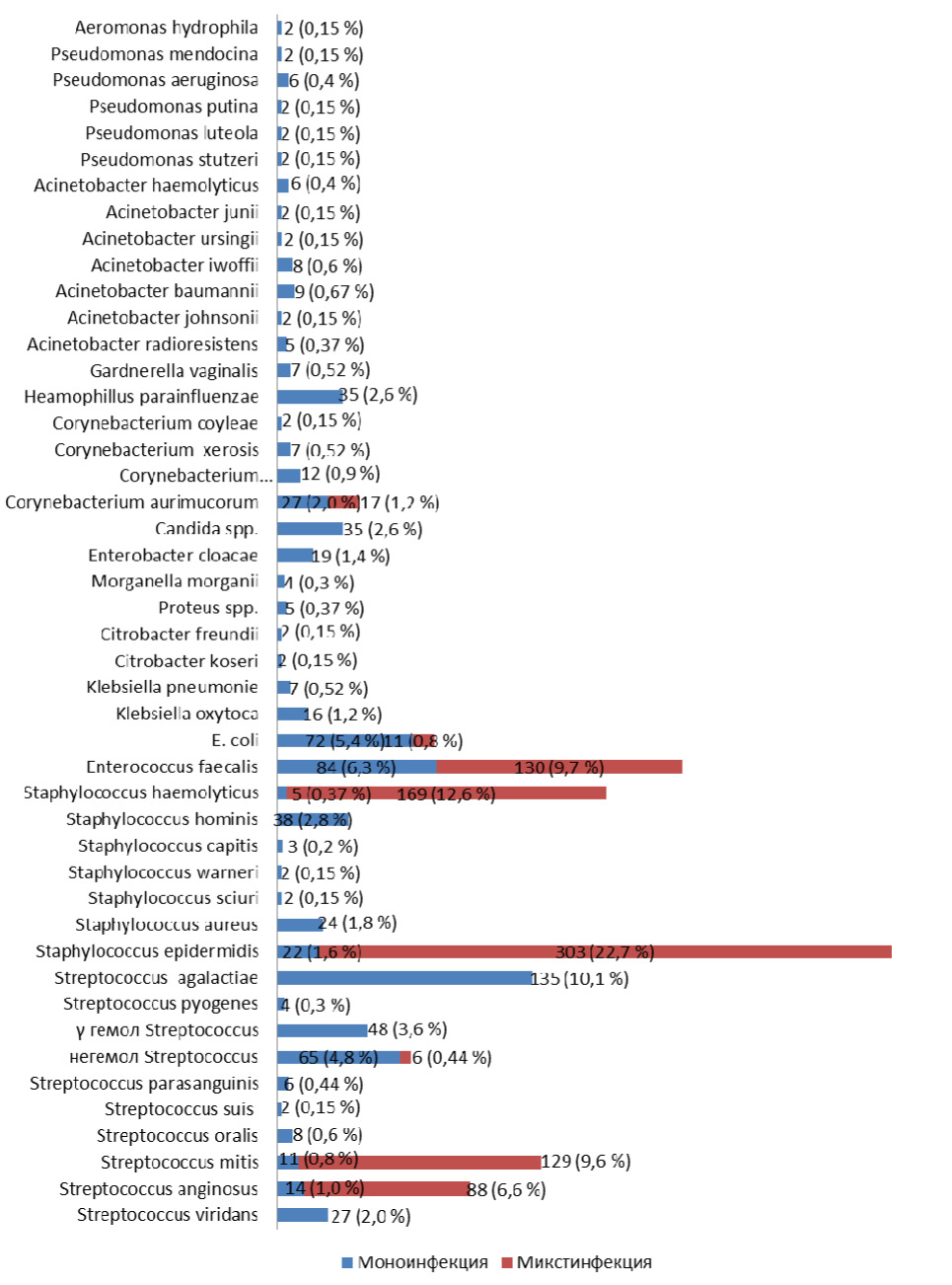
Рис. 1. Частота обнаружения условно-патогенных микроорганизмов у мужчин с негонококковыми уретритами (n=1335)*
*Поливариантный признак
Применение высокотехнологичного протеомного метода масс-спектрометрии позволило расширить представления о видовой структуре условно-патогенной микробиоты, в отличие от классических бактериологических методов, основанных на фенотипическом анализе: морфологических, тинкториальных, культуральных, биохимических и антигенных свойств микроорганизма.
Полученные данные свидетельствуют о том, что основную обсемененность урогенитального тракта составляют представители семейства Streptococcaceaе (56,6 %) – Enterococcus faecalis (16,0 %), Streptococcus mitis (10,4 %), Streptococcus agalactiae (10,1 %), Streptococcus anginosus (7,6 %), негемолитический Streptococcus (5,3 %), γ-гемолитический Streptococcus (3,6 %), Streptococcus viridans (2,0 %), Streptococcus oralis (0,6 %), Streptococcus parasanguinis (0,45 %), Streptococcus pyogenes (0,3 %), Streptococcus suis (0,2 %); семейства Micrococcaceae (42,4 %) – Staphylococcus epidermidis (24,3 %), Staphylococcus haemolyticus (13,0 %), Staphylococcus hominis (2,8 %), Staphylococcus aureus (1,8 %), Staphylococcus capitis (0,2 %), Staphylococcus warneri (0,15 %), Staphylococcus sciuri (0,15 %) и семейство Enterobacteriaceae (10,3 %) – Escherichia coli (6,2 %), Enterobacter cloacae (1,4 %), Klebsiella oxytoca (1,2 %), Klebsiella pneumonia (0,52 %), Proteus spp. (0,37 %), Morganella morganii (0,3 %), Citrobacter freundii (0,15 %), Citrobacter koseri (0,15 %). Небольшую группу представляют род Corynebacterium (5,7 %) – Corynebacterium aurimucorum (3,3 %), Corynebacterium glucuronolyticum (0,9 %), Corynebacterium xerosis (0,52 %), Corynebacterium coyleae (0,15 %), род Haemophilus – Haemophilus parainfluenzae (2,6 %), Gardnerella vaginalis (0,52 %), неферментирующие грамотрицательные палочки (3,6 %) – Acinetobacter baumannii (0,67 %), Acinetobacter lwoffii (0,6 %), Pseudomonas aeruginosa (0,45 %), Acinetobacter haemolyticus (0,45 %), Acinetobacter radioresistens (0,37 %), Pseudomonas mendocina (0,15 %), Pseudomonas putida (0,15 %), Pseudomonas luteola (0,15 %), Pseudomonas stutzeri (0,15 %), Acinetobacter junii (0,15 %), Acinetobacter ursingii (0,15 %), Acinetobacter johnsonii (0,15 %), дрожжеподобные грибы рода Candida albicans (2,6 %).
Как видно на рис. 1 наиболее часто высеваемые микроорганизмы, такие как Staphylococcus epidermidis (24,3 %), Staphylococcus haemolyticus (13,0 %), Streptococcus mitis (10,5 %), Streptococcus anginosus (7,6 %), чаще обнаруживались при микстинфекции в 22,7 %, 12,7 %, 9,7 %, 6,6 % случаев и только у 1,6 %, 0,3 %, 0,8 %, 1,0 % пациентов соответственно он выявлялись в виде моноинфекции.
Анализируя полученные данные бактериологического исследования отделяемого уретры у пациентов с НГУ отмечено, что Enterococcus faecalis выявлялся в 16,0 %, Streptococcus agalactiae в 10,1 %, Escherichia coli в 6,2 % случаев, являясь вероятной причиной воспаления в уретре.
E. faecalis обнаружен у 214 пациентов, что составило 16,0 % от общего числа больных с негонококковыми уретритами, у 84 (39,2 %) пациентов было выявлено моноинфицирование E. faecalis, а у 130 (60,8 %) больных E. faecalis диагностировался в ассоциации с другими микроорганизмами. Частота выявления микробных ассоциаций у больных с негонококковыми уретритами, ассоциированными с E. faecalis, представлена на рис. 2.
Из представленных на рис. 2 данных видно, что негонококковые уретриты, ассоциированные с E. faecalis чаще всего сочетались с Staphylococcus epidermidis в 43,8 % случаев, Staphylococcus haemolyticus в 19,2 % и Streptococcus anginosus в 16,1 % случаев.
Проведены исследования по определению чувствительности штамов E. faecalis, выделенных от 214 пациентов с негонококковыми уретритами к 15 антибактериальным препаратам различных групп (бензилпенициллин, ампициллин, гентамицин, стрептомицин, ципрофлоксацин, левофлоксацин, моксифлоксацин, эритромицин, клиндамицин, линезолид, хинупристин/дальфопристин, ванкомицин, тетрациклин, тайгециклин, нитрофурантоин). Как следует из данных представленных на рис. 3, штаммы E. faecalis показали формирование резистентности к бензилпенициллину (49,0 %) и ампициллину (52,0 %). Кроме того, обращает на себя внимание прогрессивное снижение чувствительности к гентамицину (57,0 %) и стрептомицину (64,5 %). Вместе с тем, отмечено, что все протестированные фторхинолоны обладали хорошей активностью в отношении E. faecalis. Так 59 (27,6 %) штаммов были не чувствительны к ципрофлоксацину, 45 (21,1 %) к левофлоксацину и 58 (27,2 %) к моксифлоксацину. Большинство штаммов E. faecalis (98,0 %) были чувствительны к нитрофурантоину и к ванкомицину (99,0 %). Препараты линезолид и тайгециклин демонстрировали 100 % активность к штаммам E. faecalis. Все штаммы E. faecalis были резистентны к эритромицину, клиндамицину, хинупристину/дальфопристину и тетрацик-
лину.
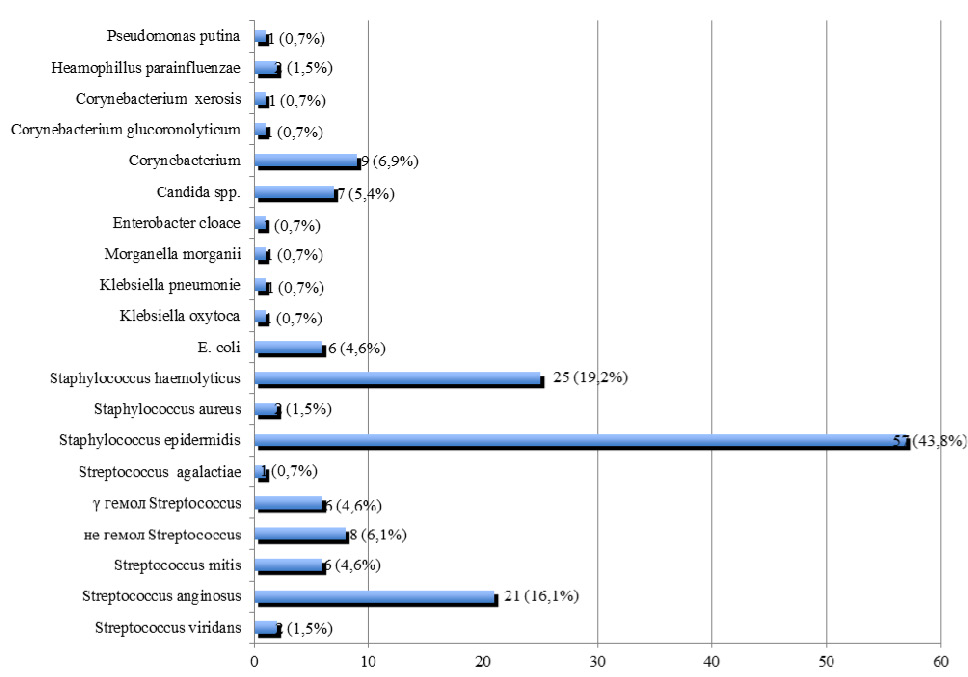
Рис. 2. Частота выявления микробных ассоциаций у больных с негонококковыми уретритами, ассоциированными с E. faecalis (n= 130)
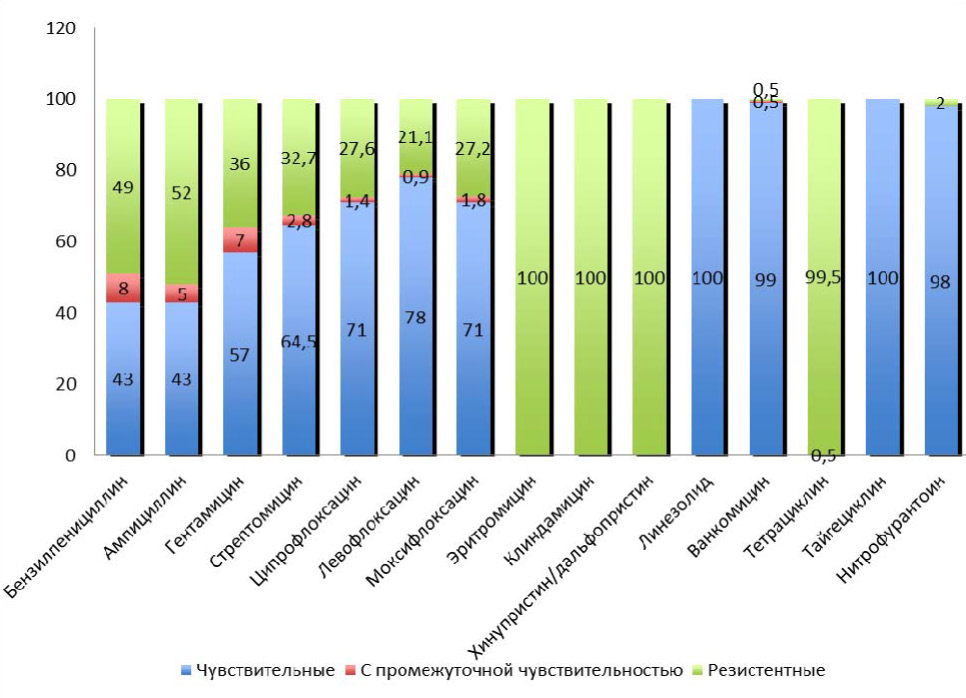
Рис. 3. Чувствительность (в %) к антибактериальным препаратам выделенных штамов Enterococcus faecalis (n = 214)
Обсуждение результатов. В настоящее время наиболее достоверным критерием, позволяющим охарактеризовать энтерококки в плане их потенциальной патогенности, является наличие у энтерококкового штамма набора генов патогенности. Обнаружена закономерная связь между наличием в штаммах энтерококков тех или иных генов патогенности и характером течения патологического процесса. Штаммы энтерококков в составе нормальной микрофлоры урогенитального тракта практически никогда не содержали генов цитолизинов при высоком содержании факторов адгезии [11]. Одним из наиболее изученных факторов E. faecalis является ген GelE, который кодирует гидролиз желатина, коллагена, казеина и других пептидов и контролируется FSR двухкомпонентной системой, состоящей из четырех генов (fsrA, fsrB, fsrD, and fsrC) (10, 14). Выработка двух вирулентных факторов: желатиназы (GelE) и сериновой протеазы (SprE) является кворум – зависимым процессом. Исследования последних лет показали, что желатиназа играет важную роль в формировании биопленок E. faecalis, что, возможно, обеспечивает их устойчивость к антибактериальной терапии (15).
Проведенное исследование показало высокую встречаемость E. faecalis (16,1 %) у больных с негонококковыми уретритами, в виде моноинфицирования у 84 (39,2 %) пациентов и в ассоциции с другими условно-патогенными микроорганизмами у 130 (60,8 %).
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков подразумевает применение антибактериальной терапии, основанной на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения антибактериальных препаратов является возможность быстрого начала терапии. Но данные литературы указывают на значительные трудности в выборе адекватной антибактериальной терапии при инфекциях, вызванных полирезистентными штаммами грамотрицательных бактерий, такими как Enterococcus spp.. Этиотропное назначение антибиотиков предполагает выделение возбудителя инфекции из клинического материала и определение его чувствительности к антибиотикам. Поэтому успешное лечение воспалительных заболеваний урогенитального тракта сопровождается микробиологическим исследованием. Возбудитель должен быть выявлен, идентифицирован и оценен на предмет его чувствительности к противомикробным средствам. Весьма проблемным в настоящее время является проведение антибактериальной терапии инфекционных процессов, ассоциированных с E. faecalis, характеризующимися множественной устойчивостью к антибиотикам. Причины развития антибиотикорезистентности до конца не установлены, однако не вызывает сомнения, что важную роль в этом играет необоснованное использование антимикробных препаратов, приводящая к селекции полирезистентных штаммов микроорганизмов как возбудителей, так и не являющихся этиологически значимыми, не входивших в спектр активности препарата, что наносит параллельный ущерб [6]. Формы устойчивости к антибиотикам становятся все более разнообразными, что требует применения новых технологий для их выявления. Оптимальным решением является автоматизация бактериологических исследований, позволяющая ускорять и стандартизировать процесс определения чувствительности.
Результаты определения чувствительности к бензилпенициллину и ампициллину – препаратам, наиболее часто применяемым для эмпирической терапии урогенитальных инфекций, показали резистентность штаммов E. faecalis в 49 %, 52 % случаев, соответственно. E. faecalis отличался значительной устойчивостью к важным для терапии энтерококковых инфекций препаратам – аминогликозидам. Умеренно-резистентные и резистентные штаммы E. faecalis выявлены к гентамицину в 43,0 %, к стрептомицину – в 35,5 % случаев. В ходе проведенного исследования установлено, что все 100 % штаммов E. faecalis были устойчивы к препаратам макролидам (эритромицин), линкозамидам (клиндамицин) и хинупристин/дальфопристину. Рядом исследований показано, что полирезистентность к макролидам, линкозамидам и стрептограминам определяется фенотипом MLSB, который обусловлен наличием генов еrm. Эти гены кодируют метилтрансферазу, которая метилирует рибосомы и предотвращает связывание антибиотика с мишенью.
Штаммы E. faecalis, выделенные от больных с НГУ проявляли чувствительность к антибактериальным препаратам линезолиду и тайгециклину (100 %), к ванкомицину (99,1 %), нитрофурантоину (98,1 %).
Возрастающая частота множественно-резистентных к традиционным антибактериальным препаратам штаммов E. faecalis, высокая чувствительность к фторхинолонам (78,0 % к левофлоксацину, 71,0 % к ципрофлоксацину и моксифлоксацину), появление новых препаратов этой группы с улучшенной активностью в отношении грамположительных микроорганизмов, позволяет рассматривать препараты группы фторхинолонов, которые не являются препаратами выбора, как альтернативные для терапии негонококковых уретритов обусловленных E. faecalis.
Таким образом, комплексное обследование отделяемого уретры 1335 пациентов с негонококковыми уретритами, с объективными и субъективными симптомами воспаления, с исключенными облигатными патогенами показало, что среди спектра условно-патогенных микроорганизмов E. faecalis выявлялся в 16,1 %, почти треть (39,2 %) из которых была в виде моноинфекции. Оценка чувствительности к антибактериальным препаратам выявила полирезистентность к традиционным препаратам и высокую чувствительность к фторхинолонам (78,0 % к левофлоксацину, 71,0 % к ципрофлоксацину и моксифлоксацину), что позволяет своевременно и дифференцированно подходить к назначению адекватной антибактериальной терапии.
Похожие темы научных работ по клинической медицине , автор научной работы — Агинова В.В.
XXI РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
имеет большой потенциал в диагностике, прогнозе и последующем наблюдении за пациентами из-за низкой инвазивности и возможности быстро и без вреда для пациента проводить исследование.
Материалы и методы. Ранее нами был разработан биологический микрочип для анализа соматических мутаций в гене BRAF (V600E [c. 1799T>A], V600M, V600K, V600R, V600D, V600E [c. 1799_1800delTGinsAA]) в опухолевой ткани. В ходе данной работы он был адаптирован для анализа мутаций и в цоДНК. Для преимущественной амплификации мутант-ной ДНК на фоне избытка ДНК дикого типа использовали LNA-блокирующую ПЦР. Длина ПЦР-продукта составляла 74 п. о., что позволило успешно анализировать деградированную ДНК. Полученные ампликоны служили матрицей на втором этапе ПЦР, в результате которого получали одноцепочечный флуоресцентно-меченный ПЦР-продукт, который затем гибридизовали с аллель-специфичными олиногуклеотидами, иммобилизованными на биочипе. Метод был протестирован на 30 контрольных образцах ДНК, выделенных из опухолевой ткани, и 19 образцах цоДНК. Генотип контрольных образцов был предварительно определен секвенированием по Сенгеру. ЦоДНК была выделена из 2—5 мл плазмы, полученной от пациентов до хирургического вмешательства.
Результаты. Генотипы всех контрольных образцов были определены корректно. Также мы протестировали 19 образцов цоДНК у пациентов с метастатической меланомой с известным статусом BRAF: 12 опухолей были мутированы и 7 были WT. Мутации были обнаружены в 10/12 образцах цоДНК у пациентов, имеющих мутацию BRAF в опухоли, и ни в одном из 7 образцов цоДНК у BRAF WT пациентов. Метод позволяет детектировать мутацию, если ее доля в образце >0,2%. Заключение. Предложенный метод идентификации соматических мутаций в гене BRAF в цоДНК на основе технологии биочипов является эффективным и простым в применении. Работа выполнена при поддержке гранта президента Российской Федерации (# МК-2519.2017.4).
Изменение профиля экспрессии ключевых генов онкогенеза при различных стадиях колоректального рака
Цель. Поиск молекулярно-генетических факторов прогноза клинического течения колоректального рака (КРР). Материалы и методы. Методом ПЦР в реальном времени проанализирован уровень экспрессии 64 генов, ответственных за пролиферацию, апоптоз, ангиогенез, адгезию, ремо-делирование межклеточного матрикса, маркеров и факторов врожденного и приобретенного иммунитета, рецепторов эстрогенов и прогестерона, ароматазы, в 261 образце ткани толстой кишки (132 образцах ткани опухоли и 129 образцах слизистой оболочки толстой кишки без морфологических признаков опухолевого роста (МНТ), полученных от тех же пациентов). Группы сравнения сформированы в зависимости от поставленной задачи: глубина инвазии первичной опухоли (Т1, Т2, Т3, Т4), наличие регионарных (N0, N+) и отдаленных
метастазов (М0, М+), прогрессирование заболевания. Средние сроки наблюдения — 31,4 ± 15,2 мес. Результаты. При определении уровня экспрессии изучаемых генов в зависимости от глубины инвазии не выявлено каких-либо достоверных изменений в группах Т1, Т2 и Т3 как в ткани опухоли, так и в МНТ, тогда как при уровне инвазии Т4 выявлено большое количество генов, достоверно (р 0,05). Препаратом выбора для лечения VRE является линезолид. В 2014 г. появились первые линезолид-резистент-ные энтерококки (LRE), а в 2016 г. их было уже 15. Крайне низкое количество VRE позволяет продолжать использовать ванкомицин в клинике. Появление LRE требует строго ограничить назначение линезолида только инфекциями, вызванными VRE.
Заключение. Среди энтерококков не отмечено нарастания VRE и LRE, однако их общее количество за весь период наблюдения составило 67 штаммов VRE и 21 штамм LRE, хотя в целом относительное количество VRE было невелико (2—7%), что позволяет использовать ванкомицин для эмпирической терапии. Использование линезолида должно быть строго ограничено как антибиотика резерва для лечения инфекций, вызванных VRE. Ампициллин/сульбактам показал хорошую активность и отсутствие нарастания резистентности в отношении E. faecalis, поэтому может быть использован в первой линии терапии инфекций, вызванных этим возбудителем. Использование даптомицина также должно быть ограничено инфекциями, вызванными VRE. Число резистентных случаев к даптомицину составило до 5% для E. facalis и 36% для E. faecium в 2016 г.
Место инфекций, вызванных Candida spp, в онкологической клинике
Цель. Определить место грибковых инфекций, вызванных Candida spp., в структуре нозокомиальных инфекций у онкологических больных.
Материалы и методы. Были выделены 4 532 штамма (шт.) микроорганизмов из биоматериалов от онкологических больных в течение 12 месяцев (2016—2017). Место Candida spp. определено среди следующих микроорганизмов (включая мультирезистентные шт.): K. pneumoniae, E. coli, P. aeruginosa, A. baumannii, S. aureus, Enterococcus spp. Эти штаммы выделены из 993 биоматериалов, включая кровь (95 шт.), мочу (322 шт.), раневое отделяемое (304 шт.), мокроту и материал, полученный при бронхоскопии (271 шт.). Идентификацию шт. и определение чувствительности проводили на анализаторах: MS Maldi Tof, WalkAway, Vitek 2.
Результаты. K. pneumoniae была выделена в 15,3% (680/4 532), E. coli — 1,7% (81/4 532), P. aeruginosa — 8,0% (366/4 532), A. baumannii — 7,3% (331/4 532), S. aureus — 9,6% (433/4 532), Enterococcus spp. — 9,9% (452/4 532), Candida spp. — 9,0% (410/4 532), прочие — 39,2%. При инфекциях кровотока выделены: Candida spp. — в 16,8%, энтерококки — 15,6%, К. pneumoniae — 14,6%, P. aeruginosa —11,5%, А. baumannii — 9,3%, S. aureus — 9,3%. При раневых инфекциях Candida spp. выделена в 10,9%, А. baumannii — 11,5%,
К. pneumoniae — 24,0% и Enterococcus spp. — 28,2%. При мочевых инфекциях (ИМП) и инфекциях дыхательных путей (ИДП) Candida spp. выделялись в 30,7% и 29,5%, а гра-мотрицательные палочки — в 12—20%. Частота выделения Enterococcus spp., S. aureus и Candida spp. была практически одинакова (9,0—9,9%, p>0,05), и они заняли 2—4-е место после K. pneumoniae. Таксономическая структура Candida spp., выделенных из крови, была следующей: C. parapsilosis (51,1%), C. albicans (21,5%), C. guilliermondi (7,4%), C. krusei (3,5%), C. glabrata (3,2%) и C. tropicalis (2,6%). Другие виды Candida spp. встречались реже
Энтерококки характеризуются природной устойчивостью ко многим АБП (цефалоспоринам, аминогликозидам), а клиническое значение наблюдаемой in vitro чувствительности к тетрациклинам, хлорамфениколу, макролидам и рифампицину окончательно не определено. Таким образом, перечень препаратов, подлежащих включению в исследование энтерококков, весьма ограничен.
Таблица 15.
При решении вопроса о необходимости определения чувствительности Enterococcus spp. к АБП крайне важно оценить клиническую значимость этих микроорганизмов. Так, энтерококки, выделенные из нестерильных локусов организма, особенно в составе ассоциаций, чаще всего следует рассматривать как контаминирующие или колонизирующие микроорганизмы, соответственно, определять чувствительность таких штаммов к АБП нецелесообразно. Проводить определение чувствительности необходимо для штаммов Enterococcus spp., выделенных из крови и других в норме стерильных жидкостей и тканей организма, а также из мочи. При этом подходы к определению чувствительности этих микроорганизмов и наборы АБП для тестирования несколько различаются в зависимости от источника выделения штаммов (таблица 15).
Пенициллин и ампициллин
Данные антибиотики являются препаратами выбора для лечения энтерококковых инфекций. Между пенициллином и ампициллином отмечается перекрестная резистентность. Полученные результаты можно экстраполировать на ингибиторо-защищенные аминопенициллины и уреидопенициллины. Поскольку известны случаи резистентности энтерококков к пенициллинам, связанные с продукцией бета-лактамаз, резистентные штаммы следует исследовать на продукцию пенициллиназы в тесте с нитроцефином.
Аминогликозиды
Несмотря на то, что энтерококки обладают природной устойчивостью к аминогликозидам, данный класс АБП широко применяется в комбинированной терапии генерализованных энтерококковых инфекций. Целесообразность таких схем лечения объясняется выраженным синергизмом между аминогликозидами и ампициллином или ванкомицином. Однако синергизм проявляется только в том случае, если МПК аминогликозидов не превосходит 500 мкг/мл для гентамицина и 1000 мкг/мл для стрептомицина. Указанное обстоятельство требует проведения скрининга (методом серийных разведений или ДДМ) на наличие у энтерококков высокого уровня резистентности к стрептомицину и гентамицину.
Ванкомицин является препаратом выбора для лечения инфекций, вызванных штаммами, резистентными к бета-лактамам и аминогликозидам. В ряде географических регионов устойчивость энтерококков к ванкомицину является серьезной клинической проблемой. Имеются сообщения о выделении единичных штаммов ванкомицинорезистентных энтерококков и в России. Для выявления устойчивости энтерококков к ванкомицину целесообразно проводить целенаправленный скрининг.
Препарат является средством выбора для лечения инфекций штаммами, устойчивыми к ванкомицину. Линезолид также рассматривается в качестве альтернативы ванкомицину при лечении инфекций, вызываемых штаммами, устойчивыми к бета-лактамам и аминогликозидам.
В отношении ванкомицинрезистентных энтеркокков, несмотря на отсутствие убедительных данных, возможно оценивать активность тетрациклинов, хлорамфеникола, эритромицина и рифампина.
Для штаммов энтерококков, выделенных при инфекциях мочевыводящих путей, целесообразно исследовать чувствительность к следующим антибиотикам:
- пенициллину или ампициллину;
- фторхинолонам;
- тетрациклинам;
- нитрофуранам;
- фосфомицину.
Критерии интерпретации результатов определения чувствительности Enterococcus spp. (пограничные значения диаметров зон подавления роста и МПК АБП) приведены в таблице 16.
Таблица 16.
Скрининг можно проводить в агаре или бульоне.
Агар или бульон на сердечно-мозговом экстракте. Питательная среда готовится в соответствии с инструкцией производителя. После автоклавирования и охлаждения до 45 - 50 °С в среду асептически добавляют растворы антибиотиков до следующих конечных концентраций:
- гентамицин для скрининга в агаре и бульоне - 500 мг/л;
- стрептомицин: для скрининга в агаре - 2000 мг/л, для скрининга в бульоне - 1000 мг/л.
Микробную взвесь готовят путем суспендирования изолированных колоний из 24-часовой культуры, выращенной на неселективных средах до концентрации 0,5 по Мак-Фарланду. Для скрининга на агаре на поверхность среды наносят 10,0 мкл суспензии. Для скрининга в бульоне в среду вносят инокулюм до конечной концентрации 5 х 10 5 КОЕ/мл. Инкубацию проводят при температуре 35 °С, для гентамицина - в течение полных 24 ч, для стрептомицина - до 48 ч.
Исследуемый штамм рассматривается как резистентный при следующих условиях:
- при скрининге на агаре - рост более 1 колонии;
- при скрининге в бульоне - любой видимый рост.
- E.faecalis ATCC 29212 - чувствительный.
- E.faecalis ATCC 51299 - резистентный.
Скрининг осуществляется на агаре.
Агар на сердечно-мозговом экстракте. Питательная среда готовится в соответствии с инструкцией производителя. После автоклавирования и охлаждения до 45 - 50 °С в среду асептически добавляют раствор ванкомицина до конечной концентрации 6,0 мг/л.
Микробную взвесь готовят путем суспендирования изолированных колоний из 24-часовой культуры, выращенной на неселективных средах до концентрации 0,5 по Мак-Фарланду. Для скрининга на поверхность агара наносят 10,0 мкл суспензии. Инкубацию проводят при температуре 35 °С в течение полных 24 ч.
Исследуемый штамм рассматривается как резистентный при росте более 1 колонии на агаре с ванкомицином.
Читайте также:


