Энтеробактер как внутрибольничная инфекция
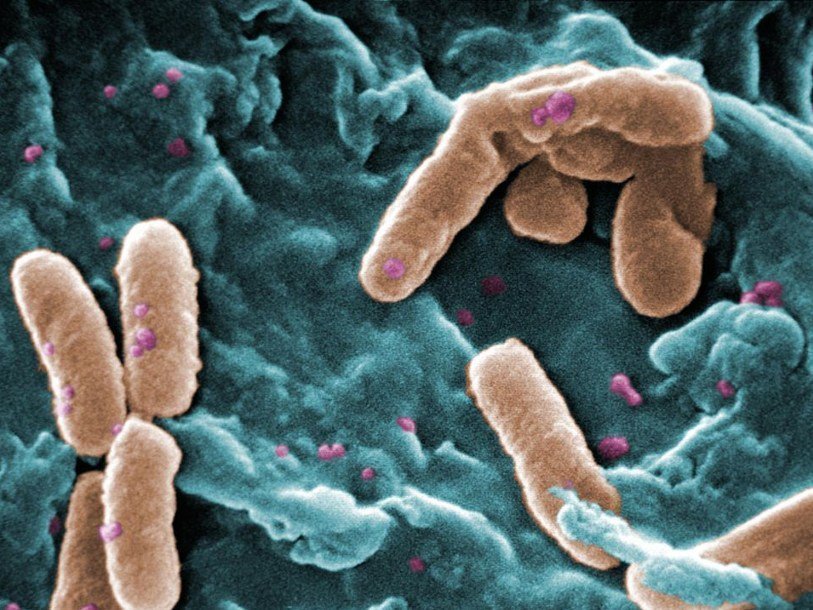
Всемирная организация здравоохранения опубликовала список из двенадцати бактерий, которые представляют наибольшую угрозу для человечества, так как у них имеются штаммы, устойчивые к антибиотикам.
Сейчас многие специалисты в области здравоохранения полагают, что резистентные к антибиотикам болезнетворные бактерии в ближайшем будущем станут более опасными для здоровья людей, чем онкологические заболевания. Если антибиотики потеряют эффективность, то смертельно опасными станут любые хирургические вмешательства, включая кесарево сечение или трансплантацию органов. Куда большую опасность, чем теперь будет представлять и химиотерапия, так как она угнетает иммунную систему пациента, и только антибиотики в этот момент способны его защитить.
Ежегодно в мире около 700 тысяч человек умирает от инфекций, вызванных бактериями, которые устойчивы к антибиотикам. По расчетам, к 2050 году число умерших возрастет до 10 миллионов в год.
Список особо опасных бактерий, устойчивых к антибиотикам
Критический уровень приоритетности
Данный вид бактерий все больше распространяется как внутрибольничная инфекция, поражая пациентов с ослабленной иммунной системой. Входит в группу ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp.) – патогенов, устойчивых к антибиотикам широкого спектра действия, ответственных за большинство внутрибольничных инфекций. Заражает также пациентов, получивших травматические повреждения кожи, например, при взрывах, проникая с загрязнением в рану. Часто инфекция отмечалась у американских военнослужащих, получивших ранения в Ираке и Афганистане. С перевозкой их по госпиталям распространялась и бактерия. Может долго сохраняться на искусственных поверхностях и противостоять высыханию. Способна распространяться через вентиляцию.
Acinetobacter baumannii. Фото: CDC/Janice Carr
2. Pseudomonas aeruginosa, синегнойная палочка, устойчива к карбапенемам
Часто обнаруживается при абсцессах и гнойных ранах, вызывает энтериты и циститы. Входит в группу ESKAPE, вызывая внутрибольничные инфекции и поражая людей с ослабленным иммунитетам. Бактерии обладают чувством кворума, то есть способны влиять на поведения друг друга, выделяя в окружающую среду особые сигнальные молекулы, что повышает их способность сопротивляться антибиотикам. О чувстве кворума подробнее можно прочитать в отдельном очерке.
Многочисленное семейство бактерий, среди которых есть как “мирные” представители человеческой кишечной микрофлоры, так и болезнетворные. Способны вырабатывать особые ферменты бета-лактамазы расширенного спектра действия (БЛРС). Эти ферменты разрушают бета-лактамное кольцо антибиотиков типа пеницилина и цефалоспорина. В результате выделяющие их бактерии устойчивы к действию целого ряда бета-лактамных антибиотиков, включая цефалоспорины третьего поколения.
Высокий уровень приоритетности
Ванкомицин-резистентные энтерококки впервые зафиксированы в 1980-х годах. Распространяются в больницах, входит в группу ESKAPE. Также отмечены у кур на птицефабриках.
5. Staphylococcus aureus, золотистый стафилококк, устойчив к метициллину, умеренно чувствителен или устойчив к ванкомицину
Вызывает широкий спектр заболеваний, от легких кожных инфекций до пневмонии, менингита, остеомиелита и эндокардита. Входит в группу ESKAPE. Исследование показало, что пациенты, заразившиеся золотистым стафилококком, вынуждены проводить в стационаре в среднем втрое больше времени (14,3 дня против 4,5 дней), причем риск смертельного исхода в этом случае впятеро выше (11,2 % против 2,3 %), чем у пациентов без этой инфекции. Вырабатывает пециниллазу – фермент, расщепляющий молекулы пенициллина. Для борьбы с золотистым стафилококком применялся модифицированный пенициллин – метициллин, молекула которого не разрушается этим ферментом, но в последние десятилетия возникли метициллин-устойчивые штаммы (MRSA).
Бактерия обитает в заднем отделе желудка человека и в большинстве случаев не вызывает никаких патологий, но в некоторых случаях влияет на стенки желудка, что приводит к возникновению гастрита и язвы желудка и двенадцатиперстной кишки.
Основным резервуаром бактерий этого рода служит домашняя птица, у которой заражение проходит, как правило, бессимптомно. Люди заражаются при употреблении в пищу продуктов питания или воды, загрязненных бактериями, или при уходе за птицами. Вид Campylobacter jejuni сейчас признан одной из главных причин пищевых инфекций в развитых странах. Для кампилобактериоза характерны воспаление, кровавый понос, судороги, лихорадка и боли. Симптомы обычно длятся от пяти до семи дней. Бактерия чувствительна к соляной кислоте в желудке человека, что несколько снижает вероятность инфекции, но означает повышенную опасность для больных с гастритом или язвой, принимающих препараты, которые снижают кислотность в желудке. В некоторых случаях бактерия может быть основной причиной синдрома Гийена-Барре.
8. Salmonellae, устойчивы к фторхинолонам
Род бактерий, ответственных за ряд тяжелых пищевых инфекций (сальмонеллезов). Поступают в организм с пищей, заселяя тонкий кишечник. Salmonella enterica серотип typhi вызывает брюшной тиф. В 2015 году был обнаружен устойчивый к антибиотикам штамм этой бактерии H58, который, по данным ученых, возник в Южной Азии и за последние 30 лет получил широкое распространение. Ныне он встречается в Юго-Восточной и Западной Азии, Восточной и Южной Африке и на островах Фиджи. Бактерия устойчива даже к новым антибиотикам, таким как ипрофлоксацин и азитромицин. Исследователи отмечают, что штамм H58 вытесняет другие штаммы брюшного тифа. В 2014 году в мире было зафиксировано приблизительно 22 миллиона случаев заболевания брюшным тифом и около 222 000 больных умерло. Брюшной тиф преимущественно распространен в Индии, странах Юго-Восточной Азии и Африки. Без лечения болезнь в 25 % случаев заканчивается смертью. При использовании антибиотиков смертность составляет 1 – 4 %. Всемирная организация здравоохранения рекомендует два типа вакцин против брюшного тифа, однако сейчас более распространено лечение при помощи антибиотиков.

Бактерии Salmonella Typhimurium (отмечены красным). Фото: Rocky Mountain Laboratories, NIAID, NIH
9. Neisseria gonorrhoeae, гонококк, устойчив к цефалоспоринам и фторхинолонам
Средний уровень приоритетности
10. Streptococcus pneumoniae, пневмококк, известен также как диплококк Вейксельбаума и диплококк Френкеля, не чувствителен к пенициллину
Один из основных возбудителей менингита, среднего отита, синусита, внебольничной пневмонии у детей и взрослых, также может вызвать эндокардит, септический артрит, первичный перитонит, флегмоны и другие инфекционные заболевания. Устойчивый к пенициллину штамм особенно распространен в Азии, Северной и Южной Америке. ВОЗ рекомендует использовать вакцинацию против пневмококковой инфекции.
11. Haemophilus influenzae, гемофильная палочка, палочка Пфайффера, устойчива к ампициллину
Латинское название объясняется тем, что до 1930-х годов бактерию ошибочно считали ответственной за заболевание гриппом (инфлюэнцей). Возбудитель гемофильной инфекции у детей, а также у взрослых с ослабленным иммунитетом. Болезнь проявляется в нескольких формах: гнойный менингит, острая пневмония, септицемия, воспаление подкожной клетчатки (целлюлит), эпиглоттит (воспаление надгортанника), гнойный артрит. Также возможны другие варианты: перикардит, синуситы, отит, заболевания дыхательных путей. Распространяется от человека к человеку воздушно-капельным путем. Во многих странах, в том числе и в России, предусмотрена обязательная вакцинация от гемофильной инфекции.
12. Shigella spp., устойчивы к фторхинолонам
Род бактерий, вызывающих шигеллезы (бактериальную дизентерию). Распространяются в основном через пищу и воду. При инфекции повышается температура, возникают озноб, жара, головная боль, падает артериальное давление. Боли в животе сначала постоянны и распространены по всей его площади, а затем приобретают схваткообразный характер и локализуются в нижней части живота.

Несмотря на поиск и внедрение новых методов борьбы с госпитальными микробами, проблема внутрибольничных инфекций остается одной из самых острых в современных условиях, приобретая все большую медицинскую и социальную значимость [1]. Актуальность проблемы внутрибольничных инфекций обусловлена появлением так называемых госпитальных (как правило, полирезистентных к антибиотикам и химиопрепаратам) штаммов стафилококков, сальмонелл, синегнойной палочки и других возбудителей. Они легко распространяются среди детей и ослабленных, особенно пожилых, больных со сниженной иммунологической реактивностью, которые представляют собой так называемую группу риска [7, 8, 9].
Заболеваемость госпитальными инфекциями колеблется от 5 до 20 % от общего числа пациентов, госпитализированных в лечебные учреждения [5]. По результатам ряда исследований, уровень смертности в группе госпитализированных и приобретших внутрибольничные инфекции пациентов в 8–10 раз превышает таковой среди госпитализированных больных без внутрибольничных инфекций [1, 5]. Возбудители госпитальных инфекций отличаются высоким персистентным потенциалом и быстро развивающейся устойчивостью к дезинфектантам и антибиотикам, что позволяет патогенной микрофлоре длительное время находиться в окружающей среде и противостоять защитным силам макроорганизма.
Основными возбудителями бактериальных инфекций являются стафилококки, пневмококки, грамотрицательные энтеробактерии, псевдомонады и представители строгих анаэробов. Главенствующую роль играют стафилококки (до 60 % всех случаев внутрибольничных инфекций), грамотрицательные бактерии, респираторные вирусы и грибы рода Candida. Штаммы бактерий, выделенные от пациентов с нозокомиальными инфекциями, как правило, более вирулентны и обладают множественной химиорезистентностью [9, 11].
В связи с этим целью данного исследования было выявление основных особенностей внутрибольничных штаммов Staphylococcus aureus нозокомиальных инфекций, включая персистентный потенциал, антибиотикорезистентность и чувствительность госпитальных штаммов к дезинфектантам.
Материалы и методы исследования
Бактериологическое исследование микробной обсемененности объектов внешней среды было проведено согласно методическим рекомендациям по санитарно-эпидемиологическому режиму [4]. Отбор проб с поверхностей различных объектов осуществляли методом смывов. Идентификацию штаммов производили с учетом их морфологических и культуральных признаков. В качестве факторов персистенции изучены антилизоцимная, антикомплементарная, каталазная активности [5]. Антибиотикочувствительность исследовали диско-диффузионным методом. Чувствительность выделенных штаммов к 0,01 % раствору анолита исследовали путем добавления в соответствующем разведении к жидкой бактериальной культуре. Статистическую обработку проводили стандартными методами.
Результаты исследования и их обсуждение
При исследовании смывов в лечебном учреждении в 35 % случаев были выделены штаммы Staphylococcus аureus, в 17 % проб были выделены штаммы Klebsiella pneumoniae, в 10 % – Proteus vulgaris и Proteus mirabilis, в 2–5 % – Enterobacter, Acinetobacter. Так как наиболее часто встречаемыми штаммами являлись штаммы Staphylococcus aureus, были исследованы характеристики золотистого стафилококка.
В качестве факторов персистенции исследовали антилизоцимную (АЛА), антиинтерфероновую (АИА), антикомплементарную (АКА) активности как возможные пути противостояния кислороднезависимому механизму фагоцитоза и активность антиоксидантного бактериального фермента – каталазы. Антилизоцимной активностью обладало 67 % (20 культур) из 30 изученных штаммов. АИА обладало 44 % (13 культур), АКА обладали 34 % (10 культур) изученных нами штаммов S.aureus.
Известно, что первичными бактерицидными факторами, выделяемыми фагоцитами, являются перекись водорода и продукты ее свободнорадикального разложения, такие как гипохлорид и гидроксильный радикал [5]. Стафилококки приспосабливаются выживать в среде с повышенной концентрацией перекиси водорода путем индукции генов раннего ответа на окислительное повреждение [5]. Белковыми продуктами этих генов являются, среди прочих, фермент каталаза, разлагающий перекись водорода до нейтральных продуктов – воды и молекулярного кислорода и фермент супероксиддисмутаза, разлагающий супероксид анион радикал до молекулярного кислорода. Каталазная активность была выявлена у 80 % штаммов, при количественной оценке каталазной активности бактерий обнаружено, что большая часть штаммов (55 %) обладала высокой активностью фермента (4,0–5,1 ед./20 млн).
35–42 % штаммов S. aureus обладали множественной резистентностью, проявляя при этом чувствительность к препаратам цефалоспоринов (цефтриаксон, цефотаксим, цефуроксим). Для исследования чувствительности к применяемым в лечебных учреждениях дезинфектантам была проведена серия опытов по определению чувствительности S. aureus к раствору анолита. Обнаружено, что выделенные штаммы проявили устойчивость более чем в 60 % случаев к 0,01 % раствору анолита.
Таким образом, при изучении основных особенностей внутрибольничных инфекций, включая персистентный потенциал, антибиотикорезистентность и чувствительность госпитальных штаммов к дезинфектантам можно сделать следующие выводы:
1. При дальнейшем подборе дезинфектантов в стационарах необходимо учесть, что выделенные штаммы проявили устойчивость к 0,01 % раствору анолита, применяемого в современных медицинских учреждениях для дезинфекции. Возможно, данный дезинфицирующий раствор необходимо применять в более высокой концентрации или заменить его другим раствором.
2. Высокий персистентный потенциал выделенных штаммов стафилококков является фактором риска для пациентов, приводя к развитию затяжных гнойно-воспалительных заболеваний. Поэтому изучение патогенетически значимых свойств микроорганизмов, направленных на инактивацию эффекторов противоинфекционого иммунитета и тем самым нарушающих процесс элиминации патогена из очага воспаления [10], может стать альтернативным подходом к прогнозированию длительности течения гнойно-воспалительных заболеваний и дает возможность своевременного подключения иммунокорригирующих препаратов.
Рецензенты:
Внутрибольничные инфекции в ожоговом стационаре

Важным фактором, определяющим эпидемический процесс внутрибольничных инфекций, является концентрация в стационаре пациентов с инфекционными, в том числе гнойными, процессами различной локализации. Глобальная тенденция заболеваемости внутрибольничными инфекциями в ожоговых стационарах имеет направленность к снижению и характеризуется нерегулярными колебаниями. Подробнее о внутрибольничных инфекциях для журнала "Дело Жизни" рассказала заведующая эпидемиологическим отделом РКБ, врач высшей категории Глушакова Ирина Александровна.
Глобальная тенденция заболеваемости внутрибольничными инфекциями в ожоговых стационарах имеет направленность к снижению и характеризуется нерегулярными колебаниями. Такого рода тенденция обусловлена снижением агрессивности медицинских технологий, повышением степени антиинфекционной защиты лечебно-диагностического процесса и адекватным эпидемиологическим надзором.
Эпидемический процесс внутрибольничных гнойно-септических инфекций развивается в условиях искусственно созданной специфической экологической системы хирургического стационара. Действующие в ней как биотические, так и абиотические факторы уникальны, а протекающие межпопуляционные процессы существенно отличаются от таковых в природе. О том, как построена работа по предупреждению развития инфекции в ожоговом отделении, мы поговорили с заведующей эпидемиологическим отделом РКБ врачом высшей категории Глушаковой Ириной Александровной.
— Ирина Александровна, расскажите, пожалуйста, как влияют внутрибольничные инфекции на лечение больных.
— Внутрибольничные инфекции (ВБИ) – инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебном учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность ВБИ в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). ВБИ представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают продолжительность лечения в 1,5 раза, а количество летальных исходов в 5 раз.
Пациенты с ВБИ находятся в стационаре в 2-3 раза дольше, чем аналогичные пациенты без признаков инфекции. В среднем на 10 дней задерживается их выписка, в 3-4 раза возрастает стоимость лечения, и в 5-7 раз – риск летального исхода.
Экономический ущерб, причиняемый данными инфекциями, значителен. Только в Российской Федерации, по самым скромным подсчетам, эта цифра может достигать 10-15 млрд рублей в год (для сравнения – ежегодный экономический ущерб в Европейском союзе составляет 7 млрд евро, а в США – 6,5 млрд долларов).
ВБИ существенно снижают качество жизни пациента, а также приводят к потере репутации учреждения здравоохранения. Основными возбудителями ВБИ выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии ВБИ велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и так далее.
Также ВБИ могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
— Как обеспечивается профилактика инфекций в ожоговом стационаре? И в чем особенности работы медиков с ожоговыми больными?
— Частота инфекционных осложнений ожоговых ран и ожоговой болезни столь велика, что от решения вопросов борьбы с инфекцией во многом будет зависеть прогресс в лечении в целом. Инфекция является одним из ведущих звеньев патогенеза ожоговой болезни, обуславливающим ее клинические проявления, течение и исход. Ведущее место занимает инфекция в структуре летальности тяжело обожженных.
Ожоговая травма нарушает целостность кожи и слизистых оболочек, что приводит к массивной микробной инвазии, а отделяемое ожоговой раны является идеальной средой для развития микроорганизмов. Нарушения микроциркуляции приводят к затруднению поступления в рану фагоцитов, антител, кислорода, снижаются хемотаксис и фагоцитарная активность макрофагов и нейтрофилов раны, уменьшается потребление нейтрофильными лейкоцитами кислорода, в организме снижается выработка гуморальных факторов неспецифической резистентности. Значительно страдает иммунная система.
Микрофлора ожоговых ран представлена, как правило, ассоциациями условно патогенных грамположительных и грамотрицательных микроорганизмов. При этом наиболее часто выделяется ассоциация метициллинрезистентного стафилококка и беталактамо-продуцирующих штаммов синегнойной палочки с энтерококками, протеем, кишечной палочкой, грибами и ацинетобактериями. Проведенные нами исследования титров антител к микроорганизмам, выделяемым из ожоговых ран, с целью выявления основного возбудителя инфекции показали главенствующую роль в ее этиологии штаммов S.aureus и P.aeruginosa.
Серьезной проблемой является рост резистентности возбудителей ожоговой инфекции к антибактериальным препаратам. Высокая антибиотикоустойчивость возбудителей ожоговой инфекции создает значительные трудности в подборе средств местной и общей антибактериальной терапии, микробная инвазия госпитальными штаммами микроорганизмов приводит к развитию тяжелых инфекционных осложнений.
Решение проблемы профилактики и лечения инфекции и инфекционных осложнений у обожженных может быть только комплексным. Необходима разработка системы мер, направленных на раннее и адекватное оказание помощи пострадавшим от ожогов на местах, профилактику госпитальной инфекции в ожоговых стационарах.
Контроль инфекции в ожоговом стационаре требует обязательного системного подхода, мероприятия которого можно подразделить на:
организационные;
эпидемиологические;
диагностические;
лечебно-профилактические.
Организационные мероприятия проводятся администрацией лечебно-профилактического учреждения, на базе которого располагается ожоговый стационар, и включают в себя:
рациональное планирование строительства ожоговых центров;
создание центрального стерилизационного отделения;
организацию бактериологической службы;
обеспечение возможности проведения иммунологических, цитологических и гистологических исследований.
Создание в стационаре комиссии по профилактике госпитальной инфекции, состоящей из компетентных лиц, представляющих все госпитальные службы.
Эпидемиологические мероприятия:
строгое соблюдение асептики всеми сотрудниками ожогового центра при работе в палатах, перевязочных и операционных;
регулярная уборка всех помещений ожогового центра с использованием современных дезинфицирующих средств;
ограничение доступа к зонам лечения;
ограничение посетителей;
наличие и своевременная смена спецодежды персоналом отделения;
изоляция больных с инфекцией.
В профилактике госпитальных инфекций большое значение имеет организация работы медицинского персонала. При работе с больными сотрудники должны выполнять все установленные правила гигиены, асептики и антисептики, соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием.
Большое значение в профилактике ВБИ имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники лечебно-профилактического учреждения подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов.
Предупредить возникновение и распространение ВБИ позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
— В чем суть дезинфекционных и стерилизационных мероприятий, проводимых в ожоговом отделении?
— В целях профилактики инфекций, связанных с оказанием медицинской помощи, лечебными учреждениями выполняются дезинфекционные и стерилизационные мероприятия, повышение эффективности которых предусматривает:
организацию в учреждении централизованного стерилизационного отделения отвечающего современным требованиям;
разработку стратегии и тактики обоснованного выбора и применения дезинфицирующих средств в конкретной медицинской организации с учетом ее типа и структуры, целей и задач дезинфекции, эпидемиологической ситуации и особенностей циркулирующих возбудителей ВБИ;
создание стратегических запасов дезинфицирующих средств из разных химических групп с учетом необходимости ротации и целевого назначения, особенностей циркулирующих возбудителей ВБИ;
разработку мероприятий, направленных на предупреждение формирования госпитальных штаммов микроорганизмов, устойчивых к дезинфицирующим средствам;
систематическое проведение профилактической дезинсекции и дератизации эффективными и малотоксичными средствами, рекомендованными для использования в организациях здравоохранения.
Интенсивное развитие высокотехнологичных инвазивных методов диагностики и лечения в сочетании с широким распространением микроорганизмов с множественной лекарственной устойчивостью определяет необходимость непрерывного совершенствования систем надзора и контроля.
В заключение можно сказать, что неотъемлемой составляющей системы оказания медицинских услуг населению является эпидемиологическая деятельность лечебного учреждения, направленная на создание безопасных условий и предотвращение инфицирования пациентов и медицинского персонала в процессе оказания медицинской помощи.
Журнал "Дело Жизни"
Ольга Пелепец
Глушакова Ирина Александровна
Заведующая эпидемиологическим отделом РКБ, врач высшей категории
(синоним нозокомиальные инфекции)
инфекционные болезни, связанные с пребыванием, лечением, обследованием и обращением за медицинской помощью в лечебно-профилактическое учреждение. Присоединяясь к основному заболеванию, В. и. ухудшает течение и прогноз болезни.
Проблемы В. и. приобрели большую актуальность в связи с появлением так называемых госпитальных (как правило, полирезистентных к антибиотикам и химиопрепаратам) штаммов стафилококков, сальмонелл, синегнойной палочки и других возбудителей. Они легко распространяются среди детей и ослабленных, особенно пожилых, больных со сниженной иммунологической реактивностью, которые представляют собой так называемую группу риска.
Внутрибольничные инфекции могут возникнуть как во время пребывания в лечебно-профилактическом учреждении, так и после выписки из него. Они разнообразны по своим клиническим проявлениям и могут протекать в виде локализованных форм, генерализованных септических процессов, а также бессимптомного носительства возбудителей. К ним относятся и заболевания медработников, возникшие в связи с лечением и уходом за инфекционными больными. Наиболее распространены следующие нозологические формы В. и., подлежащих регистрации: генерализованные формы (сепсис, менингит, остеомиелит), болезни кожи и подкожной клетчатки (пиодермия, абсцесс, флегмона и др.), омфалит, конъюнктивит, отит, мастит, эндометрит, уретрит, цистит, пиелонефрит, пневмония, острые кишечные инфекции, вызванные установленным и неустановленным возбудителем (гастроэнтерит, энтерит, колит и др.), раневая послеоперационная инфекция, постинъекционные осложнения, другие инфекционные болезни (краснуха, корь, вирусные гепатиты и др.). Пневмония регистрируется в родовспомогательных учреждениях, отделениях новорожденных (недоношенных) детских стационаров и реанимационных больниц.
Этиологическая структура В. и. меняется. На смену стрептококкам пришли стафилококки (до 60%) и большая группа грамотрицательных микроорганизмов (кишечная палочка, синегнойная палочка, клебсиелла и др.). В отделениях интенсивной терапии наиболее частыми возбудителями В. и. являются стафилококки, синегнойная палочка, кишечная палочка, энтерококк. В этиологии септицемии главную роль играют грамотрицательные бактерии. При внутрибольничных пневмониях все большую этиологическую роль приобретают легионеллы, а также Acinetobacter, Achromatobacter и др. — последние преимущественно у лиц с иммунодефицитными состояниями. Большое значение в этиологии В. и. имеют также протей, клебсиеллы, энтеробактер, энтерококки, серрации, клостридии, кандида и др., а также вирусы — гриппа, аденовирусы, ротавирусы, энтеровирусы, возбудители гепатитов и др. Среди В. и. наибольшее значение имеют гнойно-воспалительные заболевания.
Источниками В. и. являются больные, особенно страдающие хронической и стертой формами инфекций, а также бессимптомные носители возбудителей из числа лиц, находящихся на лечении в лечебно-профилактических учреждениях, посетителей этих учреждений, медперсонала, а также матерей в акушерских стационарах и отделениях для детей младшего возраста.
Основными предпосылками для возникновениия В. и. являются несоблюдение санитарно-гигиенического и противоэпидемического режима в лечебно-профилактическом учреждении. Внутрибольничному распространению инфекции способствуют наличие невыявленных источников инфекции среди персонала и пациентов, нарушение персоналом правил асептики, антисептики, личной гигиены, текущей и заключительной дезинфекции, режима уборки, нарушение режима стерилизации и дезинфекции медицинских инструментов, аппаратов, приборов.
В условиях инфекционных больниц внутрибольничное заражение возможно в приемном отделении при одновременном приеме больных воздушно-капельными и кишечными инфекциями. В детских лечебно-профилактических учреждениях В. и. встречаются чаще, чем в больницах для взрослых. Наибольшее значение имеют вирусные болезни с воздушно-капельным механизмом передачи и кишечные инфекции. В родильных домах возможно появление острых респираторных, кишечных инфекций, стафилококковых заболеваний. Наиболее опасными источниками возбудителей инфекции в отделениях для новорожденных являются носители патогенных кишечных бактерий и стафилококков среди рожениц и персонала. К В. и. относят и гнойно-воспалительные заболевания, связанные с инъекциями, оперативными вмешательствами, диагностическими и другими медицинскими манипуляциями, которые были проведены с нарушением правил асептики и антисептики.
В основе профилактики В. и. лежит пунктуальное выполнение комплекса диагностических, санитарно-профилактических и противоэпидемических мероприятий, регламентированных для лечебно-профилактических учреждений. В частности, предусматриваются наличие фильтра и отдельный прием лихорадящих детей в детских поликлиниках (и взрослых во время эпидемии гриппа); обследование персонала на носительство возбудителей и, в случае выявления такового, отстранения от работы до выздоровления; санирование больных стертыми формами инфекций и бессимптомных носителей возбудителей: проведение текущей и заключительной дезинфекции (в т.ч. в кабинете инфекционных заболеваний, операционном блоке, перевязочных, центральном стерилизационном отделении, физиотерапевтическом отделении и др.) с использованием дезинфицирующих средств, бактерицидных ламп и др.; соблюдение методов асептики и антисептики, максимальное использование одноразовых инструментов и систем; тщательная обработка рук персонала, правильная организация операций и перевязок. Больной с неясной инфекционной болезнью или возможным сочетанием инфекций должен находиться в боксе или в отдельной палате при приемном отделении до уточнения диагноза. За лицами, общавшимися с больными, страдающими В. и., устанавливают клиническое наблюдение, проводят лабораторные исследования, необходимые при предполагаемом виде инфекции. Госпитализация больных в отделение, где выявлена В. и., полностью прекращается на срок максимального инкубационного периода. Прием новых больных разрешается после заключительной дезинфекции.
Самыми эффективными лечебными препаратами при внутрибольничных гнойно-воспалительных заболеваниях являются Цефалоспорины. Возможно сочетание их с аминогликозидами (Аминогликозиды). Если возбудитель В. и. не выделен, но имеется подозрение на наличие грамотрицательной флоры, эмпирически можно применить аминогликозиды (гентамицин, тобрамицин, амикацин). В СССР для лечения и профилактики В. и. используют также иммунные стафилококковые препараты: анатоксин, вакцину, антифагин, иммунную плазму, иммуноглобулин. При вирусных инфекциях показан интерферон.
Библиогр.: Беляков В.Д. Госпитальная инфекция, Л., 1976; Богданов И.Л. Внутрибольничные инфекции и их профилактика, Киев, 1963, библиогр.; Громашевский Л.В. Общая эпидемиология, М., 1965
Читайте также:



