Для лечения инфицированных ран применяют местно
Расширение ассортимента лекарственных препаратов для локальной консервативной фармакотерапии раневого процесса позволяет проводить дифференцированное лечение ран и ожогов, которое осуществляется путем последовательного применения различных лекарственных средств с разнообразным механизмом их действия (Ляпунов Н.А. и соавт., 1995), влияющих на определенные фазы раневого процесса. Активный поиск эффективных лекарственных веществ в разных лекарственных формах является актуальным и в настоящее время.
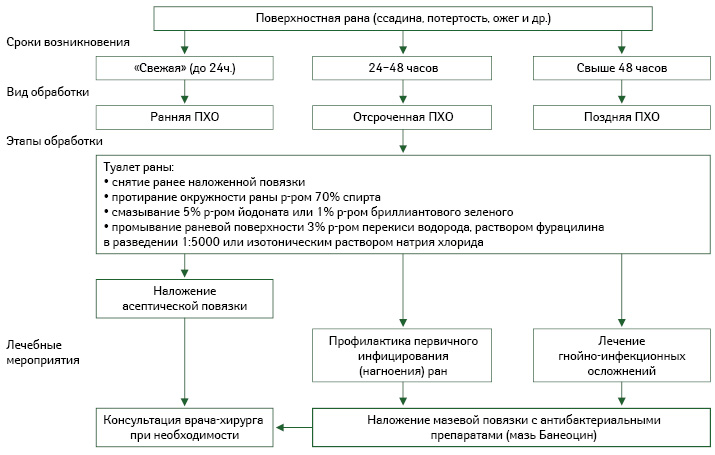
Нанесение лекарственных препаратов для наружного применения на рану определяют как местное медикаментозное лечение. Для успешной терапии ран необходимо комплексное воздействие на раневой процесс (Кузнецов Н.А., 2006) с учетом не только степени тяжести его течения, но и уровня его распространения в глубину, количества вовлеченных в воспалительный процесс анатомических структур и т.д. (таблица; алгоритм обработки поверхностных ран).
| Таблица | Классификация хирургической инфекции мягких тканей (Ahrenholz D., 1991; Блатун Л.А., 2007) |
| Уровень | Поражение | Заболевания |
| I | Собственно кожи | Фурункул |
| Фурункулез | ||
| Рожа | ||
| Эризипелоид | ||
| II | Подкожной клетчатки | Карбункул |
| Гидраденит | ||
| Абсцесс | ||
| Целлюлит | ||
| III | Поверхностной фасции | Некротизирующий фасциит |
| IV | Мышц и глубоких фасциальных структур | Пиомиозит |
| Инфекции мышечных футляров | ||
| Клостридиальный мионекроз | ||
| Неклостридиальный мионекроз |
Терапия включает локальное назначение широкого спектра лекарственных веществ в форме мазей, гелей, порошков, масел и раневых покрытий (Кузин М.И., 1999; Блатун Л.А., 2007).
Поверхностные инфицированные раны лечат дренирующими сорбентами и протеолитическими ферментами. При лечении гнойных глубоких ран в первой фазе проводят терапию мазями под повязками (Блатун Л.А., 2009), причем успех профилактики и лечения ран в данной фазе определяется своевременным назначением различных лекарственных средств с антимикробным действием. А вот во второй фазе — регенерации, образования и созревания грануляционной ткани применяют мази, раневые покрытия, гелевые повязки и масла с активными компонентами, уже способствующими стимуляции этих процессов (алгоритм обработки поверхностных ран).
Неомицин — представитель антибиотиков-аминогликозидов, оказывает бактерицидное действие путем подавления синтеза бактериального белка и угнетения генетического кода бактерий. Для него характерен широкий спектр противомикробного действия (рис. 1).
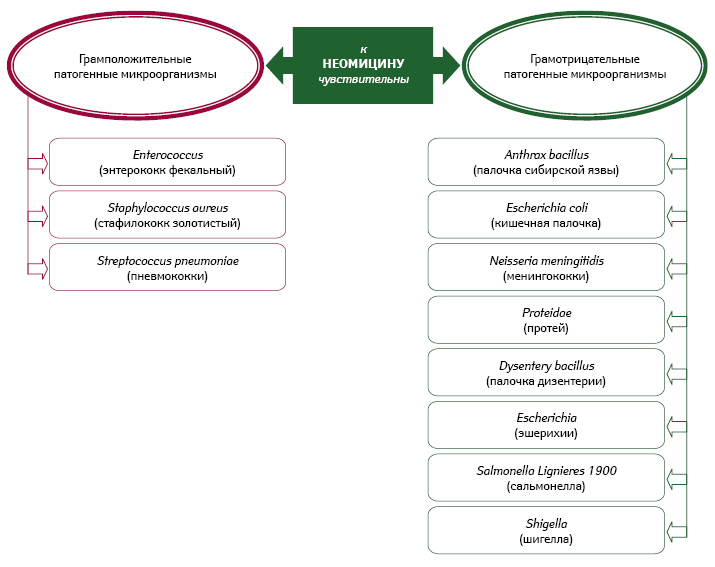
Очевидно, что неомицин проявляет широкий спектр антибактериальной активности, оказывая бактерицидное действие на чувствительную к нему микрофлору (Даценко Б.М. и соавт., 1989). Характерно медленное формирование устойчивости микроорганизмов к неомицину. Наружное применение неомицина в форме порошка или мази не позволяет развиться его токсическим проявлениям, которые могут возникать при парентеральном применении (ото-, нефротоксичность, блокада нейромышечной передачи). Неомицин не применяют перорально ввиду возможности его кумулирования в плазме крови, отмечающееся при нарушенной функции почек (Коваленко В.Н., 2012).
Бацитрацин — полипептидный антибиотик. Он угнетает синтез клеточной стенки путем подавления кругооборота липидных переносчиков субъединиц пептидогликанов (блокада синтеза пептидогликанов), что также реализуется в виде бактерицидного действия. Спектр антибактериального действия бацитрацина представлен на рис. 2.
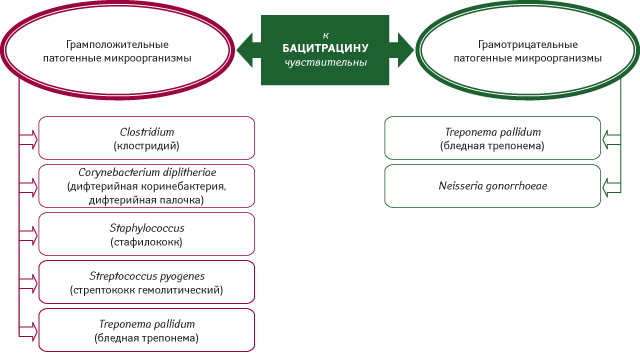
К бацитрацину устойчивость развивается крайне редко, механизмы ее развития не установлены. Он хорошо переносится тканями организма человека и не инактивируется кровью, тканевыми компонентами, биологическими продуктами (Паршина В.Л., 2007). Особенно актуально то, что при локальном его применении снижается риск проявлений повышенной чувствительности к составляющим Банеоцина .
Таким образом, фармацевтическая композиция неомицина и бацитрацина ( Банеоцин ) приводит к синергическому фармакологическому взаимодействию двух лекарственных средств. Такое объединенное действие в итоге превышает сумму действий этих действующих веществ (усиление действия друг друга) по сравнению с их раздельным использованием.
Эта комбинация антибактериальных средств выпускается в виде двух лекарственных форм — порошка и мази.
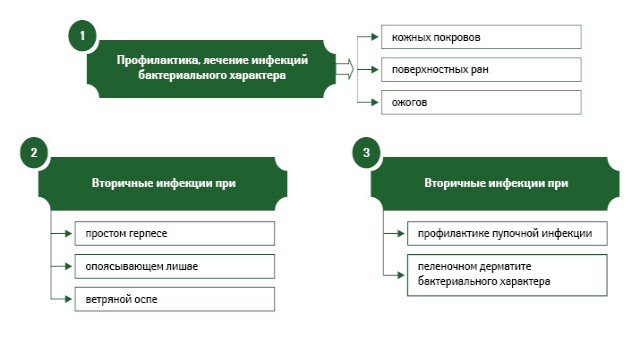
Показания к применению Банеоцина в форме мази и порошка представлены на рис. 3 и 4.

В качестве вспомогательного вещества в состав порошка Банеоцин входит крахмал кукурузный, содержащий не более 2% магния оксида (основа порошковая стерилизованная) (Коваленко В.Н., 2012). Ранее уже были отмечены высокие абсорбционные свойства порошковой основы, которые как раз и проявляются за счет легковесных аморфных порошков — магния оксида и крахмала кукурузного.
Порошок Банеоцин в короткие сроки купирует проявления воспалительного процесса, упреждает возможное возникновение нагноения (Зорин А.Н. и соавт., 2005). При нанесении на кожу порошок Банеоцин обусловливает активное поглощение раневого экссудата, осушение раны и на протяжении нескольких часов обеспечивает дренаж из раны с одновременным образованием защитного антибактериального слоя (Буслаев О.А. и соавт., 2006).
Также порошок Банеоцин обладает замечательными дополнительными действиями: охлаждающим и успокаивающим. Это особенно важно для лечения ран у пациентов детского возраста ввиду их высокой чувствительности к боли и страха перед спиртосодержащими средствами, традиционно используемыми для обработки ран.
Эффективность Банеоцина подтверждена комплексным изучением клинико-лабораторных показателей в лечении пациентов с гнойным поражением кожи и мягких тканей (бактериологическая эффективность составляла 92,5%, а клиническая — 95%) (Блатун Л.А., 2009). Это обусловлено длительным осмотическим действием порошка Банеоцин , что особенно эффективно в лечении гнойных ран в первой фазе раневого процесса, когда происходит активное впитывание раневого отделяемого. Ценным качеством Банеоцина является быстрое разрешение кожных проявлений инфекционных поражений кожи, таких как атопический дерматит, импетиго, фолликулит и т.д., которое отмечается в течение 1 или 2 сут от начала лечения (Шерстобитов А.С., 2008). Банеоцин успешно применяется в лечении пациентов с трофическими язвами и у больных с аллергологическим анамнезом, когда они не могут применять традиционные локальные препараты (Буслаев и соавт., 2006; Блатун Л.А., 2007; 2009). Кроме того, обработка ран, возникших вследствие лазерной деструкции (Соколовский Е.В. и соавт., 2004), порошком Банеоцин с дальнейшим переходом на мазь Банеоцин оказывается более щадящим методом по сравнению с традиционной обработкой (Хорук С.А., 2008).
В свою очередь, мазь Банеоцин представляет собой комбинированный мягкий лекарственный препарат с антибиотиками, введенными в дифильную абсорбционную основу, состоящую из гидрофобного компонента — вазелина, и вещества с дифильными свойствами — ланолина, обладающего эмульгирующей способностью (Хишова О.М., 2009).
Вазелин можно отнести к веществам, которые давно и успешно используют в качестве средства для смягчения кожных покровов, защиты кожи после некоторых косметических процедур и т.д. Это связано с тем, что вазелин способен удерживать влагу в клетках кожи, что, в свою очередь, позволяет смягчить загрубевшие участки кожи, устранить раздражение, защитить слизистую оболочку и саму кожу от агрессивного и вредного воздействия лекарственных препаратов или окружающей среды. При этом вазелин и введенные в него вещества, не проникают в глубокие слои кожи и, тем более, под кожу. Последнее особенно актуально, если рассматривать его в аспекте безопасности применения Банеоцина . Как уже было отмечено выше, использование как неомицина, так и бацитрацина предполагает их исключительно локальное применение с целью предотвращения побочного действия на организм.
Ланолин, относящийся к натуральным вспомогательным веществам, кроме прочего обладает увлажняющими и смягчающими свойствами, позволяющими защищать кожу от неблагоприятных внешних факторов, а также связывать и удерживать в коже влагу. Именно эти позитивные качества ланолина успешно используются в медицине и косметологии с целью обеспечения уменьшения потери влаги и восстановления натуральной мягкости и эластичности кожи. В качестве одного из свойств чистого ланолина отмечают положительное местное его применение у кормящих грудью, помогающее заживлению трещин на сосках и предотвращающее их появление.
Так, учитывая вышеизложенные свойства вспомогательных веществ, входящих в состав мази Банеоцин , можно резюмировать: мазевая основа обладает умеренными абсорбционными свойствами на фоне низких показателей осмотической активности; не нарушает аэрацию кожи и не всасывается в глубокие слои; гидрофобные компоненты, покрывая кожу, препятствуют сухости кожи вследствие исключения излишней потери влаги.
С точки зрения биофармацевтических аспектов создания мягких лекарственных средств, мазевая основа сегодня является не только носителем действующих веществ, поэтому основа мази Банеоцин , отвечая медико-биологическим требованиям к мазям определенного назначения, активно участвует в терапевтическом процессе.
Банеоцин в форме мази эффективен в лечении поверхностных ран, во второй фазе раневого процесса (где может быть использован наряду с порошком) (Буслаев и соавт., 2006). Банеоцин в высоких концентрациях скапливается в гнойном очаге, оказывая бактерицидное действие, не оказывая системного эффекта. При его нанесении образуется тонкая пленка, защищающая молодой эпителий от деструктирующих факторов. Нанесение Банеоцина под повязки приводит к полной эридикации болезнетворных микроорганизмов в короткие сроки и обеспечивает профилактику повторного инфицирования поверхности раны госпитальной инфекцией (Оболенский В.Н., 2013). Уместно использовать мазь Банеоцин в третьей фазе раневого процесса для организации рубца и эпителизации, когда пленка, образуемая мазью, защищает эпителий от повреждения и способствует ускорению эпителизации. Неоспоримые достоинства фармакологического действия Банеоцина объясняют его активное назначение и на этапе стационарного комплексного лечения больных, и в поликлинических условиях.
Доказана высокая клиническая эффективность Банеоцина при распространенной форме акне средней и тяжелой степени (Кунгуров Н.В., 2009; Шабардина О.В., 2010). При локальном применении Банеоцина снижен риск возникновения гиперчувствительности к его компонентам (Ширшов О.Н., 2008). Характерна достаточно хорошая переносимость Банеоцина . Отмечается успешное использование Банеоцина в педиатрии при топическом дерматите, осложненном вторичной инфекцией (Ahrenholz D.H., 1991; Зорин А.Н. и соавт., 2005), а также при сочетании топического дерматита с пиодермией, и даже в неонатологической практике применение порошка Банеоцина позволяет сокращать сроки эпителизации пупочной ранки новорожденных. Назначение Банеоцина предупреждает развитие серьезных гнойно-септических осложнений у новорожденных, позволяет эффективно купировать клинические проявления инфицированного пеленочного дерматита и эксфолиативного дерматита Риттера (Паршина В.Л., 2007).
Таким образом, благодаря комбинации двух антибактериальных компонентов достигается широкий спектр действия препарата и синергизм в отношении широкого ряда микроорганизмов, в который не попадают лишь псевдомонады, нокардии, грибы и вирусы. При местном нанесении на кожные покровы, раневые поверхности Банеоцин переносится хорошо, не вызывая раздражения; через интактную кожу препарат не всасывается, а через поврежденные кожные покровы всасывание незначительно, что позволяет создать максимальную концентрацию препарата непосредственно в месте применения. А две лекарственные формы Банеоцина ориентированы на последовательное его применение на различных стадиях раневого процесса (Буслаев О.А. и соавт., 2006).
Особые указания при применении Банеоцина
- Нельзя допускать попадания мази и порошка Банеоцин в глаза.
- С осторожностью наносить препарат на участки кожных покровов со значительными повреждениями.
- Нельзя применять Банеоцин в наружный слуховой проход в случае, если у пациента нарушена целостность барабанной перепонки и имеется сквозной дефект.
- Кратность нанесения порошка составляет 2–4 раза в сутки.
- Мазь Банеоцин наносится 2–3 раза в сутки.
- Суточная доза не должна превышать 1 г Банеоцина .
- Курс лечения обычно составляет 7 дней.
- При назначении повторного курса максимально допустимая доза снижается в 2 раза.
- Банеоцину присуща фотосенсибилизация. Поэтому рекомендуется предотвращать доступ прямых солнечных лучей к месту нанесения препарата.
Фармацевтическая опека при применении Банеоцина
- Не применять Банеоцин у пациентов с повышенной чувствительностью к бацитрацину, неомицину и другим антибиотикам аминогликозидного ряда.
- Не допускать сочетанного применения антибиотиков аминогликозидного ряда местного и системного действия из-за возможной их кумуляции и, как следствие, — риска развития токсичности.
- С осторожностью применять при миастении и других заболеваниях нервно-мышечной системы, а также при аллергических реакциях в анамнезе.
- При обширных поражениях кожи возникает риск абсорбции бацитрацина и неомицина, что может привести к развитию токсических проявлений у пациентов с нарушенной функцией печени или почек.
- Дисфункция вестибулярной и кохлеарной систем, патология почек с нарушением их выделительной функции является противопоказанием для приема Банеоцина , особенно при возможности его всасывания в системный кровоток.
- При ожоговых поражениях кожи площадью более 20% поверхности тела больного порошок Банеоцин наносится только 1 раз в сутки.
- При развитии аллергии или суперинфекции Банеоцин следует отменить.
- Избегать инсоляции из-за возможности возникновения фотосенсибилизации и фототоксических реакций.
- При лечении в период беременности и кормления грудью фармакотерапию Банеоцином следует проводить с осторожностью.
- Применение мази Банеоцин в педиатрии проводится по показаниям, аналогичным таковым у взрослых.
- Порошок Банеоцин применяется у детей с первых дней жизни при преобладании пользы от применения Банеоцина над риском развития его побочных эффектов.
- Нет сведений о способности Банеоцина изменять скорость реакций при управлении транспортными средствами и работе с другими механизмами.
Список использованной литературы
Информация для профессиональной деятельности медицинских и фармацевтических специалистов
БАНЕОЦИН (BANEOCIN) . Код АТС : D06A X54**. Состав и форма выпуска: мазь, туба 20 г, № 1 (бацитрацин цинк — 250 МЕ/г, неомицина сульфат — 5000 МЕ/г) — р.с. № UA/3951/01/01 от 28.04.2011 г. до 28.04.2016 г.; порошок накожный, контейнер 10 г, № 1 (бацитрацин цинк — 250 МЕ/г, неомицина сульфат — 5000 МЕ/г) — р.с. № UA/3951/02/01 от 11.05.2011 г. до 11.05.2016 г.). Показания . Порошок — бактериальное инфицирование ограниченных участков кожи при герпетических инфекциях, в том числе при ветряной оспе; инфицированные варикозные язвы; экзема; бактериальный пеленочный дерматит; профилактика пупочной инфекции у новорожденных; после хирургических манипуляций: как вспомогательная терапия в послеоперационный период (в том числе лечение разрывов промежности и эпизиотомии, мастита при дренировании, посттравматических инфекций); инфекции при ожогах. Мазь — местное лечение и профилактика бактериальных инфекций кожи, вызванных чувствительными к препарату микроорганизмами: фурункулы, карбункулы (после хирургического вмешательства), абсцессы (после разреза), сикоз, в том числе глубокий, на участке подбородка, гнойный гидраденит, псевдофурункулез, паронихии; бактериальные инфекции кожи ограниченной степени, в том числе контагиозное импетиго, инфицированные варикозные язвы, вторичные инфекции при экземе, инфекции при ожогах, после косметической хирургии и пересадки кожи (также с профилактической целью и при применении повязок); как вспомогательная терапия при лечении послеоперационных инфицированных ран (например при наружном отите, вторичном инфицировании хирургических рубцов). Побочные эффекты . Обычно препарат переносится хорошо. При продолжительном лечении возможно развитие аллергических реакций (гиперемия, сухость и шелушение кожи, сыпь, зуд). Если поражения распространяются или раны не заживают, это может быть следствием аллергической реакции (очень редко — в виде контактной экземы). Для пациентов со значительным поражением кожи следует учитывать возможную абсорбцию препарата и развитие таких побочных эффектов, как нарушения вестибулярной и кохлеарной функции, слуха, нервно-мышечной проводимости. Более детальная информация изложена в инструкции по медицинскому применению.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов. Ведущим ограничением в выборе антибактериальных препаратов в настоящее время является широкое распространение полирезистентных микроорганизмов. Это значительно сужает выбор как системных, так и местных препаратов эмпирической антибактериальной терапии ран. В настоящее время в целях профилактики прогрессирования раневой инфекции находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов.
К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран, можно отнести сульфаниламид (Ранавексим), сульфатидин серебра, неомицин с бацитрацином. Местная терапия инфицированных ран должна базироваться на этиологических и анамнестических характеристиках раны, фазе раневого процесса и объеме поражения. Местное применение антибактериальных препаратов (например, сульфаниламида) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги).
Ключевые слова: раны, антибактериальная терапия, полирезистентность, местное применение антибиотиков, сульфаниламид.
Для цитирования: Левчук И.П., Костюченко М.В. Антибактериальные препараты для местной терапии ранений различной этиологии. РМЖ. Медицинское обозрение. 2018;2(II):64-68.
Antibacterial drugs for topical therapy of the wounds of various etiologies
Levchuk I.P., Kostyuchenko M.V.
Pirogov Russian National Research Medical University, Moscow
The article deals with modern problems of antibiotic therapy of the wounds of various etiologies, possibilities and limitations of the use of topical antibiotics. Currently, the main limitation in the choice of antibacterial drugs is the widespread use
of multiresistant microorganisms. This fact significantly reduces the choice of both systemic and topical drugs for empirical antibiotic therapy of wounds. At present, topical antibiotics are often used to prevent the progression of wound infection, which often allows to avoid systemic side effects. Topical antibacterial preparations most actively used for outpatient management of wounds can be attributed to a sulfanilamide (Ranavexim), sulfatides silver, neomycin with bacitracin. Topical therapy
of wounds should be based on etiological and anamnestic characteristics of the wound, phase of the wound process and the extent of the lesion. Topical use of antibacterial drugs (e. g. sulfanilamide) is possible with small lesions without an active infectious process in the wound (such as abrasions, scratches, small cuts and burns).
Key words: wounds, antibacterial therapy, multidrug resistance, topical application of antibiotics, sulfanilamide.
For citation: Levchuk I.P., Kostyuchenko M.V. Antibacterial drugs for topical therapy of the wounds of various etiologies // RMJ. Medical Review. 2018. № 2(II). P. 64–69.
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов
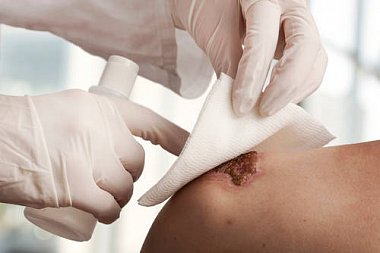
Все раны, полученные в нестерильных условиях, являются инфицированными, рост бактериальной флоры в ране провоцирует развитие воспалительного процесса, сопровождающегося повышением местной температуры, гиперемией, болью и нарушением функции части тела, на которой находится рана. Частота развития инфекционных осложнений остается весьма значительной и достигает в целом 45%. Наиболее подвержены развитию инфекционных осложнений раны, загрязненные землей, с нарушением кровоснабжения в области непосредственно самого повреждения или всей части тела, огнестрельные и минно-взрывные раны, укусы животных и человека. В зависимости от вида повреждения и условий окружающей среды в раны могут попадать различные микроорганизмы: резидентные — постоянно живущие и размножающиеся на коже (преимущественно коагулазонегативные кокки, например Staphylococcus epidermidis, S. aureus, и дифтeроиды, например Corinebacterium spp., реже — грамотрицательные бактерии), и транзиторные — в норме отсутствующие и попадающие на кожу после контакта с контаминированными объектами окружающей среды и больными людьми. В зависимости от области тела (голова, конечности, перианальная область и т. д.) спектр резидентной микрофлоры может быть различным. Транзиторная флора
также неодинакова по составу, который зависит от характера раны, этиологии, окружающей среды и может быть представлен различными инфекционно-опасными микроорганизмами (Escherichia coli, Klebsiella spp., Pseudomonas spp., Salmonella spp. и другими грамотрицательными бактериями, S. aureus, вирусами и грибами, Candida albicans, ротавирусами и др.). При повреждении кожи транзиторные микроорганизмы способны длительно колонизировать и инфицировать кожу, формируя при этом новую, гораздо более опасную резидентную (но не нормальную) флору. В большинстве случаев инфицирование обусловливается микробными ассоциациями. Так, укусы собак сопровождаются инфекционным осложнением примерно в 20% случаев, кошек — до 30–50%, человека — 70–80% [1–3].
Из-за изменения гистохимических параметров тканей в результате повреждения и разрушения защитной барьерной функции кожи даже непатогенные микроорганизмы могут стать причиной выраженных воспалительных, гнойных процессов. Для выбора оптимальной антибактериальной терапии необходимо учитывать возможный микробный спектр раны (табл.1). 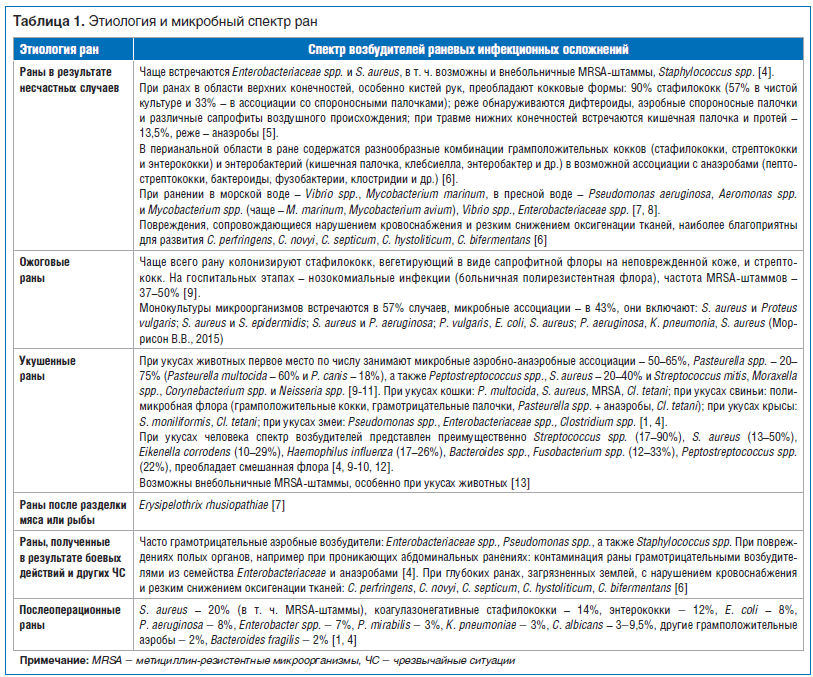
Только для зарегистрированных пользователей
Гной в воспаленном очаге представляет собой не что иное, как тканевую жидкость и огромное количество находящихся в ней лейкоцитов. Эти клетки крови реагируют на чужеродный инфекционный агент в ране и перераспределяются из сосудов в место раневой поверхности. Там они поглощают инфекцию путем фагоцитоза (захватывание чужеродной частички в лейкоцит), а затем ферменты, которые находятся в специальных органеллах (лизосомах), уничтожают агент, а лейкоцит погибает. Таким образом, в месте инфицированной раны образуется скопление мертвых лейкоцитов, которое отделяется в виде беловато-желтой, сливкообразной жидкости – гноя.
Отделению и удалению избытка гноя в небольших кожных дефектах может помочь мазь для заживления гнойных ран. При массивных поражениях требуется оперативное вмешательство по вскрытию и удалению гноя.
Необходимые свойства
- Крем для такого лечения должен иметь в своем составе антисептик, который будет дезинфицировать дефект на коже.
- Повязка с мазью, которая будет наложена на рану после ее обработки, должна обладать гигроскопичностью, то есть способностью притягивать к себе жидкость. Таким образом, не создается “парниковый эффект” под повязкой, рана не мокнет и заживает быстрее.
- Многие мази содержат ферментативные компоненты, которые помогают разлагать избыток гноя и чужеродные агенты. Благодаря этому свойству рана (инфицированная ссадина, царапина) заживает в относительно краткие сроки.

Важно помнить, что лечить раневой дефект можно начинать только на 2-3 день, потому как до этого протекает фаза активного заживления, а применение жирных кремов мешает ране подсыхать.
При крупных гнойных воспалениях, например, при абсцессах или флегмонах (разлитые поражения, находящиеся под кожей или во внутренних органах) сначала производят оперативное вскрытие и дренирование (промывание полости и налаживание дренажа) гнойного очага. Затем в рану могут ввести турунды (марлевые валики с нанесенным на них раствором антисептика или мазями для лечения гнойных ран). После полного отхождения гноя рану зашивают; на некоторое время в ней может оставаться дренажная трубка, которую удаляют, когда пропадает необходимость в ее использовании.
Какие средства используются в гнойной хирургии?
Рассмотрим список самых “популярных” мазей для лечения гнойных поражений:
- Мазь Вишневского (линимент бальзамический). Приготовлена на основе березового дегтя и ксероформа. Средство имеет специфический запах, цвет его – от светло-коричневого до коричневато-зеленого. Это средство постепенно теряет свою популярность в связи с тем, что за последние годы были разработаны более действенные и менее аллергенные аналоги. Раньше она была практически единственной мазью, которая добавлялась в повязки, накладываемые на фурункулы (единичные небольшие гнойники), карбункулы (скопление фурункулов). Препарат также активно применялся в терапии различных сосудистых болезней, например, пролежней (отторжение ткани из-за нарушения в ней питания при длительном сдавливании, развивается зачастую у лежачих больных).
- Левомеколь содержит два основных компонента – хлорамфеникол и метилурацил. Метилурацил обладает способностью стимулировать деление здоровых клеток, что ускоряет заживление раны, а также активировать работу клеточных факторов защиты. Хлорамфеникол – это антибиотик широкого спектра действия. В качестве вспомогательных веществ выступают полиэтиленоксиды, которые придают крему гигроскопичность и плотность. Левомеколь на сегодняшний день является одной из наиболее часто применяемых мазей для лечения гнойных ран в хирургии.
- Мазь Повидон-Йод содержит йодированный повидон, а в качестве вспомогательных веществ выступают макрогол и натрия гидроксид. Мазь обладает насыщенным коричневым цветом и специфическим запахом. Основное ее свойство – дезинфицирующее, так как йодированный повидон обладает высокой активностью против гноеродной флоры – стрептококков, стафилококков и др. Данную мазь следует с особой осторожностью применять людям, имеющим проблемы с щитовидной железой (зобы различной этиологии, гипертиреоз), так как йод попадает в кровь и может вызвать расстройство выработки тиреоидного гормона (который синтезируется с участием этого элемента).
- Левосин – комбинированный препарат, представляющий собой левомеколь, дополненный такими компонентами, как тримекаин и сульфадиметоксин. Тримекаин обладает местным обезболивающим эффектом, что помогает снять болезненные ощущения в месте травмы. Сульфадиметоксин – это антибиотик широкого спектра действия сульфаниламидной группы.

Правила применения и противопоказания
- Лечение повязками с мазями начинается только после завершения активной фазы заживления (первые 2 – 3 дня).
- Мазь наносится не на раневую поверхность, а на внутреннюю сторону повязки, которой забинтовывают дефект.
- Перед наложением повязки место повреждения обрабатывается антисептиками, удаляются участки омертвевшей кожи, дренируемые полости промываются.
- Повязку рекомендуется менять не реже, чем 1 раз в день.
Возможные противопоказания к применению мазей от гнойных ран:
- Непереносимость и гиперчувствительность к компонентам мази для лечения гнойных ран, аллергические реакции (кожная сыпь).
- Беременность (2 и 3 триместры) и лактация. Эти лекарства могут преодолевать плацентарный барьер, пагубно влияя на плод, а при кормлении грудью попадают в состав грудного молока.
- Возраст детей до трех лет, что связано с более медленной утилизацией препаратов из детского организма.
Мази для гнойных ран чаще всего отпускаются без рецепта, однако необходима консультация по вопросам лечения того или иного заболевания у врача. Не занимайтесь самолечением!
Читайте также:


