Диета при лимбическом энцефалите
04 сентября 2018
- 3461
- 2,7
- 0
- 5
На изображении видны изменения в метаболизме базальных ганглиев и медиальных височных областей при одном из типов аутоиммунного энцефалита
В настоящее время все больше внимания уделяется тому, как иммунитет влияет на разные процессы в нашем организме. Обнаруженные в новых исследованиях нарушенные иммунные реакции становятся недостающим звеном патогенеза. Это стимулирует поиск новых лекарств и других профилактических и лечебных воздействий. В этом тексте мы обсудим особый иммунный статус мозга — его изолированность от системных процессов иммунитета. Кроме этого поговорим о расстройствах, которые нарушают иммунный суверенитет центральной нервной системы — об аутоиммунных энцефалитах.
Привилегированный орган
Мозг — это орган, примечательный во многих отношениях [1]. Бесконечная сложность устройства, его функциональные возможности и связь нашей жизни с его состоянием приковывают к мозгу внимание исследователей. Взаимоотношения мозга с иммунной системой нашего организма тоже носят особенный характер: мозг является иммуннопривилегированным органом. Иммунные реакции, которые легко развиваются в остальных тканях (клетках печени, мышцах, жировой клетчатке), в мозге возникают редко. Вместе с мозгом в таких особых отношениях с иммунной системой оказались щитовидная железа, яички и некоторые ткани глаза, в частности, роговица.
Длительное время считалось, что основой иммунной привилегии головного мозга является наличие гемато-энцефалического барьера (ГЭБ). ГЭБ — это комплекс клеточных и внеклеточных структур, которые отделяют кровь, текущую в капиллярах, от нейронов паренхимы мозга. Клетки стенок сосудов, базальная мембрана, на которой они лежат, астроциты участвуют в формировании ГЭБ. Иммунная привилегированность частей центральной нервной системы хорошо согласовывалась с распространенностью ГЭБ внутри нее. Паренхима головного мозга надежно защищена ГЭБ, и в ней редко возникают воспалительный процессы (энцефалиты). Хориоидные сплетения, продуцирующие спинномозговую жидкость, и оболочки головного мозга не имеют такого прикрытия, и их воспаление (хориоидит, менингит) встречается гораздо чаще (рис. 1).
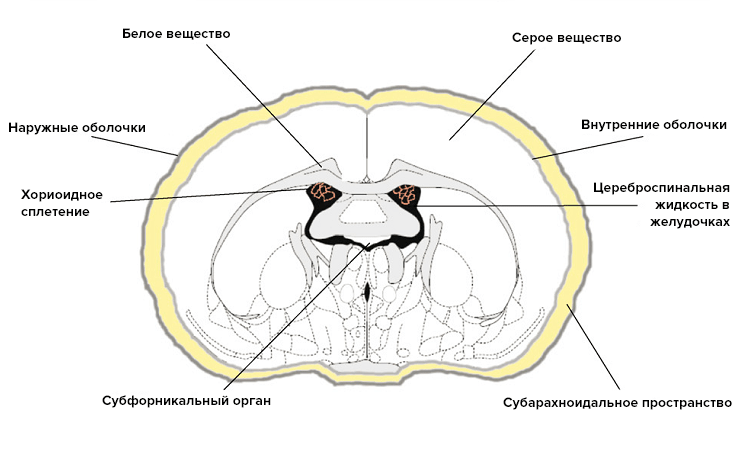
Рисунок 1. Строение центральной нервной системы. К частям, которые хорошо защищены ГЭБ, относятся серое и белое вещества. Другие компоненты не имеют такой защиты.
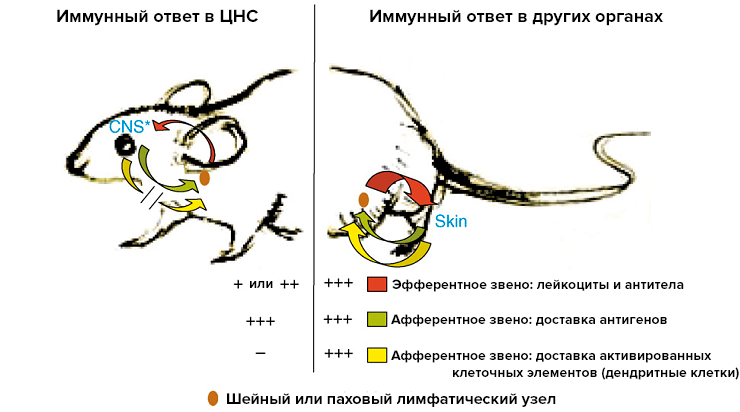
У мозга возникают сложности при доставке активированных клеток иммунитета в шейные лимфатические узлы. За работу с антигенами в головном мозге отвечают дендритные клетки. В других органах они распознают антиген, а затем предоставляют информацию о нем T- и B-лимфоцитам в лимфоузлах. При воспалении в мозге такого процесса не происходит: дендритные клетки не мигрируют в лимфоузлы и не представляют антиген. Иммунный ответ становится локальным, и дендритные клетки регулируют его в паренхиме головного мозга. Если в других органах клеточные элементы иммунитета после презентации антигена устремляются в место проникновения бактерий [6], то при развитии воспаления в паренхиме мозга этого не происходит. Мозгу приходится рассчитывать на самого себя. Подобная локальность иммунного ответа наблюдается в паренхиме, но не в хориодиных сплетениях и оболочках мозга.
Аутоиммунные энцефалиты
После разговора об особом иммунном статусе мозга мы перейдем к теме аутоиммунных энцефалитов — группе заболеваний, которые связаны с поражением мембранных и внутриклеточных структур нейронов собственным иммунитетом организма. В современной практике аутоиммунные энцефалиты диагностируются редко. Это объясняется тем, что первые случаи подробно описали только в 2005 году [10]. Можно предположить, что на самом деле случаев этого заболевания больше, чем регистрируется специалистами. Некоторым пациентам с аутоиммунным энцефалитом могут устанавливать диагноз других расстройств, например, шизофрении или инфекционного энцефалита. Это связано с тем, что врачи мало осведомлены об этом заболевании. Врачи диагностируют только те болезни, которые им известны. Чем больше арсенал диагнозов в запасе у врача, тем точнее диагностика и правильнее лечение.
Аутоиммунные энцефалиты можно разделить на две группы:
- заболевания, вызванные активированными T-клетками (нечто похожее происходит при рассеянном склерозе [11]);
- заболевания, которые возникают при воздействии антител на внутри- и внеклеточные компоненты нейрона, например, ионные каналы.
Для первой группы аутоиммунных энцефалитов характерно повреждение клеток антителами и активированными Т-лимфоцитами [12]. Эти энцефалиты носят более тяжелый характер и требуют интенсивных лечебных вмешательств в отличие от представителей второй группы.
Антитела проникают снаружи, из-за пределов ГЭБ, или производятся проникшими в головной мозг и активированными B-лимфоцитами [15]. В тех случаях, когда антитела направлены против внутриклеточных структур, атаку на нейроны возглавляют цитотоксические T-лимфоциты. При помощи перфорина и гранзима B они повреждают мембрану нейронов, что приводит к их гибели [16], [17]. ГЭБ, о котором мы говорили выше, в этом свете представляется надежной крепостной стеной, защищающей тихий город, который отвык воевать. Если в стене возникнет брешь, то город быстро падет: нервные клетки окажутся слишком чувствительны к воздействию иммунных факторов.
Признаки аутоиммунных энцефалитов очень разнообразны, но можно выделить три типа симптомов.
- Психиатрические симптомы: психозы, агрессивные действия, сексуальная расторможенность, панические атаки, навязчивые действия, чувство эйфории или страха.
- Двигательные симптомы: повышение тонуса мышц и его неравномерность, мышечные подергивания и повторяющиеся движения конечностей.
- Припадки: генерализованные эпилептические припадки, эпилептический статус.
Начальными проявлениями аутоиммунного энцефалита могут быть симптомы психического расстройства: нарушение памяти, галлюцинации или появление бредовых идей. Например, при аутоиммунном поражении глутаматных NMDA-рецепторов у 80% пациентов были выявлены симптомы психических заболеваний, а больше 60% первоначально были госпитализированы в психиатрические отделения [18], [19]. Врачи-психиатры должны уметь выявлять пациентов с аутоиммунными энцефалитами или хотя бы заподозрить это заболевание, чтобы вовремя отправить пациента на соответствующие обследования и консультации к другим врачам.
- Лимфоцитарный плейоцитоз или появление олигоклональных полос при электрофорезе ЦСЖ.
- Эпилептические припадки.
- Фациобрахиальные дистонические припадки.
- Подозрение на злокачественный нейролептический синдром.
- Отклонения на МРТ.
- Отклонения на ЭЭГ.
- Сниженный уровень сознания.
- Нарушение позы и движений.
- Нестабильность вегетативной нервной системы.
- Очаговая неврологическая симптоматика.
- Нарушения речи (афазия и дизартрия).
- Быстрое, несмотря на лечение, прогрессирование психоза.
- Гипонатриемия.
- Кататония.
- Головные боли.
- Наличие других аутоиммунных заболеваний, в том числе тиреоидитов.
Кроме совокупности ранее описанных симптомов, диагноз аутоиммунного энцефалита должен быть подтвержден лабораторными исследованиями и другими диагностическими процедурами [21]. Например, можно выполнить анализ на антитела к конкретным рецепторам. При аутоиммунном энцефалите, поражающем глутаматные NMDA-рецепторы, можно обнаружить повышение титра антител к ним. Интересно, что при энцефалите увеличивается количество иммуноглобулинов класса G, а при шизофрении — классов А и М [22]. В настоящее время установлено соответствие между антителами, поражающими конкретные структуры нейрона, и симптоматикой энцефалита (табл. 1). При проведении магнитно-резонансной томографии (МРТ) могут быть обнаружены изменения в структуре головного мозга, а электроэнцефалографическое исследование (ЭЭГ) в случае аутоиммунного энцефалита может показать нарушение функционирования головного мозга.
| Структура, к которой вырабатывается антитело | Психиатрические симптомы | Другие симптомы | Типичный пациент |
|---|---|---|---|
| NMDA-рецептор | Психоз, шизофреноподобные расстройства, кататония, агрессия | Эпилептические припадки, дискинезия, вегетативная нестабильность, нарушение речи и сознания | Молодые женщины, частая связь с тератомой яичника |
| Caspr2 | Бессонница, панические атаки, депрессия, шизофреноподобные расстройства | Синдром Морвана, нейромиотония, мышечные спазмы, фасцикуляции | Пациенты среднего и старшего возраста, возможна связь с тимомой |
| LGI1 | Амнезия и другие нарушения памяти, спутанность, депрессия | Лимбический энцефалит, фациобрахиальные дистонические припадки, гипонатриемия | Пациенты среднего и старшего возраста, соотношение мужчин и женщин 2:1, возможна связь с тимомой |
| Глициновый рецептор | Поведенческие изменения, шизофреноподобный синдром | Синдром мышечной скованности, прогрессирующий энцефаломиелит с ригидностью, миоклонус, гиперэкплексия | Пациенты среднего и старшего возраста, возможна связь с тимомой и лимфомой |
| Синаптические антигены (GAD) | Шизофреноподобный синдром, аутизм, синдром дефицита внимания и гиперактивности | Лимбический энцефалит, синдром мышечной скованности, припадки, стволовая дисфункция, атаксия | Пациенты среднего и старшего возраста, возможна связь с мелкоклеточным раком легких |
| Онконевральные антигены (Yo, Hu, CV2, Ri, Ma2) | Поведенческие нарушения | Лимбический энцефалит, мозжечковая дегенерация, сенсорная нейропатия | Пожилые пациенты, часто со злокачественными опухолями |
В некоторых случаях аутоиммунное поражение центральной нервной системы вызвано развитием паранеопластического синдрома, который может сопровождать появление в организме злокачественной опухоли. При паранеопластическом синдроме опухоль может начать самостоятельно вырабатывать гормоны и гормоноподобные вещества, нарушая регуляцию различных процессов в организме. Кроме этого паранеопластический синдром может проявляться в виде аутоиммунного заболевания, например, аутоиммунного энцефалита.
По этой причине при диагностике аутоиммунных энцефалитов отдельное внимание уделяется поиску опухоли в организме пациента. Удаление опухоли в случаях паранеопластического генеза аутоиммунного энцефалита приведет к значительному улучшению состояния пациента. Пока же опухоль находится в организме человека, антитела продолжают вырабатываться, а состояние пациента ухудшаться.
Если терапия первой линии не работает, то переходят к использованию ритуксимаба и циклофосфамида. Ритуксимаб — это моноклональные антитела к рецептору CD20, который обнаруживается на поверхности B-лимфоцитов [23]. В-лимфоциты производят самые разные антитела, в том числе и аутоантитела против нервных клеток, и их уничтожение может привести к улучшению состояния. Рецептор CD20 появляется на поверхности нормальных B-лимфоцитов и B-лимфоцитов, которые прошли процесс малигнизации (озлокачествления). Благодаря этому свойству ритуксимаб эффективен при аутоиммунных заболеваниях и B-клеточных лимфомах. Лекарство присоединяется к рецептору CD20 на поверхности лимфоцита и дает возможность другим компонентам иммунной системы уничтожить клетку.
На примере аутоиммунных энцефалитов можно рассмотреть два важнейших тренда в современной медицине. Первый тренд — изучение влияния иммунных процессов на функционирование нервной системы человека и попытки вмешаться в этот процесс при лечении неврологических и психических заболеваний. Сейчас мы близки к пониманию того, что мозг — это не просто электрохимическая лаборатория под черепной коробкой, но и особый иммунный мир со своими правилами. В наших интересах изучить эти правила и начать играть по ним в свою пользу. Второй же тренд — это биологизация психиатрии, поиск конкретных биологических изменений в организме, которые приводят к нарушению психического здоровья. Психиатрия — это часть медицины, большой отрасли, где соединяются теоретические знания и их практическое применение. Без биологической основы медицина перестанет быть научной. Если игнорировать биологические законы и знания внутри одной из медицинских специальностей, то с ней произойдет то же самое. Психиатрия должна становиться биологической, чтобы оставаться научной и выполнять свои медицинские задачи.
В последнее время исследователи и врачи все больше внимания уделяют реакциям врожденного иммунитета при развитии нейродегенеративных заболеваний (болезни Альцгеймера [24], болезни Паркинсона [25], хореи Гентингтона [26]) и психических расстройств [27]. Накопление бета-амилоида, который сам, вероятнее всего, вовлечен в иммунные реакции центральной нервной системы [28], связано с нарушением баланса между его накоплением и элиминацией (удалением). Последний процесс отчасти зависит от того, как экспрессируется толл-подобный рецептор 2 (TLR2) [29]. На мышиных моделях показано: чем ниже уровень экспрессии TLR2, тем хуже удаляется бета-амилоид [30]. Снижение элиминации бета-амилоида приводит к его накоплению в нервных клетках и последующему нарушению их функции и гибели. Изучение внутренних иммунных процессов мозга может стать основой для поиска новых препаратов при нейродегенеративных заболеваниях. Сейчас фармацевтические компании тестируют моноклональные антитела для терапии болезни Альцгеймера, но успехи остаются скромными.


В последнее время появляется все больше данных об аутоиммунной природе некоторых неврологических и нейропсихиатрических расстройств. Задача представленного обзора – рассмотреть в разделе двигательных расстройств палитру аутоиммунных энцефалитов (или энцефалопатий), пусковым фактором которых являются инфекционные агенты, опухоли или другие причины, провоцирующие синтез аутоантител к различным структурам мозга, в том числе его многообразным рецепторам. Основная канва обозрения заимствована из статьи Baizabzl-Carvallo и Jankovic [1].
Следует отметить, что коварность аутоиммунных энцефалитов заключается в том, что они могут имитировать инфекционные, токсико-метаболические, нейродегенеративные и демиелинизирующие заболевания, что ведет к ошибочной или поздней их диагностике, тогда как своевременно установленный диагноз и назначение иммунотропной терапии (глюкокортикоидов, плазмафереза, внутривенных иммуноглобулинов) в большинстве случаев обусловливают положительный эффект. Летаргический энцефалит, долгое время описываемый как заболевание с подострым началом, паркинсоническими, нейропсихиатрическими и глазодвигательными проявлениями, в настоящее время рассматривается как синдромальный диагноз, объединяющий заболевания, вызванные различными причинами, включая постинфекционные и аутоиммунные (энцефалиты, вызванные антителами к NMDA- или дофаминовым рецепторам) [2–4].
По этиологическому принципу аутоиммунные энцефалиты делятся на паранеопластические, постинфекционные и идиопатические (когда причина неясна, но часто сопряжена с наличием других аутоиммунных заболеваний).
Механизм развития аутоиммунных энцефалитов зависит от особенностей аутоантител, которые могут являться патогенными (ориентированы на антигены на поверхности клеток мозга), и аутоантител, направленных на внутриклеточные антигены с вовлечением в патогенез элементов клеточного иммунитета (Т-клеток), что обусловливает, в отличие от первых, их плохой ответ на иммунотропную терапию. Независимо от запускающего фактора и характера синтезируемых в ответ на него аутоантител, могут формироваться различные клинические варианты расстройств в соответствии с регионом приложения аутоиммунного процесса: лимбический энцефалит, мозжечковая дегенерация, стриарный (подкорковый), стволовой энцефалит, лейкоэнцефалопатия. По возрасту начала заболевания выделяют аутоиммунные энцефалиты детского возраста и взрослых.
Таким образом, среди всего спектра экстрапирамидных заболеваний, объединенных в эту группу исключительно по принципу внешних проявлений, выделяется подтип, в основе патогенеза которого лежат аутоиммунные механизмы, раннее распознавание которых может превратить их в потенциально излечимые болезни.
Хорея Сиденгама (ХС) впервые была описана еще в 1686 году Т. Сиденгамом, а ее связь c ревматизмом обнаружилась только в 1810 году [4–5]. Несмотря на то, что ХС – только одно из множества экстрапирамидных и нейропсихиатрических проявлений этого заболевания, оно по-прежнему называется хореей, а не, например, болезнью Сиденгама. ХС является прототипом расстройств, при которых инфекционный агент (в данном случае β-гемолитический стрептококк) становится триггером для аутоиммунного ответа, вызывающего разнообразные двигательные и нейропсихиатрические симптомы [6–11]. Антитела к базальным ганглиям обнаруживаются в острый период ХС в 100 % случаев и только у 12 % больных с ревматизмом без экстрапирамидных проявлений [12]. Подозрение на данную патологию оправдано в каждом случае остро развившейся хореи у ребенка. Предшествующая стрептококковая инфекция в горле, повышенные титры антистрептолизина О (ASLO) подтверждают диагноз. Вовремя установленный диагноз определяет успех лечения не только с точки зрения назначения специфической терапии, но и с тех позиций, что у больных ХС слишком высок риск развития острых дистонических реакций и других экстрапирамидных осложнений в ответ на прием нейролептиков, блокирующих дофаминовые рецепторы, сравнивая, в частности, с пациентами с синдромом Туретта (СТ) [13].
Рисперидон переносится лучше, чем галоперидол или пимозид, но предпочтение отдают тетрабеназину (истощающему моноамины), поскольку он не приводит к риску поздних дискинезий [14]. В качестве симптоматической терапии ХС можно рассматривать вальпроаты и карбамазепин [6, 15]. Кортикостероиды, плазмаферез и внутривенный иммуноглобулин назначаются в тяжелых рефрактерных случаях [16]. Но в редких случаях могут происходить и спонтанные ремиссии. Для предупреждения повтора стрептококкового инфицирования прописывают ежемесячные курсы пенициллина на протяжении 10 лет или до достижения 40-летнего возраста в случае осложнений со стороны сердца, а также в течение 5-летнего периода или до 21-летнего возраста – при отсутствии поражения сердца [17].
- начало заболевания с 3-летнего возраста до пубертатного;
- наличие обсессивно-компульсивного (ОКР) и/или тикозного расстройств;
- острое появление симптомов, наличие обострений и ремиссий;
- неврологические нарушения без хореиформных проявлений;
- временная связь со стрептококковой инфекцией.
Предполагаемая связь между широким спектром нейропсихиатрических проявлений и возможным аутоиммунным ответом, спровоцированным стрептококковой инфекцией, как и у больных ХС, вызвала бурные дебаты в отношении реального существования PANDAS и его связи с СТ, и до сих пор эта тема остается предметом спора.
Однако ряд исследований подтверждает высокое преобладание титров ASLO и антител к базальным ганглиям у больных СТ в сравнении со здоровыми [19–27]. Результаты ретроспективных наблюдений также доказывают высокую частоту стрептококковой инфекции на протяжении года, предшествующего развитию тиков или ОКР [28–29].
Тем не менее существуют данные, не подтверждающие этой связи. Поскольку не было обнаружено корреляции между наличием антител к базальным ганглиям и префронтальной коре, повышением цитокинов в ликворе и обострением неврологической симптоматики в виде тиков и ОКР, что поддерживает статус спорности для существования этой нозологии [30–33].
Несмотря на то, что другие двигательные расстройства – тремор, дистония, стереотипии, миоклонус, опсоклонус, пароксизмальный хореоатетоз и кататония — описаны у пациентов со стрептококковой инфекцией, патогенетическая связь между ними до сих пор достоверно не установлена [34–36]. Положительный результат на фоне лечения внутривенными иммуноглобулинами и плазмаферезом изучался у небольшого количества пациентов с PANDAS, поэтому иммуномодулирущее лечение этой патологии, существование которой еще вызывает сомнения, не может быть широко рекомендовано, хотя каждый отдельный случай должен рассматриваться индивидуально [37–39].
У пациентов с паранеопластическими поражениями обычно подостро развиваются следующие синдромы в чистом виде или их комбинации [40]:
- энцефалиты или энцефаломиелиты;
- стволовые энцефалиты;
- лимбические или мозжечковые энцефалиты;
- паранеопластическая дегенерация мозжечка;
- синдромы поражения периферической или вегетативной нервной системы.
Целевой антиген при паранеопластических синдромах может быть как внутриклеточным, так и локализоваться на поверхности клеточных мембран [41]. Внутриклеточная группа антигенов также известна как классические паранеопластические онконевральные антигены, поскольку у пациентов с данными синдромами наличие опухоли ассоциировано со специфическим интратекальным их синтезом [42]. Патогенетическая роль этих антител в развитии неврологических расстройств остается спорной после неудачных экспериментальных исследований, хотя при этом существуют строгие доказательства Т-клеточной иммунной атаки против невральных антигенов, что может объяснять плохой ответ на иммунотерапию [41–45].
Примерами из этой категории расстройств являются паранеопластическая мозжечковая дегенерация с антителами анти-Yo, анти-Tr, анти-Ri и анти-Hu [46–48]. Атипичный паркинсонизм ассоциирован с антителами анти-Ма, хорея — с анти-CV2/CRMP5, опсоклонус-миоклонус — с анти-Ri [49–55].
Вторая группа расстройств вызывается антителами, направленными против антигенов на поверхности клеток нервной системы, и у 70 % пациентов ассоциирована с наличием опухолей [56–58]. Существуют в отношении данных антител убедительные экспериментальные доказательства их патогенетической роли в развитии неврологических расстройств, поскольку они существенно снижают количество синаптических рецепторов в структурах мозга [56, 59]. Пациенты с этими синдромами демонстрируют улучшение на фоне лечения внутривенными иммуноглобулинами и удаления опухоли [41]. Такими примерами может служить широкий спектр состояний, связанных с антителами к натриевым каналам (VGKC), включая паркинсонизм, тремор, миоклонус и хорею [60]. К тому же в последнее время доказано, что эти антитела направлены против LGI1 или CASPR2 – протеинов, которые выступают частью транссинаптического комплекса, обеспечивающего синаптическую передачу [61]. Одним из типичных проявлений энцефалопатии, вызванной антителами к VGKC, является лимбический энцефалит, проявляющийся грубыми нарушениями памяти, дезориентацией и эпиприпадками. В частности, он может быть паранеопластическим, но чаще – непаранеопластическим (неопухолевым) процессом. Более того, оптимальная иммунотерапия приводит к снижению VGKC-антител в ликворе, что коррелирует с клиническим улучшением, но не исключает резидуальных когнитивных нарушений.
Отдельную группу составляют энцефалиты, обусловленные синтезом антител к NMDA-рецепторам. Как правило, они возникают у молодых женщин, начинаясь с продромальной стадии в виде головной боли и повышения температуры тела, за которой развиваются психозы, эпиприпадки, гиповентиляция, вегетативные нарушения и дискинезии, преимущественно вовлекающие орофациальную область. У этих больных в ликворе обнаруживаются антитела к NMDA-рецепторам в высоких титрах [62]. Несомненна связь с опухолями яичников или реже яичек у мужчин. Положительный эффект наблюдается на фоне иммунотерапии и после удаления опухоли, однако возможно и фатальное разрешение при позднем установлении диагноза.
Начинается это заболевание подостро — в виде прогрессирущих когнитивных нарушений в сочетании с миоклонусом, тремором, атаксией, высокими титрами антител к тиреопероксидазе и, как правило, без сопутствующего гипотиреоза. В некоторых случаях первые эпизоды болезни обнаруживаются в виде кратковременных миоклонических подергиваний в мышцах лица и конечностей, периодов появления замедления речи и мыслительных процессов, продолжающихся от нескольких дней до недель, а могут за несколько лет предшествовать бурным проявлениям с нарушением сознания и тонико-клоническими судорогами, которые требуют срочной госпитализации. Чаще всего на МРТ не оказывается никаких изменений, а на ЭЭГ отмечается генерализованная или пароксизмальная медленноволновая активность без эпилептиформной симптоматики. Высокие титры антител к тиреопероксидазе, даже при эутиреозе, позволяют заподозрить аутоиммунную энцефалопатию Хашимото. Иммуносупрессивная терапия, начиная со стероидов, обычно приводит к полной ремиссии в 80–96 % случаев.
Энцефалит Расмуссена – заболевание детского возраста, манифестирущее парциальными эпиприпадками, включая фокальный миоклонус, слабоумием (когнитивным снижением), экстрапирамидными нарушениями и унилатеральной церебральной атрофией. Данную патологию связывают с возможной вирусной инфекцией, однако имеется больше данных именно о патогенетической роли Т-клеток [72–74]. В частности, при паранеопластических аутоиммунных расстройствах выявление и удаление опухолей — основной подход для остановки аутоиммунизации, причем в комбинации с иммунотерапией (кортикостероидами, плазмаферезом, внутривенным иммуноглобулином, ритуксимабом) [75, 76]. А при заболеваниях, связанных с антителами к поверхностным антигенам, очевиден ответ на иммунотропную терапию еще до удаления опухоли. При активации антител, направленных на внутриклеточные антигены, препаратами выбора являются циклофосфамид, такролимус, циклоспорин или микофенолата мофетил [41]. Симптоматическое лечение может включать короткие курсы нейролептиков или тетрабеназина для паранеопластической хореи, ГАМК-ергические препараты (бензодиазепины, барбитураты) для SPS, ботулинический токсин — для миоклонус-дистонии при энцефалите Расмуссена [14, 16, 77–79].
Системная красная волчанка (SLE) и антифосфолипидный синдром (APC) — комплекс аутоиммунных заболеваний, часто проявляющихся двигательными расстройствами. Хорея — наиболее распространенное проявление SLE, возникающая в течение первого года после установления диагноза, а также часто может предшествовать ему [80]. Среди 2–3 % пациентов с SLE у 96 % эта патология наблюдается у женщин, причем в половине случаев она является односторонней. Часто хорею сопровождают другие проявления: эпиприпадки, инсульты, когнитивные нарушения, личностные расстройства и психозы [81, 83]. Признаки хореи на фоне антифосфолипидного синдрома не отличаются от таковых при SLE, но начинаются в более раннем возрасте (моложе 15 лет). Возможна роль эстрогенов в патогенезе расстройства, поскольку преобладают женщины, обострения возникают во время беременности и на фоне приема контрацептивов [81, 82, 84]. Предполагается, что при обоих расстройствах антифосфолипидные антитела проникают в ЦНС через гематоэнцефалический барьер и связываются со структурами мозга, богатыми фосфолипидами, в частности базальными ганглиями. Клиническое улучшение у больных с хореей на фоне SLE и АРС отмечается при приеме галоперидола и тетрабеназина, вальпроевой кислоты и клонидина, а также кортикостероидов, антикоагулянтов и аспирина [85–87]. При рефрактерной хорее успешно используются иммуноглобулины внутривенно и плазмаферез. В дополнение к хорее, у лиц с SLE описан паркинсонизм, происхождение которого связывают с антителами к дофаминовым рецепторам [88–90]. Успешное лечение наблюдалось на фоне кортикостероидов, азатиоприна, циклофосфамида, агонистов дофаминовых рецепторов и леводопы [91–94]. Отмечается вовлечение мозжечка у 2% пациентов с SLE. Подостро у большинства больных развивается атаксия без нейропсихиатрических нарушений, а в отдельных случаях возникают изолированный тремор, блефароспазм, цервикальная дистония и SPS [95–97]. Но во всех эпизодах улучшение наступало на фоне циклофосфамида и иммуноглобулинов внутривенно. А при антифосфолипидном синдроме существуют единичные описания различных двигательных феноменов: пароксизмальной дискинезии, гемидистонии, писчего спазма, паркинсонизма, кортикобазального синдрома и атаксии.
Целиакия характеризуется иммунным ответом на пищевой глютен и множеством гастроэнтерологических и других системных проявлений. У 10–50 % больных наблюдаются неврологические нарушения [98, 99]. Впрочем, нередки случаи изолированных неврологических проявлений без патологии со стороны ЖКТ, но при серологическом подтверждении чувствительности к глютену. Наиболее частой является мозжечковая, или глютеновая атаксия [100]. Она характеризуется прогрессирующей мозжечковой симптоматикой (обычно на 5-й декаде жизни), реже наблюдается снижение глубокой чувствительности. Мозжечковая атрофия обнаруживается на МРТ в 60–80 % случаев [101]. Механизм развития атаксии связывают с лейкоцитарным антигеном аллелей DQ2 и DQ8 [102]. У этих пациентов также отмечаются циркулирующие антитела к глиадину (AGAs). Причем у пациентов с наследственными (спиноцеребеллярными атаксиями 1, 2, 3, 4, 6 и 7-го типов, атаксией Фридрайха) и спорадическими атаксиями, а также мультисистемной атрофией частота обнаружения AGAs достигает 41 % в сравнении с 12–15 % в контрольной группе. Однако вопрос о причинной роли AGAs остается спорным, к тому же высказывается мнение об их вторичности по отношению к мозжечковой дегенерации [103–104]. Аутоиммунная патофизиология при глютеновой атаксии подтверждается появлением атаксии у экспериментальных животных после переливания им AGAs. Среди других двигательных нарушений при глютеновой гиперчувствительности описаны пароксизмальная дискинезия, хорея, ассоциированная с атаксией, миоклонус и паркинсонизм [105–107]. Несмотря на спорные вопросы в понимании патогенетических взаимосвязей между повреждением структур нервной системы и определенными антителами, у больных обнаруживается существенное клиническое улучшение после перехода на безглютеновую диету в течение года [101]. Дополнительными эффективными мерами оказались назначение витамина Е и иммуноглобулинов внутривенно [108].
Синдром Шегрена (SS) относится к аутоиммунным расстройствам, характеризующимся лимфоцитарной инфильтрацией и повреждением слюнных и слезных желез, с наличием антител SSA/Ro и SSB/La, из которых последний более специфичный. Неврологические осложнения наблюдаются в 1,5–25 % случаев, среди них паркинсонизм с преобладающей акинезией, плохим ответом на леводопу в сочетании с подкорковыми сосудистыми очагами на МРТ или асимметричный паркинсонический синдром с хорошим ответом на леводопу и отсутствием изменений на МРТ [109–113]. Некоторые ученые связывают данные проявления с церебральной васкулопатией [113–115]. Среди других экстрапирамидных нарушений при SS – хорея и дистония [116–119]. Оправдана терапия кортикостероидами, а в случае паркинсонизма – дополнительно леводопой [112, 114].
Несмотря на существование множества вопросов, оставшихся без ответа, относительно аутоиммунных патогенетических причин некоторых двигательных расстройств, знание об их существовании позволит выявить их среди множества экстрапирамидных заболеваний, которые в настоящее время рассматриваются как идиопатические. Благодаря лучшему пониманию механизмов аутоиммунных двигательных расстройств можно будет использовать патогенетически направленную, а значит, эффективную терапию.
Аутоиммунное происхождение двигательных нарушений следует заподозрить в случае подострого начала, быстрого прогрессирования симптоматики, сочетания двигательных феноменов с нейропсихиатрическими и поведенческими нарушениями, а также во всех случаях, когда у пациента есть еще одно аутоиммунное заболевание. Выявление текущей инфекции или имеющейся опухоли в сочетании с типичными феноменологическими проявлениями, описанными в литературе, позволит вовремя назначить правильное лечение, включающее глюкокортикоиды, внутривенный иммуноглобулин или плазмаферез, кроме специфически направленной терапии (антибактериальной, противовирусной, операций по удалению опухолей). Следует подчеркнуть, что отсутствие инфекции или опухоли ни в коем случае не исключает возможность аутоиммунного заболевания, которое в этом случае будет входить в разряд идиопатического. Кроме того, обнаружение специфических антител подтверждает предположение о наличии аутоиммунного заболевания.
Список литературы находится в редакции.
Читайте также:


