Цитомегаловирусная инфекция соэ не снижается
Цитомегаловирус (Cytomegalovirus, CMV) относится к семейству герпес-вирусов. CMV-инфекция относится к заболеваниям, для которых характерна длительная персистенция вируса в организме. Активация персистирующего вируса способна привести к развитию острой или хронической инфекции. Первичная CMV-инфекция представляет наибольший риск для беременных женщин, вызывая врождённую CMV-инфекцию у плода. У иммуносупрессированных пациентов (реципиентов органов, пациентов с лимфоидными новообразованиями, ВИЧ-инфицированных) CMV-инфекция является основной причиной заболеваний и смертности. При первичной инфекции IgA начинают вырабатываться на 1-2 неделе от начала заболевания, максимума достигают на 3-4 неделе, быстро снижаются после выздоровления и в небольшом количестве могут сохраняться в среднем в течение 3-4 месяцев. Возможно использовать в диагностике реинфекции.
Антитела класса IgA к цитомегаловирусу (ЦМВ).
Anti-CMV-IgA, CMV Antibody, IgA.
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Цитомегаловирус (ЦМВ) относится к семейству вирусов герпеса. Так же, как и другие представители этой группы, он может сохраняться у человека всю жизнь. У здоровых людей с нормальным иммунитетом первичная инфекция протекает без осложнений (и часто бессимптомно). Однако цитомегаловирус опасен при беременности (для ребенка) и при иммунодефиците.
Цитомегаловирусом можно заразиться через различные биологические жидкости: слюну, мочу, сперму, кровь. Кроме того, он передается от матери к ребенку (во время беременности, родов или при кормлении).
Как правило, цитомегаловирусная инфекция протекает бессимптомно. Иногда заболевание напоминает инфекционный мононуклеоз: повышается температура, болит горло, увеличиваются лимфатические узлы. В дальнейшем вирус сохраняется внутри клеток в неактивном состоянии. Но если организм окажется ослаблен, то вирус снова начнет размножаться.
Для женщины важно знать, была ли она заражена ЦМВ в прошлом, потому что именно это определяет, есть ли риск осложнений при беременности. Если раньше она уже была инфицирована, то риск минимален. Во время беременности может возникнуть обострение старой инфекции, однако такая форма обычно не вызывает тяжелых последствий.
Если у женщины еще не было ЦМВ, значит, она входит в группу риска и ей следует уделять особое внимание профилактике цитомегаловирусной инфекции. Для ребенка опасна именно инфекция, которой мать заразилась первый раз во время беременности.
При первичной инфекции у беременной женщины вирус часто попадает и в организм ребенка. Это еще не означает, что он заболеет. Как правило, заражение ЦМВ протекает бессимптомно. Однако примерно в 10 % случаев оно приводит к врождённым патологиям: микроцефалии, церебральной кальцификации, сыпи и увеличению селезенки и печени. Это часто сопровождается снижением интеллекта и глухотой, возможен даже летальный исход.
Таким образом, для будущей матери важно знать, была ли она в прошлом заражена ЦМВ. Если да, то риск осложнений из-за возможного ЦМВ становится незначительным. Если же нет – нужно проявлять особую осторожность во время беременности: избегать незащищенного секса, не контактировать со слюной другого человека (не целоваться, не использовать общую посуду, зубные щетки и пр.), соблюдать правила гигиены при играх с детьми (мыть руки, если на них попадает слюна или моча), сдавать анализ на ЦМВ при признаках общего недомогания.
Кроме того, цитомегаловирус представляет опасность при ослаблении иммунной системы (например, из-за иммунодепрессантов или ВИЧ). При СПИДе ЦМВ протекает в тяжелой форме и является частой причиной смерти больных.
Основные симптомы цитомегаловируса: воспаление сетчатки (которое может приводить к слепоте), колит (воспаление толстой кишки), эзофагит (воспаление пищевода), неврологические расстройства (энцефалит и др.).
Выработка антител – это один из способов борьбы с вирусной инфекцией. Существует несколько классов антител (IgG, IgM, IgA и др.), которые отличаются по своим функциям. IgA появляются через 10-14 дней после начала заболевания, и вначале их даже можно обнаружить в семенной и вагинальной жидкостях. Уровень антител IgA обычно снижается к 2-4 месяцу после инфицирования в случае успешного лечения. При повторном инфицировании уровень антител IgA вновь возрастает. Если уровень IgA не падает после проведенного лечения, то это — признак хронической формы инфекции. Реинфекция, или повторная инфекция, выявляется быстрым подъемом уровня антител IgA или IgG. Антитела IgA имеют более высокую концентрацию у пациентов старшего возраста и более точно диагностируют текущую инфекцию у взрослых.
Исследование обладает высокой специфичностью (85 %) и чувствительностью (96 %); позволяет провести раннюю диагностику инфекции: IgA – маркер острой инфекции; дифференциальную диагностику стадии инфекции; диагностику реинфекции.
Для чего используется исследование?
- Для диагностики активной цитомегаловирусной инфекции.
- Для дифференциальной диагностики острой стадии первичной инфекции и реинфекции в комплексе с исследованиями иммуноглобулинов других классов.
Когда назначается исследование?
- При иммунодефиците (в частности, при ВИЧ-инфекции). При иммунодефиците симптомы ЦМВ-инфекции могут быть достаточно разнообразными: от общего недомогания до ретинита, колита, энцефалита и др.
- Когда у человека с нормальным иммунитетом есть симптомы мононуклеоза (если тесты не выявили вирус Эпштейна – Барр).
- Если у новорождённых детей подозревают ЦМВ-инфекцию.
- Во время беременности: при симптомах заболевания, если УЗИ выявило нарушения развития плода, для скрининга риска патологий. ЦМВ-инфекция у беременных женщин часто протекает бессимптомно. Однако в некоторых случаях повышается температура, увеличиваются лимфоузлы, печень и/или селезенка.
- Новорождённому анализ может быть назначен, если у ребенка: желтуха, анемия, увеличена селезенка и/или печень, размер головы меньше нормального, есть нарушения слуха или зрения, неврологические расстройства (задержка умственного развития, конвульсии).
Что означают результаты?
Референсные значения: не обнаружены.
Выявление антител класса IgA к CMV является маркером острой инфекции или реинфекции.
Выявление антител IgА и (или) низкоавидных антител IgG подтверждает наличие инфекции.
Реактивация гораздо чаще сопровождается гиперпродукцией антител класса IgА, чем IgM. Просто выявление IgG имеет низкое диагностическое значение. Диагностическую ценность повышает определение авидности антител IgG: выявление низкоавидных антител IgG свидетельствует о текущей или недавно перенесенной инфекции, снижение индекса авидности возможно и при реактивации. Обнаружение высокоавидных антител IgG позволяет исключить первичную инфекцию, однако реактивация может протекать при наличии высокоавидных антител, что подтверждается выявлением антител IgА. Таким образом, для исключения реактивации целесообразно определение антител IgА и авидности антител IgG.
При повторном выявлении антител класса IgM при отсутствии антител класса IgА и (или) низкоавидных IgG результат выявления антител IgM считают ложноположительным.
- В природе существует несколько разновидностей ЦМВ. Поэтому возможна ситуация, когда человек, уже инфицированный одним типом вируса, заражается еще и другим - так называемая реинфекция.
45 Cytomegalovirus, IgG(иммуноблот)
11 Cytomegalovirus, IgM
31 Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с обязательной микроскопией мазка крови)
40 Панель тестов "TORCH-антитела"
9 Cytomegalovirus, ДНК [реал-тайм ПЦР]
Кто назначает исследование?
Врач общей практики, терапевт, инфекционист, гинеколог.
Что такое инфекция цитомегаловирусная? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 12 лет.

Определение болезни. Причины заболевания
Цитомегаловирусная болезнь (ЦМВИ, цитомегалия, вирусная болезнь слюнных желёз, болезнь с включениями) — это общее системное инфекционное заболевание, вызываемое вирусом семейства герпесов V типа — цитомегаловирусом, который специфически поражает лейкоциты и клетки различных органов (слюнных желёз, почек, лёгких, печени, головного мозга и другие).
Клинически характеризуется многообразием проявлений — от бессимптомного течения до генерализованных (распространённых) форм с поражением внутренних органов и центральной нервной системы, а также пожизненного пребывания в организме.
Вид — Cytomegalovirus hominis (открыт в 1956 году)
Является древним человеческим вирусом (предположительно с Кембрийского периода), который в ассоциации с другими герпесвирусами оказал значительное влияние на формирование иммунитета современного человека.
Внутривидовая структура неоднородна. Известно о трёх штаммах вируса: Davis, АД 169, Kerr и Towne. Они могут иметь различия в тропизме к тканям человека, различаться по степени вирулентности и патогенности.
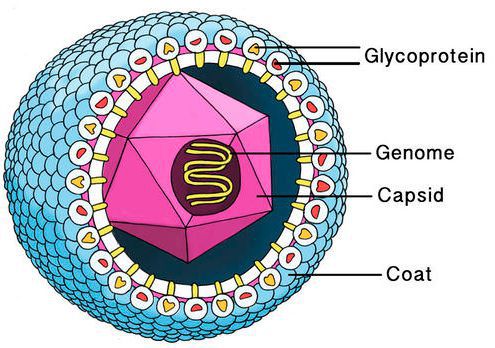
Цитомегаловирус имеет внешнюю гликопротеиновую оболочку, в составе которой есть B и H звенья — к ним формируются антитела. Представляет собой двухцепочечный ДНК-содержащий крупный вирус с диаметром нуклеокпсида до 180 нм.
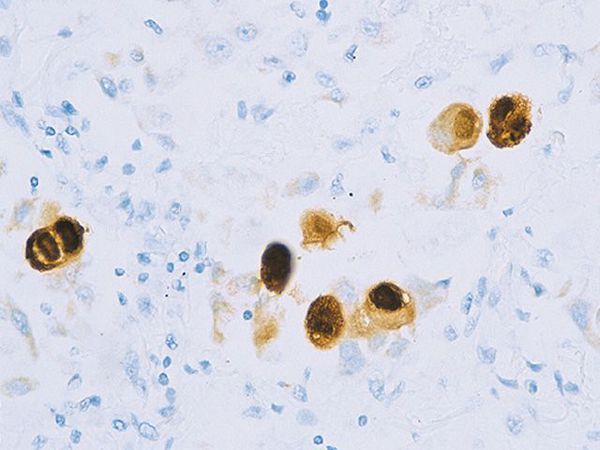
Вирус способен поражать практически любую ткань человеческого организма, т.е. обладает политропностью. При развитии в ядрах инфицированных клеток образует включения (незрелые вирионы), описываемые как "глаз совы".
Вызывает цитомегалию (увеличение) клеток, не приводя к их гибели. Способен при активном течении значительно снижать иммунитет. Возможна трансплацентарная передача вируса с развитием врождённой инфекции.
Культивируется на культуре фибробластов (клеток соединительной ткани) человека. Изменения хромосомного набора клеток не вызывает. Очень чувствительны к ЦМВ клетки плода и новорождённого.
Малоустойчив в окружающей среде, быстро погибает при повышении температуры до 56°С и действии дезинфицирующих средств, теряет заражающие свойства при замораживании. В условиях комнатной температуры способен сохраняться в течение нескольких дней. [1] [3] [4] [8]
Антропоноз. Источник инфекции — только человек (больной различными формами и носитель), причём выделение вируса возможно в течение всей жизни человека и зависит от его индивидуальных иммунологических особенностей. Возможно заражение различными штаммами ЦМВ, роль этого в изменении патологии и клинической картине пока не выяснена.
Механизмы передачи — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой пути), гемоконтактный (парентеральный, при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Факторами передачи вируса выступают слюна (преимущественно), моча, кровь, вагинальный секрет, слёзы, сперма, фекалии, грудное молоко.
Восприимчивость среди населения высокая, наибольшее количество заражённых выявляется в детском и подростковом возрасте, когда происходит повышение контактных взаимодействий между людьми. Во взрослом состоянии ЦМВ инфицировано до 95% населения планеты, которые являются пожизненными носителями вируса. [1] [2] [3] [8]
Симптомы цитомегаловирусной инфекции
Инкубационный период — от 15 дней до трёх месяцев (при манифестной, т. е. явно выраженной форме).
Чаще всего первичное инфицирование протекает или бессимптомно, или по типу ОРЗ нетяжёлого течения. Наблюдаются лёгкая слабость, субфебрилитет (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение лимфатических узлов шеи, увеличение и болезненность слюнных желёз.
Зачастую такие проявления не вызывают настороженности в плане ЦМВ и самостоятельно купируются в течение 1-2 недель — болезнь переходит в стадию латентного течения (носительство).
При инфицировании в более позднем возрасте (взрослые люди), а также у некоторых детей (с нарушением иммунитета) и ослабленных больных заболевание, как правило, протекает с явными морфофункциональными нарушениями и гораздо тяжелее, чем у первой группы лиц. Наблюдается:
- длительная лихорадка с повышением температуры тела до фебрильных цифр (37,5-38,0°С);
- выраженная слабость, недомогание, головные боли;
- дискомфорт и боли в животе в области правого и левого подреберий;
- увеличение и болезненность области слюнных желёз;
- увеличение и чувствительность шейных и углочелюстных лимфоузлов;
Синдром тонзиллита не характерен. Увеличивается печень и селезёнка, значимо изменяются показатели гемограммы и функциональных печёночных проб.
В зависимости от состояния иммунной системы и возможностей её коррекции клинически значимая первичная инфекция у данной группы людей продолжается в течение 1-3 месяцев и, как правило, завершается победой организма над вирусной экспансией с последующим формированием вирусоносительства без каких-либо явных клинических проявлений.
В некоторых случаях (ВИЧ-инфекция, онкологические заболевания, длительный приём цитостатических препаратов, генетические дефекты иммунной системы) может наблюдаться длительное волнообразное течение первичной инфекции или реактивация (обострение) имеющегося носительства вируса (латентной формы). В этом случае отмечается:
- длительная волнообразная лихорадка с повышением температуры тела от субфебрильных до фебрильных цифр;
- общее недомогание;
- чаще генерализованное увеличение всех групп лимфоузлов;
- широкий спектр органной патологии (исходя из пантропизма вируса и индивидуальных особенностей) в виде одиночного или чаще комбинированного поражения слюнных желёз (сиалоаденит), цитомегаловирусного гепатита, поражения глаз, пневмонии, поражения половых органов, пищевода, кишечника, сердца;
- увеличение печени и селезёнки, повышение АЛТ и АСТ, изменения периферической крови вирусного характера (почти всегда).
У беременных первичная инфекция может протекать бессимптомно или с ограниченными клиническими проявлениями (чаще всего). При заражении ребёнка (плода) до родов в зависимости от сроков первичного инфицирования женщины (иногда истинной реактивации ЦМВ при СПИДе) возможно развитие врождённой цитомегаловирусной инфекции.
Риск внутриутробной передачи — до 90% от всех случаев инфицирования на любом сроке беременности. Большинство детей после рождения имеют те или иные последствия цмв-инфекции.
При заражении в ранние сроки беременности высок риск самопроизвольного выкидыша, мертворождения или рождения детей с явными пороками развития (патологии лёгких, головного мозга, почек, сердца, сосудов, органа слуха, психоневрологическими нарушениями). При обследовании у такой группы больных сразу после рождения выявляются низкая масса тела, увеличение печени и селезёнки, желтуха, увеличение всех групп лимфоузлов, высыпания геморрагического характера, различные органные поражения, резкие изменения гемограммы и функциональных тестов. В крови, слюне и моче выявляется вирусная ДНК (в ряде случаев выделение вируса продолжается на протяжении нескольких лет).
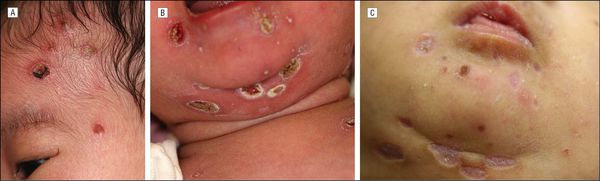
Прогноз серьёзен и зависит от тяжести поражения и объёма проводимых лечебных мероприятий. В более поздние сроки инфицирования беременной вероятность тяжёлых проявлений заболевания существенно ниже, и новорождённые, как правило, не имеют симптомов врождённой ЦМВ-инфекции на начальных этапах после родов, однако это не говорит о полном клиническом благополучии в будущем — возможно поражение нервной системы различной степени выраженности и нейросенсорная тугоухость. Поэтому такие дети нуждаются в обследовании и наблюдении профильных специалистов, а при необходимости — в лечении.
Интересной особенностью является влияние возраста беременной, на котором произошло первичное инфицирование, на частоту передачи инфекции: у женщин до 20 лет риск передачи в три раза выше и не зависит от сроков беременности, а после 20 лет риск внутриутробного инфицирования существенно ниже. [1] [2] [3] [5] [8] [10]
Патогенез цитомегаловирусной инфекции
Входные ворота — слизистая оболочка различных органов, преимущественно ротоглотки и верхних дыхательных путей (также желудочно-кишечного тракта, мочеполовой системы и других органов).
В месте внедрения никаких структурных и воспалительных изменений не наблюдается. После проникновения вируса в организм он атакует свои главные мишени — лимфо- и моноциты, эпителиальные клетки слюнных желёз, лёгких, почек и других органов.
Поражённые клетки увеличиваются в размерах в 3-4 раза (цитомегалия), в ядре клетки формируются включения (незрелые вирионы), в результате чего клетка приобретает вид "совиного глаза". При активном течении болезни развивается депрессия большинства звеньев иммунитета, в том чичле и белка ИНФ-α.
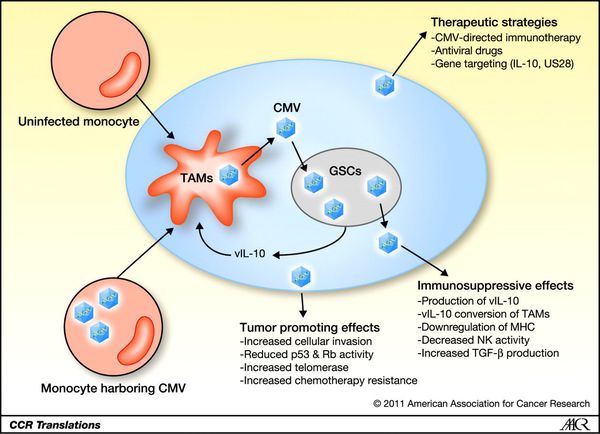
В дальнейшем в ответ на проникновение ЦМВ развивается защитная реакция в виде образования специфических антител различных классов, активации Т-киллеров и развития реакций гиперчувствительности замедленного типа, проявляющейся в поражённых органах образованием узелковых лимфомоноцитарных инфильтратов.
Однако инфицированные клетки не погибают, а продолжают функционировать и выделяют специальный слизисто-белковый секрет, который, обволакивая вирионы, обеспечивает маскировку вируса от иммунной системы человека. Это выражается в слабом иммунном ответе и переходу острого заболевания в длительный латентный процесс (носительство).
При слабой репликации и равновесных отношениях с иммунитетом вирус может длительно (пожизненно) сохранятся в организме в состоянии относительной стабильности, не вызывать никаких органных поражений и не причинять никаких неудобств человеку. Вирусную ДНК при таком состоянии в крови выявить не удаётся, однако в эпителии слюнных желёз и моче вирус можно обнаружить (обычно в незначительном количестве).
При значительном снижении иммунитета (ВИЧ, онкологические заболевания, пересадка органов, длительный приём цитостатиков) происходит активизация вирусной репликации, вирус попадает в кровь и вновь атакует различные органы. [1] [3] [10]
Классификация и стадии развития цитомегаловирусной инфекции
Общепринятой классификации не существует, она разнится в зависимости от особенностей медицинского подхода к проблематике заболевания.
Классификация по клинической форме:
1. Приобретённая ЦМВ:
- латентная — отсутствие клинических проявлений, постановка диагноза возможна только при выполнении лабораторных тестов;
- манифестная — с наличием клинических проявлений и изменением лабораторных показателей:
○ генерализованная (мононуклеозоподобная, лёгочная, церебральная и почечная, печёночный гепатит, с поражением ЖКТ, комбинированного вида);
2. Врождённая ЦМВ:
Отдельно выделяют цитомегаловирусную болезнь у ВИЧ-инфицированных.
Классификация по МКБ-10:
- P35.1 Врождённая цитомегаловирусная инфекция;
- B27.1 Цитомегаловирусный мононуклеоз;
- B25.0 Цитомегаловирусный пневмонит (J17.1*);
- B25.1 Цитомегаловирусный гепатит (K77.0*);
- B25.2 Цитомегаловирусный панкреатит (K87.1*);
- B25.8 Другие цитомегаловирусные болезни;
- B25.9 Цитомегаловирусная болезнь неуточненная.
Классификация по степени тяжести:
- лёгкая — нет явного поражения внутренних органов и изменения их функции;
- среднетяжёлая — умеренно выраженные поражения внутренних органов с нарушением функционирования без критичных сдвигов;
- тяжёлая — ярко выраженные поражения внутренних органов (генерализованный характер с катастрофичными функциональными провалами и развитие осложнений). [1][2][10]
Осложнения цитомегаловирусной инфекции
Осложнения при цитомегалии бывают специфическими неспецифическими.
Специфические осложнения:
- пневмония, плеврит (новое повышение температуры тела, кашель с мокротой и без, боли в груди при кашле, одышка, изменения на ФЛГ);
- миокардит (боли и дискомфорт в области сердца, ощущение перебоев в работе, тахикардия, колебания артериального давления, изменения на ЭКГ);
- артрит (дискомфорт и боли в различных суставах, повышение ревматологических показателей);
- энцефалит (синдромы поражения нервов, появление патологической очаговой симптоматики, нарушения психики);
- синдром Гийена — Барре (нарушения чувствительности и двигательных функций).
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры. Это гнойные осложнения — повышение температуры тела до 41°С, соответствующие симптомы поражения определенных органов, нейтрофильный лейкоцитоз. [1] [3] [9] [10]
Диагностика цитомегаловирусной инфекции
Лабораторная диагностика:
- клинический анализ крови (лейкоцитоз или лейкопения, нейтропения, абсолютные лимфо- и моноцитоз, при остром течении — тромбоцитопения и повышение СОЭ);
- биохимический анализ крови (повышение трансаминаз, преимущественно АЛТ и АСТ, щелочной фосфатазы, ГГТ);
- иммуноферментный анализ крови (выявление антител классов М в острый период и при обострении и появление антител классов G в более поздний период, что свидетельствует о давнем заражении и авидности антител класса G);
- ПЦР диагностика (материал для исследования — кровь, моча, слюна, соскоб эпителия и другие, причём наиболее актуальные показатели при активной стадии даёт именно ПЦР крови, т.к. присутствие вируса в других средах может отражать фазу носительства);
Также проводится инструментальная диагностика:
- УЗИ, КТ и МРТ органов брюшной полости — появление внутренних увеличенных лимфоузлов, увеличение печени и селезёнки, периферических лимфоузлов, слюнных желёз и прочее;
- нейросонография;
- ЭЭГ, ЭКГ и ЭХО-КГ.
Дифференциальная диагностика:
- инфекционный мононуклеоз (ВЭБ-инфекция);
- вирусные гепатиты;
- ОРЗ затяжного течения;
- ВИЧ;
- токсоплазмоз;
- заболевания крови;
- другие герпесвирусные заболевания (герпесы 6,7 типов);
- листериоз, псевдотуберкулёз;
- эпидемический паротит. [1][2][3][6][7]
Лечение цитомегаловирусной инфекции
Лечения больных ЦМВ лёгкой степени тяжести осуществляется в амбулаторных условиях. Больные средней тяжести, тяжёлые пациенты и дети неонатального возраста подлежат стационарному обследованию, наблюдению и лечению.
Питание больных осуществляется согласно тяжести заболевания, проявлениям и возрастному фону. В общем показана диета №5 по Певзнеру с отказом от жирной, жареной, острой и раздражающей пищи, механически и химически щадящие питание.
Принципы терапии должны отвечать следующим требованиям:
- предупреждении прогрессии заболевания;
- предупреждение генерализации инфекции;
- предупреждение инвалидизации и остаточных явлений.
С учётом индивидуальных особенностей проводится этиотропная терапия, направленная на ослабление вируса, прекращение его генерализованной циркуляции (персистенции) и патогенного потенциала.
В зависимости от условий могут применяться специфические цитомегаловирусные иммуноглобулины, специфические противовирусные препараты прямого противоцитомегаловирусного действия (в основном в условиях реанимации и интенсивной терапии).
В целях повышения сопротивляемости организма показано назначение средств иммунокоррекции и иммунотерапии, патогенетическое и симптоматическое лекарственное обеспечение.
Важно отметить, что заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека, т.е. иммунная система среднестатистического жителя планеты способна самостоятельно найти достойный выход из ситуации. Это определяет основную лечебно-диагностическую тактику при выявлении активной (острой) ЦМВ-инфекции (при отсутствии тяжёлого течения и осложнений) — это здоровое питание, полноценный отдых и динамическое наблюдение. Лишь в случаях упорного течения и выраженных отклонений клинико-лабораторного характера следует подключать средства медикаментозного лечения.
После выписки за переболевшими устанавливается диспансерное наблюдение в течении 6-12 месяцев с периодическими осмотрами профильных специалистов и обследованием, объём и кратность которого определяется лечащим врачом. [1] [2] [5] [8] [10]
Прогноз. Профилактика
Прогноз, как правило, благоприятный (переход в неактивное носительство ).
Специальной профилактики заражения не существует.
В очаге заболевания противоэпидемические мероприятия не проводятся, карантина нет.
После клинического выздоровления дети допускаются в коллективы без ограничительных мероприятий.
В целях выявления источников повышенной опасности ЦМВ проводятся обследования донорам крови, органов и тканей, а также беременным женщинам. Если беременная не имеет специфических антител IgG к ЦМВ, за ней следует установить более тщательное наблюдение с трёхкратным обследованием на ЦМВ за время беременности. В это время ей следует по возможности минимизировать общение с детьми, не пользоваться чужой посудой и не целоваться с новыми людьми.
Рекомендовано назначение профилактического лечения больным СПИДом и после трансплантации органов препаратами прямого противовирусного действия.
Вакцина для предотвращения врождённого ЦМВ находится в стадии разработки. [1] [2] [9]

Общий анализ крови (ОАК) - один из важнейших диагностических методов, тонко отражающих реакцию кроветворных органов на воздействие различных физиологических и патологических факторов. Данные, полученные при его выполнении, представляют собой интегральные показатели состояния гемопоэтической системы, зрелые элементы которой осуществляют основные защитные функции организма и принимают активное участие во всех видах обмена [7].
Количественные и качественные изменения форменных элементов крови характерны для многих инфекционных заболеваний как бактериальной, так и вирусной этиологии. Наиболее выраженные изменения в периферической крови наблюдаются при герпетических инфекциях, кори, краснухе, ВИЧ-инфекции, вирусных гепатитах и др. [1].
Инфекционный мононуклеоз - острое инфекционное заболевание, вызываемое герпетическими вирусами 4, 5, 6-го типов, характеризующееся лихорадочным состоянием, ангиной, увеличением лимфатических узлов, печени и селезенки [5].
В настоящее время инфекционный мононуклеоз следует считать полиэтиологическим заболеванием. Согласно МКБ -10 выделяют: инфекционный мононуклеоз, вызванный гамма-герпетическим вирусом Эпштейн-Барр (В27.01); цитомегаловирусный мононуклеоз (В27.1);
другой инфекционный мононуклеоз (В27.8); инфекционный мононуклеоз неуточненный (В27.9).
Основными проявлениями инфекционного мононуклеоза, определяющими его сущность и название, служат изменения в периферической крови, которые возникают в первые дни болезни и достигают максимума в ее разгар. Это умеренный лейкоцитоз, увеличение количества одноядерных элементов крови (лимфомоноцитоз), умеренное повышение СОЭ [8]. В начале болезни у большинства больных значительно снижается содержание сегментоядерных нейтрофилов и увеличивается количество палочкоядерных. Самым характерным признаком инфекционного мононуклеоза является наличие атипичных мононуклеаров, которые появляются в разгар болезни и сохраняются 2-3 недели. На ранних стадиях - это В-лимфоциты, содержащие специфические иммуноглобулины в цитоплазме. В последующие стадии большую часть атипичных мононуклеаров составляют Т-клетки [2].
Диагностическое значение имеет увеличение количества атипичных мононуклеаров с широкой цитоплазмой не менее чем до 10-12%, хотя число этих клеток может достигать 80-90%. Следует заметить, что отсутствие атипичных мононуклеаров при характерных клинических проявлениях заболевания не противоречит предполагаемому диагнозу, поскольку их появление в периферической крови может задерживаться до конца 2-3-й недели болезни [4].
При обследовании детей с инфекционным мононуклеозом анализ крови обычно включает определение количества эритроцитов, лейкоцитов, тромбоцитов, ретикулоцитов, подсчёт лейкоцитарной формулы, определение концентрации гемоглобина, СОЭ, вычисление цветового показателя и гематокрита (Ht).
Данные общего анализа крови позволяют получить комплексное представление о тяжести течения инфекционного мононуклеоза, наслоении бактериальной инфекции, эффективности проводимой терапии.
Цель исследования - выявление закономерностей изменения показателей периферической крови у детей при инфекционном мононуклеозе различной этиологии.
Материалы и методы исследования
Под нашим наблюдением находилось 140 детей с инфекционным мононуклеозом в возрасте от 1 до 15 лет, проходивших стационарное лечение в Волгоградской областной детской клинической инфекционной больнице. Верификацию возбудителя осуществляли с помощью молекулярно-генетического (ПЦР) метода исследования. Также всем больным проводилось комплексное обследование, которое включало в себя общеклинические (сбор анамнеза, осмотр, пальпацию, перкуссию, аускультацию) и лабораторно-инструментальные методы: общие анализы крови и мочи, биохимические тесты (АЛТ, АСТ, коэффициент де Ритиса, тимоловые пробы), УЗИ органов брюшной полости.
С целью определения степени интоксикации и выраженности гнойно-воспалительного процесса в ротоглотке при инфекционном мононуклеозе у детей производили расчёт лейкоцитарного индекса интоксикации (ЛИИ). Определение ЛИИ имело важное значение как для контроля за лечением, так и для прогноза заболевания.
Существует несколько способов расчета лейкоцитарного индекса интоксикации. Нами была выбрана формула В.К. Островского (1983), в которой в числителе находится сумма процентного содержания клеток миелоидного ряда, а в знаменателе - сумма остальных клеток белой крови [6].
Формула расчёта ЛИИ,
где: ПК - плазматические клетки, миел. - миелоциты, ю. - юные, п. - палочкоядерные, с. - сегментоядерные, Лимф. - лимфоциты, мон. - моноциты, э. - эозинофилы, б. - базофилы.
Результаты и их обсуждение
Данные, полученные при исследовании носоглоточной слизи и сыворотки крови у 140 детей методом ПЦР, показали, что на долю классического ИМ, вызванного Эпштейн-Барр вирусом (ЭБВ), приходилось 74,3% всех случаев. У 1/3 детей мононуклеоз был обусловлен другими возбудителями: в 9,2% - цитомегаловирусом (ЦМВ), в 8,6% - микст-инфицированием ЦМВ и ЭБВ, у 7,9% детей этиологию заболевания установить не удалось.
Далее нами был проведен анализ гемограмм наблюдаемых детей с учетом этиологии заболевания. Полученные данные представлены в табл. 1 и 2.
Таблица 1 - Частота встречаемости патологических изменений показателей ОАК при инфекционном мононуклеозе различной этиологии
Таблица 2 - Средние значения патологических показателей ОАК при инфекционном мононуклеозе различной этиологии
Сниж. гемоглобина (г/л)
Повыш. гемоглобина (г/л)
Сниж. гематокр. (г/л)
Ускорение СОЭ (мм/час)
Оценка данных таблиц показала, что при Эпштейн-Барр вирусном мононуклеозе лейкоцитоз отмечался у 43,3% больных, лейкопения - у 2,9%. Количество лейкоцитов колебалось в широких пределах - от 4,0х109 г/л до 32,7х109 г/ л и в среднем составляло 16,3±5,3х109 г/л. Характерным для ИМ-ЭБВ этиологии изменением в периферической крови было снижение сегментоядерных нейтрофилов (в среднем до 18,1±8,2%), что отмечалось у 39,4% детей. Нейтрофилез встречался редко и был зафиксирован только у 7,7% больных. В 16,3% случаев у детей с ИМ-ЭБВ этиологии в ОАК отмечался палочкоядерный сдвиг влево. Количество палочкоядерных нейтрофилов колебалось от 0 до 42%, составляя в среднем - 11,4±8,9%.
Процентное содержание лимфоцитов в периферической крови у детей было разнообразным и варьировало от 2,0 до 85,0%. Лимфоцитоз, при сравнении с нормальными возрастными показателями, был выявлен у 21,2% обследованных, лимфопения - у 15,4%. Нарастание моноцитов отмечалось у 23,0% детей, их среднее значение составило - 15,6±3,3%.
Наличие в периферической крови атипичных мононуклеаров при инфекционном мононуклеозе Эпштейн-Барр вирусной этиологии являлось кардинальным симптомом и встречалось в 74,0% случаев. Количество плазматических клеток было разнообразным и в большинстве случаев зависело от сроков заболевания. Так, у 39,4% больных их значение не превышало 10% и в среднем равнялось 5,5±2,8%. У 34,6% - количество атипичных мононуклеаров в крови было более 10% и имело среднее значение - 21,9±1,7%.
Тромбоцитопения была частым симптомом ЭБВ-инфекции и выявлялась у 52,9% больных. Значение показателей тромбоцитов колебалось в пределах от 81х109 до 173х109 г/л и в среднем составляло 131±14,5х109 г/л.
Ускорение СОЭ отмечалось у 34,6% детей при ЭБВ-инфекции. Значения данного показателя были разнообразными и колебались от 13 до 50 мм/час, в среднем составляя 24±10,9 мм/час.
Цитомегаловирусная инфекция была подтверждена у 13 детей, поступавших в стационар с диагнозом инфекционный мононуклеоз. Характерными особенностями ОАК крови при ЦМВ-инфекции были: значительный лейкоцитоз со сдвигом влево и повышением общего количества лейкоцитов до 17,5±6,6х109 г/л, который наблюдался у 1/3 больных, нейтропения (у 23,0%), лимфоцитоз (23,0%), эритроцитоз (30,8%), гипохромная анемия (30,8%), тромбоцитопения (53,8%), выраженное снижение гематокрита, в среднем до 25,7 ±1,2 г/л, что наблюдалось у 61,5% детей. Обращала на себя внимание высокая частота встречаемости атипичных мононуклеаров в периферической крови у больных цитомегаловирусной инфекцией (84,6%), причем их количество в подавляющем большинстве случаев превышало 10% и в среднем составляло 17,5±2,1%.
СОЭ при ЦМВ-инфекции чаще соответствовало возрастной норме, ее ускорение отмечалось лишь у 23,0% детей.
Инфекционный мононуклеоз, обусловленный одновременным инфицированием Эпштейн-Барр и цитомегаловирусом, был диагностирован у 12 детей. Изменение показателей ОАК при микст-инфекции также имело характерные особенности: лейкопения за счет снижения сегментоядерных нейтрофилов, что выявлялось в 33,3% случаев, выраженный лимфоцитоз (у 33,3%) с повышением количества лимфоцитов в среднем до 74,3±13,2%, нормальное содержание моноцитов. Атипичные мононуклеары при микст-инфекции обнаруживались в крови у 33,3% больных, что было вдвое реже, чем при изолированных Эпштейн-Барр и ЦМВ-инфекциях. Их количество в подавляющем большинстве случаев не превышало 10% и в среднем соответствовало 8,2±2,4%.
Характерной особенностью инфекционного мононуклеоза смешанной этиологии была высокая частота встречаемости ускоренной СОЭ, что было выявлено у 58,3% больных. Данный показатель колебался в пределах от 13 до 40 мм/час, в среднем составляя 21±9,9 мм/час.
СОЭ была ускоренной у 54,5% детей, колебалась в пределах от 15 до 36 мм/час, в среднем не превышала 21±7,9 мм/час.
Для оценки степени интоксикации и выраженности гнойно-воспалительного процесса в ротоглотке при инфекционном мононуклеозе у детей мы производили расчёт лейкоцитарного индекса интоксикации (табл. 3).
Таблица 3 - Значение лейкоцитарного индекса интоксикации при инфекционном мононуклеозе различной этиологии
Читайте также:


