Цитомегаловирусная инфекция проявления в полости рта
В.Н. Почтарь, А.Б. Македон, В.Я. Скиба
Институт стоматологии АМН Украины
Резюме. Данная статья является обобщением опыта обследования больных с различными заболеваниями слизистой оболочки полости рта с преимущественным вирусным этиологическим фактором: герпетические высыпания могут возникать на любом участке кожного покрова и слизистых оболочек. Независимо от их локализации, реактивация оказывает одинаковое негативное действие на организм человека в целом (дисбаланс системы иммунитета, психоэмоциональные нарушения, возможность развития системных форм заболевания, злокачественных новообразований и т. д.).
Ключевые слова: вирусная инфекция, вирус герпеса человека, острый герпетический стоматит, слизистая оболочка полости рта, вирусные папилломы, цитомегаловирус, вирус Эпштейна-Барра.
В настоящее время опубликован ряд научных работ, посвященных взаимосвязи герпесвирусной и бактериальной инфекций при заболеваниях полости рта [7, 16, 17].
Открыто 80 представителей семейства Herpesviriolae, из которых около восьми являются патогенными для человека и подразделяются, в свою очередь, на α-, β-, γ-герпесвирусы [8, 1].
Четыре из них ассоциируются с возникновением язвенных поражений на слизистой оболочке полости рта: вирус простого герпеса I типа (ВПГ-1 или ВГЧ-1); вирус герпеса человека II типа (ВПГ-2 или ВГЧ-2); вирус герпеса человека V типа (ВГЧ-5) – цитомегаловирус (ЦМВ) и вирус опоясывающего герпеса (ВОГ) [10, 19].
Все более возрастающий интерес к проблеме простого герпеса (ПГ) со стороны клиницистов различных специальностей связан с рядом объективных моментов.
ВИРУСНАЯ ИНФЕКЦИЯ ПРИ СТОМАТИТАХ
Во-первых, с отмечаемым в последнее время резким нарастанием инфицированности населения и значительным увеличением частоты встречаемости клинических проявлений инфекции в полости рта.
Во-вторых, с пониманием сложности патогенеза ПГ и неоднородности механизмов формирования иммунных нарушений, как лежащих в основе рецидивов вирусного процесса, так и ведущих к развитию ассоциированных с ВПГ заболеваний [10,21].
В-третьих, с крайне выраженным клиническим полиморфизмом ПГ – от ограниченных поражений кожи, слизистых и конъюнктивы глаз до системных, генерализованных форм с вовлечением в вирусный процесс жизненно важных внутренних органов, а также развитием на фоне хронической персистенции ВПГ злокачественных новообразований [2, 3].
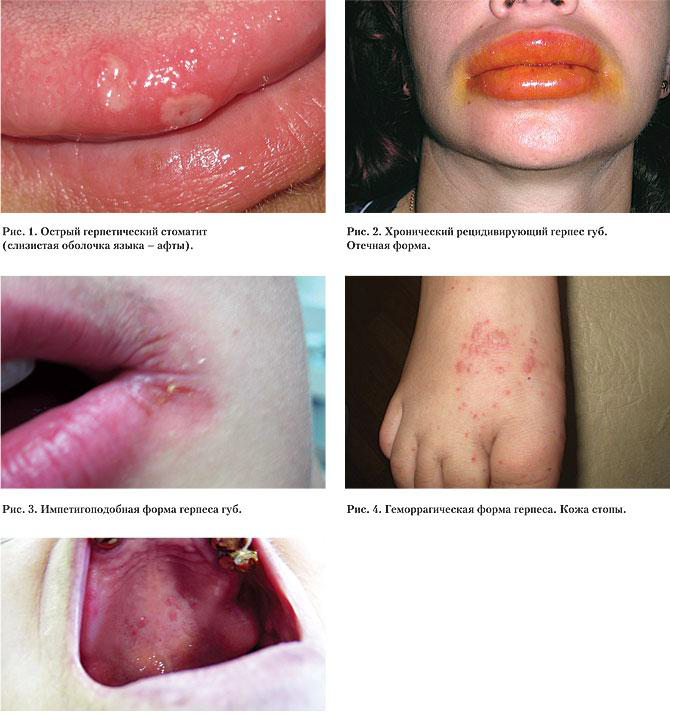
Наблюдения стоматологов, дерматологов и других специалистов позволили сегодня говорить о существенных изменениях клинической картины данного заболевания и выделить целый ряд редких, атипичных форм заболевания, которые часто представляют значительные диагностические трудности [18, 19, 21], а именно: геморрагическую, геморрагически-некротическую, язвенную, отечную, элефантиазоподобную, рупиоидную, зудящую, эритематозную и папулезную, герпетиформную экзему Капоши, генерализованный герпес (рис. 1, 2, 3, 4, 5).
случаях определяются рецидивирующее течение, высыпания на фоне предвестников и локализация поражения на одних и тех же местах. Высыпания без лечения регрессируют в течение 7–10-ти дней без тенденции к распространению и диссеминации.
В таких случаях необходимо исключить либо установить герпетическую природу дерматоза периоральной зоны (обнаружение ВПГ в содержимом пузырей: ПЦР-диагностика).
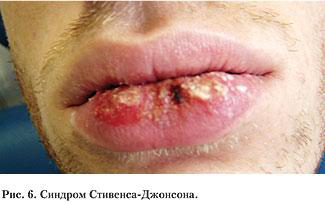
В последние 10–15 лет клиническое наблюдение за больными с синдромом Стивенса-Джонсона как тяжелым вариантом течения многоформной экссудативной эритемы также дает основания предполагать вирусную инициирующую природу этого заболевания. Специалистам известны две формы проявления синдрома Стивенса-Джонсона (рис. 6). Одна из них – тяжелый вариант идиопатической многоформной экссудативной эритемы. Ее развитие может быть обусловлено вирусом простого герпеса, Micoplasma pneumonie, вирусом Коксаки, паротита, гистоплазмы, тифозной, дифтерийной, туберкулезной палочки, гемолитического стрептококка, Chlamidia trahomatis и др. [9, 13]. Вторая форма – тяжелый вариант токсико-аллергической реакции.
Большинство авторов – А.Ю. Родин и Г.В. Еремина, Г.М. Цветкова и В.Н. Мордовцев предполагают генетическую предрасположенность организма к развитию синдрома Стивенса-Джонсона [6].
Клинические проявления данного синдрома в полости рта характеризуются острым развитием – в течение нескольких часов, иногда 2–3-х суток. В 100 % случаев они проявляются пузырями, вскрывающимися с образованием эрозии, быстро покрывающимися серовато-белым налетом, такие же эрозии возникают и на красной кайме губ. В 5–7 % случаев поражаются слизистые половых органов, развиваются явления вульвовагинита, в 91 % случаев отмечаются поражения глаз. Высыпания на коже обычно представлены диссеминированно располагающимися эритематозно-папулезными элементами, имеющими багровый периферический край и слегка запавший синюшный центр. Течение синдрома Стивенса-Джонсона продолжается 2–6 недель. Основное место в лечении больных с данным синдромом занимают кортикостероидные препараты. Однако при инфекционном генезе заболевания кортикостероиды используют в сочетании с антибактериальной терапией и противовирусными препаратами. D.F. Detjen, R. Patterson и другие авторы описали хороший терапевтический эффект применения преднизолона с ацикловиром и другими противовирусными препаратами [11, 13, 20].
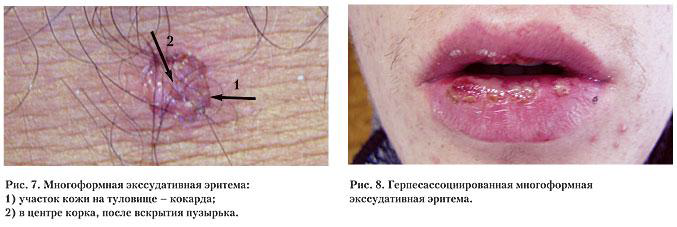
Как простой герпес, так и герпесассоциированная многоформная эритема характеризуются хроническим течением, при этом частота обострений может быть различной – от ежемесячных до 1–2-х раз в год. Степень тяжести заболеваний в первую очередь зависит от выраженности нарушений иммунитета, контролирующего латентное состояние ВПГ в организме человека [4, 7] (рис. 7, 8).
Все вышеизложенное имеет не только теоретический интерес, но и во многом определяет тактику и стратегию лечения больных, что является наиболее важной практической задачей.
Анализ современных подходов к терапии острого герпетического, хронического рецидивирующего стоматита, папилломавирусной инфекции, герпесассоциированной МЭЭ позволяет говорить, что сегодня существуют два ее приоритетных направления – иммунное и этиотропное, оба из которых патогенетически обоснованны.
Клинические формы папилломавирусной инфекции, в частности слизистой оболочки полости рта, играют важную роль в диагностике и установлении окончательного диагноза заболевания.
HPV 13, 32 – папилломы слизистой оболочки полости рта. Папилломы слизистой оболочки полости рта (локальная эпителиальная гиперплазия – болезнь Бека, папилломатозный невус) – сосочковидные разрастания на слизистой оболочке полости рта белесовато-розового цвета, имеют широкое основание.
Диагностика типичных проявлений ПВЧ не вызывает затруднений, трудным является их определение на ранних стадиях. Основным методом диагностики атипичных разновидностей является гистологическое исследование с обнаружением койлоцитарных клеток в биоптате, а также метод цепной реакции с полимеразой ПЦР с определением типа вируса.
При стоматоскопии пациентов с жалобами на сухость полости рта не исключена роль хронической инфекции вирусами гепатитов.
Необходимо также учитывать роль вирусов как индукторов аутоиммунного ответа при болезни Шегрена. Потенциальными кандидатами на роль триггеров в этиопатогенезе Шегрена в настоящее время считаются герпесвирусы: вирус Эпштейна-Барра – EBV, герпесвирус VI типа – HHV-6, а также вирусы гепатита В (HBV) и С (HCV) и другие [12].
При первичном осмотре у врача-стоматолога необходимо дифференцировать инфекционный мононуклеоз.
Вирусы герпеса являются лимфотропными агентами. Этиология данного заболевания обусловлена герпесвирусами типа Эпштейна-Барра (ВЭБ, EBV) и цитомегалии (ЦМВ). В настоящее время с помощью современных молекулярно-генетических и серологических методов исследований установлено, что мононуклеозоподобный синдром может быть вызван не только ВЭБ, но и другими возбудителями: вирусом простого герпеса I типа, цитомегало-вирусом, вирусами гриппа А и В, вирусом герпеса человека VI типа, токсоплазмами [16]. Эта ситуация требует обязательного определения причины ИМ в связи с принципиальными различиями в прогнозе заболевания и стратегии терапии. ИМ – антропонозное заболевание с преимущественно капельным механизмом передачи, характеризующееся интоксикацией, лихорадкой, аденопатией и вироцитозом периферической крови.
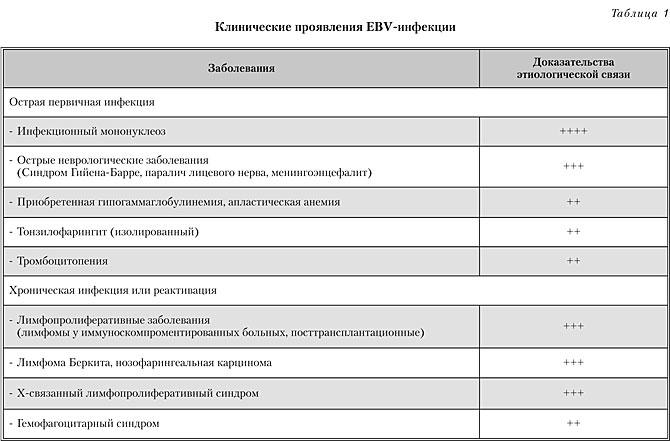
Первичная EBV-инфекция у детей разного возраста чаще бессимптомная (табл. 1). Инкубационный период 2–7 недель. Типичный симптомокомплекс – лихорадка, тонзиллофарингит, лимфаденопатия. В 1/3 случаев появляется налет на миндалинах, в 5 % случаев ассоциируется с стрептококковой инфекцией (b-гемолитический стрептококк группы А).
Значительная лимфаденопатия – характерный признак инфекционного мононуклеоза. Увеличиваются шейные лимфатические узлы (передние и задние), возможна генерализованная лимфоденопатия с поражением подчелюстных, подязычных, подмышечных, паховых, надключичных и локтевых лимфатических узлов. Лимфатические узлы увеличены симметрично, при пальпации болезненны.
Слизистая оболочка полости рта может быть гиперемирована, отечна. В области миндалины пузырьки от одного до десяти с прозрачным содержимым. Пузырьки могут сливаться и через 2–3 дня лопаются, формируя эрозии яркокрасного цвета с фестончатыми краями. Эрозии покрыты фибринозным налетом. Может диагностироваться катаральный или язвенный гингивит.
В первые три недели заболевание у 50 % больных сопровождается спленомегалией, болью в животе. Может регистрироваться пятнисто-папулезная сыпь у 3–15 % пациентов. У 25–50 % детей отличается энантема на мягком небе.
При этих заболеваниях возможен широкий спектр осложнений, таких как: разрыв селезенки, обструкция верхних дыхательных путей, неврологические гематологические осложнения, гепатит, миокардит, психические реакции, а также Х-связанный лимфо-пролиферативный синдром, опухоли, ассоциированные с вирусом Эпштейна-Барра.
Общий анализ крови: отмечаются лимфоцитоз и наличие атипичных лимфоцитов более 10 %, лейкоцитоз 10,0–20,0 ґ 109/л. Умеренная тромбоцитопения проявляется у более чем 50 % больных. Гематологические изменения характеризуются увеличением количества моноцитов, атипичных мононуклеаров и палочкоядерных нейтрофилов.
Эпштейн-Барр-вирусная инфекция стимулирует поликлональную продукцию антител, инфицированных b-лимфоцитами, в том числе транзиторную продукцию гетерофильных антител, которые относятся к классу IgM и появляются на 1–2 недели заболевания. Титр снижается на 2–3-й месяц. А через шесть месяцев у большинства больных они исчезают. Однако у 20 % больных гетерофильные анти-тела определяются в течение 1–2-х дней.
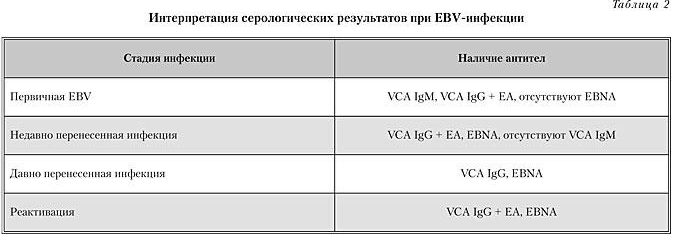
Серологическая диагностика EBV-инфекции необходима для подтверждения EBV-инфекции или ранее перенесенного заболевания (табл. 2). Такая диагностика важна при атипичных формах инфекционного мононуклеоза, лимфопролиферативных заболеваниях, тяжелом, длительном течении, при отсутствии гетерофильных антител. С диагностической целью определяются антитела к следующим вирусным антигенам: капсидного (VCA), ранних (ЕА) и ядерного (EBNA).
У некоторых пациентов с атипичным течением болезни серологическая диагностика может быть недостаточной. Для определения генома вируса или его антигенов используются ПЦР-реакция в плазме крови, иммунный блотинг, ДНК-гибридизация [5, 14].
Подводя итог сказанного, следует подчеркнуть, что знания о роли герпетиформных вирусов в этиологии воспалительных заболеваний слизистой оболочки полости рта и челюстно-лицевой области представляются важными для более полного пони-мания механизмов их развития.
Накопленный научный и практический материал предопределяет своевременную диагностику вирусологического этиологического фактора. Возникает необходимость обязательных молекулярно-генетических и серологических исследований и содружество со специалистами: инфекционистом, дерматологом, иммунологом, гематологом, онкологом. Данный подход обеспечит своевременную диагностику и позволит определить стратегию успешного плана лечения.
1. Ершов Ф.И. Антигерпетики // Герпес. – 2006. – № 1. – С. 5–11.
2. Иванищев В.Н. Дерматологические проявления ВИЧ-инфекции. Саркома Капоши-СПИД-индикаторное заболевание // Клінічна імунологія. Алергологія. Інфектологія. – № 2 (13). – 2008. – С. 72–75.
3. Кубанов А.А., Кисина В.И. Частота и характер фоновых и диспластических процессов шейки матки при бактериальных и вирусных инфекциях // Вестник дерматологии и венерологии. – Москва. – 2003. – № 2. – С. 43–46.
4. Новиков Д.К. Противовирусный иммунитет // Иммунопатология, аллергология инфектология. – 2002. – № 1. – С. 5–14.
5. Прохорова Н.А., Волчкова Е.В., Михайловская Г.В. и др. Клиническое значение молекулярно-генетических и серологических исследований в диагностике инфекционного мононуклеоза // Инфекционные болезни. – Москва. – 2008. – Т. 6. – № 2. – С. 17–20.
6. Родин А.Ю., Еремина Г.В. К вопросу о патогенезе синдрома Стивенса-Джонсона // Вестник дерматологии. – 1993. – № 5. – С. 32–34.
7. Солошенко Э.Н. Основные принципы рационального применения иммунотропных средств при комплексном лечении больных распространенными дерматозами и инфекциями, передающимися половым путем // Український журнал дерматології, венерології, косметології. – 2003. – № 2. – С. 41–45.
8. Шульженко А.Е. Герпетические инфекции человека: перспективы диагностики и противовирусной терапии // Герпес. – 2006. – № 1. – С. 51–58.
9. Юлдашев У.И., Дымерец Е.М. // Клиническая медицина. – 1978. – 126 с.
10. Deepak Kademani, BDS, DMD, Michael Click, DMD. Изъязвления в полости рта у ВИЧ-инфицированных пациентов: клиническое проявление, диагностика, лечение и прогрессирование заболевания // Квинтэссенция. – Москва. – 1999. – № 1. – С. 49–61.
11. Detjen D.F., Patterson R. et al. // Arch. Intern. Med. – 1992. – Vol. 152. – Р. 1513–1516.
12. Ferguson M.M. // New Zealand Family Practice. – 2002. – Vol. 29. – № 4. – Р. 259–265.
13. Hafb J.C. Principles and practice of Dermatology // Eds. W.M. Sams, P.J. Zynch. – 2-d ed. – New York. – 1996. – Р. 483–490.
14. Hess R.D. Routine Epstein-Barr virus diagnostics from the laboratory perspective: still challenging after 35 years // J. of Clinical Microbiology. – 2004. – № 7. – Р. 3381.
15. Kamma J.J., Slots J. Herpesviral-bacterial interactions in aggressive periodontitis // J. Clin. Periodontol. – 2003. – 30. – № 5. – Р. 420–426.
16. Sabeti M., Simon J.H., Nowrari H., Slots J. Cytomegalovirus and Epstein-Barr virus active infection in periapical lesions of teeth with intact crowns // Endodontics. – 2003. – 29. – № 5. – Р. 321–323.
17. Sabeti M., Simon J.H., Slots J. Cytomegalovirus and Epstein-Barr virus are associated with symptomatic periapical pathosis // Oral Microbiol. Immunol. – 2003. – 18. – № 5. – Р. 327–328.
18. Максимова О.П. Лечение хейлита у детей и взрослых // Клиническая стоматология. – М. – 2001. – №1. – С. 18–21
19. Банченко Г.В., Рабинович И.М. Проявление специфических заболеваний в полости рта // Труды V съезда Стоматологической ассоциации России. – Москва. – 1999. – С. 180–182.
20. Рабинович И.М., Герчиков Л.Н., Банченко Г.В. Пиралвекс в патологии слизистой оболочки полости рта // Стоматология для всех. – М. – 2000. – № 1. – С. 34–36.
21. Рабинович И.М., Банченко Г.В. Поражения слизистой оболочки полости рта у ВИЧ-инфицированных больных // Клиническая стоматология. – М. – 1999. – № 3. – С. 48–50.
Монография предназначена для студентов стоматологического факультета, клинических ординаторов, врачей-интернов, практических врачей. В монографии представлены этиология, эпидемиология, патогенез, клиника, диагностика, современные методы лечения, профилактика герпесвирусной и энтеровирусной инфекций.
В последние годы наблюдается тенденция к увеличению числа заболеваний слизистой оболочки полости рта, этиологически связанных с вирусами. До настоящего времени в стоматологической практике диагностика и лечение вирусных поражений полости рта представляет определенные трудности.
Герпетическую инфекцию считают важной медико-социальной проблемой современного здравоохранения. Герпетическая инфекция в целом относится к числу самых распространенных и плохо контролируемых. По данным ВОЗ, среди вирусных инфекций заболевания, обусловленные герпесвирусами, занимают второе место после гриппа.
Большинство вирусов попадает в организм человека через полость рта и носоглотку. Это входные ворота инфекции. Поражения слизистой оболочки полости рта встречаются как у взрослых, так и у детей, причем, не только как симптомы при заболеваниях вирусной природы (корь, паротит, грипп), но и как самостоятельные патологические процессы в виде различных форм фарингитов, ангин, стоматитов, вызванных различными вирусами.
Представители семейства герпесвирусов распространены во всех регионах мира, поражая 60–93 % населения, как в развитых, так и в развивающихся странах. Специалисты Европейского регионального бюро ВОЗ пришли к выводу, что герпесвирусные инфекции будут определять в XXI веке будущее инфекционной патологии.
По данным литературы, общая зараженность герпесвирусами колеблется от 50 до 100 %, что делает герпесвирусные заболевания социально значимыми. Вирус относится к умбиквитарным вирусам, он постоянно циркулирует среди населения земного шара, практически инфицируя всех без исключения. Герпетической инфекцией болеет одна треть населения земного шара, и свыше половины таких больных за год переносят несколько атак заболевания, в том числе нередко с проявлениями в полости рта. С каждым годом увеличивается заболеваемость острым (первичным) герпетическим стоматитом.
За последние 50 лет выделено и классифицировано свыше 100 представителей отдельных герпесвирусов, исходя из общности их структурных и генетических характеристик. В настоящее время в соответствии с решением Комитета экспертов по таксономии и классификации вирусов, семейство герпесвирусов включает в себя три подсемейства: α, β, γ.

Альфа-герпесвирусы характеризуются широким спектром хозяев, коротким циклом репликации, способностью к эффективному разрушению инфицированных клеток и развитию латентной инфекции в сенсорных ганглиях. Бета-герпесвирусы имеют ограниченный круг хозяев и длительный цикл репликации, вызывают возникновение манифестной и латентной инфекции в слюнных железах, почках и других тканях. Гамма-герпесвирусы имеют ограниченный круг хозяев, инфицируют Т- и В-лимфоциты, хотя репродуцируются в основном в В-клетках.
Следует отметить возможную роль вирусов герпеса (в ассоциации с папиловирусом, цитомегаловирусом, хламидиями и микоплазмами) в развитии неопластических процессов у человека.
Особая актуальность проблемы герпесвирусных инфекций связана с появлением больных СПИДом. Доказано, что вирусы герпеса могут активировать ВИЧ, находящихся в стадии провируса, и являются кофактором прогрессирования ВИЧ-инфекции и СПИДа. В этой связи герпетическая инфекция является одним из важных СПИД-индикаторных заболеваний.
Вирусы герпеса индуцируют процессы атеросклероза, где вирус герпеса, возможно, выступает в ассоциации с цитомегаловирусом.
Впервые на роль герпесвируса при заболеваниях слизистой оболочки полости рта указал еще в начале XX века Н.Ф. Филатов (1902). Он предположил возможную герпетическую природу самого распространенного среди детей острого афтозного стоматита. Доказательства эти были получены позднее, когда в эпителиальных клетках пораженных участков слизистой оболочки полости рта стали обнаруживать антигены вируса простого герпеса.
По международной классификации болезней и проблем, связанных со здоровьем, последнего (десятого) пересмотра (МКБ 10, Женева, 1995), заболевание регистрируется как острый герпетический стоматит (ОГС).
Острый герпетический стоматит не только занимает первое место среди всех поражений слизистой оболочки полости рта, но и входит в лидирующую группу среди всех инфекционных заболеваний. При этом у каждого 7–10-го ребенка острый герпетический стоматит рано переходит в хроническую форму с периодическими рецидивами.
Энтеровирусные инфекции человека представляют собой острые самостерилизующиеся болезни, вызываемые энтеровирусами – полиовирусами, вирусами Коксаки и ЕСНО. Актуальность изучения энтеровирусной инфекции, вызванной вирусом Коксаки и ЕСНО, обусловлена широкой циркуляцией возбудителей среди населения, специфической тропностью вирусов к иммунокомпетентным клеткам, отсутствием средств специфической профилактики и этиотропной терапии.
Среди энтеровирусов, патогенных для человека, выделяют 23 типа вируса Коксаки А, 6 типов Коксаки В, 31 тип вирусов ЕСНО и 4 энтеровируса типов 68–71. Некоторые из вирусов вызывают лишь единичные спорадические случаи заболеваний при широко распространенном носительстве среди здорового населения.
Клинический полиморфизм энтеровирусной инфекции приводит к тому, что больные попадают в поле зрения врачей различных специальностей, в том числе и стоматологов, диагноз зачастую носит топический характер и этиопатогенетическое лечение теряет необходимые четкие очертания, что является одной из наиболее типичных врачебных ошибок.
В монографии нашли отражение современные данные литературы и личный врачебный опыт авторов. Она преследует цель восполнить пробел и помочь врачам в вопросах этиологии, эпидемиологии, патогенеза, клиники, диагностики, лечения, профилактики заболеваний, вызываемых герпес- и энтеровирусами человека.

Дата публикации: 17.03.2015 2015-03-17
Статья просмотрена: 535 раз
На сегодняшний день издано целый ряд научных работ, которые посвящены взаимосвязи герпесвирусной инфекции и бактериальной инфекции при заболеваниях полости рта [7,16,17]. Открыто 80 представителей семейства Herpesviriolae, из которых около восьми есть патогенными для человека и подразделяются, в свою очередь, на α-,β-,γ- герпесвирусы [8,1]. Четыре из них ассоциируются из возникновением язвенных поражений на слизистой оболочке полости рта: вирус простого герпеса І типа (ВПГ-1 или ВГЧ-1); вирус герпеса человека Vтипа (ВГЧ-5) — цитомегаловирус (ЦМВ) и вирус опоясывающего герпеса (ВОГ) [10,19].
Все больший интерес возникает к проблеме простого герпеса (ПГ) со стороны клиницистов разных специальностей связанный с рядом объективных моментов. Во-первых, с отмеченным в последнее время нарастанием инфицирования населения и значительным увеличением частоты клинических проявлений инфекции в полости рта. Во-вторых, с пониманием важности патогенеза ПГ и неоднородности механизмов формирования иммунных нарушений, как основы рецидивов вирусного герпеса, так и ведущих к развитию ассоциированных с ВПГ заболеваний [10,21]. В-третьих, с выраженным клиническим полиморфизмом ПГ — от ограниченных поражений кожи, слизистых оболочек и конъюнктивы глаз к системным, генерализированным формам с привлечением в вирусный процесс жизненно важных внутренних органов, а также развитием на фоне хронической персистенции ВПГ злокачественных новообразований [2,3].
За последние 15–20 лет наблюдения за синдромом Стивенса-Джонсона как тяжелым вариантом течения многоформной экссудативной эритемы также дает основу считать инициацию вирусной природы этого заболевания. Специалистам известны две формы проявления синдрома Стивенса-Джонсона. Одна из них — тяжелый вариант идиопатической многоформной экссудативной эритемы. Ее развитие может быть обусловлено вирусом простого герпеса, Micoplasma pneumonie, вирусом Коксаки, паротита, гистоплазмы, тифозной, дифтерийной, туберкулезной палочки, гемолитического стрептококка, Chlamidia trahomatis и др.. [9,13]. Вторая форма — тяжелый вариант токсико-аллергической реакции. Большинство авторов — А. Ю. Родин и Г. В. Еремина, Г. М. Цветкова и В. Н. Мордовцев предполагают генетическую предрасположенность организма к развитию синдрома Стивенса-Джонсона [6]. Клинические проявления данного синдрома в полости рта характеризуются острым развитием — в течение нескольких часов, иногда 2–3-х суток. В 100 % случаев они проявляются пузырями, которые вскрываются с образованием эрозии, которые быстро покрываются серо-белым налетом, также эрозии возникают и на красной кайме губ. В 5–7 % случаев поражаются слизистые полостных органов, развиваются явления вульвовагинита, в 91 % случаев отмечаются поражения глаз. Сыпь на коже обычно представлена диссеминацией расположенных эритематозно-папулезных элементов, имеющими багровый периферический край и едва запавший синюшный центр. Течение синдрома Стивенса-Джонсона длится 2–6 недель. Основную роль в лечении больных с данным синдромом занимают кортикостероидные препараты. Но при инфекционном генезе заболевания кортикостероиды используются в сочетании с антибактериальной терапией и противовирусными препаратами. D. F. Detjen, R. Patterson и другие авторы описали хороший терапевтический эффект использования преднизолона с ацикловиром и другими противовирусными препаратами [11, 13, 20]. Как простой герпес, так и герпесасоциированая многоформная экссудативная эритема, характеризуется хроническим течением, при этом частота обострений может быть разной — от ежемесячных до 1–2 раза в год. Степень тяжести заболеваний в первую очередь зависит от выраженности нарушений иммунитета, который контролирует латентное состояние ВПГ в организме человека [4,7].
Анализ современных подходов к терапии острого герпетического, хронического рецидивирующего стоматита, папиллома вирусной инфекции, герпесасоциированой МЭЭ позволяет говорить, что сегодня существует два ее приоритетных направления — иммунный и этиотропный, оба из которых патогенетический обоснованы. Клинические формы папилломавирусной инфекции, в частности слизистой оболочки полости рта, играют важную роль в диагностике и установлении окончательного диагноза заболевания.
Диагностика типичных проявлений ПВЧ не вызывает трудностей, трудности возникают на ранних стадиях заболевания. Основным методом диагностики атипичных видов является гистологическое исследование с выявлением койлоцитарных клеток в биоптате, а также метод ценной реакции с полимеразой ПЦР с определением типа вируса. При стоматоскопии пациентов с жалобами на сухость в полости рта не исключена роль хронической инфекции вирусами гепатитов. Необходимо также учитывать роль вирусов как индукторов аутоиммунных ответов на болезнь Шегрена. Потенциальными кандидатами на роль триггеров в этиопатогенезе Шегрена в настоящее время считаются герпесвирусы: вирус Эпштейна — Барра — EBV, герпесвирус V и типа — ННV-6, а также вирусы гепатита В (HBV) и С (НСV) и другие [12]. При первичном осмотре у врача-стоматолога необходимо дифференцировать инфекционный мононуклеоз. Вирусы герпеса является лимфотропных агентами. Этиология данного заболевания обусловлена герпесвирусами типа Эпштейн-Барра (ВЭБ, ЕВV) и цитомегалии (ЦМВ). В настоящее время с помощью современных молекулярно-генетических и серологических методов исследования установлено, что мононуклеозоподобный синдром может вызываться не только ВЭБ, но и другими возбудителями: вирусом простого герпеса I типа, цитомегаловирусом, вирусами гриппа А и В, вирусом герпеса человека V и типа, токсоплазмами [16]. Эта ситуация требует специального определения причины ИМ в связи с принципиальными разнообразия в прогнозе заболевания и стратегии терапии. ИМ — антропонозное заболевание с преимущественно капельным механизмом передачи, характеризующееся интоксикацией, лихорадкой, аденопатией и вироцитозом периферической крови.
Первичная ЕВV-инфекция у детей разного возраста чаще бессимптомная. Инкубационный период 2–7 недель. Типичный симптомокомплекс — лихорадка, тонзиллофарингит, лимфаденопатия. В 1/3 случаев появляется налет на миндалинах, в 5 % случаев ассоциируется со стрептококковой инфекцией (β-гемолитический стрептококк группы А). Значительная лимфаденопатия — характерный признак инфекционного мононуклеоза. Увеличиваются шейные лимфатические узлы (передние и задние), возможна геннерализированая лимфаденопатия с поражением подчелюстных, подъязычных, паховых, подмышечных, надключичных и локтевых лимфатических узлов. Лимфатические узлы увеличены симметрично, при пальпации безболезненны.
Слизистая оболочка полости рта может быть гиперемирована, отечная. В области миндалин пузырьки от одного до десяти с прозрачным содержимым. Пузырьки могут сливаться и через 2–3 дня лопаться, формируя эрозии ярко-красного цвета с фестончатыми краями. Эрозии покрыты фибринозным налетом. Можно диагностировать катаральный или язвенный гингивит. В первые три недели заболевания у 50 % больных сопровождается спленомегалией, болью в животе. Может регистрироваться пятнисто-папулезные высыпания в 3–15 % пациентов. В 25–50 % детей отмечается энантема на мягком небе. При этих заболеваниях возможен широкий спектр осложнений, таких как: разрыв селезенки, обструкция верхних дыхательных путей, неврологические гематологические осложнения, гепатит, миокардит, психические реакции, а также Х-связанный лимфопролиферативний синдром, опухоли, ассоциированные с вирусом Эпштейн-Барра.
В общем анализе крови отмечается лимфоцитоз и наличие атипичных лимфоцитов более 10 %, лейкоцитоз 10,0–20,0 г 109 / л. Умеренная тромбоцитопения проявляется более чем у 50 % больных. Изменения в анализе крови характеризуются увеличением количества моноцитов, атипичных мононуклеаров и палочкоядерных нейтрофилов. Епштей-Барр-вирусная инфекция стимулирует поликлональную продукцию антител, инфицированных b-лимфоцитами, в том числе транзиторную продукцию гетерофильных антител, которые относятся к классу IgM и появляются на 1–2 недели заболевания. Титр снижается на 2–3-й месяц. А через 6 месяцев у большинства больных они исчезают. Но у 20 % больных гетерофильные антитела определяются в течении 1–2-х дней. Серологическая диагностика EBV-инфекции необходима для подтверждения EBV-инфекции или ранее перенесенного заболевания (табл..1). Такая диагностика важна при атипичных формах инфекционного мононуклеоза, лимфопролиферативных заболеваниях, тяжелом, длительном сечении, при отсутствии гетерофильных антител. С целью диагностики определяются антитела к следующим вирусных антигенов: капсидному (VCA), ранних (EA) и ядерного (EBNA).
Читайте также:


