Цитомегаловирусная инфекция от кошек

Цитомегаловирусная инфекция – широко распространенная вирусная инфекция, характеризующаяся многообразием проявлений от бессимптомного течения вплоть до тяжелейших генерализованных форм с поражением внутренних органов и центральной нервной системы. Во время трансплацентарной передачи инфекции возможно поражение плода.
Уровень инфицирования цитомегаловирусной инфекцией и степень зараженности организма зависит от социально-экономических условий, этнической принадлежности, практики медицинского обслуживания новорожденных и детей младшего возраста, времени вступления в половые отношения.
Доля носителей ЦМВ в России составляет около 90%.
Попадая в клетки человеческого организма, цитомегаловирус способен оставаться в нем пожизненно.
Возбудитель (Cytomegalovirus hominis) относится к вирусам герпеса (семейство Herpesviridae)
Резервуаром и источником инфекции является только человек. Вирус может находиться в слюне, молоке, моче, испражнениях, семенной жидкости, в секрете шейки матки.
У 20-30% здоровых беременных женщин ЦМВ присутствует в слюне, 3-10 % - в моче, 5-20% - в цервикальном канале или вагинальном секрете.
Кровь около 1% доноров содержит цитомегаловирус.
Хотя, вирусные частицы могут быть обнаружены по всему телу, цитомегаловирус, чаще всего, ассоциирован со слюнными железами.
Cпособы передачи инфекции
Цитомегаловирусная инфекция распространяется не только через слюну при близких контактах, но и во время полового контакта, через кровь, от беременной матери плоду, а также контактно-бытовым путем.
Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности. Возбудитель, проникший в плод через кровь в ранние сроки беременности, вызывает формирование врожденных пороков развития.
При наличии инфекции в канале шейки матки у беременной, заражение плода может происходить в родах, во время прохождения плода по родовым путям.
Основной путь заражения ребенка до года – передача вируса через грудное молоко.
Источником заражения детей до 5-6 лет являются матери, выделяющие вирус со слюной или мочой.
Дети, находящиеся в организованных коллективах заражаются чаще контактно-бытовым путем.
Заражение в возрасте 16-30 лет происходит, как правило, при близком контакте через поцелуи и половым путем.
Переливание крови и другие манипуляции с кровью также могут приводить к заражению цитомегаловирусом.
Симптомы цитомегаловирусной инфекции
В здоровом организме вирус никак себя не проявляет, но может быть смертельно опасен для людей с иммунодефицитами: для ВИЧ-инфицированных, больных, после трансплантации органов, а также ожидающих трансплантацию, новорождённых.
При врожденной цитомегаловирусной инфекции характер поражения плода зависит от срока его заражения. Особенно опасно острое инфицирование матери в первые 20 недель беременности.
К чему может привести заражение в ранние сроки беременности?
Внутриутробная гибель плода;
Грубые врожденные пороки (анэнцефалия, микроцефалия, гидроцефалия, нарушение строения легких, бронхиального дерева, аномалии строения почек и др.).
Врожденные пороки в большинстве случаев несовместимы с жизнью.
При заражении ЦМВ в более поздние сроки беременности формирования пороков развития не происходит.
К чему приводит заражение ребенка цитомегаловирусом во время родов?
Клинические признаки, как правило, появляются через 1-2 месяца после родов.
Поражение легких (пневмония);
Увеличение печени, селезенки;
Поражение желудочно-кишечного тракта;
Заболевание может носить длительный рецидивирующий характер.
Максимальная летальность от цитомегаловирусной инфекции приходится на 2-4 месяц.
Профилактика цитомегаловирусной инфекции
Во время консультирования беременных женщин, или планирующих беременность необходимо информировать о главных источниках и путях инфицирования (половые контакты с инфицированными ЦМВ партнерами, физический контакт при ежедневном уходе за ребенком дома или профессиональный контакт с детьми младшего возраста в стационарах, домах ребенка, дошкольных учреждениях).
Для снижения риска первичного заражения ЦМВ беременным женщинам, использовать барьерные контрацептивы при половых контактах, соблюдать правила личной гигиены (мыть руки после прикосновения к дверным ручкам, прикосновения к игрушкам, испачканными слюной , мочой ребенка), не рекомендуется доедать или допивать за детьми, использовать совместную посуду, нельзя облизывать соску. Необходимо избегать поцелуев в губы детей грудного возраста, которые могут выделять вирус со слюной.
При планировании переливания крови недоношенному ребенку или взрослому человеку с ослабленной иммунной системой, необходимо осуществлять проверку крови и ее компонентов на наличие ДНК ЦМВ.
В статье проанализированы опубликованные данные по вопросам адекватной диагностики антенатальной и постнатальной цитомегаловирусной инфекции (ЦМВИ), а также лечению острых ЦМВИ у беременной, плода и новорожденного. Представлены отечественные клинические р
The article gives analysis of the data on the issues of relevance of diagnostics of antenatal and postnatal cytomegaloviral infection (CMVI), as well as treatment of acute CMVI in the pregnant, fetus and newborns. National clinical guidelines on diagnostics and treatment of congenital CMVI developed by the Russian Association of antenatal medicine in 2016, were presented; as well as the first unofficial international guidelines on the issues of diagnostics and treatment of congenital CMVI.
Цитомегаловирус (ЦМВ) — чрезвычайно распространенный вирус, поражающий людей всех возрастов и формирующий пожизненную персистенцию в организме инфицированного человека. Считается, что в большинстве случаев персистенция начинается в ранние годы жизни и протекает латентно, не оказывая выраженного патологического влияния на состояние здоровья инфицированного. С другой стороны, доказано, что персистенция вируса может сопровождаться хроническим воспалением, формировать разнообразные многочисленные иммунные дисфункции и определять развитие вторичных иммунных, аутоиммунных и дегенеративных нарушений. Различного рода иммунокомпрометации могут приводить к рецидивам размножения вируса и многообразным клиническим проявлениям с поражением любых органов и систем в любом возрасте.
Особое значение имеют врожденные инфекции детей, которые отличаются высоким риском развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией (ЦМВИ), что определяет потребность в своевременном пренатальном выявлении беременных и плодов с высоким риском развития врожденной ЦМВИ и ранней диагностике и лечении инфекций у новорожденных.
Теоретические дискуссии по вопросам адекватной диагностики антенатальной и постнатальной ЦМВИ, а также лечению острых ЦМВИ у беременной, плода и новорожденного продолжаются с 1990-х гг., но отсутствие единых руководящих принципов затрудняет практическую работу врачей. Российской ассоциацией специалистов перинатальной медицины в 2016 г. выработаны отечественные клинические рекомендации по диагностике и лечению врожденной ЦМВИ. Созданная в рамках 5-й Международной конференции по ЦМВИ (Брисбен, Австралия, 19 апреля 2015) международная группа экспертов на основе консенсусных дискуссий и обзора литературы выработала первые неофициальные международные рекомендации по вопросам диагностики и лечения врожденной ЦМВИ, которые опубликованы в Lancet Infect Dis в марте 2017. Все эти рекомендации будут нуждаться в постоянном обновлении по мере поступления дополнительных данных.
ЦМВ — двухцепочечный ДНК-вирус, член семейства герпес-вирусов (β-герпесвирус человека). Синтез вирусного генома ДНК происходит в ядре клетки-хозяина. Исследования последних лет подтверждают гипотезу о том, что штаммы ЦМВ могут варьировать в их вирулентности, тропизме и патогенном потенциале, который, в свою очередь, вероятно, связан с генетической изменчивостью ключевых для патогенеза генов. Внешняя оболочка вируса содержит множественные гликопротеины, кодируемые вирусом. Гликопротеин B и гликопротеин H, по-видимому, являются основными факторами для формирования гуморального иммунитета — антитела к ним способны нейтрализовать вирус. Эти гликопротеины используют сегодня при разработке анти-ЦМВ-вакцин [3].
Вирус распространяется различными способами: через продукты крови (переливание, трансплантация органов), грудное вскармливание, пролиферацию в местах контактов (кожа, любые слизистые оболочки), перинатально и половым путем. ЦМВИ может протекать в виде первичной инфекции ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни [4].
При острой ЦМВ-инфекции могут поражаться практически все типы клеток человеческого организма — эндотелиальные клетки, эпителиальные клетки, клетки гладкой мускулатуры, фибробласты, нейронные клетки, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и пр. Все типы клеток поражаются и в мозге: нейроны, астроциты, клетки эпендимы, выстилающие желудочки, макроглия, эндотелий капилляров, оболочек, микроглия, сплетения сосудистой оболочки, дендриты и аксоны — т. е. вирус в мозге не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения нервной системы у больных [5].
Считается, что ЦМВ реплицируется в эндотелиальных клетках с низкой скоростью, вызывая преимущественно подострые инфекции, однако истинная скорость репликации вируса в клетках определяется эффективностью цитотоксического Т-клеточного иммунитета и степенью иммуносупрессии хозяина. Так, например, на моделях ЦМВИ у животных продемонстрировано, что отсутствие CD4 Т-клеток сопровождалось более тяжелым и стремительным заболеванием ЦМВИ. Известно также, что ВИЧ-инфицированные новорожденные имеют очень высокую частоту врожденной ЦМВИ с высоким риском смерти, неврологических дефектов и прогрессии ВИЧ-инфекции [6–7].
Особое свойство ЦМВИ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [7].
Доказано, что и первичные и латентные ЦМВИ сами могут индуцировать хронические воспалительные системные реакции с устойчивой иммунной активацией, запускать и поддерживать аутоиммунные процессы, усиливать аллореактивность Т-клеток после трансплантации и, возможно, участвовать в комплексе причин повышения частоты нейродегенеративных состояний с возрастом человека (Jones R. P. The debility cascade in neurological degenerative disease). Установлено также, что ЦМВ-индуцированные иммунные изменения в пожилом возрасте могут отвечать, например, за замедленную элиминацию вируса гриппа из легких, сниженный поствакцинальный иммунитет на гриппозные вакцины, измененную реакцию организма на терапию интерферонами [8].
Многие годы риск развития врожденных инфекций плода ассоциировали преимущественно с первичной инфекцией матери, однако к настоящему моменту не вызывает сомнения, что большая доля врожденных ЦМВИ (до 75%) встречается в условиях рецидивирующей во время беременности материнской инфекции. Допускаются также и экзогенные реинфекции с новыми штаммами ЦМВ — доказательства основываются на молекулярных данных, подтверждающих получение нового штамма вируса.
Вместе с тем степень риска вертикального инфицирования плода в условиях первичной инфекции матери рассматривают по-прежнему как чрезвычайно высокую — в 30–50% случаев острой первичной инфекции беременной развивается врожденная инфекция ребенка. Показано, что ранее существовавший материнский иммунитет хоть и не гарантирует полной защиты, тем не менее обеспечивает снижение риска врожденной ЦМВИ при следующих беременностях на 69% [9].
Недавними исследованиями установлено, что ЦМВ может поражать амниотическую мембрану, ухудшая цитотрофобласт-индуцированный лимфангиогенез и ремоделирование сосудов в плаценте и задерживая правильное развитие клеток — предшественников трофобласта, одновременно вызывает врожденную провоспалительную иммунную реакцию. Это приводит к гипоксии плода, задержке внутриутробного развития и возможным последующим гипоксическим повреждениям головного мозга. Степень поражения плода определяется сроками антенатального инфицирования и вирусной нагрузкой в размножающихся клетках — чем меньше гестационный возраст, тем более выражена альтерация (разрушение) тканей с формированием пороков развития [10]. Особенно быстро ЦМВ достигает максимума в астроцитарных и глиальных клетках, при этом максимальная экспрессия вируса найдена в глиальных клетках развивающегося мозга мышат (что объясняет микрогирию, микроцефалию и другие пороки ЦМВ-инфицированного мозга детей). По мере увеличения срока гестации в клинической картине инфекционного заболевания плода преобладают симптомы системного воспаления с выраженной пролиферацией и экссудацией. У 1/3 умерших от ЦМВИ новорожденных (из них 60% — недоношенные) при морфологическом исследовании выявляют различные пороки развития. У 43% — признаки генерализованной внутриутробной инфекции с геморрагическими и ишемическими инфарктами (в том числе в головном и спинном мозге) [11].
Способность вируса реплицироваться в любых клетках человеческого организма определяет многообразие клинических форм болезни; ЦМВ может вызывать как генерализованные инфекции, так и поражения отдельных органов: печени, головного мозга, сердца, легких, мочеполовых органов, желудочно-кишечного тракта и др.
У беременных острая первичная ЦМВИ протекает чаще бессимптомно (25–50%) или малосимптомно — с неспецифическими проявлениями (обычно лихорадка, астения и головная боль).
Как первичная, так и рецидивирующая ЦМВИ матери может стать причиной антенатальных ультразвуковых признаков поражения плода в результате трансплацентарной инфекции. Самые частые УЗИ-признаки: задержка роста плода, вентрикуломегалия, микроцефалия, перивентрикулярная гиперэхогенность, кальцификаты в мозге, плевральный выпот или асцит, гепатоспленомегалия, гиперэхогенный кишечник и мекониальный илеус и др. Эти УЗИ-аномалии эмбриона прогнозируют тяжелую генерализованную манифестную врожденную ЦМВИ новорожденного с высоким риском формирования инвалидизирующих исходов болезни и смерти. Поэтому первичная острая ЦМВИ во время беременности может являться показанием к ее искусственному прерыванию. Установлено, что около 4% детей с антенатальной ЦМВИ умрут в утробе матери или вскоре после рождения, среди остальных около 60% будут иметь когнитивные дефекты, нейросенсорную потерю слуха и другие неврологические и прочие проблемы [11–12].
Сегодня установлено также, что нейросенсорная тугоухость является прогрессирующим заболеванием и может формироваться в течение 5–6 лет жизни даже у детей, родившихся с бессимптомной ЦМВИ (это связывают с многолетней репликацией ЦМВ в перилимфе), что требует соответствующей длительности наблюдения ребенка.
При инфицировании в поздние сроки гестации ЦМВИ у новорожденного может проявляться и как генерализованная инфекция, и как поражение отдельных органов с нетяжелыми транзиторными симптомами болезни, например, умеренной гепатомегалией, изолированным снижением количества тромбоцитов или повышенным уровнем аланинаминотрансферазы. Возможна и клинически бессимптомная ЦМВИ с изолированной нейросенсорной тугоухостью.
У 10% всех новорожденных в течение первого месяца жизни возникают инфекционные заболевания в результате в основном семейных контактов, в том числе грудного вскармливания. Экскреция ЦМВ с грудным молоком в течение первых недель после родов бывает низкой, достигает максимума к 4–8 неделям, завершается к 9–12 неделям. Считается, что риск трансмиссии вируса коррелирует с вирусной нагрузкой в молоке, передача максимальна при высокой экскреции. У доношенных детей в результате инфицирования ЦМВ через молоко матери формируется, как правило, субклиническое течение инфекции без остаточных явлений; в клинической картине более вероятно развитие энтероколита и транзиторного холестатического гепатита с минимальным цитолизом. Недоношенные дети (вес
И. Я. Извекова 1 , доктор медицинских наук, профессор
М. А. Михайленко
Е. И. Краснова, доктор медицинских наук, профессор
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения/ И. Я. Извекова, М. А. Михайленко, Е. И. Краснова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 90-95
Теги: новорожденные, беременность, инфекция, персистирование
ЦИКЛОФЕРОН В ТЕРАПИИ ЦИТОМЕГАЛОВИРУСНОЙ ИНФЕКЦИИ ОБЕЗЬЯН
Инфекция, вызываемая цитомегаловирусом (ЦМВ), широко распространена среди людей и обезьян и ассоциирована с большим спектром патологических состояний. Разновидность патологии, вызываемой ЦМВ, закономерности его распространения, филогенез, сходство циркуляции у человека и макаков резус позволяют считать ЦМВ-инфекцию обезьян адекватной моделью для человека, на которой можно разрабатывать вопросы профилактики и лечении этой инфекции у людей. В работе приведены результаты изучения эффективности действия иммуномодулирующего и антивирусного препарата циклоферон при цитомегаловирусной инфекции макаков резус. Показано, что циклоферон вызывал повышение у обезьян продукции ИФН-а и способствовал продлению сроков ремиссии у животных, носителей ЦМВ. В настоящее время проблема цитомегаловирусной (ЦМВ) инфекции имеет большое значение в медицине в связи с широким распространением этого заболевания в человеческой популяции и его актуальностью в акушерстве, неонатологии, педиатрии, клинической вирусологии, трансфузиологии, трансплантологии. Усугубляется эпидемиологическая значимость распространения ЦМВ из-за бессимптомного носительства, которое наблюдается у 80 % населения . Аналогичная ситуация наблюдается и среди обезьян, особенно макаков резус (RhCMV). В некоторых колониях носительство этого вируса отмечено у 100 % приматов. Медленная репликация представителей этого семейства, относительно низкая вирулентность и цито-патогенность служат причиной перехода вируса в латентное состояние, вызывая хронические инфекции с постоянными рецидивами, частота которых с годами возрастает . Согласно исследованиям, проведенным в Адлерском питомнике и литературным данным большинство взрослых обезьян и значительное количество обезьян до 1 года инфицировано этим вирусом. Наибольшую опасность ЦМВ-инфекция представляет для обезьян с иммунодефицитами, беременных самок и новорожденных . У обезьян наблюдается пожизненное носительство инфекции. Вывести вирус из организма невозможно. Показано, что такие препараты как ацикловир, ганцикловир, фоскарнет влияют на размножение вируса, однако не способны полностью его элиминировать. Исследования ЦМВ-инфекции обезьян (эпидемиологии, особенностей молекуляр-но-биологической структуры и филогенеза) позволяют рассматривать ее как адекватную модель для изучения этого заболевания людей с целью разработки специфической терапии и профилактики. Кроме того, на обезьянах Адлерского питомника отечественные ученые изучали препарат кипферон и показали его эффективность . Герпесвирусные инфекции, вызванные вирусами простого герпеса, цитомегаловирусом, вирусом Эп-штейна-Барр и др. характеризуются стимуляцией образования интерферонов (ИФН) -альфа, -бета, -гамма, а также продукцией ряда про- и противовоспалительных цитоки-нов (фактора некроза опухолей - ФНО-альфа, интерлейкинов - ИЛ-1бета, ИЛ-2, ИЛ-6, ИЛ-10, ИЛ-12, ИЛ-13, гранулоцито-макрофагального колониестимулирую-щего фактора) и хемокинов, действие которых направлено на стимуляцию клеточного и гуморального иммунитета, а также на формирование специфического противовирусного иммунитета. ЦМВ обладает множественными механизмами иммуносупрессии и ускользания от иммунного ответа хозяина, свойственными другим вирусам.Понимание механизмов иммуносупрессии, составляющих патогенетическую основу развития латентной ЦМВ инфекции, представляет особый интерес для определения средств лечения страдающих этим заболеванием. Отечественные индукторы ИФН (циклоферон, амиксин, кагоцел, ридостин и др.) стали успешно применять в последние 8-10 лет.Установлено, что антивирусное действие этих препаратов опосредовано в основном индукцией в ИФН-альфа,бета,гамма и других цитоки-нов, обладающих широким спектром эффекгорных и иммунорегулирующих функций, усиливающих иммунный ответ организма на внутреннюю инфекцию. Для исследования на ЦМВ-инфицированных обезьян нами был выбран препарат циклоферон. Терапия гер-песвирусных инфекций представляет значительные трудности. В связи с появлением в последнее время новых штаммов, резистентных к ацикловиру, стал актуален поиск новых средств терапии
Проблемы цитомегаловирусной инфекции
Раиса Викторовна Вартанян, канд. мед. наук, ст. научн. сотр. клинического отдела
Научно-исследовательского института вирусологии им.Д.И.Ивановского РАМН.
За последние 25 лет выявлено более 30 видов новых инфекционных заболеваний, среди которых уже известные и хорошо контролируемые болезни получили широкое распространение. В этом ряду особое место занимает цитомегаловирусная инфекция (ЦМВИ, цитомегалия), которая вызывается вирусом, относящимся к семейству герпесов. Несмотря на то что история этой болезни насчитывает более 100 лет, наши знания о ее значении в патологии детей и взрослых далеко не полные. По определению Всемирной организации здравоохранения (ВОЗ), цитомегалия - новая таинственная инфекция.
27 июня 1881 г. на заседании Нижнерейнского общества врачей немецкий патологоанатом Х.Риберт впервые описал гипертрофию почечных канальцев при нефрите у мертворожденного младенца с врожденным сифилисом. Обнаружив в эпителии почечных канальцев необычные гигантские клетки с ядерными включениями, он предположил, что их возникновение обусловлено специфической инфекцией. Позднее, в 1904 г., он описал подобные клетки в различных органах новорожденных детей [1].
В 1921 г. Е.Гоодпастун и Ф.Талбот впервые высказали мнение, что гигантские клетки образуются из нормальных эпителиальных клеток в результате хронического воспаления, и назвали их цитомегалами, а состояния, при которых они встречаются, - детской цитомегалией. Спустя четыре года были описаны такие же клетки в печени и кишечнике умершего тридцатилетнего мужчины, страдавшего язвенным колитом и абсцессом печени.
В 1926 г. Р.Коле и А.Куттнер доказали вирусную природу цитомегалии у животных, выделив вирус из слюнных желез грызунов и проведя его семь пассажей. А спустя шесть лет К.Фарбер и К.Вольбах предположили, что цитомегалия у детей также вирусного происхождения. Только в 1956 г. А.Смит и В.Рове независимо друг от друга изолировали цитомегаловирус (ЦМВ) из ткани почек и подчелюстной железы. Через год А.Веллер с сотрудниками обнаружили этот вирус в моче у детей с клиническими симптомами цитомегалии и рекомендовали использовать свой метод для диагностики. В нашей стране первые работы, посвященные этому заболеванию, относятся к 1958 г., а в 1961 г. вирус был выделен из мочи, слюны и молока кормящих матерей. В 1967 г. ЦМВИ вошла как нозологическая единица в международную номенклатуру ВОЗ.
Известно, что источник инфекции - человек, носитель вируса или больной острой формой. В большинстве случаев цитомегалия протекает латентно, но становится опасной при беременности, в перинатальном периоде, у детей раннего возраста, а также при иммунодефиците. После первичного инфицирования вирус не выводится из организма хозяина, а циркулирует в нем всю жизнь. Отсюда и довольно высокая (до 100%) его выявляемость в отдельных популяциях.
Семейство Herpes viridae, к которому принадлежит цитомегаловирус (HHV5, или Cytomegalovirus ), объединяет около 70 вирусов и включает три подсемейства: Alphaherpesvirinal, куда входят вирусы простого герпеса человека, ветряной оспы и опоясывающего герпеса; Gammaherpesvirinal, к которому относится вирус Эпштейн-Барра; Bethaherpesvirinal, включающее вирус цитомегалии человека и мышей.
Все вирионы герпеса имеют примерно одинаковый размер (120-150 нм в диаметре) и сложное строение. Сердцевина, заключенная в белковый капсид, содержит ДНК. Геном вируса представляет линейная двунитчатая ДНК с молекулярной массой 80-150·106. Капсид, состоящий из 162 мономеров, окружен липопротеидной оболочкой с шипиками на поверхности. Между капсидом и оболочкой расположен слой, размер которого значительно варьирует у разных вирусов. Молекулярная масса вирионов более 10·108.
Пять гликопротеидов (oA, oB, oC, oD и oE) расположены на наружной поверхности липопротеидной оболочки. Ряд вирусных антигенов связан и с внутренними белками, и с гликопротеидами. Основные иммуногены - гликопротеиды (gB, gC, gD), которые индуцируют синтез антител, нейтрализующих вирус, и клеточный иммунный ответ организма.
Вирусы термолабильны, чувствительны к эфиру, детергентам, инактивируются при pH
Схема строения цитомегаловируса.
Очень ранняя фаза продолжается первые 24 ч после инфицирования. В этот период образуются протеины, обеспечивающие начало вирусной репликации. Антигены аккумулируются в клеточном ядре и синтезируются в течение вирусной репликации.
Ранняя фаза определяется от начала синтеза вирусной ДНК (спустя 2-4 ч от инфицирования) и длится 24-72 ч. На этом этапе возникают ферменты, необходимые для размножения ДНК, - ДНК-полимеразы.
Поздняя фаза начинается спустя 24-48 ч после инфицирования и заканчивается гибелью клетки. Вирус строится в ядре клетки, а затем вымывается через цитоплазму к поверхности клетки.
На электронно-микроскопических снимках цитоплазматические и внутриядерные вирусные частицы имеют различное строение. Чаще всего в ядрах вирусных клеток видны частицы в виде колечек, реже - кольцевидные двухконтурные частицы. Встречаются электронно-плотные образования округлой, овальной форм различной величины, часто в виде скоплений.
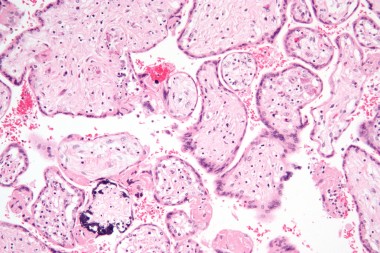
Морфологии цитомегаловирусных поражений посвящено много работ как в нашей стране, так и за рубежом. Основной, наиболее типичный признак - появление гигантских (диаметром 25-40 мкм) клеток с ядерными и цитоплазматическими включениями, похожих на совиный глаз. Они имеют типичную структуру, разнообразную форму и размеры, зависящие от стадии метаморфоза. Обнаружение подобных клеток в моче, слюне и других выделениях позволяют поставить диагноз цитомегалии.
Цитомегаловирусные включения, напоминающие совиный глаз,
в почечном канальце ( слева ) и в протоках слюнной железы.
Увел. 320.
Наиболее часто цитомегалы встречаются в слюнных железах, почках, печени, поджелудочной железе, кишечнике, надпочечниках, щитовидной железе, мозге и легких. Поскольку вирус выделяется с мочой, носоглоточным секретом, слюной, спермой, молоком, кровью, заражение соответственно может быть перинатальным, трансплацентарным, через грудное молоко, трансфузию крови и ее препаратов, половым и контактно-бытовым. Когда-то из-за частого обнаружения в слюне пациентов цитомегаловирусных включений даже существовал термин “болезнь поцелуев”. Распространенность этой инфекции зависит от социально-экономических и гигиенических условий жизни. У лиц, имеющих более низкий уровень жизни и проживающих в условиях скученности, антитела к цитомегаловирусу определяются чаще.
Механизм развития заболевания зависит от пути передачи вируса, его особенностей, а также от состояния организма в момент инфицирования, и в первую очередь иммунитета. Первичная репродукция вируса вероятнее всего происходит в клетках ретикулоэндотелиальной системы и эндотелия в результате его непосредственного перехода из одной клетки в другую.
Отдельные специалисты считают, что вирус попадает в слюнные железы, где может длительно циркулировать, проходя своеобразную тренировку вирулентности. Эпителиальные клетки слюнных желез - хорошая питательная среда для вируса, в которой его активность, а значит, и способность проникать в клетки, достаточно высоки. При носительстве или латентной инфекции, когда подавлен иммунитет (вирусные инфекции, гиповитаминозы, облучение, беременность), вирус реактивируется и может привести к активному процессу. В настоящее время активно изучается роль иммунной системы в патогенезе заболевания, в основном клеточного звена иммунитета.
Многообразие клинических форм этой инфекции обусловлено способностью вируса поражать различные ткани и органы. Это дало повод сравнивать цитомегаловирус с многоликим Протеем - мифологическим чудовищем, принимающим облик различных существ.
Вспомним, что впервые цитомегалия была обнаружена у новорожденного. И сегодня эта инфекция особое значение имеет для беременных и детей, среди которых она распространяется из-за увеличения числа инфицированных женщин. Вирус в основном попадает к детям от матерей-носителей. В ходе беременности плод получает его через плаценту. Во время родов источником может быть инфицированная шейка матки. Наиболее опасны для плода первые 20 недель беременности при первичном заражении женщины. Инфицирование в ранние сроки беременности приводит к мертворождению, выкидышам и различным уродствам. Заражение во второй половине беременности или реактивация хронической цитомегалии вызывает внутриутробное поражение различных органов и систем у плода. После родов важную роль в передаче инфекции играет грудное вскармливание. У 8-10% детей, рожденных от матерей с первичной цитомегалией, имеются клинические признаки - гепатоспленомегалия, гидроцефалия, микроцефалия, тромбоцитопения, петехии, гепатит. Спустя несколько лет после заражения у 5-15% детей может возникнуть слепота, глухота, умственная отсталость, т.е. дети с такими расстройствами становятся инвалидами [3, 4].
Наиболее часто страдает печень, при этом гепатит протекает в безжелтушной и желтушной форме. У новорожденных цитомегалы находят в эпителии желчных протоков, в капиллярах и реже в паренхиме.
В головном мозге в результате инфекции развивается гидроцефалия или микроцефалия. Инфицированию, особенно у новорожденных, подвергаются нервные клетки и глия [5]. При УЗИ выявляют кисты, хореоретинит с атрофией зрительного нерва, нередко приводящий к слепоте.
При поражении желудочно-кишечного тракта возникает диспептический синдром, энтероколит, ведущий к дистрофии. Особенно часто ЦМВ-антиген выявляется в клетках пищевода, тонкой и толстой кишке, в прямой кишке.
Когда вирус проникает в нижние дыхательные пути, картина характеризуется появлением бронхита, бронхиолита и интерстициальной пневмонии.
Цитомегалия способствует возникновению миокардитов, васкулопатий, атеросклероза [4]. Постоянные носители или резервуары вируса - больные СПИДом, которые и распространяют инфекцию [6]. Высокий риск заражения отмечен также для онкологических больных, проходящих курс агрессивной химиотерапии.
В настоящее время ведется поиск новых локализаций цитомегаловируса и генеза самого заболевания. Как довольно часто бывает, прогресс в одной области создает проблемы в смежных областях. Так, достижения трансплантологии породили новые проблемы в отношении вирусных заболеваний, сопровождающих пересадку органов. Ведущим инфекционным фактором в трансплантологии считается цитомегаловирус. После пересадки различных органов риск заражения резко возрастает (от 69 до 92%) и зависит от иммунного статуса реципиента (пациента), донора и от наличия (или отсутствия) профилактики инфекции. Особенно отчетливо такая тенденция проявляется при трансплантации костного мозга: очень часто наблюдается тяжелая пневмония, нередко заканчивающаяся летальным исходом. В то же время успехи реконструктивной хирургии одновременно стимулируют и поиск новых диагностических технологий и терапевтические подходы к цитомегаловирусной инфекции.
В отличие от других вирусных заболеваний клинический диагноз цитомегалии нельзя установить без соответствующего лабораторного подтверждения. В настоящее время существует целый ряд лабораторных методов. Сравнительно простым и доступным считается присутствие в осадках слюны и мочи характерных внутриядерных включений. Для клинициста более значимы вирусологические методы, основанные на выделении вируса или его белковых антигенов в культуре ткани, зараженной материалами от больных. Наряду с этим используют также и иммунологические тесты - определение специфических антител различных классов. Так, наличие IgM антител свидетельствует об острой форме инфекции или ее реактивации, IgG - о латентной или хронической форме.
В последнее время для обнаружения вирусной ДНК широко применяются молекулярно-биологические методы: молекулярная гибридизация, полимеразная цепная реакция. Помимо специфических лабораторных данных, необходимо учитывать клинические проявления, анамнез и результаты других методов исследования (УЗИ, биохимии крови, состояния Т-клеточного иммунитета и др.).
Несмотря на то что цитомегаловирусную инфекцию изучают более 100 лет, единой классификации этого заболевания нет ни в нашей стране, ни за рубежом. В повседневной практике мы используем рабочий вариант, предложенный сотрудниками Института вирусологии им.Д.И.Ивановского (с учетом срока и механизма инфицирования): врожденная и приобретенная ЦМВИ, острая и хроническая форма, реактивация инфекции, латентное течение (табл.). Правомерная интерпретация лабораторных показателей, определение формы и типа течения болезни способствуют выбору оптимальной терапии [7].
Эффективное лечение цитомегалии сопряжено с определенными трудностями как в диагностике, так и в выборе медикаментов. В арсенале врачей сегодня имеются несколько терапевтических средств - антивирусные препараты (ганцикловир, фоскарнет, валганцикловир) и человеческие иммуноглобулины, оказывающие антиинфекционное и иммуномодулирующее действие.
Ганцикловир подавляет синтез ДНК вируса при активной фазе болезни. Показания для его применения очень строгие: наличие вируса в культуре клеток, определение цитомегаловирусного антигена в крови, моче или методом молекулярной гибридизации ДНК цитомегаловируса. Если анализы не подтверждают активную инфекцию, то ставить диагноз только по присутствию антител к ЦМВ или по обнаружению вирусных включений в биоптатах нужно осторожно.
Специфические анти-ЦМВ-иммуноглобулины (Цитотект, Мегалотект) в отличие от противовирусных препаратов способствуют нейтрализации свободного и внутриклеточного вируса, тем самым предотвращая инфицирование других клеток.
Однако и противовирусные препараты, и иммуноглобулин Цитотект весьма дорогостоящие, и их применение в наших условиях проблематично. Для нейтрализации ЦМВ-антигена и ограничения размножения вируса в организме мы используем отечественный нормальный человеческий иммуноглобулин для внутримышечного введения (титр антител к ЦМВ в иммуноферментном анализе 1:640 000).
Многолетние наблюдения за пациентами, инфицированными цитомегаловирусом, выявили дисбаланс иммунокомпетентных клеток (снижение субпопуляций хелперов-индукторов и увеличение супрессоров-киллеров, снижение соотношений хелперов-супрессоров
1. Демидова С.А., Семенова Е.И., Жданов В.М. и др. Цитомегаловирусная инфекция человека. М., 1976.
2. Букринская А.Т. // Вирусология. 1986. С.198-200.
3. Фарбер Н.А., Кетиладзе Е.С. // Сов. медицина. 1982. №2. С.68-71.
4. Ершов Ф.И., Касьянова Н.В. // Инфекции и антимикробная терапия. 2002. Т.4. №4. С.116-119.
5. Лещинская Е.В., Мартыненко И.Н., Демидова С.А. и др. // Вопр. охраны материнства и детства. 1985. №5. С.610-615.
6. Fuomcissi D., Tosti A., Baldelli F. et al. // AIDS. 1997. V.11. P.1341-1345.
7. Чешик С.Г., Малышев Н.А., Досев С.Д. и др. // Рос. вестн. перинатол. и педиатрии. 1995. Т.40. №2. С.15-18.
8. Вартанян Р.В. // Врач. 2002. №3. С.26-28.
Читайте также:
- Инструменты по инфекционной безопасности
- Должностная инструкция санитарки инфекционного кабинета в поликлинике
- Переносчики инфекции домашние животные
- Где в крыму нет кишечной инфекции
- Могут ли тики у детей быть от инфекции
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

